猴D型逆转录病毒p27基因的克隆表达及诊断价值评价
周 洁, 杨燕飞,2, 胡建华, 陶凌云, 高 诚(2.上海实验动物研究中心, 上海20203; 2.扬州大学兽医学院, 扬州225009)
猴D型逆转录病毒p27基因的克隆表达及诊断价值评价
周 洁1, 杨燕飞1,2, 胡建华1, 陶凌云1, 高 诚1
(2.上海实验动物研究中心, 上海201203; 2.扬州大学兽医学院, 扬州225009)
目的 克隆表达猴D型逆转录病毒(SRV) p27基因,评价其诊断价值。方法 PCR扩增p27基因片段,定向克隆至原核表达载体pET-28b(+),重组质粒转化大肠杆菌Rosetta (DE3)中诱导表达,利用SDS-PAGE和Western blot对表达产物进行鉴定,目的蛋白经镍柱亲和层析纯化后用ELISA方法评价其诊断价值。结果 重组质粒转化宿主菌后在37 ℃,异丙基-β-D-硫代半乳糖苷(IPTG)浓度为0.5 mmol/L的条件下诱导4 h,可溶性p27蛋白表达量最大,且具有免疫学活性。纯化后测定融合蛋白浓度为2.043 g/L,纯度93.3%,以融合蛋白为诊断抗原包被ELISA板检测3份标准阳性血清和22份阴性血清,检出率为100% 。结论 p27 基因成功表达并具有良好的反应原性,可作为猴D型逆转录病毒血清学检测的候选抗原。
猴D型逆转录病毒; p27基因; 原核表达; 血清学检测
猴D型逆转录病毒(simian type-D retrovirus,SRV), 属逆转录病毒科肿瘤病毒亚科的D型病毒, 是猴获得性免疫缺陷综合征(simian acquired immunodeficiency syndrome, SAIDS)即猴艾滋病的主要病原体之一[1]。SRV的自然宿主是猕猴, 主要通过猴间互相撕咬使唾液中的病毒进入血液而传播, 也可通过性传播和胎盘传播。感染后的临床表现和病理特征与人艾滋病类似, 如顽固性腹泻、贫血、体质量减轻、脾肿大、淋巴结病、慢性感染并对治疗不产生疗效反应、坏死性口炎、表皮和腹膜后纤维瘤等。SRV在其天然宿主亚洲猴群中流行率较高, 有的猴群可达100%,1970年代末和1980年代初, 美国几个灵长类研究中心爆发SRV导致了大批实验用猴死亡, 近年来还有SRV感染人的报道[2-6]。
由于猴在形态学、生殖生理特性和生化代谢等方面与人类非常类似,其遗传物质和人类有很高的同源性,因此猴被作为人类最理想的替身和重要的研究、实验对象,广泛应用于医学、药学、毒理学等领域的科学研究,特别是在新药临床前安全性评价中猴是不可替代的实验动物。其质量不仅直接影响科学研究的进程和结果,而且也直接影响从事实验动物科研、生产等相关人员的生命健康和安全以及社会公共卫生体系的安全[7]。因此需要定期对猴群进行SRV感染的监测以剔除传染源,必要时使用疫苗。我国国标GB/T 14926.61-2001[8]规定SRV是SPF级猴的必检项目,推荐方法为酶联免疫吸附试验(ELISA)或免疫荧光试验(IFA)。目前除了美国BioReliance和VRL等少数几个实验室拥有实验猴SRV的ELlSA试剂盒之外,市场上还没有同类产品出售。国外试剂盒价格昂贵且货期不稳定,因此建立一种快速、准确的SRV检测方法有助于国内开展实验猴SRV的检测工作。本研究对SRV的高度保守序列p27基因进行了克隆表达,并对其诊断价值进行了评价,为进一步开展SRV的快读诊断方法奠定了基础。
1 材料与方法
1.1 材料
1.1.1 毒株、菌株及载体 SRV-2株细胞培养物、pET-28b(+)载体质粒均由本实验室保存; pMD18-T载体购自宝生物工程(大连)有限公司生物公司; 感受肽细胞E.coli Rosetta (DE3)购自天根生化科技(北京)有限公司。
1.1.2 主要试剂 QIAamp Viral RNA Mini Kit购自Qiagen公司(德国); PrimeSTAR Max DNA Polymerase聚合酶、AMV逆转录酶、dNTPS、T4连接酶、限制性核酸内切酶均购自宝生物工程(大连)有限公司生物公司; 辣根过氧化物酶(HRP)酶标山羊抗猴IgG购自上海优宁维生物科技有限公司; 琼脂糖凝胶回收试剂盒及质粒小提试剂盒购自天根生化科技(北京)有限公司; Ni-IDA-SefinoseTMResin试剂盒购自生工生物工程上海(股份)有限公司。
1.2 方法
1.2.1 目的基因的克隆 根据GenBank发表的SRV-2株基因序列(16605.1), 针对p27基因(nt1385~nt2062)设计一对特异性引物, 用于扩增p27基因。
上游引物: 5'-AGCCATATGATTTTCCCAGTAACG-3',引入NdeⅠ酶切位点;
下游引物:5'-TGATCTCGAGGTCTGTCCACTAAAG-3', 引入XhoⅠ酶切位点;
SRV细胞培养物病毒总RNA的提取按照QIAamp Viral RNA Mini 试剂盒说明书操作; 反转录过程参照AMV逆转录酶操作说明书; 取上述3 μL cDNA产物作为PCR模板,PCR反应条件为: 通过RT-PCR方法扩增p27 基因, 扩增条件为: 95 ℃ 3 min;95 ℃ 22 s,58 ℃ 20 s, 72 ℃ 45 s, 30个循环; 72 ℃5 min。回收PCR产物与pMD18-T 载体连接,转化感受态E.coli DH5α细胞,提取质粒送生工生物工程(上海)股份有限公司测序,将鉴定为阳性的重组质粒命名为pMD-P27。
1.2.2 重组质粒的构建 pMD-P27经Xho I/ Nde I双酶切后与进行同样处理的pET-28b(+)载体相连,接连接产物转化感受态E.coli Rosetta(DE3)细胞,鉴定后获得的阳性质粒命名为pET-P27。
1.2.3 重组蛋白的诱导表达 pET- P27转化感受态E.coli Rosetta (DE3),挑取单菌落于含30 mg/L卡那霉素和34 mg/L氯霉素的LB培养基中,37 ℃,220 r/min摇床培养至A600值0.6左右时添加终浓度为0.5 mmol/L的IPTG, 220 r/min,37 ℃诱导4 h,未加IPTG诱导剂的阳性菌液作为阴性对照。离心收集菌体细胞, 用缓冲液(20 mmol/L PB, 300 mmol/L NaCl,质量分数0.1%TritonX-100,pH8.0)重悬,冰浴中超声破碎菌体,分别离心收集上清和沉淀,沉淀用500 μL包涵体溶解液(8 m/L 尿素, 50 mmol/L Tris-HCl,150 mmol/L NaCl,pH8.0)溶解,分别用于SDS-PAGE分析表达产物。
1.2.4 重组蛋白的纯化 大量诱导表达后离心收集菌体超声处理后,上清用Ni-IDA-SefinoseTMResin试剂盒纯化, 具体步骤如下: 取5 mLNi-IDA, 用10倍柱床体积的结合缓冲液(binding buffer)清洗平衡柱子,流速5 mL/min; 上柱,流速为2 mL/min,收集穿透液; 10倍柱床体积的结合缓冲液清洗柱子,流速5 mL/min; 漂洗缓冲液(wash buffer)洗去杂质,流速2 mL/min,收集洗脱液; 洗脱缓冲液(elution buffer)洗脱,流速2 mL/min,收集洗脱液。将收集到的各组分进行SDS-PAGE检测后,将纯度最好的组分透析至1×PBS,pH8.0中,0.45 μm滤膜过滤浓缩分装,测定蛋白的浓度(具体操作按照生工的SK3071非干扰型蛋白质浓度测定试剂盒进行)及纯度,-80℃分装保存。
1.2.5 重组蛋白的Western blot鉴定 纯化后的蛋白经SDS-PAGE电泳转移至PVDF膜上, 加封闭液(含5%脱脂奶粉的TBST)温室摇床封闭1 h; 先后以50倍稀释的SRV标准阳性血清4 ℃孵育过夜,2 000倍稀释的羊抗猴IgG-HRP温室摇床孵育1 h,TMB显色。
1.2.6 重组蛋白的诊断价值评价 以纯化的重组蛋白作为诊断抗原包被ELISA板(浓度为3.063 mg/孔)4℃包被过夜; 封闭缓冲液(blocking buffer)于37 ℃封闭2.5 h; 标准阴、阳性血清1∶100稀释, 作用60 min; 酶标二抗1:10 000稀释,底物显色15 min,2 mol/L H2SO4终止反应; 酶标仪测量A630值, 以阴性血清的平均A630值乘以2.1作为阳性判定标准。
2 结果
2.1 目的基因克隆及表达载体的构建
经RT-PCR扩增获得大小约为750 bp 的特异性片断(图1),与预期大小相符,连接pMD18-T 载体测序,结果证实扩增片断723 bp, 包含有SRV-2 p27完整ORF共678 bp,编码226 aa。将pMD-P27双酶切后与同样处理的pET-28b(+)载体连接,获得阳性质粒pET- P27。设计一对特异性引物,用于扩增p27基因。
上游引物: 5'-AGCCATATGATTTTCCCAGTAACG-3',引入NdeⅠ酶切位点;
下游引物: 5'-TGATCTCGAGGTCTGTCCACTAAAG-3', 引入XhoⅠ酶切位点;
SRV细胞培养物病毒总RNA的提取按照QIAamp Viral RNA Mini 试剂盒说明书操作; 反转录过程参照AMV逆转录酶操作说明书; 取上述3 μL cDNA产物作为PCR模板,PCR反应条件为: 通过RT-PCR方法扩增p27 基因, 扩增条件为: 95 ℃ 3 min;95 ℃ 22 s,58 ℃ 20 s,72 ℃ 45 s,30个循环;72 ℃ 5 min。回收PCR产物与pMD18-T 载体连接,转化感受态E.coli DH5α细胞,提取质粒送生工生物工程(上海)股份有限公司测序,将鉴定为阳性的重组质粒命名为pMD-P27。
1.2.2 重组质粒的构建 pMD-P27经Xho I/ Nde I双酶切后与进行同样处理的pET-28b(+)载体相连,接连接产物转化感受态E.coli Rosetta (DE3)细胞,鉴定后获得的阳性质粒命名为pET-P27。
1.2.3 重组蛋白的诱导表达 pET- P27转化感受态E.coli Rosetta (DE3),挑取单菌落于含30 mg/L卡那霉素和34 mg/L氯霉素的LB培养基中,37 ℃,220 r/min摇床培养至A600值0.6左右时添加终浓度为0.5 mmol/L的IPTG,220 r/min, 37 ℃诱导4 h,未加IPTG诱导剂的阳性菌液作为阴性对照。离心收集菌体细胞, 用缓冲液(20 mmol/L PB, 300 mmol/L NaCl,质量分数0.1%TritonX-100,pH8.0)重悬,冰浴中超声破碎菌体, 分别离心收集上清和沉淀, 沉淀用500 μL包涵体溶解液(8 m/L Urea,50 mmol/L Tris-HCl,150 mmol/L NaCl,pH8.0)溶解,分别用于SDS-PAGE分析表达产物。
1.2.4 重组蛋白的纯化 大量诱导表达后离心收集菌体超声处理后, 上清用Ni-IDA-SefinoseTMResin 试剂盒纯化, 具体步骤如下: 取5 mL Ni-IDA, 用10倍柱床体积的结合缓冲液清洗平衡柱子, 流速5 mL/min;上柱,流速为2 mL/min,收集穿透液; 10倍柱床体积的结合缓冲液清洗柱子,流速5 mL/min; 漂洗缓冲液洗去杂质,流速2 mL/min, 收集洗脱液; 洗脱缓冲液洗脱,流速2 mL/min,收集洗脱液。将收集到的各组分进行SDS-PAGE检测后,将纯度最好的组分透析至1×PBS,pH8.0中,0.45 μm滤膜过滤浓缩分装,测定蛋白的浓度(具体操作按照生工的SK3071非干扰型蛋白质浓度测定试剂盒进行)及纯度,-80℃分装保存。
1.2.5 重组蛋白的Western blot鉴定 纯化后的蛋白经SDS-PAGE电泳转移至PVDF膜上,加封闭液(含5%脱脂奶粉的TBST)温室摇床封闭1 h; 先后以50倍稀释的SRV标准阳性血清4 ℃孵育过夜, 2 000倍稀释的羊抗猴IgG-HRP温室摇床孵育1 h, TMB显色。
1.2.6 重组蛋白的诊断价值评价 以纯化的重组蛋白作为诊断抗原包被ELISA板(浓度为3.063 mg/孔)4℃包被过夜; 封闭缓冲液(blocking buffer)于37 ℃封闭2.5 h; 标准阴、阳性血清1∶100稀释, 作用60 min; 酶标二抗1∶10 000稀释,底物显色15 min,2 mol/L H2SO4终止反应; 酶标仪测量A630值,以阴性血清的平均A630值乘以2.1作为阳性判定标准。
2 结果
2.1 目的基因克隆及表达载体的构建
经RT-PCR扩增获得大小约为750 bp 的特异性片断(图1),与预期大小相符,连接pMD18-T载体测序, 结果证实扩增片断723 bp, 包含有SRV-2 p27完整ORF共678 bp,编码226 aa。将pMD-P27双酶切后与同样处理的pET-28b(+)载体连接,获得阳性质粒pET- P27。
2.2 重组蛋白的表达及活性鉴定

图1 RT-PCR扩增p27基因产物M: DNA molecular weight standards; 1: Water control;2: RT-PCR products Figure 1 RT-PCR products of p27 gene
重组质粒转化E.coli Rosetta (DE3), 37℃, IPTG浓度0.5 mmol/L诱导4 h表达量最大, 表达产物的SDS-PAGE分析结果表明,重组蛋白以上清形式表达,蛋白分子量约29000, 与预期相符(图2), Western blot 结果表明重组蛋白具有良好的特异性和反应原性(图3)。
2.3 重组蛋白纯化
表达菌大量诱导表达后收集裂解上清, 经Ni-IDA过柱纯化后蛋白大小与纯化前一致(图4),按照SK3071 非干扰型蛋白浓度测定试剂盒说明书,以不同体积蛋白的480 nm吸收值的平均值作为纵坐标,对应的BSA蛋白质浓度为横坐标,绘制BSA标准曲线图,按照480 nm吸光度与蛋白质量的线性关系为y=-0.0043x+1.1157,求得目的蛋白浓度为2.043 mg/mL,薄层扫描确定其纯度为93.3%。蛋白测定结果见表1,图5。

图2 SDS-PAGE检测重组p27蛋白在Rosetta中的表达Figure 2 Expression of recombinant p27 protein in E.coli Rosetta analyzed by SDS-PAGE

图3 重组p27蛋白Western-blot 分析结果Figure 3 Western blot analysis of recombinant p27 protein
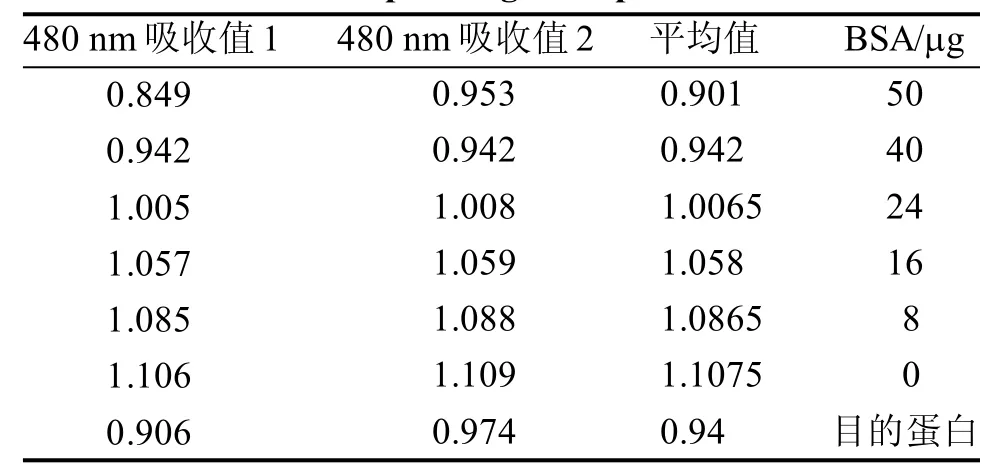
表1 各体积蛋白的480 nm吸收值及对应BSA蛋白浓度测定Table1 480nm absorption value of each volume protein and its corresponding BSA protein concentration
2.4 重组p27蛋白的诊断价值评价
以纯化的重组蛋白作为诊断抗原包被ELISA板,对3份标准阳性血清和22份阴性血清进行检测,3份阳性血清的A630值在0.355~1.210,22份阴性血清A630值在0.072~0.228,平均值为0.133,按照阴性平均A值的2.1 倍计算,阳性判定阈值为0.278。3份阳性血清检出率及22份阴性血清检出率为100%。

图5 BSA标准曲线图Figure 5 BSA standard curve
D型逆转录病毒分为内源性病毒(SERV)和外源性病毒(SRV)。SRV是引起SAIDS的主要病原。目前发现的SRV有7个血清型,其中,SRV-1~3已测序完成[9]。SRV的基因组结构与其他逆转录病毒相似, 两端为长末端重复序列(LTR), 其在病毒DNA的合成、整合和病毒基因的表达等方面起调节作用。中间包含4个开放阅读框架(ORF), 从5'端至3'端依次为: (1)编码核心蛋白的gag基因, 它编码一个大的前体核心蛋白,在病毒成熟过程中, 被蛋白酶水解成6个核心蛋白: p10、pp24、pp18、p12、p27、p14、p4; (2)编码蛋白酶(Protease)的prt基因;(3)编码逆转录酶(RT)和整合酶(核酸内切酶)的pol基因; (4)编码囊膜蛋白(包括外膜蛋白gp70、跨膜蛋白gp20)的env基因。在env基因之后还有一个意义不明的延伸到右侧LTR的短ORF[10,11]。

表2 重组蛋白对标准血清的ELISA检测结果Table2 Result of ELISA with recombinant protein to test standard sera
SRV不同血清型之间有交叉反应, 主要发生在衣壳蛋白p27和跨膜蛋白gp20~gp22区域, 在D型逆转录病毒基因组中它们是高度保守的一段序列[12]。本研究选取编码p27蛋白的基因作为研究对象,将其完整ORF插入原核表达载体pET-28b(+)的多克隆位点区,在37 ℃,IPTG浓度0.5 mmol/L 的条件下诱导4 h, 蛋白获得较高水平的表达, 且以上清形式存在。目的蛋白大小约29 000 (含His标签),与预期大小一致,Western blot 证实重组蛋白与猴SRV标准阳性血清发生特异性反应,具有良好的反应原性。基于融合蛋白所带的6个组氨酸标签,利用Ni-IDA柱对重组蛋白进行了纯化, 并获得了较高纯度的蛋白。将纯化的重组蛋白作为包被抗原, 通过间接ELISA方法严证重组蛋白的诊断价值。结果显示,3份阳性血清的A630值在0.355~1.210, 22份阴性血清A630值在0.072~0.228, 平均值为0.133, 按照阴性平均A值的2.1 倍计算,阳性判定阈值为0.278。3份阳性血清检出率及22份阴性血清检出率为与VRL的SRV试剂盒完全相符。本结果显示,重组蛋白具有血清学诊断价值,为下一步建立诊断方法奠定了基础。
[1] Gardner MB, Marx PA.Simian acquired immunodeficiency syndrome[J].Adv Virol Oncol, 1985(5):57-81.
[2] Hampton AL, Colby LA, Bergin IL Facial paralysis and lymphocytic facial neuritis in a rhesus macaque(Macaca mulatta)positive for simian retrovirus type D2.[J].Comp Med, 2011, 61(6):538-545.
[3] 王芸, 吕龙宝, 马玉华, 等.猴D型逆转录病毒的研究进展[J].上海畜牧兽医通讯, 2012, 6:14-15.
[4] 陈志斌, 贲昆龙.猴D型逆转录病毒和猴艾滋病[J].动物学研究, 1992, 13(2):193-199.
[5] Lerche NW, Marx PA, Osborn KG, et a1.Natura1 history of endemic type D retrovirus infection and acquired immune deficiency syndrome in group-housed rhesus monkeys[J].Natl Cancer Inst, 1987, 79(4):847-854.
[6] Montiel NA.An updated review of simian beta retrovirus (SRV) in macaque hosts [J].J Med Primatol, 2010, 39(5):303-314.
[7] 张高红, 李明华, 郑永唐.AIDS猕猴模型在HIV疫苗研究中的应用[J].动物学研究, 2007, 28(5):556-562.
[8] GB/T 14926.61-2001.猴逆转D型病毒检测方法[S].
[9] Nandi JS, Tikute SA, Chhangani AK, et a1.Natural infection by simian retrovirus-6(SRV-6) in Hanuman langurs (Semnopithecus entellus) from two different geographical regions of India[J].Virology, 2003, 3l1(1):192-201.
[10] Hara M, Sata T, Kikuchi T, et al.Isolation and characterizationof a new simian retrovirus type D subtype from monkeys at the Tsukuba Primate Center, Japan[J].Microbes Infect, 2005,7(1):126-131.
[11] Van der Kuyl AC, Mang R, Dekker JT, et al.Complete nucleotide sequence of simian endogenous type D retrovirus with intact genome organization: evidence for ancestry to simian retrovirus and baboon endogenous virus[J].J Virol,1997, 71(5):3666-3676.
[12] Sonigo P, Barker C, Hunter E, et al.Nucleotide sequence of Mason-Pfizer monkey virus: an immune-suppressive D-type retrovirus[J].Cell, 1986, 45(3):375-385.
Production of Recombinant Simian Type-D Retrovirus p27 Gene and Evaluation of its Diagnostic Potential
ZHOU Jie1, YANG Yan-fei1,2, HU Jian-hua1, TAO Ling-yun1, GAO Cheng1
(1.Shanghai Research Center of Laboratory Animal, Shanghai 201203;
2.Yangzhou University College of Veterinary, Yangzhou 225009)
Objective To Clone and express p27 gene of simian type-D retrovirus and evaluate its diagnostic potential.Method The p27 gene was amplified by RT-PCR and cloned into the prokaryotic expressive vector pET-28b(+) after sequencing.Recombinant plasmid was transformed into E.coli Rosetta DE3) and recombinant protein was analysed by SDS-PAGE and Western blot.The protein was purified affinity chromatography with Ni-NTA, and its diagnostic value was evaluated by ELISA.Results The highest soluble expression level of recombinant protein was obtained after being induced at 37℃ for 4 h,with the concentration of Isopropyl-β-D-thiogalactoside (IPTG) was 0.5 mmol/L, and the recombinant protein had immunological activity.After purified, the concentration of protein was 2.043 g/L, and the purity was 93.3%.The indirect ELISA was developed using the purified recombinant protein,detection of 3 standard positive sera and 22 negative sera showed the detection rate were 100%.Conclusion Recombinant p27 protein from prokaryotic expression system had perfect antigenicity,which would can be used as the candidate antigen of simian type-D retrovirus.
Simian type-D retrovirus; p27 gene; Prokaryotic expression; Serological detection
Q95-33
A
1674-5817(2016)04-0270-06
10.3969/j.issn.1674-5817.2016.04.005
上海市科委科技创新行动计划(13140900600), 上海市科委研发平台专项(15DZ2292400)
周 洁(1978-), 女, 博士, 副研究员, 主要从事动物病毒分子生物学及免疫学方面的研究。E-mail: zhoujie0526@163.com
高 诚(1961-), 男, 研究员。E-mail: gaochengdgb@126.com

