小鼠显微外科血管插管活体手术模型使用与维护操作
苏 红, 王亚飞, 谷元亮, 赵进顺, 邹宝波(宁波大学医学院预防医学系, 宁波 315211)
小鼠显微外科血管插管活体手术模型使用与维护操作
苏 红, 王亚飞, 谷元亮, 赵进顺, 邹宝波
(宁波大学医学院预防医学系, 宁波 315211)
小鼠显微外科血管插管手术模型是一种用途广泛的实验研究模型, 与体外细胞实验相比,更接近人体的实际状况。但在动物模型制作与使用过程中,相对标准的操作规程可以确保动物模型在统一的标准下制作、使用与维护,这样可以使不同实验室之间的实验结果具有可比性。因此,在建立活体动物模型的同时,对模型制作与使用过程中的操作规程进行优化研究,对该类模型的推广使用具有十分重要的意义。
小鼠; 血管插管; 手术模型; 操作规程
在生命科学中,人类的健康和福利研究都离不开动物实验。医学史上许多科学家采用动物模型获得重大发现,如早在1912年Carrel通过动物实验,开创了血管与器官移植的实验研究,并因此获得诺贝尔生理学与医学奖。然而,很多动物模型的制作离不开显微外科技术[1]。近年来,显微外科手术技术已经在大动物(如猪、犬、兔等)[2-4]的活体模型建立中得到了广泛应用,利用大鼠制作动物模型的显微外科手术研究也很多[5-8]。但是由于大动物价格昂贵,纯系品种来源困难,使其应用受到了限制。而小鼠因为具有品系较纯、来源广、价格便宜、试剂来源多、免疫学检测方便,且其在食物结构、生理、生化和发育过程与人类较为接近,小鼠基因和人类基因有大于80%的同源性等优点,利用小鼠制作活体动物模型进行器官移植及心肌梗死等研究的越来越普遍[9-12]。
作者采用显微外科技术, 已建立多种小鼠血管内活体插管手术实验模型[13,14], 本文探讨在手术模型使用与维护过程中的标准化操作及实验适用条件。
1 手术后插管的连接
手术后将动脉、静脉的血管插管分别与微分析旋转输液阀(美国 Instech laboratories, Inc,型号375/d/22qm)(图1)的下端、侧端导管连接。旋转输液阀上端、侧端再与微量输液泵(美国 Braintree Scientific, Inc,型号BS-8000)(图2)上的注射器相连接。手术后通过输液泵持续不断地输入20单位肝素,以保证动脉、静脉插管的通畅。
从旋转输液阀上引出的动脉导管先与一个Y型导管的下端连接(图3),导管Y头一端与微量输液泵连接,另一端与信号转换系统(美国DATAG Instruments, Inc.型号DI720系列)连接。信号通过软件转换在计算机屏幕上显示出小鼠的血压、心率(图4)。而通过轨迹信号放大系统则可以显示动脉导管的通畅程度。若发现轨迹变窄或成一条直线,说明动脉导管即将或堵塞。
2 手术后从动脉插管获取血液标本
模型建立后,从静脉导管注射营养成分、药物与毒物后,需要从动脉导管采集血液样本进行分析。通过采集血液标本,分离血清检测血液中各种成分的变化,分析研究因素的作用。采血方法:用一个小的血管夹夹住靠近旋转输液阀插管的一端,将动脉插管与旋转输液阀分开,并与26G针头的1 mL注射器(内含20 U肝素)连接。松开血管夹回抽血液,待血液到达针头处停止,再用血管夹夹住插管, 更换另一个干净的注射器,松开血管夹回抽100 μL血液(用于实验研究)。再次夹住插管, 更换先前的注射器,并将血液推还回血管中。最后一次夹住插管,将插管与旋转输液阀上的导管连接, 即完成了1次从动脉插管采血。作者在动物手术后2 d开始从动脉导管中采集血液,每日1次,每次100 μL,连续5 d,观察小鼠均无异常。
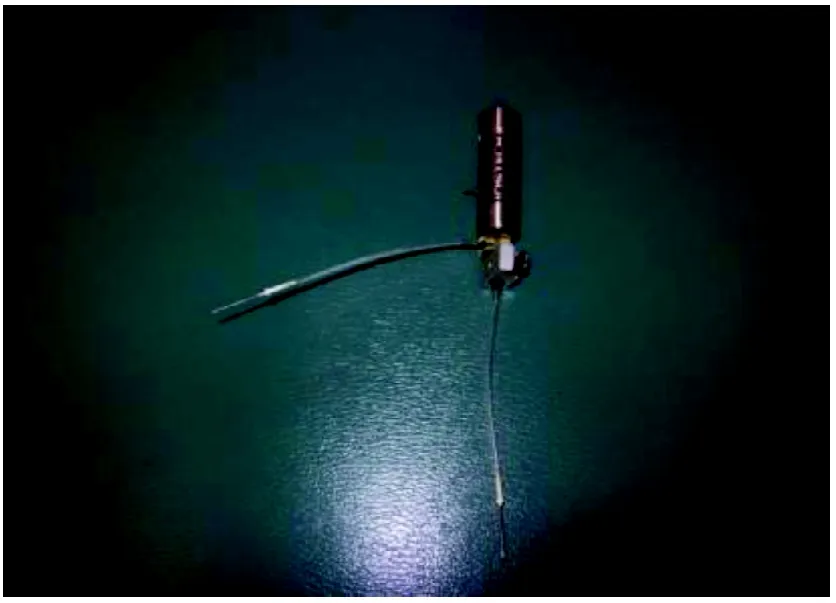
图1 微分析旋转输液阀

图2 微量输液泵

图3 Y型导管

图4 信号显示器
3 动脉导管采血间隔时间与采血量
由于小鼠体型较小, 血容量也只有1 mL左右,如果需每日多次采血,又不影响动物的健康及实验结果的准确性,最佳的采血方法为: 采血后,将离心取得血浆后的血细胞再用肝素稀释后重新输回小鼠体内,以免多次抽血而引起动物贫血。即在当日不同时间点采血,每次100 μL,分离血浆保存(用于危险因素的研究等)。分离的血细胞用20 μL (100 U/mL)肝素生理盐水混悬后,再回输到小鼠体内。作者在用小鼠做糖钳夹实验时,每10 min采血1次,均按上述方法进行,实验持续4 h,结果显示小鼠活动均正常。
4 动脉管堵塞的相关因素
动物模型建立后最易发生动脉导管堵塞, 其影响因素为: 动脉导管的粗细、导管固定的牢固程度、肝素的给予量和微量注射泵系统是否有气泡等。
作者在手术过程中使用不同粗细的导管,结果表明内径0.30 mm,外径0.64 mm的导管较好,太粗不易插入; 太细虽然方便插入,但易堵塞。
手术后, 通过输液泵持续输入不同浓度(10 U/mL、20 U/mL、30 U/mL)肝素,以流速12~15 μL/h输送入动脉插管内各12例,观察动脉管的堵塞时间及手术部位的出血情况,结果表明,使用浓度为10 U/mL肝素, 动脉导管易堵塞; 使用浓度为30 U/mL肝素,手术部位易出血。使用20 U/mL肝素的条件下,动脉导管可以畅通使用6.0±2.5 d。
任何时间都要注意保持输液系统管路内没有气泡。因此,需每日2次检查计算机屏幕,若发现轨迹变窄或成一条细线(如图4屏幕上显示的第2条细线),说明该小鼠的动脉插管已经狭窄或堵塞。若发现较早,立即用连接26G针头的1 mL注射器(内含20 U肝素)人工冲洗,可能使插管重新通畅,计算机屏幕上显示的压力轨迹又变宽(如图4显示的第1条轨迹)。
5 静脉导管持续工作时间影响因素
待小鼠恢复正常活动后(一般情况下,术后2 d即恢复),用注射泵通过股静脉持续注入研究因素。作者分别给予0.9%生理盐水(200 μL/h)、50%葡萄糖(100 μL/h)和脂肪乳(100 μL/h),观察3组静脉导管工作时间。结果表明,第1组维持时间最长(3周),第3组最短(仅1周),说明静脉导管持续工作时间的长短与输入液体的粘稠度有关。另外,静脉导管极易因感染而渗漏,从而影响静脉导管工作时间。
6 导管系统细菌污染相关因素
进行该类手术,最易发生血液系统的感染。手术时无菌程度及术后旋转输液阀、微量注射泵系统的洁净程度,手术后通过输液泵持续输入液体的无菌状况等,均是导致感染的危险因素。
理论上,一例动物实验结束后,应全面更换输液系统的管路,这是确保系统无菌的最佳办法。但在实际工作中,通常难以做到。因为更换一套系统需要增加很多工作量,且更换后的管路经常有气泡存在,管路中的气泡极易造成动脉管的堵塞,使手术模型失去使用价值。
因此,在按严格无菌操作技术规范进行系统处理的状态下,观察管路无菌持续的时间,以寻找最佳的管路更换时间。实验方法为采集手术后不同时间点的旋转输液阀动、静脉插管连接处管路中的液体(0.2 mL)进行细菌培养(采用涂擦法), 37 ℃,18~24 h观察细菌生长情况,在一切均按严格无菌操作情况下,导管通常可以持续工作4周而没有污染(即所有管路均无细菌生长)。
7 导管、管路消毒与保洁
手术前, 对已经制成J型的塑料导管[13,14]以及其他输液管路的塑料导管用环氧乙烷(EO)灭菌。对固定设备如旋转输液阀的处理方法为: 先用500 mg/L含氯消毒剂冲洗一遍,再用体积分数75%乙醇冲洗,最后用0.9%无菌生理盐水冲洗。每例实验前,对旋转输液阀按上述方法处理以备使用。每4周对所有管路及微量注射泵系统按同样方法进行清洗消毒。处理后的导管晾干,放入专用包装袋中EO消毒。
作者的经验表明,血液系统的感染多与旋转输液阀及微量注射泵系统污染有关。若严格按规定操作,手术后小鼠血液系统的感染率较低。若为免疫低下动物或手术后给予免疫抑制剂者,在采血过程中更要严格按无菌技术操作。
8 小结与展望
小鼠显微外科血管插管活体手术模型是一种用途广泛的实验研究模型, 与体外细胞实验相比, 其更接近人体的实际状况。目前, 国外研究机构已经开始采用该模型进行多方面的医学实验研究[15-17],但国内少见该手术实验模型技术建立和应用的研究报道。
1990年代以来,随着显微外科技术发展,一些以大动物为对象的动物模型正在逐渐被小动物模型取代[18,19],以小鼠为实验模型的显微外科实验研究正在逐年增加。尤其是近年来,小鼠活体血管插管显微外科技术已经在药物代谢、糖尿病与肥胖机理研究中得到应用[19,20]。值得注意的是,尽管国外已经有学者用小鼠活体血管插管手术模型进行医学研究,但尚缺乏模型标准化操作规程及实验适用条件方面的研究。各实验室都是按照自己的方法进行手术、术后维护及模型动物的使用等。鉴于该类模型动物是在清醒、自由活动与进食状态下进行的连续动态实验,手术的麻醉方式、手术过程中的失血量多少、手术中的保暖措施、手术过程中的无菌技术、手术所用的导管粗细及材质材料等均可能对模型动物产生影响。因此,相对标准的操作规范可以确保动物模型在统一的标准下制作、维护与使用,这样可以使不同实验室间的实验结果具有可比性。在建立活体动物模型的同时,对模型制作过程中的操作规程进行优化研究,对该类模型的推广使用具有十分重要的意义。
在医学研究飞速发展的今天, 新的药物和食物不断开发成功, 而新的或潜在的毒物也在不断产生。为确保人类的健康与安全, 研究者需要通过活体动物模型对药物、毒物、营养物等在体内的代谢、生理和病理作用进行动态连续观察,以探索人类疾病的发病机理、药物的作用机制、疾病预防的效果等。随着我国科学技术的飞速发展,医学研究要达到或赶超国际先进水平,建立活体血管插管动物模型,提供科研实验平台显得尤为重要与迫切。
[1] Carrel A.Results of the permanent intubation of the thoracic aortia [J].Surg Gynecol Obstet,1912,15(3):245-248.
[2] 刘学刚, 施超, 王康武, 等.Hybrid方法建立肺血减少型先天性心脏病幼猪动物模型[J].中华心血管病杂志, 2011,39(1):79-83.
[3] 常宝志, 黄莚庭, 那加, 等.动物痔模型初探[J].中华现代外科学杂志, 2008, 5(1):4-6.
[4] 李琳, 周振理.可复性机械性完全性肠梗阻模型的制作[J].中华实验外科杂志, 2009, 26(4):525-526.
[5] 王启弘, 马廉亭, 周志红, 等.改进手术技术制作的犬囊状动脉瘤模型[J].中华实验外科杂志, 2005, 22(9):1107-1108.
[6] 殷立平, 苏健, 李必波, 等.大鼠慢性移植肾肾病动物模型的制作经验总结[J].中华器官移植杂志, 2011, 32(7):433-437.
[7] 马宝苗, 张栗, 吕秀依, 等.大鼠静脉自身给药颈静脉插管手术方法的改进[J].中国药物依赖性杂志, 2010, 19(6):476-480.
[8] 郭予太, 韩天旺, 郭付有, 等.大鼠双侧肾动脉后支结扎术制作肾性高血压模型[J].中华实验外科杂志, 2006, 23(1):103-104.
[9] Yue X, Yu H, Lin X, et al.Investigation into the optimal surgical conditions for coronary artery ligation for establishing a myocardial infarction model in mice[J].Exp Ther Med, 2013,6(2):341-346.
[10] Ogawa H, Mohiuddin MM, Yin DP, et a1.Mouse-heart grafts expressing an incompatible carbohydrate antigen II Transition from accommodation to tolerance[J].Transplantation,2004, 77(3):366-373.
[11] 李忠梅.冠状动脉结扎法建立小鼠心肌梗死模型的病理及心功能变化的观察[D].沈阳: 中国医科大学, 2006.
[12] 王晓亮, 彭志海.小鼠腹部心脏移植模型的制作与改进[J].中国比较医学杂志, 2008, 18(2):68-70.
[13] 史宏博, Ruth Magaye, 王尊, 等.小鼠股动脉及股静脉插管手术模型制备方法[J].宁波大学学报: 理工版, 2012, 25 (3):71-74.
[14] 岳霞, Ruth Magaye, 王尊, 等.小鼠股动脉及胃插管复合手术模型制备方法[J].实验动物与比较医学, 2013, 33(2):139-142.
[15] Yeh TH, Krauland L, Singh V, et al.Liver-specific beta-catenin knockout mice have bile canalicular abnormalities, bile secretory defect, and intrahepatic cholestasis[J].Hepatology,2010, 52(4):1410-1419.
[16] Woodske ME, Yokoe T, Zou B, et al.Hyperinsulinemia predicts survival in a hyperglycemic mouse model of critical illness[J].Crit Care Med, 2009, 37(9):2596-2603.
[17] Levitt HE, Cyphert TJ, Pascoe JL, et al.Glucose stimulates human beta cell replication in vivo in islets transplanted into NOD-severe combined immunodeficiency (SCID) mice[J].Diabetologia, 2011, 54(3):572-582.
[18] Zhong R.Organ transplantation in mice: current status and future prospects[J].Microsurgery, 1999, 9(2):52-55.
[19] Lee EJ, Alonso LC, Stefanovsk D, et al.Time-dependent changes in glucose and insulin regulation during intermittent hypoxia and continuous hypoxia[J].Eur J Appl Physiol,2013, 113:467-478
[20] Pascoe J, Hollern D, Stamateris R, et al.Free fatty acids block glucose-induced β-cell proliferation in mice by inducing cell cycle inhibitors p16 and p18[J].Diabetes, 2012,61(3):632-641.
Q95-33
B
1674-5817(2016)04-0310-04
10.3969/j.issn.1674-5817.2016.04.013
2016-03-07
国家自然科学基金(81273111), 浙江省公益性技术应用研究计划项目(2015C37117, 2015C33148)
苏 红(1991-), 女, 硕士研究生, 研究方向: 劳动卫生与环境卫生学。E-mail: suhong0908@126.com
邹宝波, 副主任技师。E-mail: zoubaobo@nbu.edu.cn

