NLRP3炎性小体在金黄色葡萄球菌血流感染小鼠免疫反应中的作用
吴 丹 ,周树生,胡仕静,刘 宝
NLRP3炎性小体在金黄色葡萄球菌血流感染小鼠免疫反应中的作用
吴 丹 ,周树生,胡仕静,刘 宝
目的 探讨NLRP3炎性小体在金黄色葡萄球菌(金葡菌)血流感染小鼠模型免疫反应中的作用机制。方法 对C57BL/6小鼠分别经尾静脉注射金葡菌菌液或磷酸盐缓冲液(PBS)作为血流感染组和对照组,在处理后的24 h、48 h处死小鼠并检测相关指标。小鼠血液及组织匀浆(肝、肺、肾)经24~48 h细菌培养后检测其细菌计数;酶联免疫吸附法检测血清及组织匀浆中细胞因子IL-1β和IL-18含量;荧光定量-聚合酶链反应(qRT-PCR)及Western blot方法分别检测组织匀浆中NLRP3、ASC、caspase-1中mRNA及蛋白的含量;HE染色定性观察组织中炎性改变以及免疫组化方法半定量观察组织中炎性小体表达情况。结果 血流感染组血液及组织匀浆中细菌计数在感染后24 h及48 h后显著增加,HE染色观察组织见大量炎性细胞浸润甚至有脓肿或坏死,并随感染时间而加重;所有组织匀浆中IL-1β和IL-18的水平显著提高;3种组织匀浆中的ASC 和caspase-1 mRNA表达水平均在感染后48 h显著升高,而肝脏及肺脏中NLRP3 mRNA表达水平在感染后24 h就显著升高;而且,感染组各组织匀浆中的NLRP3、ASC、pro-caspase-1 以及 caspase-1 p20 蛋白水平均有显著升高。结论 金葡菌血流感染与炎性小体的激活有关,并且炎性小体表达水平与感染严重程度有关。研究结果可能为血流感染或脓毒症的发病机制提供一个新的研究方向,并为其治疗带来新的方法。
NLRP3炎性小体; 金黄色葡萄球菌; 血流感染
金黄色葡萄球菌(金葡菌)所致的血流感染越来越成为影响ICU严重感染发生率和死亡率的重要因素[1]。最近,研究发现NOD样受体(NLRs)与自身免疫性疾病、肿瘤及炎症相关,而这一类NLR的蛋白复合物称为炎性小体[2]。其中,应答于多种刺激因子诸如病毒、细菌、真菌以及坏死细胞碎片的炎性小体是NLRP3炎性小体,其是由NLRP3、caspase-1、ASC 3种蛋白组成[3]。NLRP3蛋白的激活以及对ASC及caspase-1前体(procaspase-1)的招募,导致caspase-1的激活,随后调节促炎细胞因子IL-1β和IL-18的成熟[4]。尽管之前的一些研究已经探讨了NLRP3炎性小体在许多炎症性疾病,例如急性重症肺炎、急性鼻窦炎以及肾脏炎性疾病中的作用,但是其在金葡菌诱导血流感染中的作用研究尚少[5-7]。因此,我们建立了金葡菌所致血流感染的小鼠模型来探讨NLRP3炎性小体在发病过程中的作用。
1 材料与方法
1.1材料
1.1.1菌株来源 金葡菌标准菌株ATCC 29213由安徽医科大学附属省立医院临床微生物实验室惠赠。
1.1.2实验动物 SPF级C57BL/6 雄性小鼠(20~25 g,6~8 周) ,购自安徽省实验动物中心[SCXK(皖)2011-002)]。动物饲养于ASBL2动物室,实验前适应环境1周。
1.1.3主要仪器和材料 LHP型恒温恒湿培养箱及60 ℃烤箱(常州普天仪器制造有限公司),qRTPCR分析系统(美国Biosystems 7500),光学显微镜及荧光正置显微镜(日本尼康),紫外分光光度计(上海天普分光光度计有限公司),SDS-PAGE电泳及转移系统(美国 Bio-Rad 公司),超纯水仪(中国瑞枫公司);IL-1β和IL-18酶联免疫吸附测定(ELISA)试剂盒(英国R&D公司),Trizol (美国Invitrogen公司),反转录试剂盒(美国Thermo公司),荧光定量PCR试剂盒(QuantiFast SYBR Green PCR Kit德国凯杰公司),RealTime专用八连管(美国ABI公司),DEPC处理水(北京索莱宝科技有限公司)β-actin 单克隆抗体(北京中杉金桥生物公司),NLRP3、ASC、caspase-1 p20多克隆抗体(美国Santa Cruz公司);BCA蛋白浓度测定试剂盒、RIPA裂解液、蛋白酶抑制剂(PMSF)、SDS-PAGE蛋白上样缓冲液、PVDF膜、脱脂牛奶、ELC发光液等Western blot 相关试剂(上海生工生物工程公司),石蜡、无水乙醇、二甲苯、无菌磷酸盐缓冲液(PBS)、DAB显色液等HE及免疫组化相关试剂(上海生工生物工程公司)。
1.1.4引物设计 依据GenBank中小鼠肌动蛋白(β-actin) 、NLRP3、ASC、caspase-1 基因设计引物用于qRT-PCR检测,PCR引物由南京金斯瑞生物科技有限公司合成,各引物序例见表1。

表1 NLRP3 炎性小体基因引物序列Table1 Sequence of the primers for NLRP3 inflammasome-related genes
1.2方法
1.2.1菌液培养 菌株于LB培养液中37 ℃摇菌过夜,然后以1∶100(v/v) 稀释于新鲜LB中继续摇菌4~6 h。菌液离心(3 000 r/min,5 min)后重悬于PBS,重复3次,麦氏比浊法确定1.5麦氏单位相当于4.5×108CFU/mL菌液浓度作为感染浓度。
1.2.2感染 实验小鼠随机分为血流感染24 h组、48 h组和对照组(每组30只),分别对经腹腔麻醉后的小鼠经尾静脉注射等体积的上述菌液(0.1 mL/10 g体重)及无菌PBS,感染后24 h及48 h安乐死处死小鼠,对照组为正常未感染小鼠于实验开始时即安乐死处死小鼠。
1.2.3ELISA检测 对血清及肺、肝、肾脏组织匀浆中细胞因子(IL-1β及IL-18)的含量严格按照试剂盒说明进行操作,各孔用酶标仪在450 nm处测定吸光度(D )值,用标准品的浓度与D值制作标准曲线,根据线性回归方程和样品的D值计算获得对应的浓度,样品最终浓度= 所测浓度×稀释倍数。
1.2.4总mRNA提取与cDNA合成 分别取感染组和对照组的新鲜动物组织0.1~0.2 g迅速倒入匀浆器中,加入1 mL预冷的Trizol,在冰浴中迅速匀浆20~30 s,将细胞悬液吸入另一EP管,室温静置5 min,严格按说明书操作提取总RNA,加入20 µL DEPC处理水(RNase free水)溶解RNA。读取RNA稀释样品在紫外分光光度计260、280 nm波长处的D 值,并计算D260/D280的比值,通常在1.7~2.0说明RNA样品纯度较高。按照逆转录试剂盒说明书合成cDNA,条件为42℃ 60 min,70℃ 5 min终止反应。20 µL的反转录体系如下:Total RNA 2 µL ,RT Primer Mix 2 µL,RNase Free dH2O 9 µL,5×M-MLV Reaction Buffer 4 μL,RNAsafe(30 U/µL) 1 μL,dNTP(2.5 mmoL/L each) 2 μL,M-MLV RT(200 U / μL) 1 μL。将产物cDNA冻存于-80 ℃备用。
1.2.5qRT-PCR检测 cDNA中NLRP3、ASC、caspase-1 mRNA的含量 以感染组与对照组小鼠组织中的cDNA建立25 µL的反应体系:2 × QuantiFast SYBR Green PCR Master Mix 12.5 µL,Primer A 0.5 µL,Primer B 0.5 µL,RNase-free 水9.5 µL,cDNA 2 µL。根据试验处理数和检测基因数确定所加样的管数,一般每个处理做2管平行。每管样品按2个平行(20 μL / 管)分装到RealTime专用八连管中。样品加完后装入qRT-PCR仪样品台(记住每个处理和基因的位置),打开电脑,按照AB7500说明操作,运行RT-PCR仪控制软件。反应条件为95 ℃预变性5 min,95 ℃ 10 s、58 ℃ 40 s,共40个循环。β-actin mRNA作为内参,得出每个样本的CT值后,用2-ΔΔCt法算出每个mRNA的相对定量值。
1.2.6NLRP3、ASC、pro-caspase-1、caspase-1 p20蛋白Western blot 检测 取感染组和对照组小鼠组织(肝、肺、肾)各100 mg样本,加入1 mL裂解液及10 µL PMSF放入匀浆器中捣碎,静置30 min(冰上操作)后离心取上清液。上清液按照BCA蛋白浓度测定试剂盒确定各样本蛋白浓度。上清液加入SDS-PAGE蛋白上样缓冲液(4∶1体积),100 ℃变性10 min后-20 ℃保存。NLRP3 及β-actin蛋白用10 %分离胶,ASC、caspase-1 p20蛋白用12 %分离胶,4种蛋白都用5 %浓缩胶。浓缩胶70 V,分离胶120 V进行电泳,根据预染Maker 指示,转移相应蛋白到PVDF膜上,用5 %脱脂牛奶封闭液封闭,室温1 h,封闭后分别用NLRP3、ASC、caspase-1 p20 1∶200、β-actin 1∶1 000抗体4 ℃孵育过夜,TBST洗涤10 min × 3 次,孵育二抗辣根过氧化物酶标记山羊抗兔IgG 1∶10 000,室温1 h,TBST 洗涤10 min× 3 次,用ECL曝光、显影,用ImageJ软件进行灰度值测定。
1.2.7组织HE染色及免疫组化 感染组及对照组小鼠的各组织分别经固定、包埋、切片后HE染色,显微镜下观察各组病理变化。切片经脱蜡,脱二甲苯,抗原修复,加入一抗(NLRP3 1∶500;ASC,1∶500;caspase-1 p20,1∶500)4 ℃孵育过夜,二抗室温孵育30 min,DAB显色,烤干后正置荧光显微镜下观察。
1.2.8统计分析 采用SPSS16.0对数据进行处理,计量数据均采用均数±标准差表示,两组间数据比较用独立样本t检验,多组间数据比较用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1金葡菌血流感染小鼠模型的建立
血及组织匀浆中的细菌在感染后24 h及48 h计数显著升高,且48 h组明显高于24 h组,见表2。此外,组织切片HE染色后观察到感染组小鼠的肝、肺、肾组织中均有炎性细胞浸润及组织脓肿和坏死,见图1,这表明全身血流感染模型成功建立。
2.2血流感染小鼠血清及组织匀浆中细胞因子IL-1β和IL-18水平
本研究发现,与24 h组相比,48 h组中血清及肝、肺匀浆中的IL-1β,血清中的IL-18 显著降低,而肾匀浆中IL-1β和肺匀浆中IL-18显著升高 ,见表3。
2.3组织匀浆中 NLRP3、ASC、 caspase-1 mRNA的表达
与对照组相比,感染组3种组织匀浆中ASC 和caspase-1 mRNA表达在感染后48 h显著增加,而肝和肺匀浆中的NLRP3 mRNA表达在感染后24 h就明显增加,见图2。

图1 血流感染组及对照组小鼠HE染色(400×)Figure 1 Representative photomicrographs of HE-stained sections of the tissues from BSI or PBS control mice (magnification,400×).
2.4NLRP3、ASC、pro-caspase-1和caspase-1 p20蛋白表达
感染组NLRP3、ASC、pro-caspase-1和 caspase-1 p20蛋白水平显著升高。与感染后24 h相比,感染后48 h 肺、肾组织中ASC蛋白,肺、肝组织中procaspase-1、caspase-1 p20蛋白水平显著升高。此外,同组中NLRP3、pro-caspase-1和caspase-1蛋白在肝、肾组织中表达水平更高,而ASC在肺组织中表达水平更高,见图3。
2.5免疫组化结果
感染组显示了金葡菌诱导炎性细胞的招募以及NLRP3、ASC 和 caspase-1蛋白的阳性表达。NLRP3、ASC和caspase-1蛋白主要在炎性细胞的细胞浆质中表达。对照组几乎不表达目标蛋白,而感染组不同组织中的阳性蛋白的表达量随感染时间而增加。我们还发现与肺组织相比,肝和肾组织中表达的阳性蛋白更多。这些结果表明NLRP3、ASC、caspase-1炎性小体可能加速金葡菌中炎性细胞的浸润,见图4。

表2 各组小鼠血及组织匀浆(肝、肺、肾)中的细菌计数Table 2 Bacterial colony-forming units in blood samples and tissue homogenates in each group (mean±SD)
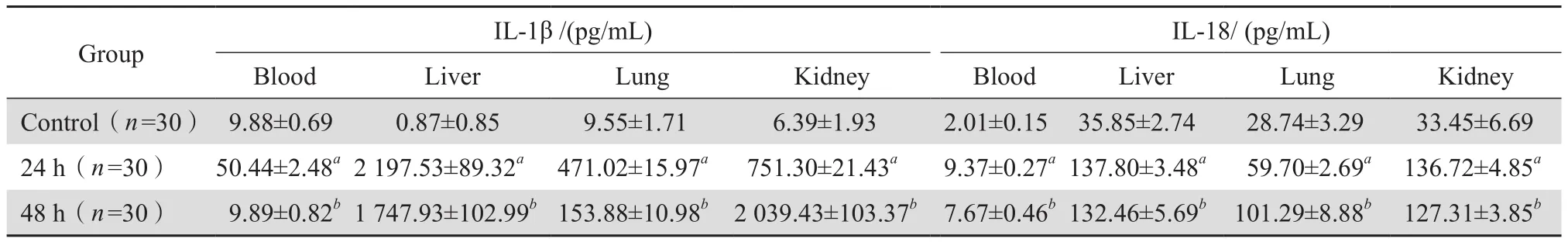
表3 血流感染组及对照组小鼠血和组织匀浆中IL-1β、IL-18水平Table 3 IL-1β and IL-18 levels in blood and tissue homogenates in the mice model of S. aureus-induced BSI and control mice (mean±SD)
3 讨论
在本研究中,我们建立了金葡菌血流感染的小鼠模型;细菌计数和病理组织HE染色证明细菌持续感染以及器官组织炎性细胞浸润和坏死。IL-1β 和IL-18被认为是依赖于NLRP3炎性小体的细胞因子,其水平在金葡菌血流感染组中显著升高(P<0.05)[8]。本研究中金葡菌所致血流感染小鼠的血浆和组织匀浆中IL-1β 和IL-18显著升高,NLRP3、 ASC、 caspase-1 mRNA及其蛋白表达水平也随之升高。血流感染组小鼠血液和组织匀浆中的细菌计数较对照组显著增加,而且每一时间点的感染组小鼠血液中的细菌计数比组织匀浆中升高的少。这可能是因为血液中的补体系统及溶菌酶能直接吞噬一部分细菌[9]。

图2 各组小鼠组织中NLRP3、ASC 和caspase-1 mRNA的表达Figure 2 NLRP3,ASC and caspase-1 mRNA expression in tissues of mice
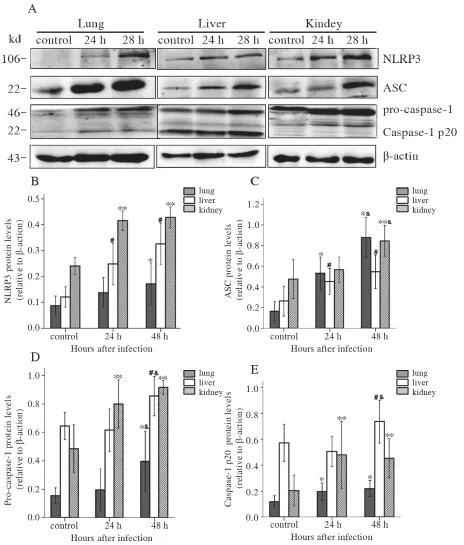
图3 各组小鼠组织中 NLRP3,ASC,pro-caspase-1 和 caspase-1 p20蛋白的表达Figure 3 Expression of NLRP3,ASC,pro-caspase-1 and caspase-1 p20 proteins in tissues

图4 免疫组化法检测各组小鼠组织中 NLRP3、ASC 和caspase-1蛋白表达Figure 4 Expression of NLRP3,ASC and caspase-1 proteins in the tissues of mice determined by immunohistochemistry
组织的炎性病理变化能够证实脓毒症的严重性。组织细胞充血水肿、炎性细胞浸润、脓肿及坏死等是血流感染小鼠器官组织主要的病理变化[10]。本研究发现,在感染后24~48 h,肺组织出现大量中性粒细胞积聚以及组织坏死;同样在肝脏中观察到肝细胞及血管周围大量的中性粒细胞聚集;在肾脏组织中,有更严重的病理变化,例如中性粒细胞脓肿、肾小管坏死和钙化。其他的一些脓毒症研究发现,肾小管上皮细胞空泡形成、坏死[11],但是肺和肝脏可能没有变化[12]。此外,FISHER等[13]也发现,在FIP小鼠中肺和肾脏没有显著的病理炎性改变。我们的观察结果与之有所不同,这可能与每项研究所采用的不同动物模型有关。
NLRP3-ASC-pro-caspase-1复合物即NLRP3炎性小体是一种与血流感染相关的重要的模式识别受体(PRR),其能促进细胞因子IL-1β 和IL-18分泌[5]。因此,我们检测小鼠组织匀浆中NLRP3、ASC、 pro-caspase-1以及caspase-1 p20蛋白来验证NLRP3炎性小体是否参与了金葡菌所致血流感染中的炎性免疫反应。结果显示,金葡菌血流感染后其组织匀浆中NLRP3、 ASC、pro-caspase-1 及caspase-1 p20蛋白水平显著增高。然而,我们发现在3种组织中不是所有的蛋白表达水平在感染后48 h都比24 h显著提高,免疫组化的结果与Western blot结果相似。金葡菌血流感染后小鼠组织中炎性细胞浸润以及NLRP3、ASC 和 caspase-1蛋白表达显著增多;而且在肝脏和肾脏中的表达比肺脏中更明显。qRT-PCR结果也发现,感染后NLRP3、ASC、caspase-1 mRNA的表达水平显著升高;还观察到肝脏和肺脏中NLRP3 mRNA的表达在感染后24 h就开始显著升高,而3种组织中ASC 和 caspase-1 mRNA的表达在感染后48 h才开始显著升高。因此,我们得出结论,金葡菌所致的血流感染激活NLRP3炎性小体,其在不同组织中的表达水平不同,而且在基因水平上与血流感染的严重程度呈正相关。
在之前一项脓毒症诱导的急性肺损伤模型中,LUO等[14]报道盲肠结扎穿孔术(CLP)诱导NLRP3、ASC和 caspase-1 mRNA及蛋白 的表达,随后引起IL-1β 和 IL-18的分泌增加。MCGILLIGAN等[15]在小鼠结膜杯状细胞中发现NLRP3 炎性小体的成分,其被金葡菌通过caspase-1路径激活随后分泌成熟的IL-1β。此外,KEBAIER等[16]发现nlrp3-/-小鼠感染金葡菌后发生严重肺炎的可能性更小,这项研究预示着NLRP3炎性小体将可能作为严重金葡菌感染的药物治疗新靶点。这些研究都表明NLRP3炎性小体在包括金葡菌血流感染在内的多种感染中起到重要的促炎作用。与我们的研究中关注脓毒症诱导的急性肾损伤不同的是,其他一些多是在慢性肾脏疾病中研究发现NLRP3炎性小体及IL-1β 、IL-18在肾脏中的表达显著提高[17]。这表明NLRP3炎性小体在急性或慢性肾损伤中都起到重要的作用。
很多文献已经报道了IL-1β 和IL-18在多种病原微生物感染中的作用[8]。金葡菌细胞壁的吞噬作用能够促进IL-1β的分泌,IL-1β的分泌对中性粒细胞的招募及细菌的清除发挥重要的作用[17]。IL-18的作用是促进干扰素γ的产生来增强巨噬细胞的杀菌活性,以及其他促炎细胞因子IL-1β、肿瘤坏死因子α、IL-8和粒细胞-巨噬细胞集落刺激因子的活性[8]。本研究发现金葡菌诱导的血流感染小鼠的血清及组织匀浆(肝、肺、肾)中IL-1β 及IL-18的水平显著升高。我们还发现肾组织中IL-1β水平及肺组织中IL-18水平在感染后48 h比24 h显著升高,而血清及肝、肺组织中的IL-1β水平,血清中的IL-18水平显著下降。NLRP3炎性小体能直接激活和促进IL-1β 和 IL-18的释放[8]。先前的研究发现,活化的caspase-1是作为IL-1β转化酶,能直接促进IL-1β成熟[18]。
总之,本研究显示,在金葡菌诱导的血流感染中NLRP3炎性小体的表达呈上调,而且NLRP3炎性小体在血流感染的发展中起到重要作用。这些结果为研究血流感染或脓毒症潜在的发病机制提供新的方向。此项研究的不足之处在于未能探讨NLRP3炎性小体的调控机制,这也将成为我们下一步实验研究的方向,为金葡菌诱导的血流感染提供新的治疗靶点。
[1]GARROUSTE-ORGEAS M,TIMSIT JF,TAFFLET M ,et al. Excess risk of death from intensive care unit acquired nosocomial bloodstream infections:a reappraisal[J]. Clin Infect Dis,2006,42(8):1118-1126.
[2]SHAW PJ,MCDERMOTT MF,KANNEGANTI TD. Inflammasomes and autoimmunity[J]. Trends Mol Med,2011,17(2):57-64.
[3]STROWIG T,HENAO-MEJIA J,ELINAV E,et al. Inflammasomes in health and disease[J]. Nature,2012,481 (7381):278-286.
[4]LATZ E,XIAO TS,STUTZ A. Activation and regulation of the inflammasomes[J]. Nat Rev Immunol,2013,13(6):397-411.
[5]WANG YJ,GONG GQ,CHEN S,et al. NLRP3 Inflammasome sequential changes in Staphylococcus aureus-induced mouse model of acute rhinosinusitis[J]. Int J Mol Sci,2014,15(9):15806-15820.
[6]LIU D,XU M,DING LH,et al. Activation of the Nlrp3 inflammasome by mitochondrial reactive oxygen species:A novel mechanism of albumin-induced tubulointerstitial inflammation[J]. Int J Biochem Cell Biol,2014,57:7-19.
[7]KEBAIER C,CHAMBERLAND RR,ALLEN IC,et al. Staphylococcus aureus α-hemolysin mediates virulence in a murine model of severe pneumonia through activation of the NLRP3 inflammasome[J]. J Infect Dis,2012,205(5):807-817.
[8]SAHOO M1,CEBALLOS-OLVERA I,DEL BARRIO L,et al. Role of the inflammasome,IL-1β,and IL-18 in bacterial infections[J]. Sci World J,2011,11:2037-2050.
[9]TROUW LA,DAHA MR. Role of complement in innate immunity and host defense[J]. Immunol Lett,2011,138(1):35-37.
[10]VAN DEN BERG S,LAMAN JD,BOON L,et al. Distinctive cytokines as biomarkers predicting fatal outcome of severe Staphylococcus aureus bacteremia in mice[J]. PLoS One,2013,8(3):e59107.
[11]YASUDA H,YUEN PS,HU X,et al. Simvastatin improves sepsis induced mortality and acute kidney injury via renal vascular effects[J]. Kidney Int,2006,69(9):1535-1542.
[12]DOI K,LEELAHAVANICHKUL A,HU X ,et al. Pre-existing renal disease promotes sepsis-induced acute kidney injury and worsens outcome[J]. Kidney Int,2008,74(8):1017-1025.
[13]FISHER BJ,KRASKAUSKAS D,MARTIN EJ et al. Attenuation of sepsis induced organ injury in mice by vitamin C[J]. JPEN J Parenter Enteral Nutr,2014,38(7):825-839.
[14]LUO YP,JIANG L,KANG K,et al. Hemin inhibits NLRP3 inflammasome activation in sepsis-induced acute lung injury,involving heme oxygenase-1[J]. Int Immunopharmacol,2014,20(1):24-32.
[15]MCGILLIGAN VE,GREGORY-KSANDER MS,LI D,et al. Staphylococcus aureus activates the NLRP3 inflammasome in human and rat conjunctival goblet cells[J]. PLoS One,2013,8 (9):e74010.
[16]KEBAIER C,CHAMBERLAND RR,ALLEN IC,et al. Staphylococcus aureus a-hemolysin mediates virulence in a murine model of severe pneumonia through activation of the NLRP3 inflammasome[J]. J Infect Dis,2012,205(5):807-817.
[17]MILLER LS,PIETRAS EM,URICCHIO LH,et al. Inflammasome-mediated production of IL-1β is required for neutrophil recruitment against Staphylococcus aureus in vivo[J]. J Immunol,2007,179(10):6933-6942.
[18]THORNBERRY NA,BULL HG,CALAYCAY JR,et al. A novel heterodimeric cysteine protease is required for interleukin-1 betaprocessing in monocytes[J]. Nature,1992,356(6372):768-774.
Effect of NLRP3 inflammasome on the immune response in a mouse model of Staphylococcus aureus-induced bloodstream infection
WU Dan,ZHOU Shusheng,HU Shijing,LIU Bao. (Department of Critical Care Medicine,Anhui Provincial Hospital Affiliated to Anhui Medical University,Hefei 230001,China)
Objective To explore the role of NLRP3 inflammasome in the immune response in a C57BL/6 mouse model of bloodstream infection (BSI) induced by S. aureus. Methods Mice were assigned to PBS control group to receive phosphate buffered saline (PBS),or to BSI group to receive S. aureus challenge via caudal vein. The animals were sacrificed 24 h and 48 h after treatment,respectively. The corresponding bacterial colony-forming units and the levels of cytokines IL-1β and IL-18 in serum and tissues were measured. qRT-PCR and Western blot analysis were used to detect NLRP3,ASC,caspase-1 mRNA and proteins in tissue homogenate. Histopathologic changes were assessed by hematoxylin-eosin staining qualitatively. The expression of inflammasome was evaluated by immunohistochemistry semi-quantitatively. Results Colony forming units in blood and tissue homogenate (liver,lungs,and kidneys) significantly elevated at 24 h and 48 h post-challenge in BSI group. Hematoxylin-eosin staining showed significant inflammatory cell infiltration,even abscess or necrosis in the tissues in BSI group. Tissue damage aggravated gradually over time. Levels of IL-1β and IL-18 increased significantly in all tissue homogenates. qRT-PCR showed that ASC and caspase-1 mRNA expression significantly increased 48 h after S. aureus challenge in all the three tissue homogenates in BSI group. The expression of NLRP3 mRNA in liver and lung homogenates increased significantly since 24 h after challenge. Western blot and immunohistochemistry analysis showed significant elevation of NLRP3,ASC,pro-casepase-1 and caspase-1 p20protein levels in S. aureus-induced BSI. Conclusions These results suggest that S. aureus-induced BSI is associated with activation of NLRP3 inflammasome. The expression level of NLRP3 inflammasome is correlated with the severity of S. aureus-induced BSI. It may offer a new direction for studying the underlying mechanisms of bloodstream infections or sepsis and will probably provide a new approach for managing S. aureus-induced BSI.
NLRP3 inflammasome; Staphylococcus aureus; bloodstream infection
R378.11
A
1009-7708(2016)04-0411-08
10.16718/j.1009-7708.2016.04.007
安徽医科大学附属省立医院重症医学科,合肥 230001。
吴丹(1988—),女,硕士研究生,主要从事细菌感染与免疫方面研究。
刘宝,E-mail:DrLiubao@outlook.com。
2015-08-07
2015-10-30

