T2*值评价健康成年人脑铁含量及其与性别的相关性研究*
王波,马莎,芮茂萍,陈婧,张宏江,代红樱,陈渝晖,张洁
[云南省第一人民医院(昆明理工大学附属医院),云南 昆明 650032]
论著
T2*值评价健康成年人脑铁含量及其与性别的相关性研究*
王波,马莎,芮茂萍,陈婧,张宏江,代红樱,陈渝晖,张洁
[云南省第一人民医院(昆明理工大学附属医院),云南 昆明 650032]
目的采用3.0T磁敏感加权成像定量测量健康成年人额叶白质区及灰质核团的T2*值,探讨灰质核团与性别的相关性。方法选取年龄25~85岁的128例年龄相匹配的男性组及女性组进行磁共振成像(M R I)常规及磁敏感加权成像(S W I)扫描,经后处理在T2*图像上分别测量左右侧额叶白质区、红核、黑质网状带、黑质致密带、尾状核头、壳核、苍白球和丘脑的T2*值,分析T2*值与性别的相关性。结果男、女性组左、右侧的T2*值在苍白球最低,其次为黑质网状带、红核,额叶白质区的最高。男性组右侧黑质网状带、黑质致密带T2*值小于左侧,女性组右侧黑质网状带T2*值小于左侧(P<0.05)。壳核、丘脑的T2*值男、女性组比较,差异有统计学意义(P<0.05);其余感兴趣区的T2*值比较差异无统计学意义(P>0.05)。结论健康成年人的壳核、丘脑的脑铁含量与性别具有相关性。
磁共振成像;脑铁沉积;性别
在健康人群的生长过程中,以及一些神经退行性疾病的病理生理过程中,脑铁沉积起着一定的作用。而在各种神经退行性疾病中,男性的发病率要较女性高,男性的发病年龄亦较女性早[1],推测与男性的脑铁含量相对较高有关[2]。目前能进行准确、无创的活体脑铁含量检测成为迫切需要解决的问题,而磁敏感加权成像(s u sceptibility w ei g hted ima g in g,S W I)的应用使人们可以进行无创脑铁含量测量。本研究对一组年龄相匹配的健康成人志愿者进行颅脑常规及S W I扫描,研究脑内灰质核团及额叶白质区的脑铁含量与性别的相关性。
1 资料与方法
1.1一般资料
选取2011年1月-2015年7月本院128例右利手的成年健康志愿者作为研究对象,行常规颅脑磁共振成像(ma g netic resonance ima g in g,M R I)扫描及S W I检查无异常,其中男性组及女性组各64例,年龄匹配,25~85岁,平均58.25岁。所有志愿者排除可能影响神经系统的系统性疾患及代谢性疾病,既往无神经系统、精神疾病病史,扫描前均签署知情同意书。
1.2扫描方法
1.2.1M R I的扫描使用G E S i g na H D X t 3.0T超导型磁共振仪和8通道颅脑线圈(德国G E通用电气公司)。扫描参数有:横轴位自旋回波序列(spin echo,S E)T2加权图像(T2w ei g hted ima g in g,T2W I):重复时间(repeatin g time,T R)2 820ms,回波时间(echo time,TE)111 ms;液体衰减反转恢复成像(f l u id atten u ated in v ersion reco v ery,F L A I R)S ET1加权图像(T1w ei g hted ima g in g,T1W I)(T R/TE:1777~1 823/26.8 ms,T I:860 ms);F L A I R S E T2W I(T R/TE:8 002/146~153 ms,T I:2 000~2 250ms)。S W I横轴位:O blic 3D M ode,快速扰相梯度回波(f ast spoiled g radient echo,F S PG R),T R/TE:68.2 ms/6.06、13.44、20.81、28.18、35.55、42.92、50.30和57.67ms,层厚/层间距:2/0mm,翻转角20°,信号平均次数(n u mber o f si g nal a v era g ed,nsa)1,扫描视野(f ield o f v ie w,F OV)240mm,B and w ith 31.25,距阵512×512。
1.2.2T2*图像后处理及T2*值的测量扫描完成后在a w 4.4工作站的F u nctool软件对S W I强度和相位的信息进行图像后处理,得到相位图、幅值图及T2*图像。在相位图、幅值图上剔除基底节区并发钙化的病例,全部数据由2位M R I医师使用多边形测量工具,分别测量得出双侧额叶白质区、红核、黑质网状带、黑质致密带、尾状核头、壳核、苍白球和丘脑的T2*值(见图1~3),并取其均值以尽可能减少人为误差,不同意见共同协商达成一致意见。
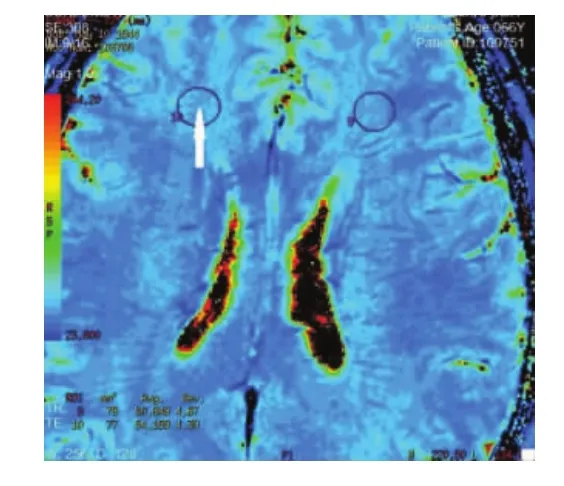
图1 双侧额叶白质区感兴趣区示意图

图2 红核、黑质致密带、黑质网状带感兴趣区示意图

图3 双侧尾状核头、壳核、苍白球及丘脑感兴趣区示意图
1.3统计学方法
采用S P SS 17.0统计软件进行数据分析,计量资料以均数±标准差(x±s)表示,用配对t检验分别比较男性组及女性组左、右侧各额叶白质区及灰质核团的T2*值,用独立样本t检验比较男性组与女性组不同侧别各脑深部核团及额叶白质区T2*值,用协方差分析来分析各额叶白质区及灰质核团的性别差异,P<0.05为差异有统计学意义。
2 结果
2.1男性组及女性组各感兴趣区的脑铁含量分布
男性组及女性组苍白球的T2*值最低,其次为黑质网状带、红核,额叶白质区的T2*值最高,说明男性组及女性组苍白球脑铁含量最高,其次为黑质网状带、红核,额叶白质区的脑铁含量最少。男性组左、右侧黑质网状带、黑质致密带的T2*值比较,经配对t检验,差异有统计学意义(t=2.052和2.525,P=0.044和0.014),女性组左、右侧黑质网状带的T2*值比较,经配对t检验,差异有统计学意义(t=3.317,P=0.002);其余感兴趣区的T2*值比较差异无统计学意义。见表1、2。
2.2男性组与女性组不同侧别各感兴趣区的脑铁含量比较
男性组与女性组不同侧别各感兴趣区的T2*值比较,经独立样本t检验,差异有统计学意义(左侧壳核:t=1.995,P=0.048;右侧丘脑:t=-2.072,P= 0.040),说明女性在壳核的脑铁含量低于男性,而丘脑的脑铁含量高于男性。余大脑区域的T2*值比较差异无统计学意义。见表3、4。
2.3大脑不同感兴趣区的脑铁含量与性别的相关性
表1 男性组左、右侧各感兴趣区的T2*值的比较 (ms,)
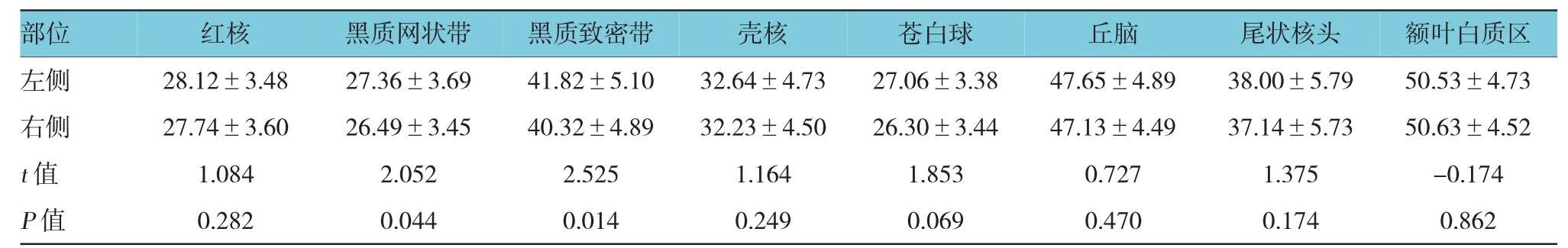
表1 男性组左、右侧各感兴趣区的T2*值的比较 (ms,)
部位额叶白质区左侧 2 8 . 1 2 ± 3 . 4 8 2 7 . 3 6 ± 3 . 6 9 4 1 . 8 2 ± 5 . 1 0 3 2 . 6 4 ± 4 . 7 3 2 7 . 0 6 ± 3 . 3 8 4 7 . 6 5 ± 4 . 8 9 3 8 . 0 0 ± 5 . 7 9 5 0 . 5 3 ± 4 . 7 3右侧 2 7 . 7 4 ± 3 . 6 0 2 6 . 4 9 ± 3 . 4 5 4 0 . 3 2 ± 4 . 8 9 3 2 . 2 3 ± 4 . 5 0 2 6 . 3 0 ± 3 . 4 4 4 7 . 1 3 ± 4 . 4 9 3 7 . 1 4 ± 5 . 7 3 5 0 . 6 3 ± 4 . 5 2 t值 1 . 0 8 4 2 . 0 5 2 2 . 5 2 5 1 . 1 6 4 1 . 8 5 3 0 . 7 2 7 1 . 3 7 5 -0 . 1 7 4 P值 0 . 2 8 2 0 . 0 4 4 0 . 0 1 4 0 . 2 4 9 0 . 0 6 9 0 . 4 7 0 0 . 1 7 4 0 . 8 6 2红核黑质网状带黑质致密带壳核苍白球丘脑尾状核头
表2 女性组左、右侧各感兴趣区的T2*值的比较 (ms,)

表2 女性组左、右侧各感兴趣区的T2*值的比较 (ms,)
部位额叶白质区左侧 2 8 . 1 0 ± 4 . 5 0 2 7 . 0 5 ± 4 . 3 4 4 0 . 4 6 ± 5 . 4 6 3 0 . 8 0 ± 5 . 6 4 2 5 . 8 5 ± 3 . 6 5 4 8 . 8 4 ± 5 . 0 0 3 7 . 6 9 ± 7 . 2 6 5 1 . 0 8 ± 5 . 7 8右侧 2 7 . 8 9 ± 3 . 8 9 2 5 . 6 4 ± 3 . 6 8 3 9 . 7 3 ± 4 . 9 1 3 0 . 9 2 ± 5 . 7 6 2 5 . 6 1 ± 3 . 1 7 4 8 . 6 8 ± 3 . 9 8 3 7 . 0 3 ± 5 . 8 5 5 0 . 4 0 ± 3 . 7 5 t值 0 . 5 9 0 3 . 3 1 7 1 . 3 1 0 -0 . 4 4 2 0 . 7 2 7 0 . 2 2 7 1 . 1 4 7 0 . 9 0 9 P值 0 . 5 5 7 0 . 0 0 2 0 . 1 9 5 0 . 6 6 0 0 . 4 7 0 0 . 8 2 1 0 . 2 5 6 0 . 3 6 7红核黑质网状带黑质致密带壳核苍白球丘脑尾状核头
表3 男、女性组各感兴趣区左侧的T2*值的比较 (ms)

表3 男、女性组各感兴趣区左侧的T2*值的比较 (ms)
部位额叶白质区男性 2 8 . 1 0 ± 4 . 5 0 2 7 . 0 5 ± 4 . 3 4 4 0 . 4 6 ± 5 . 4 6 3 0 . 8 0 ± 5 . 6 4 2 5 . 8 5 ± 3 . 6 5 4 8 . 8 4 ± 5 . 0 0 3 7 . 6 9 ± 7 . 2 6 5 1 . 0 8 ± 5 . 7 8女性 2 8 . 1 0 ± 4 . 5 0 2 7 . 0 5 ± 4 . 3 4 4 0 . 4 6 ± 5 . 4 6 3 0 . 8 0 ± 5 . 6 4 2 5 . 8 5 ± 3 . 6 5 4 8 . 8 4 ± 5 . 0 0 3 7 . 6 9 ± 7 . 2 6 5 1 . 0 8 ± 5 . 7 8 t值 0 . 0 2 6 0 . 4 3 1 1 . 4 5 4 1 . 9 9 5 1 . 9 3 5 -1 . 3 6 4 0 . 2 6 9 -0 . 5 9 2 P值 0 . 9 7 9 0 . 6 6 7 0 . 1 4 9 0 . 0 4 8 0 . 0 5 5 0 . 1 7 5 0 . 7 8 8 0 . 5 5 5红核黑质网状带黑质致密带壳核苍白球丘脑尾状核头
表4 男、女性组各感兴趣区右侧的T2*值的比较 (ms)

表4 男、女性组各感兴趣区右侧的T2*值的比较 (ms)
部位额叶白质区男性 2 7 . 7 4 ± 3 . 6 0 2 6 . 4 9 ± 3 . 4 5 4 0 . 3 2 ± 4 . 8 9 3 2 . 2 3 ± 4 . 5 0 2 6 . 3 0 ± 3 . 4 4 4 7 . 1 3 ± 4 . 4 9 3 7 . 1 4 ± 5 . 7 3 5 0 . 6 3 ± 4 . 5 2女性 2 7 . 8 9 ± 3 . 8 9 2 5 . 6 4 ± 3 . 6 8 3 9 . 7 3 ± 4 . 9 1 3 0 . 9 2 ± 5 . 7 6 2 5 . 6 1 ± 3 . 1 7 4 8 . 6 8 ± 3 . 9 8 3 7 . 0 3 ± 5 . 8 5 5 0 . 4 0 ± 3 . 7 5 t值 -0 . 2 3 9 1 . 3 4 6 0 . 6 8 1 1 . 3 6 6 1 . 1 8 0 -2 . 0 7 2 0 . 1 1 5 0 . 3 1 9 P值 0 . 8 1 1 0 . 1 8 1 0 . 4 9 7 0 . 1 7 4 0 . 2 4 0 0 . 0 4 0 0 . 9 0 8 0 . 7 5 0红核黑质网状带黑质致密带壳核苍白球丘脑尾状核头
由于年龄的增长伴随着脑铁含量逐渐增加,因此本课题采用男性组与女性组年龄相匹配以剔除年龄的影响。本组数据采用协方差分析,其中年龄作为协变量,性别作为自变量,以控制年龄对脑铁含量的影响。各个不同感兴趣区中,性别和年龄间均不存在交互作用(P>0.05)。红核、黑质网状部、黑质致密部、壳核、苍白球、丘脑、尾状核头、额叶白质区的T2*值与年龄之间存在线性关系(F=11.276、10.540、11.673、52.928、18.688、11.741、30.454和6.952,P= 0.001、0.001、0.001、0.000、0.000、0.001、0.000和0.009)(见图4)。控制年龄的影响后,红核、黑质网状部、黑质致密部、苍白球、尾状核头、额叶白质区的T2*值与性别无关(F=0.013、0.991、1.592、3.479、0.056和0.055,P=0.910、0.331、0.209、0.065、0.813和0.814),说明该6个脑区的T2*值不受性别差异的影响;而壳核、丘脑的T2*值与性别比较,差异有统计学意义(F=4.204和4.961,P=0.042和0.028),说明性别对这2个脑区的T2*值有影响。

图4 T2*值随年龄变化的散点图
3 讨论
3.1SW I的T2*值检测脑铁含量的可靠性及可行性
局部磁场的不均匀是S W I用来显示脑铁分布的基本原理[3-4]。S W I采用的是薄层三维容积扫描,较常规磁共振检查能更清晰地显示脑深部核团的细微形态和解剖结构,为本研究的测量提供较好的图像质量,得到的数据就更为准确。由于铁的顺磁效应可缩短T2*弛豫时间,造成T2*的缩短、信号降低,因此脑内铁的沉积量与T2*值相关[5]。本研究通过直接测量脑内结构的T2*值来推测脑铁沉积的分布变化,为反映脑内铁沉积分布、测量和观察其变化提供一种可靠的活体检测方法。
3.2脑铁的分布及含量
铁是脑组织新陈代谢所必需的微量元素之一,参与着体内氧气运输、细胞的有氧代谢活动等多项重要的生理功能。铁为许多重要酶能够发挥正常功能提供基础,并且参与髓鞘中脂质和胆固醇的合成[6]。不同的脑细胞摄取铁的能力不一致,并且在不同脑区铁的密度亦不同,因而脑铁的分布具有不均衡性[7],说明不同脑区对铁的需求量不同形成不同的功能区,尤其是苍白球与黑质网状部的铁含量最多,反应铁在锥体外系具有重要意义。S P A T Z[8]于1922年采用P erls染色法首先进行脑铁含量的系统研究,发现人体脑铁分布不一致,深部核团最高,皮质次之,白质最低。随后H A LL G R EN等[9]对81例死者脑标本的组织化学分析亦得出类似结果,锥体外系脑铁浓度最高,其次是灰质,白质最低。本课题的研究亦发现在苍白球脑铁含量最高,其次为黑质网状带、红核,额叶白质区的铁含量最少,与文献报道一致[8-10]。
3.3两侧脑铁含量的差异
本研究中男性组右侧黑质网状带、黑质致密带脑铁含量大于左侧,女性组右侧黑质网状带脑铁含量大于左侧,其余额叶白质区、红核、尾状核头、壳核、苍白球和丘脑左、右侧的脑铁含量比较,差异无统计学意义。说明左、右侧黑质网状带、黑质致密带脑铁含量存在侧别差异,与文献报道不一致[10-12]。夏爽等[10]采用磁敏感图对不同年龄63例健康志愿者脑铁含量进行定量测量,除壳核外,黑质、红核、苍白球、尾状核头、丘脑和额叶白质区的铁含量均为右侧大于左侧,得出左右两侧脑结构的铁含量存在不对称性。X U等[11]研究得出,右侧壳核、苍白球、黑质、丘脑以及额叶白质的脑铁含量低于右侧。而张京刚等[12]研究认为,右侧壳核、苍白球、黑质及尾状核的铁含量低于左侧,推测可能与人脑运动功能的半球优势差异及多巴胺系统半球有关。究其原因分析如下:①感兴趣区选取。本课题中除额叶白质外,各核团的勾画均在解剖结构清晰的最大层面S W I图像上人工进行,能更准确地测量脑铁含量;②成像方法的选择。X U[11]和张京刚等[12]采用的是S W I相位图的成像方法。国内外部分学者认为,S W I相位图是测量局部脑铁含量的较好方法[13-14]。但脑铁含量与相位值之间的绝对关系仍需进一步研究来加以证实[15]。而本研究直接测量T2*值来评价脑铁沉积的分布变化,较相位值更为可靠。③志愿者的选取及数量分布。据文献报道正常人深部灰质核团随着年龄的增长,铁在其部位的沉积逐渐增多[16-17]。本研究结果亦证明,大脑各脑区的T2*值与年龄之间存在线性关系。因此本研究选取年龄相匹配的受试者进行统计学分析,剔除年龄变化对脑铁含量的影响,较以上3种方法更为准确。
3.4脑铁含量与性别的相关性
本研究中女性在壳核的脑铁含量低于男性,而丘脑的脑铁含量高于男性,而在额叶白质区、黑质网状带、黑质致密带、红核、苍白球和尾状核头无性别差异,与文献报道不一致[11]。B A R T Z OK I S等[2]采用磁场依赖性R2增加技术对脑铁进行测量,得出脑铁含量存在性别差异。而X U等[11]对78例(男性40例,女性38例)年龄在22~70岁的成年健康志愿者进行S W I扫描,测量黑质、红核、苍白球、壳核、尾状核头、丘脑和额叶白质区的平均相位值,经统计学处理,男性与女性比较差异无统计学意义,而认为成年人的脑铁含量不存在性别差异。分析原因,与成像方法、感兴趣区人为误差、志愿者的选取及数量分布、习惯、人种的差别等有关。
3.5神经系统变性疾病的特定部位脑铁含量变化
国内外多位学者研究证实,神经系统变性疾病患者存在中枢神经系统铁的异常沉积[5-6、18-20]。常见的有帕金森病(par k inson disease,P D)、阿尔茨海默病(al z heimer disease,A D)、运动神经元病和多系统萎缩等。王波等[18]采用S W I的T2*值对40例原发性帕金森患者组及40例年龄、性别相匹配的正常对照组进行常规序列及S W I序列的扫描,发现在P D的亚临床期就有铁的异常沉积,局部铁含量的增加与单侧症状P D的发病有关,但与病情的严重程度无关;P D铁异常沉积的部位包括黑质致密部、黑质网状部、红核,与苍白球、壳核、丘脑和尾状核无关。S MI T H等[19]研究发现,轻度认知功能障碍(mildco gniti v e impairment,MCI)的患者皮质和小脑均有铁含量升高,采用S W I对MCI患者进行4年多的随访,发现进展为A D的MCI患者左侧壳核的铁含量增长速度较快,提示左侧壳核铁异常增加可能与认知功能减退密切相关。
综上所述,本研究得出成年男性黑质网状带、黑质致密带和女性黑质致密带脑铁含量存在侧别差异;成年男、女性在壳核及丘脑的脑铁含量存在性别差异。该结果使笔者对于生理状态下脑铁沉积有进一步的认识,为某些神经功能障碍性疾病中脑内过度铁沉积的鉴别及临床诊断提供依据。
[1]T A Y L O R K S,C OOK J A,C OU N S E LL C E.H etero g eneity in male to f emale ris k f or par k inson's disease[J].J Ne u rol Ne u ros u r g P sychiatry,2007,78(8):905-906.
[2]B A R T Z OK I S G,T I S H L E R T A,L U P H,et al.B rain f erritin iron in f l u ence a g e-and g ender-related ris k s o f ne u rode g eneration[J]. Ne u robiol Ag in g,2007,28(3):414-423.
[3]H AA C K E E M,C H EN G N Y,C H EN G Y C,et al.Su sceptibility w ei g hted ima g in g(S W I)[J].M a g n R eson M ed,2004,52(3):612-618.
[4]S E H G A L V,DE L P R O P O S T O Z,H AA C K E E M,et al.C linical applications o f ne u roima g in g w ith s u sceptibility-w ei g hted ima g in g[J]. M a g n R eson I ma g in g,2005,22(4):439-450.
[5]王波,马莎,戴敏方,等.原发性单侧症状帕金森病S W I脑铁沉积的定量研究[J].中国临床医学影像杂志,2013,24(4):234-238.
[6]张静,张云亭,何宁,等.磁敏感加权成像对帕金森病患者丘脑底核的显示价值初探[J].磁共振成像,2011,2(5):353-357.
[7]M OO S T,N I E LS EN T R,S KJO RR I N G E T,et al.I ron tra ff ic k in g inside the brain[J].J Ne u rochem,2007,103(5):1730-1740.
[8]S P A T Z H.Über den eisennach w eis im g ehirn,besonders in z entren des e x trapyramidal-motorischen systems.I.Teil[J].Z eitschri f t Für Die G esamte Ne u rolo g ie u nd P sychiatrie,1922,77(1):261-290.
[9]H A LL G R EN B,S OU R A NDE R P.The e ff ect o f a g e on the nonhaemin iron in the h u man brain[J].J Ne u rochem,1958,3(1):41-51.
[10]夏爽,柴超,沈文,等.M R定量磁敏感图评估正常人脑铁含量的初步研究[J].中华放射学杂志,2014,48(9):730-735.
[11]X U X J,W A N G Q D,Z H A N G M M.Ag e,g ender,and hemispheric di ff erences in iron deposition in the h u man brain:an in v i v o M R I st u dy[J].Ne u ro I ma g e,2008,40(1):35-42.
[12]张京刚,胡春洪,邢伟,等.正常人脑核团铁含量分布及年龄相关性M R磁敏感成像初步研究[J].实用放射学杂志,2012,28(8): 1159-1163.
[13]H AA C K E E M,A Y A Z M,KH A N A.Establishin g a baseline phase beha v ior inma g neticresonance ima g in gto determine normal and abnormal iron content in the brain[J].J M a g n R eson I ma g in g,2007,26(2):256-264.
[14]Z H A N G W,S U N S G,J I A N G YH,et al.Determination o f brain iron content in patients w ith par k inson's disease u sin g ma g netic s u sceptibility ima g in g[J].Ne u rosci B u ll,2009,25(6):353-360.
[15]H AA C K E E M,MI TT A L S,WU Z,et al.Su sceptibility-w ei g hted ima g in g:technical aspects and clinical applications,part 1[J]. A J N R A m J Ne u roradiol,2009,30(1):19-30.
[16]毛磊,戴建平,孙波.磁敏感加权成像观察健康人群脑内铁含量[J].中国医学影像技术,2009,25(6):996-998.
[17]苗延巍,刘婷,伍建林,等.磁敏感加权成像评价正常人大脑灰质铁代谢[J].中国医学影像技术,2009,25(3):377-379.
[18]王波,戴敏方,王云勇,等.帕金森病脑内铁沉积的S W I定量研究[J].放射学实践,2012,27(11):1174-1179.
[19]S MI T H M A,Z HU X W,T A B A T O N M,et al.I ncreased ironand f ree radical g eneration in preclinical A l z heimer disease and mild co g nati v e impairment[J].J A l z heimer's Dis,2010,19(1):363-372.
[20]de R E U C K J,A U G E R F,C O R D O NN I E R C,et al.C omparison o f 7.0-T T2W ma g netic resonance ima g in g o f cerebral bleeds in post-mortem brain section o f A l z heimer patient w ith their ne uropatholo g ical correlates[J].C erebro v asc u lar Diseases,2011,31(5): 511-517.
(童颖丹 编辑)
Study of gender-related iron deposition in brain using T2*value*
Bo Wang,Sha Ma,Mao-ping Rui,Jing Chen,Hong-jiang Zhang,Hong-ying Dai,Yu-hui Chen,Jie Zhan g
[The First People's Hospital of Yunnan Province(The Affiliated Hospital of Kunming University of Science and Technology),Kunming,Yunnan 650032,China]
Objective To quantitatively analyze the iron deposition in deep brain gray nuclei and frontal white matter in healthy population and its correlation with gender using susceptibility-weighted imaging(SWI)with 3.0 Tesla scanner.Methods A total of 128 healthy subjects(64 males and 64 females,aged 25 to 85 years)were scanned with routine sequences and SWI sequences by 3.0T MR.T2*value was measured in left and right frontal white matter,red nucleus,substantia nigra pars reticulata,substantia nigra pars compacta,globus pallidus,putamen,head of caudate nucleus and thalamus;the correlations between the T2*value and gender were analyzed.Results The T2*value was the lowest in the globus pallidus,followed by substantia nigra reticulata and red nuclei.The highest T2*value was seen in the frontal white matter.The T2*value of the right substantia nigra compacta and substantia nigra pars reticulata was lower than that of the left-side one in the males(P<0.05),and the T2*value of the right substantia nigra pars reticulate was lower than that of the left-side one in the females(P<0.05).The T2*value of putamen and thalamus was significantly different between the males and the females(P<0.05).Conclusions Using T2*value,a significant correlation has been found between putamen and thalamus iron deposition and gender in health population.
magnetic resonance imaging;brain iron deposition;gender
R 445.2
A
10.3969/j.issn.1005-8982.2016.15.015
1005-8982(2016)15-0081-06
2015-12-04
云南省教育厅科学研究基金重点项目(No:2015Z052);云南省第一人民医院昆华·奥新科技计划项目(No:2014D S008)
张洁,E-mail:994100457@qq.com;Tel:13808709420

