孤独症谱系障碍儿童尾状核头的弥散峰度成像研究
孙永兵,赵鑫,陆林,邢庆娜,何雄鹏,张小安*
作者单位:1.郑州大学第三附属医院放射科,郑州 450052;2.郑州大学神经科学研究所,郑州 450052
孤独症谱系障碍(autism spectrum disorder,ASD)是一种神经发育障碍性疾病,其特征是持续的社会交往、沟通障碍、刻板印象或重复行为和兴趣。据美国最新流行病学报道,8岁以下儿童ASD患病率为1/54[1],我国6~12岁儿童为0.29%[2],且患病率逐年升高,全球患病率约1%[3]。迄今为止,ASD病因不明确。语言障碍是ASD儿童监护人最易察觉异常的症状,语言障碍虽不是ASD最常见症状,却是最常见的住院原因[4]。一项关于ASD预后的纵向研究表明,儿童时期语言延迟可能会导致语言效果不佳,如语言智商下降,成年后词汇生成能力较差[5]。皮质下灰质结构,特别是纹状体,在语言加工中发挥重要作用[6]。神经成像研究表明,左侧尾状核头与语言控制过程关系密切[7-8]。弥散峰度成像(diffusional kurtosis imaging,DKI)作为一种描述复杂组织的非高斯水分子弥散技术,可敏感地检测大脑灰质核团的微结构改变[9]。ASD伴语言障碍儿童尾状核头改变仍不清楚,本研究应用DKI分析2~5岁ASD儿童尾状核头改变,探索尾状核头与临床言语测评分数的关系。
1 对象和方法
1.1 研究对象
回顾性分析2019年10月至2021年8月郑州大学第三附属医院儿童保健科首次确诊为ASD伴语言障碍儿童34 例及同期体检的健康儿童30 例。ASD伴语言障碍儿童排除标准:精神发育迟缓、发育性语言障碍等精神疾病史、已行药物或行为学干预、有明显出生缺陷、存在MRI检查禁忌证、MRI检查脑部存在明显器质性病变等儿童。健康儿童排除标准:头部外伤史,语言发育迟缓等神经系统疾病。所有样本均为右利手,家庭用语为汉语。本研究符合赫尔辛基宣言,所有参与者家长均被告知MRI检查目的及可能影响。本研究通过郑州大学第三附属医院伦理委员会批准(批准文号:2021-138-01),免除受试者知情同意。
1.2 方法
1.2.1 评估工具
病例组采用以下工具进行评估。(1)自制调查问卷:记录检查者及其家庭一般情况,包括受检者基本信息、出生孕周、出生体质量、检查体质量、喂养方式(A母乳、B配方奶、C混合)、父母受教育程度(①小学及以下,②初中-高中,③本科及以上)、母孕史等;(2)诊断依据美国精神障碍诊断统计手册第5 版[10],儿童孤独症评定量表得分≥30 分;(3)自闭症儿童心理教育评核第三版[Psychoeducational Profile (Third Edition),PEP-3][11]由发展和行为10个副测试以及儿童照顾者报告两部分组成,最终得到沟通合成分数、体能合成分数和行为合成分数,其中沟通得分是由副测试的认知得分、语言表达和语言理解得分合成,主要是评估儿童说话、聆听、阅读和读写能力,分数越高,表示其沟通能力越强。
对照组应用自制调查问卷和PEP-3 量表进行评估,以上量表均由临床经验丰富的发育行为学专业医生进行双盲评定。问卷信息不完善时,调查员通过现场提醒或电话回访以补充数据。
1.2.2 MRI数据采集
MRI 检查:所有儿童检查前30 min注射5 mg/kg苯巴比妥,检查时耳朵内塞入棉球以减少设备噪音对听力的影响,海绵固定在被试者头部两侧以减少运动伪影。应用美国GE 公司3.0 T 扫描仪(SIGNA.Pioneer) 16 通道头线圈待儿童熟睡后行颅脑MRI 检查,包括常规T1 (TR/TE=1750 ms/24 ms)、T2 (TR/TE=5552 ms/128 ms)序列,以排除大脑器质性病变。科研序列包括DKI:轴位,TR/TE=8200 ms/2.3 ms,视野200 mm×200 mm,矩阵256×256,激励次数1,层厚4 mm,层间距0 mm,b 值为0、1000 和2000 s/mm2,层数27,扫描时间7 min 23 s。集成磁共振序列(Synthetic MR,SyMRI):轴位,TR/TE=4266 ms/19.4 ms,视野200 mm×200 mm,矩阵22,激励次数1,层厚4 mm,层间距1.0 mm,层数27,扫描时间4 min 30 s。
1.2.3 图像处理与数据测量
将扫描后的DKI图像导入工作站iQuant进行处理,获得各向异性分数(fractional anisotropy,Fa)、平均弥散系数(mean diffusivity,Md)、轴向弥散系数(axial diffusivity,Da)、径向弥散系数(radial diffusivity,Dr)、平均弥散峰度(mean kurtosis,Mk),轴向弥散峰度(axial kurtosis,Ka)和径向弥散峰度(radial kurtosis,Kr)伪彩图。将SyMRI序列导入供应商提供的程序SyMRI 8.0 (Synthetic MR,Linköping,瑞典),自动分割颅脑,得到白质体积、灰质体积、脑脊液体积、非白质/灰质/脑脊液体积和髓鞘化体积并记录。
将处理后的7 个DKI 伪彩图依次导入ITK-SNAP 3.8.0软件,由一位经过培训的神经影像学研究生进行手动勾画感兴趣区(region of interest,ROI),并由一位十年以上经验的神经影像医生进行核准。在Fa图上清晰显示尾状核头、壳核时应用正方形测量工具,以6个体素(87~88 mm2)大小为单位进行勾画,如图1所示。每次测量均置于ROI正中部位,以减少周围组织污染,取测量三次的平均值。最终得到左右双侧尾状核头DKI参数值,并计算出右-左尾状核头比率R0(R0=右尾状核头/左尾状核头)。

图1 感兴趣区勾画LV:侧脑室;ALIC:内囊前肢;PLIC:内囊后肢;LN:壳核;黄色:右侧尾状核头;红色:左侧尾状核头。Fig. 1 Zone of interest delineation.LV: lateral ventricles;ALIC: anterior limb of internal capsule; PLIC: posterior limb of internal capsule; LN: putamen;Yellow:caput nuclei caudate of the right;Red:caput nuclei caudate of the left.
1.3 统计学分析
使用SPSS 25.0软件进行数据分析。符合正态分布的资料组间比较采用t检验,用均数±标准差表示,非正态分布资料采用Mann-WhitneyU检验,以中位数(上四分位数,下四分位数)表示。计数资料比较采用卡方检验,有序等级变量比较用Wilcoxon符号秩检验。两组尾状核头DKI特征值比较用协方差分析,Spearman相关性分析尾状核头显示差异的DKI参数值与语言评分之间的关系。P<0.05为差异有统计学意义。
2 结果
共收集35例ASD伴语言障碍儿童,其中1名儿童因脑部点片状脑软化灶被剔除,最终纳入34 例,男26 例,女8 例,年龄24~56 (34.97±9.72)个月。共收集32 例健康对照组儿童,排除1 名图像有运动伪影及1名蛛网膜囊肿儿童,最终纳入30例。男23例,女7例,年龄26~52 (34.80±8.90)个月。
2.1 两组人口学资料比较
两组儿童性别、年龄、检查时体质量、出生体质量、喂养方式、父母双亲学历、脑脊液体积、非白质/灰质/脑脊液体积和髓鞘体积差异均无统计学意义(P>0.05),见表1。与对照组比较,病例组白质体积(P=0.003)和灰质体积增大(P=0.010),沟通分数、语言理解和语言表达分数均降低(P均<0.001)。
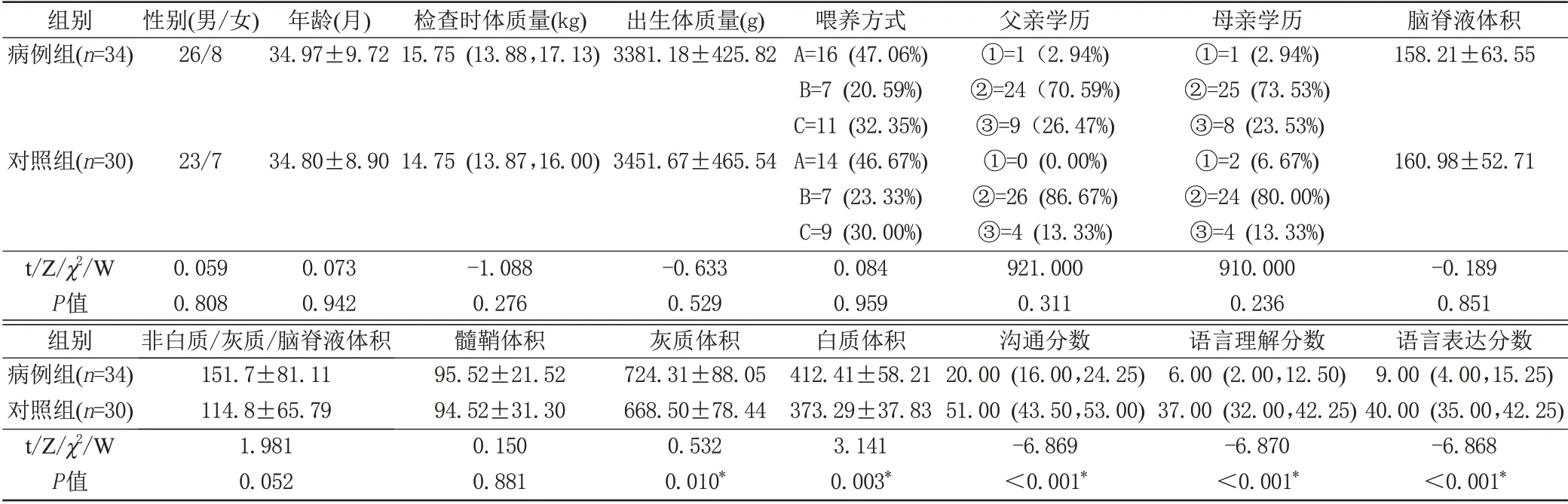
表1 两组儿童基线资料比较Tab.1 Comparison of baseline data between the two groups
2.2 两组尾状核头DKI参数值比较
控制协变量(白质体积和灰质体积)后,比较两组儿童尾状核头DKI参数的差异,结果显示与对照组相比,ASD组R0-Da值增大(P=0.049),左侧尾状核头Kr值增大(P=0.049),左侧尾状核头Mk 值增大(P=0.046),右/左尾状核头MK值减小(P=0.014)。如表2所示。

表2 两组儿童尾状核头DKI参数的比较Tab.2 Comparison of DKI parameters of caudate nucleus head between the two groups
2.3 两组语言得分与尾状核头DKI 参数值相关性分析
研究发现对照组左侧尾状核头Kr与语言理解分数呈负相关(r=-0.514,P=0.004),左侧尾状核头Mk与语言理解和语言表达分数均呈负相关(r=-0.701,P<0.001)、(r=-0.614,P<0.001),R0-Mk值与语言理解和语言表达分数均呈正相关(r=0.481,P=0.007)、(r=0.410,P=0.025)。ASD组双侧尾状核头及R0-DKI特征值与语言评分均未发现相关性(P>0.05)。如图2、3。

图2 ASD 组尾状核头R0‑Da、左尾状核头Kr、左尾状核头Mk、尾状核头R0‑Mk分别与沟通分数、语言理解分数、语言表达分数相关性分析。Da:轴向弥散系数,Mk:平均弥散峰度,Kr:径向弥散峰度。Fig. 2 Correlation analysis of R0‑Da, Kr, Mk, and R0‑Mk with communication score, language comprehension score, and language expression score in the ASD group.Da:axial diffusivity;Mk:mean kurtosis;Kr:radial kurtosis.
3 讨论
本研究应用DKI 对ASD 伴语言障碍儿童尾状核头结构进行分析,探索尾状核头DKI参数值与语言评分的相关性,结果发现ASD儿童尾状核头微结构异常并可能破坏语言形成过程。此研究为探索ASD 的神经生物学机制提供了新的线索。
3.1 ASD儿童大脑体积异常
大量研究表明,ASD幼儿患者颅内体积增大[12],且未发现此差异是由ASD特定亚类驱动。本研究中ASD组儿童白质和灰质体积大于对照组,与先前的研究一致[13]。目前结果显示,过度生长可能在ASD 中持续存在,且灰质和白质发育失衡[14-15]。我们认为,ASD 儿童大脑可能存在大量纤维束的无效链接导致大脑连通性异常[16],信息传递的异常导致纤维束病理性增生,从而导致脑白质体积增大。研究表明ASD患者在额叶、顶叶和颞叶广泛分布的白质连接性降低,并与社会意识和同理心困难有关[17]。ASD儿童灰白质体积增大也可能与其脑突触棘突密度下降不足有关,由于其突触修复功能不足,导致神经元体积的增大[18]。
3.2 ASD组儿童尾状核头

图3 对照组尾状核头R0‑Da、左尾状核头Kr、左尾状核头Mk、尾状核头R0‑Mk分别与沟通分数、语言理解分数、语言表达分数相关性分析。Da:轴向弥散系数,Mk:平均弥散峰度,Kr:径向弥散峰度。Fig. 3 The correlation analysis of R0‑Da, Kr, Mk, and R0‑Mk with communication score, language comprehension score, and language expression score in the control group was conducted.Da:axial diffusivity;Mk:mean kurtosis;Kr:radial kurtosis.
Wegiel等[19]报道ASD患者尾状核体积增加,推测可能与神经元密度有关。本研究显示与对照组相比,病例组儿童左侧尾状核头Kr值和Mk值增大,R0-Da值升高,R0-Mk值降低。DKI表示非高斯分布的水分子弥散特性,可反映组织微观结构特征[20],参数值越大表明弥散受限越严重,组织微结构越复杂[21]。一项针对小鼠脑结构的DKI研究表明,DKI参数与尾状核中神经密度之间具有很强的正相关性[22]。Mk是DKI最常用的参数之一,代表组织沿空间各方向弥散峰度的平均值。左侧尾状核头Mk值增大,表明左侧尾状核头内部结构紊乱,而右侧尾状核头结构变化不明显,随之R0-Mk值降低。Da值反映水分子沿轴突传导方向结构变化,R0-Da值增大,可能因为左侧尾状核头树突和神经元消除过程受阻,树突的过度生长和分枝导致水分子沿轴突弥散时阻力增大。Kr值表示水分子垂直于轴突纤维方向弥散的峰度值,本研究中左侧尾状核头Kr值增大,提示其髓鞘结构异常。一项基于波谱研究证明,ASD患者尾状核头存在代谢异常及结构紊乱,且左侧尾状核头的代谢比右侧低[23],结合我们的结果,表明ASD儿童尾状核头可能存在偏侧化结构改变。
3.3 语言能力与尾状核头相关性
人们普遍认为语言功能由一系列皮质区域控制,Brodmann47区(参与语义特征工作记忆的皮质区域)的皮质-纹状体神经元投射到尾状核,特别是尾状核头[24]。一项关于尾状核头偏侧化与语言发育研究表明,儿童语言发育受到尾状核头微结构变化的影响[25],且尾状核-语言功能受认知功能的调节。我们的研究显示,对照组尾状核头与语言评分之间存在相关性,而ASD组未见相关性。对照组左侧尾状核头Kr值与语言理解得分,Mk值与语言表达和语言理解得分均呈负相关,R0-Mk 与语言理解和语言表达得分呈正相关,而R0-Da未检测到与语言分数显著的相关性关系,表明尾状核头Mk值能更敏感地量化语言能力。本研究未发现对照组儿童尾状核头DKI参数与沟通分数之间的相关性,沟通分数除语言理解和语言表达得分外,还包括认知得分,因为语言学习与认知功能密切相关,认知功能受环境因素影响较大,所以尾状核头DKI值可能无法量化这种关系。本研究还发现ASD组尾状核头微结构改变可能损害了语言加工传递过程,虽然ASD儿童尾状核头仍存在偏侧化,但是尾状核头破坏后的脑网络连接可能已失效。我们的结论与Sui 等的研究结果[26]相似。总之,ASD儿童尾状核头存在异常改变,其偏侧化改变可能影响了语言正常功能。目前,DKI 已被用于研究ASD患者的脑白质和灰质改变[27-28]。
本研究也存在局限性,“语言发展”的复杂过程由不同大脑区域和网络支持,这些区域和网络从早期就开始发育,受到遗传、环境和社会经济因素的影响,因此,未来的研究应采取更全面的方法,将这些因素纳入到ASD 的研究模型中。特别是纵向考察这些因素的大规模研究可能会更好地理解语言不同发展阶段的复杂关系。此外,本研究未将ASD组进行严重程度分类,不同程度的ASD 可能语言能力差异较大,未来研究将会对ASD 组进行更精确分类,期望能进一步揭示ASD儿童语言受损的病理生理过程。
作者利益冲突声明:全体作者均声明无利益冲突。

