胃癌中m i c roRN A-218调控BM I1基因表达的作用及机制*
范中平,胡悦东,黄宝俊
(1.本溪钢铁公司总医院 普外科,辽宁 本溪 117000;2.中国医科大学附属第一医院 眼科,辽宁 沈阳 110001;3.中国医科大学附属第一医院 肿瘤外科,辽宁 沈阳 110001)
论著
胃癌中m i c roRN A-218调控BM I1基因表达的作用及机制*
范中平1,胡悦东2,黄宝俊3
(1.本溪钢铁公司总医院 普外科,辽宁 本溪 117000;2.中国医科大学附属第一医院 眼科,辽宁 沈阳 110001;3.中国医科大学附属第一医院 肿瘤外科,辽宁 沈阳 110001)
目的探讨胃癌中m i c ro R NA-218(m i R-218)调控B M I1基因表达的作用及机制。方法应用实时定量聚合酶链反应(r ea l-t i m e P C R)检测胃癌及癌旁组织中m i R-218及B M I1基因的表达。将m i R-218的前体(m i R-218 p r e c ur s or)转染胃癌B GC823细胞,W e s t e r n blot检测B M I1蛋白的表达。应用荧光素酶实验分析m i R-218是否与B M I1基因3’非翻译区(3’-U T R)结合。结果R T-P C R结果显示,相对癌旁组织,胃癌组织中m i R-218的表达下调显著,而B M I1在胃癌组织中的表达则呈现明显的上调,m i R-218与B M I1在胃癌及癌旁组织中的表达均为明显的负相关。在转染m i R-218 p r e c ur s or的胃癌B GC823细胞中,B M I1的蛋白表达显著下调。荧光素酶实验结果证实m i R-218能够特异性地结合B M I1基因的3’-U T R,并与其表达呈负相关。结论m i R-218与B M I1基因的表达异常与胃癌的发生相关,B M I1基因是m i R-218的靶基因,m i R-218在胃癌细胞中能够靶向沉默B M I1基因。
胃癌;m i c ro R NA-218;B M I1;B GC823细胞
胃癌是我国最常见的恶性肿瘤之一,发病率居各类肿瘤之首[1]。胃癌的治疗方法是以手术为主,结合放化疗的综合治疗,但部分中晚期患者的预后不良,治疗效果欠佳,因此深入探究胃癌发生、发展的分子机制,寻找效果更佳、特异性更好的治疗靶点和方法是胃癌相关研究的重点。M icro R N A(mi R)是一类在多种生物中广泛存在的小分子非编码R N A,能够与靶基因的3’非翻译区(3’-U T R)特异性地互补结合,通过抑制靶基因m R N A的翻译或者将m R N A剪切降解,发挥沉默靶基因表达的作用[2]。mi R通过抑制靶基因的表达和功能,参与调节增殖分化、凋亡和侵袭转移等多种细胞生物学行为,并在多种复杂疾病及肿瘤的发生、发展中发挥重要作用[3-4]。本研究通过分子生物学方法探究mi R-218在胃癌细胞中调控B MI1基因表达的作用及机制。
1 材料与方法
1.1材料
选取2010年9月-2013年4月在本溪钢铁公司总医院普外科及中国医科大学附属第一医院肿瘤外科诊断为胃癌的住院患者38例,男性26例,女性12例;年龄46~61岁,中位年龄56.2岁。取患者组织标本,包括肿瘤组织及距肿瘤边缘>5 cm的癌旁组织。人胃癌B GC823细胞系由中国医科大学附属第一医院肿瘤外科提供。
1.2试剂
mi R的提取及检测相关试剂、mi R-218前体(mi R-218 prec u rsor)及mi R对照购自A mbion公司,B MI1基因 3’-U T R的野生型荧光素酶载体p G L3-W t.U T R(W t) 和突变型荧光素酶载体p G L3-M u t.U T R(M u t,于3’-U T R第1470~1477碱基序列引入突变)由上海吉玛公司构建,荧光素酶活性检测试剂盒购自I n v itro g en公司,W estern blot检测相关试剂购自上海碧云天公司,转染试剂Transmessen g er购自Q ia g en公司,B MI1小鼠抗人单克隆抗体购自S anta C r uz公司。
1.3实验方法
1.3.1实时定量聚合酶链反应提取待测组织标本中的小非编码R N A,对其进行3’端加P oly A处理,然后进行逆转录。以管家基因U6为内参基因,按照实时定量聚合酶链反应(real-time PC R)检测试剂盒说明书进行操作,扩增mi R-218。所得实验数据应用比较C t值法,即2-ΔΔCt法进行结果分析。
1.3.2细胞转染转染前24 h,在6孔板中每孔接种5×104个B GC823细胞,继续培养。取试剂盒中的Enhanser R试剂,将30 pmol待转染的mi R与其混合,加入Trans M essen g er试剂4μl混匀,再加入无血清培养基至1 000μl混匀。弃去B GC823细胞的培养基,将上述混合液加入培养孔内,孵育2 h,然后转为正常培养基培养。
1.3.3W e s t e r n blot检测收获待测细胞,提取蛋白,定量。蛋白样品经S D S-P A G E电泳后,转印至P V D F膜,再经封闭液封闭、抗体杂交孵育和发光成像等操作后得到包含B MI1蛋白条带,应用凝胶成像分析系统对条带进行定量分析。
1.3.4荧光素酶实验分别将mi R-218 prec u rsor 或mi R对照与野生型或突变型重组载体共转染至胃癌B GC823细胞中。其中A组B GC823细胞共转染 mi R-218 prec u rsor和野生型重组载体,B组B GC823细胞共转染mi R对照和野生型重组载体,C 组B GC823细胞共转染mi R-218 prec u rsor和突变型重组载体,D组B GC823细胞共转染mi R对照和突变型重组载体。转染后的B GC823细胞,按照双荧光素酶试剂盒说明书检测荧光素酶相对活性。
1.4统计学方法
采用S P SS 18.0统计软件进行数据分析,计量资料用均数±标准差(x±s)表示,检验数据的正态性以确定其分布情况,多组比较用单因素方差分析,两组比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1胃癌组织中m i R-218的表达
应用比较C t值法对R T-PC R的结果进行相对定量分析,结果显示,mi R-218在胃癌组织中的△C t值为(4.72±0.13),而在癌旁组织中的△C t值为(3.54±0.15),△△C t值为1.18。胃癌组织中mi R-218的表达量是癌旁组织的44.29%,胃癌组织中mi R-218表达降低(P<0.01)。
2.2胃癌组织中BM I1的表达及其与m i R-218表达的相关性
相对定量分析结果显示,B MI1在胃癌组织中的△C t值为(2.96±0.15),而在癌旁组织中的△C t值为(3.8±0.16),△△C t值为-0.91。胃癌组织中B MI1的表达量为癌旁组织的188.03%,胃癌组织中B MI1的表达增强(P<0.01)。P earson相关性分析显示,B MI1 和mi R-218在胃癌及其癌旁组织中的表达均表现出明显的负相关,相关系数为-0.793。
2.3m i R-218 pre c u rsor转染B G C823细胞后对BM I1蛋白表达的影响
各组 W estern blot结果见图 1。未转染的B GC823细胞和转染mi R对照的B GC823细胞间,B MI1蛋白的相对表达量差异无统计学意义;而两组B GC823细胞比较,转染 mi R-218 prec u rsor的B GC823细胞中的B MI1蛋白下调(P<0.01)。
2.4荧光素酶实验

图1 m i R-218 pre c u rsor对B G C823细胞中BM I1蛋白表达的影响
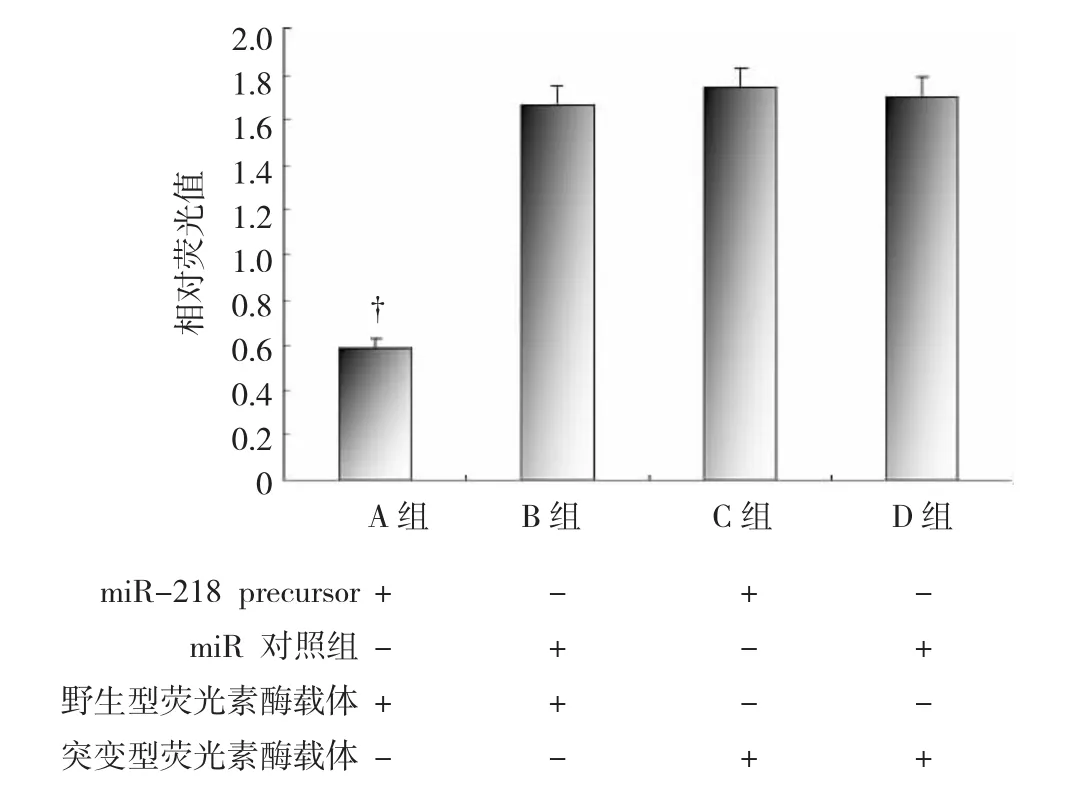
图2 荧光素酶实验报告的基因表达验证m i R-218 对BM I1基因的调控
在荧光素酶实验中,mi R-218 prec u rsor或mi R对照与野生型或突变型重组载体被按照不同的组合形式共转染至胃癌B GC823细胞中。检测被转染细胞的相对荧光值,结果显示,与转染mi R对照组B GC823细胞比较,共转染mi R-218 prec u rsor和野生型重组载体的B GC823细胞的相对荧光值下降,提示mi R-218能够与B MI1基因3’-U T R结合,并抑制荧光素酶的表达。而共转染mi R-218 prec u rsor和突变型重组载体的B GC823细胞的相对荧光值无明显改变,说明结合位点序列的改变使其失去与mi R-218结合的能力。见图2。
3 讨论
多梳基因家族(polycomb g ro u p g enes,P c G)是一组与细胞周期和增殖相关的重要基因,包括一系列转录抑制子,与多种恶性肿瘤的发生、发展相关[5-6]。1991年发现的细胞特异莫洛尼白血病病毒插入位点1(B MI1)基因亦归属于P c G基因家族[7],其在结直肠癌和胃癌中的表达显著下调,而且其表达异常与肿瘤的发生、发展、侵袭转移以及预后等多项临床病理指标相关[8-10]。本研究首先对38例胃癌组织进行B MI1基因表达检测,结果显示,与癌旁组织相比,胃癌组织中B MI1基因的m R N A表达增强。本实验结果与上述报道相符,B MI1基因在胃癌组织中确实存在明显的表达异常,B MI1基因可能作为癌基因在胃癌的发生中发挥重要作用。但是胃癌中B MI1基因表达下调的原因及机制尚不清楚。
为分析胃癌中B MI1基因表达下调的原因,明确mi R N A s是否在其中发挥作用,本研究采用多种生物信息学软件进行分析预测,分析结果显示,B MI1基因m R N A的3’-U T R上存在mi R-218的结合位点,位于3’-U T R第1470~1477碱基序列。为验证上述预测结果,明确mi R-218能够作为上游调控基因参与调节B MI I1的表达和功能,本研究将mi R-218 prec u rsor转染胃癌B GC823细胞以提高mi R-218的表达水平。后续的W estern blot检测发现,转染mi R-218 prec u rsor的B GC823细胞中,B MI1蛋白的表达下调,这提示mi R-218能够参与调节B MI1基因的表达,B MI1基因可能是mi R-218的靶基因。本研究发现,mi R-218在胃癌组织的表达下调,而且在胃癌组织及对应的癌旁组织中B MI1 m R N A与mi R-218的表达水平均表现出显著的负相关。上述实验结果进一步明确笔者对于mi R-218能够作为上游调控基因参与调节B MI1表达的推测,但调控机制如何,mi R-218是否通过与B MI1基因m R N A 的3’-U T R结合抑制其翻译,从而下调B MI1基因的表达尚不清楚。荧光素酶实验分析结果显示,mi R-218能够与B MI1基因3’-U T R的野生型载体结合,抑制荧光素酶的表达,而突变型载体则不能引起荧光素酶的表达下降,说明结合序列的改变使其失去与mi R-218结合的能力,也证实mi R-218确实是与B MI1基因3’-U T R第1470~1477碱基序列特异性结合的。
综上所述,B MI1基因是mi R-218的靶基因之一,mi R-218能够沉默B MI1基因的表达。mi R-218在胃癌中表达下调,失去沉默B MI1基因表达的作用,使B MI1基因在胃癌中表达上调,B MI1基因作为胃癌的一个癌基因存在。
[1]赵久达,李豪,曹成珠,等.1962例胃癌流行病学分析[J].现代预防医学,2008,35(3):439-440.
[2]CIP O LL I N I M,L A ND I S,G E MIG N A N I F.M icro R N A bindin g site polymorphisms as biomar k ers in cancer mana g ement and research[J].P harm g enomics P ers M ed,2014,23(7):173-191.
[3]OO M A L,HU MP H R I E S B A,Y A N G C.M icro R N A s:no v el players in cancer dia g nosis and therapies[J].B iomed R es I nt,2014(2014):959461.doi:10.1155/2014/959461.
[4]H A Y E S J,P E R U ZZ I P P,L A W L E R S.M icro R N A s in cancer: biomar k ers,fu nctions and therapy[J].Trends M ol M ed,2014,20(8): 460-469.
[5]A L O I A L,S TE F A N O B D,C R O C E L D.P olycomb comple x es in stemcells and embryonic de v elopment[J].De v elopment,2013,140(12):2525-2534.
[6]C R E A F,P A O L ICC H I E,M A R Q U E Z V E,et al.P olycomb g enes and cancer:time f or clinical application[J].C rit R e v O ncol H ematol,2012,83(2):184-193.
[7]L OHU I Z EN M V,V E R B EE K S,S C H E I J EN B,et al.I denti f ication o f cooperatin g onco g enes in E m u-myc trans g enic mice by pro v ir u s ta gg in g[J].C ell,1991,65(5):737-752.
[8]L U H,S U N H Z,L I H,et al.The clinicopatholo g ical si g ni f icance o f B mi-1 e x pression in patho g enesis and pro g ression o f g astric carcinomas[J].A sian P ac J C ancer P re v,2012,13(7):3437-3441.
[9]P U N J C S,C H A N JY J,C HU N B K M,et al.P lasma B mi1 m R N A as a potential pro g nostic biomar k er f or distant metastasis in colorectal cancer patients[J].M ol C lin O ncol,2014,2(5):817-820.
[10]R A J A B P OU R F V,R A OO F I A N R,YOU SS E F I A N L,et al. B MI1 and T W I S T1 do w nre g u lated m R N A e x pression in basal cell carcinoma[J].A sian P ac J C ancer P re v,2014,15(8):3797-3800.
(申海菊 编辑)
Effect and mechanism of m icroRNA-218 in regulation of BM I1 gene in gastric cancer*
Zhong-ping Fan1,Yue-dong Hu2,Bao-jun Huang3
(1.Department of General Surgery,the General Hospital of Benxi Iron&Steel Co.,Benxi,Liaoning 117000,China;2.Department of Ophthalmology,3.Department of Oncosurgery,the First Affiliated Hospital of China Medical University,Shenyang,Liaoning 110001,China)
Objective To explore the mechanism of microRNA-218(miR-218)in regulation of BMI1 gene in gastric cancer.M ethods Quantitative real-time PCR was used to detect the expression of miR-218 and BMI1 mRNA in gastric cancer and adjacent tissues.Western blot was used to investigate BMI1 protein level and luciferase assay was used to verify the ability of miR-218 binding to BMI1 after miR-218 precursor transfected into gastric cancer BGC823 cells.Results Quantitative real-time PCR results showed that miR-218 was down-regulated and BMI1 was up-regulated in gastric cancer tissues compared to the adjacent tissues;in both tissues miR-218 and BMI1 expressions were negatively correlated.Western blot and luciferase assay revealed that miR-218 could negatively regulate BMI1 protein expression by binding to the 3'-UTR of BMI1 gene.Conclusions The abnormal expressions of miR-218 and BMI1 are involved in gastric carcinogenesis;and miR-218 could target and silence BMI1 gene expression in gastric cells.
gastric cancer;miR-218;BMI1;BGC823 cell
R 735.2
A
10.3969/j.issn.1005-8982.2016.15.012
1005-8982(2016)15-0065-04
2015-12-23
国家自然科学基金(No:81272716)
黄宝俊,E-mail:h u an g bao j u n2014@163.com

