氯氰菊酯对小鼠小脑组织氧化损伤及核转录因子-E2相关因子2基因表达的影响
周礼华,陈 冲,张 朋,王 力,吴学森
·基础医学·
氯氰菊酯对小鼠小脑组织氧化损伤及核转录因子-E2相关因子2基因表达的影响
周礼华,陈冲,张朋,王力,吴学森
目的:研究氯氰菊酯对小鼠小脑组织氧化损伤及核转录因子-E2相关因子2(Nrf2)基因表达的影响。方法:以40只昆明小鼠为受试动物,随机分为4组,包括1个阴性对照组和3个氯氰菊酯染毒组,染毒组按5、10、20 mg/kg 3个剂量水平灌胃染毒小鼠3周,以小脑组织匀浆测定丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-PX)、总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)的含量;用免疫组织化学法检测Nrf2在小脑组织细胞中的表达;用逆转录聚合酶链反应(RT-PCR)检测Nrf2基因表达。结果:随着氯氰菊酯染毒剂量升高,小脑组织MDA含量逐渐增加,GSH-PX、T-SOD、CAT等酶学活性逐渐下降,染毒组与对照组比较差异均有统计学意义(P<0.01)。免疫组织化学法显示,随着染毒剂量增加,小鼠小脑组织细胞核Nrf2阳性细胞表达增加,与对照组比较差异均有统计学意义(P<0.01),高剂量染毒组胞核阳性细胞表达均高于低剂量染毒组(P<0.01)。RT-PCR显示,随着染毒剂量增加,Nrf2条带光密度值增加,与对照组比较差异具有统计学意义(P<0.01),高剂量染毒组基因表达均高于低剂量染毒组(P<0.01)。结论:CYP染毒造成小鼠小脑组织氧化损伤,导致氧化应激反应中关键分子Nrf2由细胞质向细胞核转位,从而增强脑组织对抗氧化应激的能力。
氯氰菊酯;氧化损伤;核转录因子-E2相关因子2;小鼠
氯氰菊酯(cypermethrin,CYP)属于Ⅱ型除虫菊酯类农药,长期低剂量接触该类农药,可导致神经系统失调、糖代谢紊乱甚至癌症的发生[1-2]。脑组织是机体氧化代谢最活跃的器官,含有高浓度多不饱和脂肪酸,对脂质过氧化作用高度敏感,其抗氧化能力却低于其他主要器官,因此防御自由基损伤的能力较差。CYP可以跨过血脑屏障,选择性地作用于脑组织,诱导该部位产生氧化应激,进而导致神经元损伤、退行性变、凋亡或坏死[3-5]。核转录因子-E2 相关因子 2(nuclear factor erythroid-2-related factor 2,Nrf2) 是氧化应激反应的关键因子,生理状态下与胞质蛋白伴侣分子 Keap1结合,Nrf2的功能处于抑制状态,当受到内外界自由基和化学物质刺激时,Nrf2与Keap1解离而活化,活化的Nrf2由细胞质进入细胞核,与抗氧化反应元件(antioxidant response element,ARE)结合,同时激活下游抗氧化酶和Ⅱ相解毒酶的表达,如血红素氧合酶-1(heme oxygenase-1,HO-1)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)等抗氧化和解毒酶,从而保护机体免受相关物质的侵害[6-8]。与大脑相比,小脑不饱和脂肪酸含量更高,更易受到自由基的侵袭。本研究拟通过体内实验观察不同剂量CYP染毒对小鼠小脑组织氧化应激、Nrf2基因表达的影响,从而探讨CYP的神经毒作用机制,为合理选择农药提供实验依据。
1 材料与方法
1.1实验动物与材料
1.1.1实验动物与分组选用安徽医科大学实验动物中心提供的健康成年雄性昆明小鼠40只[合格证号:SCXR(皖)],体质量为(30.59±2.64)g。动物饲养温度(24±2)℃,相对湿度(50±10)%,以商业鼠粮饲养小鼠,实验期间小鼠可自由进食饮水。40只昆明小鼠随机分成4组,包括1个阴性对照组和3个氯氰菊酯染毒组,每组10只。参考文献[9],染毒组的剂量确定为5、10、20 mg/kg 3个剂量水平,连续3周经口灌胃染毒,每日灌胃前称取小鼠体质量,灌胃体积为0.01 mL·g-1·kg-1,灌胃6 d,休息1 d。
1.1.2主要试剂与仪器氯氰菊酯标准品(Sigma公司,纯度99%),丙二醛(malonaldehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)、CAT、总蛋白定量测定试剂盒(南京建成生物工程研究所),Nrf2兔抗鼠多克隆抗体(anbobio公司),RNA提取试剂(北京天根生化科技有限公司),RT、PCR试剂盒(Ferments公司)。低温离心机(德国 Eppendorf 公司),生物倒置显微镜(日本Olympus 公司),Synergy2型酶标仪(美国Biotek 公司),PCR 梯度扩增仪(东胜龙公司)。
1.2实验方法
1.2.1一般情况观察实验期间,观察各组小鼠神态、摄食及活动情况,每天称取体质量,对体质量变化进行分析。
1.2.2氧化、抗氧化指标检测制备组织匀浆,按试剂盒说明书要求检测MDA含量及T-SOD、GSH-Px、CAT活性,组织匀浆的蛋白含量采用总蛋白定量测试盒测定。
1.2.3免疫组织化学法检测Nrf2阳性细胞表达多聚甲醛固定小脑组织24 h,常规石蜡包埋,连续切片,切片厚约 4 μm,隔 5取1,每份标本选取10张,免疫组织化学检测小脑组织Nrf2蛋白表达。按照试剂盒说明进行具体操作。细胞质或细胞核被染成棕黄色颗粒为Nrf2 阳性细胞。每张切片随机选择 5个高倍视野,计数阳性细胞后取平均值。
1.2.4RT-PCR分析基因表达采用RNA提取试剂盒分组提取总RNA,取光密度值在1.8~2.0之间的RNA进行逆转录,逆转录步骤按试剂盒程序进行,每组取cDNA 2 μL进行PCR反应,反应体系为50 μL。(1)Nrf2扩增片段215 bp;引物序列正义5′-TTC CTC TGC TGC CAT TAG TCA GTC-5′、反义5′-GCT CTT CCA TTT CCG AGT CAC TG-3′;扩增条件:94 ℃预变性3 min,94 ℃变性30 s,57.9 ℃退火30 s,72 ℃延伸30 s,共35个循环。(2)β-actin扩增片段150 bp;引物序列正义5′-AGT GTG ACG TTG ACA TCC GTA-3′、反义5′-GCC AGA GCA GTA ATC TCC TTC T-3′;扩增条件:94 ℃预变性3 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共35个循环。取PCR产物行凝胶电泳,用凝胶成像系统进行条带光密度半定量分析。
1.3统计学方法采用方差分析和q检验。
2 结果
2.1小鼠一般情况观察对照组小鼠摄食正常、神态安详、毛色具有光泽。染毒组小鼠精神欠佳、毛色晦暗,小鼠耳朵、尾巴和爪子出现不同程度的撕咬痕迹,尤其是高剂量组,伤痕最明显。染毒前各组小鼠体质量差异无统计学意义(P>0.05),染毒结束后,各组小鼠体质量均较染毒前增加(P<0.01),各组小鼠体质量增加程度差异均无统计学意义(P>0.05)(见表1)。
2.2小鼠小脑组织T-SOD、GSH-Px、CAT和MDA含量比较染毒组小鼠小脑组织MDA含量均明显高于对照组(P<0.01),而3组CYP染毒小鼠小脑组织MDA含量差异均有统计学意义(P<0.01)。随着染毒剂量增加,小鼠小脑组织T-SOD、GSH-Px、CAT活性逐渐降低,各染毒组与对照组差异均有统计学意义(P<0.01)(见表2)。
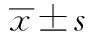
表1 4组小鼠染毒前后体质量比较(ni=10;;g)
组内配对t检验:**P<0.01
2.34组小鼠小脑组织Nrf2阳性细胞表达比较Nrf2蛋白集中分布在小脑组织细胞质中,细胞核表达较弱。CYP染毒后,细胞核Nrf2阳性细胞比例逐渐增加,细胞质表达逐渐减少(见图1),CYP 10 mg/kg和20 mg/kg组细胞质Nrf2阳性细胞表达均低于对照组(P<0.05~P<0.01),而CYP 20 mg/kg组细胞质Nrf2阳性细胞表达均低于CYP 5 mg/kg和10 mg/kg组(P<0.05)。CYP 10 mg/kg和20 mg/kg组胞核Nrf2阳性细胞表达均高于对照组与CYP 5 mg/kg组(P<0.05~P<0.01),而CYP 20 mg/kg组细胞核Nrf2阳性细胞表达显著高于CYP 10 mg/kg组(P<0.01)(见表3)。
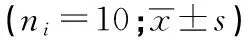
q检验:与对照组比较**P<0.01;与CYP 5 mg/kg组比较△△P<0.01;与CYP 10 mg/kg组比较##P<0.01

q检验:与对照组比较*P<0.05,**P<0.01;与CYP 5 mg/kg组比较△P<0.05,△△P<0.01;与CYP 10 mg/kg组比较#P<0.05,##P<0.01
2.44组小鼠小脑组织Nrf2 mRNA表达比较染毒后,CYP 5 mg/kg组Nrf2 mRNA表达与对照组差异无统计学意义(P>0.05),CYP 10、20 mg/kg组条带较对照组清晰(见图2),2组Nrf2 mRNA表达均明显高于对照组(P<0.01);同时,CYP 10、20 mg/kg组条带光密度值亦均显著高于CYP 5 mg/kg组(P<0.01)(见表4)。
3 讨论
随着CYP施用面积的增加,其毒性也逐渐受到重视。氧化应激是CYP公认的毒性机制,而Nrf2 能够诱导基因对抗氧化应激,活化机体自身的保护性反应,甚至在外源性抗氧化物,如维生素C、维生素E
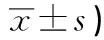
q检验:与对照组比较**P<0.01;与CYP 5 mg/kg组比较ΔΔP<0.01
缺乏的情况下,也能阻止各种氧化应激相关的并发症。Nrf2 通过与 ARE 相互作用调节编码抗氧化蛋白,启动Ⅱ相解毒酶和抗氧化酶基因的表达,保护细胞组织的正常功能[10-12]。
本研究证实,CYP导致小脑组织产生更多的脂质过氧化产物,并使GSH-PX、T-SOD、CAT等酶学活性下降,最终导致抗氧化能力下降,且随着染毒剂量增加对酶学活性的影响越大。免疫组织化学法显示,染毒组细胞核Nrf2阳性细胞表达高于对照组,同时,阳性细胞表达与染毒剂量相关,高剂量染毒组Nrf2阳性细胞表达高于低剂量染毒组。RT-PCR显示,染毒组Nrf2 mRNA表达高于对照组,中、高剂量染毒组mRNA表达量与对照组差异均有统计学意义,同时,中、高剂量染毒组与低剂量染毒组差异亦均有统计学意义(P<0.05~P<0.01),显然,CYP对小鼠小脑组织的损伤具有一定的剂量效应关系。CYP染毒造成抗氧化应激能力下降,机体产生氧化应激的同时,内源性抗氧化系统被激活,导致Nrf2 与 Keap1 解离,Nrf2由胞质转入胞核,诱导下游抗氧化靶基因表达,从而增强脑组织的抗氧化能力。文献[13-17]报道,溴氰菊酯能够影响Nrf2/ARE 转导通路,增加 Nrf2 基因及其下游基因 GCS 的转录水平,七氟烷可以通过激活 Nrf2 信号通路诱导大鼠海马神经元 HO-1 mRNA 表达。可见下游基因的表达增强是由激活的 Nrf2 所介导,Nrf2通过抗氧化损伤作用而进一步发挥神经保护作用。
CYP暴露可以降低机体抗氧化能力,诱导小脑组织氧化损伤,造成促氧化系统和抗氧化系统失衡,同时激活Nrf2,使Nrf2由胞质向胞核转位,从而增强脑组织对抗氧化应激的能力。抗氧化剂可能具有防治CYP中毒的效果,增强抗氧化酶的活性可能是防治CYP中毒的有效途径。
[1]SINGH AK,TIWARI MN,PATEL DK,etal.Long term exposure to cypermethrin induces nigrostriatal dopaminergic neurodegeneration in adult rats:postnatal exposure enhances the susceptibility during adulthood[J].Neurobiol Aging,2012,33(2):404.
[2]CHI CC,CHOU CT,LIANG WZ,etal.Effect of the pesticide,deltamethrin,on Ca2+signaling and apoptosis in OC2 human oral cancer cells[J].Drug Chem Toxicol,2014,37(1):25.
[3]ROMERO A,ARES I,RAMOS E,etal.Evidence for dose-additive effects of a type Ⅰ pyrethroid mixture.Invitroassessment[J].Environ Res,2015,4(138):58.
[4]RAMOS-CHAVEZ LA,SORDO M,CALDERON-ARANDA E,etal.permethrin/allethrin mixture induces genotoxicity and cytotoxicity in human peripheral blood lymphocytes[J].Toxicol Environ Health A,2015,78(1):7.
[5]CAO D,CHEN N,ZHU C,etal.β-cypermethrin-induced acute neurotoxicity in the cerebral cortex of mice[J].Drug Chem Toxicol,2015,8(1):44.
[6]RENE C,LOPEZ E,CLAUSTRES M,etal.NF-E2-related factor 2,a key inducer of antioxidant defenses,negatively regulates the CFTR transcription[J].Cell Mol Life Sci,2010,67(13):2297.
[7]NGUYEN T,NIOI P,PICKETT CB.The Nrf2-antioxidant response element signaling pathway and its activation by oxidative stress[J].J Biol Chem,2009,284:13291.
[8]WANG G,XIU P,LI F.Vitamin A supplementation alleviates extrahepatic cholestasis liver injury through Nrf2 activation[J].Oxid Med Cell Longev,2014,2014:273692.
[9]JIN Y,WANG L,RUAN M,etal.Cypermethrin exposure during puberty induces oxidative stress and endocrine disruption in male mice[J].Chemosphere,2011,84(1):124.
[10]HAYES JD,MCMAHON M.NRF2 and KEAP1 mutations:permanent activation of an adaptive response in cancer[J].Trends Biochem Sci,2009,34(4):176.
[11]SHEN G,KONG AN.Nrf2 plays an important role in coordinated regulation of Phase Ⅱ drug metabolism enzymes and PhaseⅢ drug transporters[J].Biopharm Drug Dispos,2009,30(7):345.
[12]LIU Q,ZHANG H,Smeester L,etal.The NRF2-mediated oxidative stress response pathway is associated with tumor cell resistance to arsenic trioxide across the NCI-60 panel[J].BMC Med Genomics,2010,8(3):37.
[13]曹旭,张临洪.溴氰菊酯及 6- 羟基多巴胺对 PC12 细胞Nrf2/ARE 通路的影响[J].现代预防医学,2013,40(17):3253.
[14]AGARWAL A,NICK HS.Renal response to tissue injury:lessons from heme oxygenase-1 gene ablation and expression[J].J Am Soc Nephrol,2000,11(5):965.
[15]CAI Z,LOU Q,WANG F.N-acetylcysteine protects against liver injure induced by carbon tetrachloride via activation of the Nrf2/HO-1 pathway[J].Int J Clin Exp Pathol,2015,8(7):8655.
[16]MARTIN D,ROJO AI,SALINAS M,etal.Regulation of heme oxygenase-1 expression through the phosphatidylinositol 3-kinase/ Akt pathway and the Nrf2 transcription factor in response to the antioxidant phytochemical carnosol[J].J Biol Chem,2004,279(10):8919.
[17]SHAO JL,ZHOU YY,CHEN HM,etal.Sevoflurane induces neuron HO-1 mRNA expression via P70S6K/Nrf2 kinase signal pathways[J].Chin Pharmacol Bull,2009,25(2):209.
(本文编辑刘璐)
Effect of cypermethrin on the oxidative damage and mRNA expression of nuclear factor erythroid-2-related factor 2 in mice cerebellar tissue
ZHOU Li-hua,CHEN Chong,ZHANG Peng,WANG Li,WU Xue-sen
(DepartmentofPreventiveMedicine,BengbuMedicalCollege,BengbuAnhui233030,China)
Objective:To observe the effects of cypermethrin on the oxidative damage and gene expression of nuclear factor erythroid-2-related factor 2(Nrf 2) mRNA in mice cerebellar tissue.Methods:Forty male Kunming mice were randomly divided into one negative control group and three cypermethrin infection groups.Three cypermethrin infection groups were infected by 5,10 and 20 mg/kg of cypermethrin gavage,once daily for three weeks,respectively.The contents of MDA,GSH-Px,T-SOD and CAT and MDA were measured in cerebellar tissue.The mRNA and protein expressions of Nrf2 in cerebellar tissue were detected using reverse transcription polymerase chain reaction(RT-PCR) and immunohistochemistry(IHC),respectively.Results:With the dose of cypermethrin increasing,the level of MDA increased,the levels of GSH-Px,T-SOD and CAT decreased in cerebellar tissue,and the differences of whose between the cypermethrin infection group and control group were statistically significant(P<0.01).The immunohistochemistry result showed that the positive expression of Nrf2 in nucleus increased in cerebellar tissue with the dose of cypermethrin increasing,the difference of which between the cypermethrin infection group and control group were statistically significant(P<0.01).The positive expression of Nrf2 in nucleus in high-dose cypermethrin infection group was higher than that in low-dose cypermethrin infection group(P<0.01).The RT-PCR results showed that the optical density value of Nrf2 increased in cerebellar tissue with the dose of cypermethrin increasing,the difference of which between the cypermethrin infection group and control group were statistically significant(P<0.01).The mRNA expression level of Nrf2 in high-dose cypermethrin infection group was higher than that in low-dose cypermethrin infection group(P<0.01).Conclusions:The cypermethrin infection can lead to the oxidative damage in cerebellar tissue and induce the translocation of Nrf2 from the cytoplasm to the nucleus,which can strength the antioxidative capacity of brain tissue.
cypermethrin;oxidative damage;nuclear factor-erythroid 2-related factor 2;mice
2016-04-26
安徽省自然科学基金项目(1508085QH188);安徽省特色专业“预防医学”项目(皖教高[2011]5号)
单位] 蚌埠医学院 预防医学系,安徽 蚌埠 233030
[作者简介] 周礼华(1977-),女,硕士,讲师.
1000-2200(2016)07-0845-05
R 595.4
A
10.13898/j.cnki.issn.1000-2200.2016.07.002

