舍曲林抗创伤后应激障碍效应及其对一氧化氮的影响
孙树峥,张黎明,姬雅君,李 雷,蒋湘云,王恒林,张有志(1.河北北方学院研究生部,河北张家口 075000;.北京解放军第09医院麻醉科,北京 100091;.军事医学科学院毒物药物研究所,北京 100850;.沧州市中心医院麻醉科,河北沧州 061000)
·论著·
舍曲林抗创伤后应激障碍效应及其对一氧化氮的影响
孙树峥1,2,3,张黎明3,姬雅君4,李 雷3,蒋湘云3,王恒林2,张有志3
(1.河北北方学院研究生部,河北张家口 075000;2.北京解放军第309医院麻醉科,北京 100091;3.军事医学科学院毒物药物研究所,北京 100850;4.沧州市中心医院麻醉科,河北沧州 061000)
目的 利用大鼠条件性恐惧模型,探讨舍曲林抗创伤后应激障碍(PTSD)作用与一氧化氮(NO)之间的关系。方法 采用声音线索配对足底电击对成年雄性SD大鼠造成条件性恐惧应激,第2天进行消退训练。每天实验前1 h,ig给予舍曲林15 mg·kg-1,连续8 d。消退训练后第1,4和7天,分别测试大鼠僵住行为。第7天测试完成后取杏仁核,Griess法检测NO含量,Western蛋白印迹法检测神经型一氧化氮合酶(nNOS)与诱导型一氧化氮合酶(iNOS)表达水平。结果 行为学结果显示,与正常对照组相比,消退对照组和消退训练组僵住不动时间均显著增高(P<0.01),提示大鼠条件恐惧造模成功。大鼠恐惧消退训练后第1和4天,舍曲林15 mg·kg-1组僵住不动时间均低于消退训练组(P<0.05);在第7天,显著低于消退训练组(P<0.01),提示舍曲林减轻了恐惧反应。舍曲林15 mg·kg-1组大鼠杏仁核区NO含量、nNOS和iNOS表达水平明显低于消退训练组(P<0.01)。结论 舍曲林能促进条件恐惧记忆的消退,在条件恐惧模型上具有抗PTSD效应,其作用机制可能与抑制NO过度释放有关。
舍曲林;创伤后应激障碍;一氧化氮合酶;条件性恐惧;杏仁核
DOl:10.3867/j.issn.1000-3002.2016.04.003
创伤后应激障碍(post-traumatic stress disorder,PTSD)是遭受突发的灾难性事件后,个体出现超乎寻常创伤应激的焦虑性精神疾病,其主要临床表现为病理性创伤记忆增强,警觉性增高,以及对创伤相关的情景出现持续的回避[1]。国外研究资料显示,加拿大PTSD终生患病率约为9.2%,美国为6.8%~12.3%[2-3]。近年来我国的儿童及青少年地震PTSD合并患病率高达30.2%[4]。
然而PTSD的发生机制错综复杂,至今尚未完全阐明。近年来,越来越多的证据提示,一氧化氮(nitric oxide,NO)作为重要的效应分子和信使分子参与PTSD的发生[5-6]。正常状态下,NO对突触可塑性、神经内分泌、神经传递等功能有着重要的生理作用,而过度释放时有明显的神经毒性。研究发现,将NO供体硝普钠微量注射到大鼠海马中可损伤该侧海马锥体神经元和齿状回颗粒细胞[7]。有研究证实,PTSD患者长时间服用帕罗西汀(parox⁃etine),可逆转海马萎缩,促进海马神经元再生,并有助于改善患者的陈述性记忆和认知能力[8]。
舍曲林(sertraline)是一种选择性5-羟色胺(血清素,hydroxy trptamine,5-HT)重摄取抑制剂(selective serotonin reuptake inhibitor,SSRI),也是被美国FDA批准为临床上抗PTSD的一线药物之一。本课题组前期在多个PTSD动物模型上发现其在15 mg·kg-1剂量时有良好治疗作用[9-10],但其抗PTSD的作用是否经由NO信号通路尚不明确。本研究观察舍曲林对大鼠条件性恐惧模型的抗PTSD作用,并探究其与NO通路作用机制之间的关系。
1 材料与方法
1.1试剂和主要仪器
舍曲林购自美国Sigma公司;NO检测试剂盒(S0021)购自上海碧云天生物技术研究所;抗神经型一氧化氮合酶抗体(anti-neuronal nitric oxide synthase,Anti-nNOS)(ab16650)和抗诱导型一氧化氮合酶抗体(anti-inducible nitric oxide synthase,Anti-iNOS)(ab3523)均购于美国Abcam公司;β肌动蛋白抗体(TA-09)、辣根酶标记山羊抗兔IgG (H+L)(ZB-2301)和辣根酶标记山羊抗鼠IgG(H+L)抗体(ZB-2305)均购于北京中杉金桥生物技术有限公司。
大鼠Med红外视频恐惧系统购自美国Med Associates,Inc公司,由4个大鼠操作性条件恐惧箱组成,外部由体积60 cm×35 cm×70 cm的光滑的木质箱(一面为门)体构成,体积为30 cm× 25 cm×25 cm的内部箱体中有三面为光滑的不锈钢墙壁(侧壁有发声器),一面为透明的有机塑料门,顶部由不锈钢壁密封,底部为不锈钢栅栏,间隔1.5 cm。外部连接一个信号处理器和计算机系统。
1.2动物
36只成年雄性SD大鼠,体质量200~220 g,购自北京斯贝福实验动物科技有限公司(动物质量合格证号:SCXK(京)2011-0004)。动物自由进食水,饲养在温度22~24℃、相对湿度约50%的安静环境下,12 h昼夜明暗交替,适应7 d后开始实验。适应期间每天抓取大鼠5 min,以减少无关应激刺激对后续实验操作的影响。所有的行为学测试均在上午8:00-12:00进行,实验前3 d,每天将大鼠放入条件恐惧箱内适应5 min。
1.3动物模型的建立和分组
大鼠随机分为正常对照组、消退对照组、消退训练组、消退训练+舍曲林药物治疗组(15 mg·kg-1),每组9只。将各组大鼠分别放入条件恐惧箱内,适应2 min后给予单一频率声音信号(4.5 kHz,70 dB,15 s)适应4次(2次声音间隔2 min),然后再给予6次以声音信号为提示的不可逃避足底电击(1 mA,5 s),声音与电击同时结束,2次声音间隔为2 min。24 h后将已建立的条件性恐惧动物再次放入条件恐惧箱,仅给予声音信号30次,每次15 s,2次声音间隔为1 min。消退对照组在对应的时间点放进条件恐惧箱,不进行消退训练(不给声音刺激)。条件性恐惧消退训练后1 h内ig给予舍曲林,正常对照组给予相应体积的生理盐水。
1.4条件性恐惧消退保持测试
各组分别在条件恐惧消退训练后的第1,4和7天进行测试,测试前1 h内进行相应的药物处理,共连续8 d给药。将大鼠放在训练箱内,给予5次声音信号,每次15 s,时间间隔为10 s,记录5 min内的僵住时间(计算机系统自动记录),作为消退保持的成绩。僵住不动时间越短,消退保持成绩越好。每只大鼠实验结束后及时清理测试箱中的排泄物,同时10%乙醇进行擦拭,避免残留气味对其他大鼠的影响。
1.5Griess法检测杏仁核内NO含量
消退训练后第7天待各组行为学测试全部结束后,断头取脑,冰上分离杏仁核,按照每1 mg组织加10 μL裂解液的比例,每组加入相应体积的裂解液(RIPA),快速冰上裂解,匀浆,离心(5000×g,4℃,30 min),取上清液。取部分样品于-80℃冰箱储存备用。采用Griess法NO检测试剂盒,检测杏仁核内NO含量。用文献已知NO浓度进行稀释标准品,严格按照说明书步骤进行操作。
1.6Western蛋白印迹法检测杏仁核内nNOS和iNOS表达
常规配制8%的分离胶和5%的积层胶,进样后,80 V电泳待marker略分开,改换120 V继续电泳约1 h,然后100 V恒压转膜约1.5 h。取出PVDF膜,5%脱脂牛奶封闭2 h,之后加抗nNOS/ iNOS兔源多克隆抗体(按1∶1000进行稀释)4℃轻度振荡过夜。PVDF膜用TBST漂洗3次,每次10 min。室温下孵育二抗(辣根酶标记山羊抗兔IgG)1 h。待TBST洗3次,后,吸掉膜上水分,使用ECL化学发光底物液用1∶1的A,B液混合后覆盖PVDF膜,在凝胶成像系统(FluorChem FC2)内显影并生成图像。以图像中的目标蛋白条带与内标蛋白条带的积分吸光度比值表示蛋白的相对表达水平。
1.7统计学分析
实验结果数据以x±s表示,采用Graphpad Prism 5.0分析软件进行统计分析,各组间差异比较采用Dunnett t检验,P<0.05为有差异具有统计学意义。
2 结果
2.1舍曲林对条件性恐惧消退训练大鼠行为的影响
表1结果显示,与正常对照组相比,消退对照组和消退训练组僵住不动时间3次测试均显著增高(P<0.01);而与消退对照组相比,消退训练组僵住时间无明显差异,提示条件恐惧造模成功后单纯采取行为训练来消除已建立的恐惧反应,其消退的效果并不理想;在消退训练后第1和4天,与消退训练组相比,舍曲林组僵住不动时间明显降低(P<0.05);第7天舍曲林组的僵住不动时间显著降低(P<0.01);且与第4天相比,消退训练组僵住不动时间呈下降趋势(无统计学差异),而舍曲林组明显下降。
2.2舍曲林对条件恐惧大鼠杏仁核内NO含量的影响
如表2所示,经过条件恐惧性应激的消退对照组大鼠杏仁核内NO含量明显高于正常对照组(P<0.01);与消退对照组相比,消退训练组大鼠杏仁核内NO含量无显著性降低,而舍曲林药物干预后,NO含量明显低于消退训练组(P<0.01),说明舍曲林能逆转条件恐惧大鼠过度增高的大鼠杏仁核内NO水平。

Tab.1 Effect of sertraline on freezing time of rats after extinction training
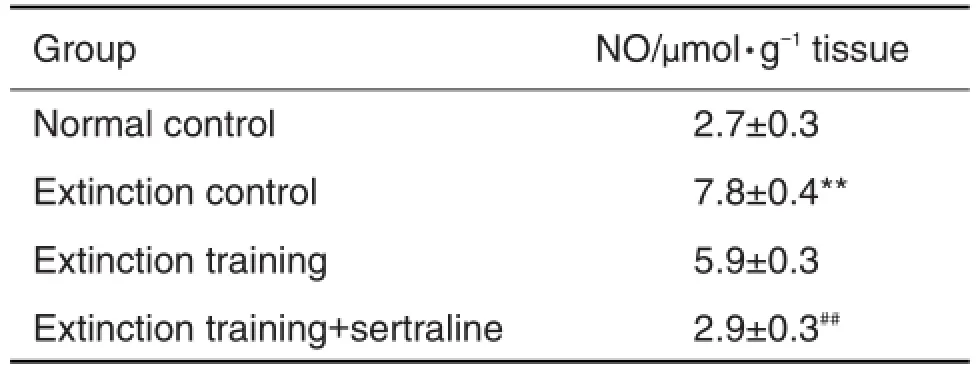
Tab.2 Effect of sertraline on released nitric oxide(NO)in amygdala tissue of rats after extinction training
2.3舍曲林对条件恐惧大鼠杏仁核内nNOS和iNOS表达的影响
如图1所示,与正常对照组相比,消退对照组nNOS和iNOS蛋白表达显著升高(P<0.05,P<0.01);与消退对照组相比,消退训练组NOS蛋白表达水平无明显变化;经过舍曲林药物干预后,与消退对照组相比,舍曲林组nNOS和iNOS蛋白水平明显降低(P<0.01)。

Fig.1 Effect of sertraline on expression of neuronal nitric oxide(nNOS)and inducible nitric oxide(iNOS)protein in amygdala tissue of rats after extinction training by Western blotting.See Tab.1 for the treatment. B was the semiquantitative result of A.±s,n=3.*P<0.05,compared with normal control group;##P<0.01,compared with extinction control group.
3 讨论
本研究发现,舍曲林具有较好的抗PTSD作用,并发现其可降低条件性恐惧大鼠杏仁核区NO含量和NOS表达,提示其抗PTSD作用机制可能与其对NO信号通路的调控有关。我们的前期研究显示,长期给予该剂量的舍曲林对大鼠一般状态无不良影响,且不影响正常大鼠学习记忆能力,具有良好的安全性。
根据文献报道,本研究以巴甫洛夫条件恐惧反射为基础,建立了以声音为线索与恐惧记忆相关的大鼠条件恐惧模型,此模型是经典的PTSD动物模型之一[11]。首先对大鼠进行非条件性刺激(如不可逃避的足底电击)与条件性刺激(如声音)相联结匹配的训练,24 h后进行只有声音线索而没有电击的消退训练,在消退训练后第1,4和7天再次将大鼠暴露于训练过的条件线索下,观察其对具体的声音线索所表现出恐惧反应,即僵住行为。该模型很好地模拟了PTSD患者对恐惧记忆产生的回避性行为,是研究PTSD发病机制较理想的动物模型。
大量文献报道,NO过度释放与焦虑症、PTSD等应激相关性疾病密切相关[12-14]:对PTSD的动物模型强烈应激3周之后发现,NOS表达水平持续性升高[15];增强NO的环磷酸鸟苷信号通路可诱发小鼠出现焦虑样行为;在大鼠捕食应激实验中,应激组大鼠海马NO和nNOS含量在捕食应激后明显增高[16]。海马萎缩以及海马神经元再生障碍与PTSD发生密切联系[17-18];而应激导致的NO过度释放进而作用于N-甲基-D-天冬氨酸受体和环磷腺苷反应元件结合蛋白,是参与海马神经元再生障碍的重要因素。有研究表明,脑室注射NOS抑制剂或nNOS基因敲除小鼠,均可表现为神经元再生增强,且nNOS抑制剂可逆转慢性应激所诱导的神经元再生减少[19-20];而SSRI类药物能抵抗PTSD小鼠海马突触蛋白的降低,逆转海马萎缩[18]。有文献报道,氟西汀的神经保护作用可归因于其能抑制小胶质细胞减少了炎症因子和NO的过度释放[21],SSRI类药物甚至被认为是特殊“NOS抑制剂”[22],在动物慢性应激抑郁样模型研究中发现,氟西汀能抑制NOS过度表达进而逆转大鼠结构异常的海马神经元[23]。随后又发现,nNOS过度表达是慢性应激大鼠造成中枢神经系统抑制,行为绝望改变等病变的主要原因[24]。因此,结合文献及本研究结果,认为舍曲林抗PTSD效应的作用机制之一可能与其抑制NO的过度释放有关。
但舍曲林影响NO变化的具体机制尚不明确,其逆转NO过度释放是间接作用还是作为“NOS抑制剂”直接发挥作用,有待进一步研究。有研究发现,时间敏化动物模型NOS表达持续性升高,帕罗西汀和选择性iNOS抑制剂氨基胍可逆转其升高,而nNOS抑制剂7-NI却无此作用,表明PTSD发生时过量产生的NO主要来自于iNOS,而非nNOS[25]。而本研究中,舍曲林干预后nNOS和iNOS表达均被抑制,过度释放的NO究竟来自nNOS还是iNOS,或是二者共同作用,需要对相关通路进行深入研究。
[1]Bisson JI,Roberts NP,Andrew M,Cooper R,Lewis C.Psychological therapies for chronic posttraumatic stress disorder(PTSD)in adults[J]. Cochrane Database Syst Rev,2013,12:CD003388.
[2]Van Ameringen M,Mancini C,Patterson BA.Posttraumatic stress disorder in Canada[J].CNS Neurosci Ther,2008,14(3):171-181.
[3]Alegría M,Fortuna LR,Lin JY,Norris FH,Gao S,Takeuchi DT,et al.Prevalence,risk,and correlates of posttraumatic stress disorder across ethnic and racial minority groups in the United States[J].Med Care,2013,51(12):1114-1123.
[4]Li Y,Dong XM,Peng L,Zhang SH,Ye YF,Ye ZB,et al.A meta-analysis on the prevalence of posttraumatic stress disorder in children and adolescents [J].Chin J Trauma(中华创伤杂志),2014,30 (11):1075-1080.
[5]Oosthuizen F,Wegener G,Harvey BH.Nitric oxide as inflammatory mediator in post-traumatic stress disorder(PTSD):evidence from an animal model [J].Neuropsychiatr Dis Treat,2005,1(2):109-123.
[6]Zhang LM,Li AS,Chen HX,Zhang YZ,Yf L.Nitric oxide:a novel target for posttraumatic stress disorder [J].Chin Pharmacol Bull(中国药理学通报),2012,28(10):1345-1347.
[7]Loiacono RE,Beart PM.Hippocampallesions induced by microinjection of the nitric oxide donor nitroprusside[J].Eur J Pharmacol,1992,216(2):331-333.
[8]Vermetten E,Vythilingam M, Southwick SM,Charney DS,Bremner JD.Long-term treatment with paroxetine increases verbal declarative memory and hippocampal volume in posttraumatic stress disorder[J].Biol Psychiatry,2003,54(7):693-702.
[9]Zhang LM,Zhou WW,Ji YJ,Li Y,Zhao N,Chen HX,et al.Anxiolytic effects of ketamine in animal models of posttraumatic stress disorder[J]. Psychopharmacology(Berl),2015,232(4):663-672.
[10]Fan QY,Xue R,Li Y,Zhang TT,Ge HX,Li YF,et al.Establishment of female rat model for posttraumatic stress disorder induced by single pro⁃longed stress[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2013,27(4):715-719.
[11]Charney DS.Psychobiological mechanisms of resil⁃ience and vulnerability:implications for successful adaptation to extreme stress[J].Am J Psychiatry,2004,161(2):195-216.
[12]Gałecki P,Maes M,Florkowski A,Lewiński A,Gałecka E,Bieńkiewicz M,et al.Association between inducible and neuronal nitric oxide synthase polymorphisms and recurrent depressive disorder [J].J Affect Disord,2011,129(1-3):175-182.
[13]Maes M, Kubera M,Mihaylova I, Geffard M,Galecki P,Leunis JC,et al.Increased autoim⁃mune responses against auto-epitopes modified by oxidative and nitrosative damage in depression:implications for the pathways to chronic depression and neuroprogression[J].J Affect Disord,2013,149(1-3):23-29.
[14]Talarowska M, Bobińska K, Zajączkowska M,Su KP,Maes M,Gałecki P.Impact of oxidative/ nitrosative stress and inflammation on cognitive functions in patients with recurrent depressive disorders[J].Med Sci Monit,2014,20:110-115.
[15]Zhang L,Li H,Benedek D,Li X,Ursano R.A strategy for the development of biomarker tests for PTSD[J].Med Hypotheses,2009,73(3):404-409.
[16]Wang QS,Wang ZG,Zhu PF,Jiang JX.Effects of predator stress on nitric oxide and neuronal nitric oxide synthase in rat hippocampus[J].Chin J Clin Rehabilitation(中国临床康复),2003,7(22):3048-3049.
[17]Golub Y,Kaltwasser SF,Mauch CP,Herrmann L,Schmidt U,Holsboer F,et al.Reduced hippocampus volumeinthemousemodelofposttraumatic stress disorder[J].J Psychiatr Res,2011,45(5):650-659.
[18]Herrmann L, Ionescu IA, Henes K,Golub Y,Wang NX,Buell DR,et al.Long-lasting hippocampal synaptic protein loss in a mouse model of posttrau⁃matic stress disorder[J].PLoS One,2012,7(8):e42603.
[19]Zhu XJ,Hua Y,Jiang J,Zhou QG,Luo CX, Han X,et al.Neuronal nitric oxide synthasederived nitric oxide inhibits neurogenesis in the adult dentate gyrus by down-regulating cyclic AMP response element binding protein phosphorylation [J].Neuroscience,2006,141(2):827-836.
[20]Estrada C,Murillo-Carretero M.Nitric oxide and adult neurogenesis in health and disease[J]. Neuroscientist,2005,11(4):294-307.
[21]Hashioka S, Klegeris A,MonjiA,KatoT,Sawada M,Mcgeer PL,et al.Antidepressants inhibit interferon-gamma-induced microglial production of IL-6 and nitric oxide[J].Exp Neurol,2007,206 (1):33-42.
[22]Crespi F.The selective serotonin reuptake inhibitor fluoxetine reduces striatal in vivo levels of voltam⁃metric nitric oxide(NO):a feature of its antide⁃pressant activity?[J].Neurosci Lett,2010,470 (2):95-99.
[23]Luo L,Tan RX.Fluoxetine inhibits dendrite atrophy of hippocampal neurons by decreasing nitric oxide synthase expression in rat depression model[J]. Acta Pharmacol Sin,2001,22(10):865-870.
[24]Zhou QG,Hu Y,Hua Y,Hu M,Luo CX,Han X,et al.Neuronal nitric oxide synthase contributes to chronic stress-induced depression by suppressing hippocampalneurogenesis[J].JNeurochem,2007,103(5):1843-1854.
[25]Harvey BH,Oosthuizen F,Brand L,Wegener G,Stein DJ.Stress-restress evokes sustained iNOS activity and altered GABA levels and NMDA receptors inrathippocampus[J].Psychopharmacology (Berl),2004,175(4):494-502.
(本文编辑:乔 虹)
Anti-post-traumatic stress disorder effect of sertraline and its effect on nitric oxide
SUN Shu-zheng1,2,3,ZHANG Li-ming3,JI Ya-jun4,LI Lei3,JIANG Xiang-yun3,WANG Heng-lin2,ZHANG You-zhi3
(1.Department of Postgraduates,Hebei North University,Zhangjiakou 075000,China;2.Department of Anesthesiology,Hospital 309 of Chinese People′s Liberation Army,Beijing 100091,China;3.Institute of Pharmacology and Toxicology,Academy of Military Medical Sciences,Beijing 100850,China;4.Department of Anesthesiology,Cangzhou Central Hospital,Cangzhou 061000,China)
OBJECTlVE To investigate the relationship between the anti-post-traumatic stress disorder(PTSD)effect of sertraline and nitric oxide in fear conditioning rats.METHODS Conditioned fear stress was established by electric shock with a cue tone,and fear extinction training was carriedout by giving the rats only tone signals the next day.The rats were treated with sertraline(15 mg·kg-1)intragastrically within 1 h before the experiment for 8 d.Freezing time was tested at the 1st,4th and 7th day after the extinction training in rats.The NO contents were detected by Griess method and the nNOS and iNOS level on amygdala was detected by Western blotting.RESULTS The behavior tests showed that compared with normal control group,the freezing time was significantly increased in extinction control group and extinction training group(P<0.01),indicating that the conditioned fear model of rats was successfully established.At the 1st and 4th day after conditioned fear extinction training in the rats,freezing time in sertraline(15 mg·kg-1)group was decreased compared with extinction training group (P<0.05).At the 7th day,the freezing time was significantly decreased(P<0.01),indicating that ser⁃traline reversed the fear response.At the same time,the contents of NO,nNOS and iNOS on amygdala of rats in sertraline group were lower than that in extinction training group(P<0.01).CONCLUSlON Sertraline can promote extinction of conditioned fear memory,suggesting that sertraline has anti-PTSD effects on the model of fear condition in rats.The underlying mechanisms may be connected with NO.
post-traumatic stress disorder;nitric oxide synthase;fear condition;amygdala
Fopundation item:The project supported by National Natural Science Foundation of China(81001653);National Natural Science Foundation of China(30973516)
WANG Heng-lin,E-mail:hlin309@sina.com,Tel:13718782182;ZHANG You-zhi,E-mail:zhyouzhi@aliyun.com,Tel:(010)66931619
R971
A
1000-3002-(2016)04-0317-06
国家自然科学基金(81001653);国家自然科学基金(30973516)
孙树峥,女,硕士研究生,主要从事麻醉药理学研究,E-mail:sszheng1212@sina.com;王恒林,男,博士,副主任医师,主要从事麻醉药理学研究;张有志,男,博士,研究员,主要从事精神药理学研究。
王恒林, E-mail:hlin309@sina.com,Tel:13718782182;张有志,E-mail:zhyouzhi@aliyun.com,Tel:(010)66931619
2015-09-13接受日期:2016-02-25)

