新型可溶性鸟苷酸环化酶激动剂sGC003对内皮素诱导的心肌细胞肥大的作用
刘 可,颜玲娣,雍 政,宫泽辉,苏瑞斌(军事医学科学院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
新型可溶性鸟苷酸环化酶激动剂sGC003对内皮素诱导的心肌细胞肥大的作用
刘 可,颜玲娣,雍 政,宫泽辉,苏瑞斌
(军事医学科学院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
目的 研究可溶性鸟苷酸环化酶(sGC)激动剂sGC003对内皮素1(ET-1)诱导的心肌细胞肥大的作用。方法 通过复合酶消化法及差速贴壁法培养SD乳大鼠原代心肌细胞,以ET-1 10 nmol·L-1刺激其发生肥大,同时给予sGC003 0.01,0.1和1.0 μmol·L-1,48 h后在倒置显微镜下观察心肌细胞形态,图像分析软件(Image-Pro Plus6.0)对心肌细胞表面积进行测量分析,BCA法检测心肌细胞总蛋白质含量,实时定量PCR法检测心房利钠肽基因(ANP)mRNA表达。结果 与正常对照组相比,ET-1 10 nmol·L-1刺激心肌细胞48 h,可使心肌细胞表面积增加80%(P<0.01),总蛋白质含量增加120%(P<0.01),ANP mRNA水平升高140%(P<0.01)。给予sGC003 0.01~1.0 μmol·L-1能对抗ET-1引起的心肌细胞表面积增大(P<0.01)和总蛋白质含量升高(P<0.05),对于ET-1诱导的ANP mRNA表达增加也有一定抑制作用(P<0.05)。结论sGC003可改善ET-1诱导的心肌细胞肥大,对心肌细胞具有保护作用。
可溶性鸟苷酸环化酶;激动剂;sGC003;心肌细胞;内皮素1;心肌肥大
DOl:10.3867/j.issn.1000-3002.2016.04.006
我国心血管疾病发生人数和死亡人数逐年增加,是城乡居民疾病死亡的首要原因[1]。心肌肥大是高血压、心肌梗死、缺血性心脏病和心瓣膜病等许多心血管疾病的共同病理过程,被公认为是引起心血管疾病发生率和死亡率显著升高的独立危险因素。因此,改善心肌肥大对多种心血管疾病的治疗有着重要意义[2]。
可溶性鸟苷酸环化酶(soluble guanylate cyclase,sGC)是一种在体内广泛分布的信号转导酶,被一氧化氮(nitric oxide,NO)激活后催化三磷酸鸟苷反应生成第二信使环鸟苷酸(cyclic guanosine monophosphate,cGMP),介导许多心血管系统生理过程,如促进血管和平滑肌舒张、抑制血小板凝聚、抑制血管重构等[3-4]。因此,NO/sGC/cGMP通路成为治疗多种心血管疾病,如肺动脉高压、急性心衰、心绞痛和心肌梗死诱发血管重构等的有效靶标[5]。多年来,众多研究者以此开发了NO供体、磷酸二酯酶抑制剂和非NO依赖性sGC激动剂等药物,其中非NO依赖性sGC激动剂能避免传统的NO供体类药物易出现耐受、作用特异性不强和持续时间短等缺点[6],受到了广泛关注。目前已有系列的sGC激动剂被相继开发,其中由德国拜耳先灵制药公司研发的利奥西呱(riociguat)已获得美国、欧盟及日本等多个国家批准,用于治疗慢性血栓栓塞性肺动脉高压和成人动脉型肺动脉高压,但利奥西呱尚未在中国上市。
本所药物化学合成研究室以利奥西呱为先导化合物进行结构改造得到了一系列化合物,从中筛选得到sGC003(相对分子质量424.8)作为候选化合物,目前已申请并获得国家专利[7]。本研究室前期药效学评价研究表明,在慢性低氧及野百合碱诱导的SD大鼠肺动脉高压模型上,预防给予sGC003能明显降低大鼠肺动脉压和右心指数,改善右心室肥大,具有良好的药理作用。以往对sGC003的研究多集中于对病理模型动物症状的改善,其是否具有直接改善心肌肥大的作用未见报道。本研究采用复合酶消化法和差速贴壁法培养SD乳大鼠原代心肌细胞,内皮素1(endothelin-1,ET-1)刺激其肥大,检测sGC003对肥大的心肌细胞表面积、总蛋白质含量和心房利钠肽基因(atrial natriuretic peptide,ANP)mRNA表达的影响,明确sGC003对心肌细胞的保护作用。
1 材料与方法
1.1试剂和仪器
sGC003和利奥西呱由军事医学科学院毒物药物研究所药物化学合成研究室合成;ET-1购自德国Merck公司;5-溴脱氧核糖尿苷(5-bromodeoxyuri⁃dine deoxyribose,BrdU)、胰岛素-转铁蛋白、谷氨酰胺和异硫氰酸荧光素(fluorescein isothiocya⁃nate,FITC)购自美国Sigma公司;DMEM/F12培养基购自美国Gibco公司;胎牛血清、青霉素和链霉素购自美国Hyclone公司;胰酶和胶原酶Ⅱ购自美国Invitrogen公司;BCA蛋白定量试剂盒购自北京普利莱基因技术有限公司;Power SYBR Green购自美国Thermo Fisher Scientific公司;其他试剂均为国产分析纯。PCR引物由北京奥科生物有限公司合成。
3-16PK低温高速离心机(美国Sigma公司),2800UV/VIS紫外分光光度计(美国UNICO公司),Gel logic1500凝胶成像系统(美国Kodak公司),EDC-810基因扩增仪(北京东胜创新科技有限公司),ABI prism 7300实时定量PCR仪(美国Applied Biosystems公司),EVOS f1大屏幕倒置荧光显微镜(美国Thermo Fisher Scientific公司)。
1.2SD乳大鼠心肌细胞原代培养[8]
出生24 h的SPF级SD大鼠乳鼠由军事医学科学院动物中心提供,动物合格证号SCXK-(军)2012-0004。无菌条件下,自乳鼠剑突处开胸,暴露心脏,剪取心尖部分置于预冷的D-Hanks液中,洗净血污并转移至另一盛有冷D-Hanks液的平皿后用D-Hanks液清洗2次,将心脏剪成约1 mm× 1 mm×1 mm的组织碎块,继续D-Hanks液清洗后转移至锥形瓶中,加入约5倍于组织体积的消化液(0.125%胰酶∶0.1%胶原酶Ⅱ=2∶1),37℃水浴,轻轻摇晃,每次3 min,消化6~8次,至心肌组织块基本消化完全,收集除第一次消化后的细胞悬液,加入等体积预冷的DMEM/F12完全培养基(含10%胎牛血清)以终止胰酶消化作用。将细胞悬液轻轻吹打约1 min,过200目筛,除去未消化组织及细胞团块。将滤液432×g离心10 min,弃上清,向沉淀中加入适量DMEM/F12完全培养基重悬细胞,转移到培养皿中,于细胞培养箱中静止培养80 min后吸取细胞悬液,根据实验需求稀释至合适密度接种在培养板或培养皿中。细胞培养的前72 h用含BrdU 0.1 mmol·L-1的DMEM/F12完全培养基培养以抑制成纤维细胞增殖,之后换成无BrdU的无血清培养基培养24 h,再进行后续给药处理。
1.3ET-1刺激心肌细胞肥大模型的建立
将心肌细胞接种于6孔板,分别加入ET-1 0,1,10和100 nmol·L-1,分别处理24和48 h,观察并检测心肌细胞表面积及ANP mRNA的表达,以确定后续实验条件。
1.4心肌细胞表面积的观察和测量[8]
将心肌细胞1×107L-1接种于6孔板,分为6组:对照组、ET-1 10 nmol·L-1组、ET-1+利奥西呱0.1 μmol·L-1组、ET-1+sGC003 0.01,0.1和1.0 μmol·L-1组,药物处理48 h后,弃去培养基,PBS洗3次,4%甲醛固定20 min;PBS洗2次,加入含0.1%FITC和0.01%Hoechst的PBS,室温下避光孵育1 h,PBS洗4次,在倒置荧光显微镜下观察,随机选择8个视野,每个视野10个细胞,拍照,用图像分析软件(Image-Pro Plus6.0)对心肌细胞表面积进行测量分析。
1.5BCA法检测心肌细胞总蛋白质含量
将心肌细胞1×108L-1接种于6孔板,分组处理同1.4。给药48 h后,弃去培养基,用适量PBS洗3次,加入适量细胞裂解液使细胞裂解,进行细胞计数,转移至1.5 mL EP管中,置于4℃冰箱中缓摇混匀。将裂解液15 000×g离心20 min,4℃,将上清液转移至另一EP管中。取适量上清液按照试剂盒说明书测定蛋白质浓度。
1.6实时荧光定量PCR法检测心肌细胞ANP mRNA表达[9]
将心肌细胞1×108L-1接种于6孔板,分组同1.4。给药48 h后,弃去培养基,用适量PBS洗3次,每孔加入0.5 mL Trizol试剂裂解细胞,收集裂解液,氯仿抽提,异丙醇沉淀,75%乙醇(现配现用)洗涤沉淀,得到细胞总RNA。1.2%琼脂糖凝胶电泳和紫外分光光度计测定RNA纯度和浓度。取1 μg总RNA进行逆转录,引物序列如表1所示,反应体系为20 μL,设定反应条件为30℃10 min,42℃ 60 min,99℃5 min,5℃5 min。以Power SYBR Green为荧光指示物,将逆转录产物进行实时定量PCR反应,GAPDH为内参。电脑自动记录样品荧光反应曲线、融解曲线及反应循环数(Ct),用2-△△Ct表示ANP mRNA相对表达水平。
1.7统计学分析
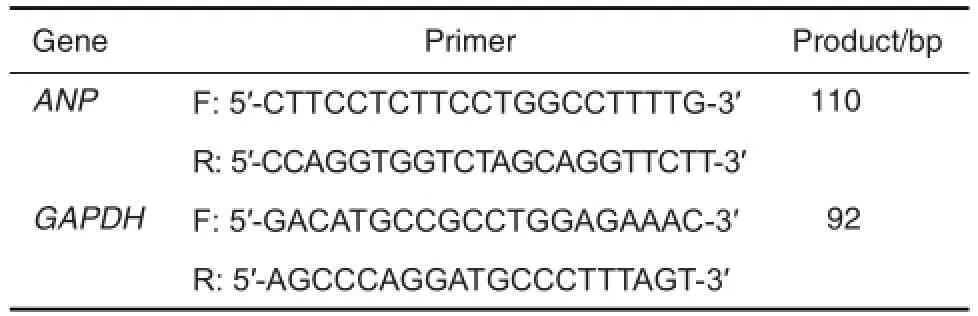
Tab.1 PCR primer sequence[10]
2 结果
2.1ET-1刺激心肌细胞肥大方法的建立及确证
由图1可见,在显微镜下观察到培养的SD乳大鼠原代心肌细胞贴壁展开,呈梭形、三角形或多边形等,有自主性节律搏动,并且较密集处的心肌细胞会形成放射状细胞簇,搏动同步化。与正常对照组比较,ET-1 1,10和100 nmol·L-1刺激24 h,心肌细胞面积无显著变化(数据略);刺激48 h,细胞面积显著增加,增大率分别为117%,163%和154% (P<0.01)。
由图2可见,ET-1 1,10和100 nmol·L-1刺激24 h,ANP mRNA表达分别上调21%,18%和24% (P<0.05);刺激48 h后,ANP mRNA表达增幅更大,分别上调94%,68%和76%(P<0.01)。故后续实验选择ET-1 10 nmol·L-1作用48 h以诱导心肌细胞肥大。

Fig.1 Effect of endothelin-1(ET-1)on cardiomyocyte area of neonatal Sprague-Dawley rats.The cardiomyo⁃cytes were treated with ET-1 1,10 and 100 nmol·L-1for 48 h,re⁃spectively.A:morphology of cardiomyocytes;B:cardiomyo⁃cyte area expressed by the elementary area.±s,n=8.**P<0.01,compared with normal control group.

Fig.2 Effect of ET-1 on ANP mRNA expression of neonatal Sprague-Dawley rat cardiomyocytes.±s,n=4. *P<0.05,**P<0.01 compared with corresponding normal control group.
2.2sGC003对ET-1所致肥大心肌细胞表面积的影响
由图3可见,与正常对照组相比,ET-1 10 nmol·L-1刺激心肌细胞48 h使细胞表面积增大约85%(P<0.01);与ET-1单独处理组比较,sGC003 0.01,0.1和1.0 μmol·L-1能降低ET-1引起的心肌细胞表面积增加,分别使细胞表面积减少了16%,21%和39%(P<0.01),其作用与利奥西呱相近,表明sGC003能有效地抑制ET-1诱导的心肌细胞肥大。
2.3sGC003对ET-1所致肥大心肌细胞总蛋白质含量的影响
由图4可见,ET-1 10 nmol·L-1刺激心肌细胞48 h后,心肌细胞总蛋白含量显著增加,为正常对照组的2.24倍(P<0.01)。与单独给予ET-1 10 nmol·L-1组相比,给予sGC003 0.01,0.1和1.0 μmol·L-1能降低ET-1引起的心肌细胞总蛋白质含量升高,分别使总蛋白含量降低了36%,38%和46%(P<0.05),其作用与利奥西呱相近。
2.4sGC003对ET-1所致肥大心肌细胞ANP mRNA表达的影响
由图5所示,ET-1 10 nmol·L-1刺激心肌细胞48 h后,ANP mRNA表达显著升高,为正常对照组的2.44倍(P<0.01);ET-1与sGC003 0.1 μmol·L-1联合处理组ANP mRNA表达较ET-1单独处理组明显下降>30%(P<0.05),sGC003 0.01和1.0 μmol·L-1对ET-1引起的ANP mRNA表达无明显影响,提示sGC003对ET-1诱导的ANP mRNA的过表达具有一定的抑制作用。

Fig.3 Effect of novel agonist of soluble guanylate cyclase sGC003 on ET-1-induced cardiomyocyte area changes in neonatal rats. Thecardiomyocyteswere cultured with ET-1(10 nmol·L-1),ET-1+riociguat(0.1 nmol·L-1)and ET-1+sGC003(0.01,0.1 and 1.0 nmol·L-1)for 48 h. A:cardiomyocyte morphology;B:the cardiomyocyte area expressed by the elementary area.±s,n=8-9.**P<0.01,com⁃pared with normal control group;##P<0.01,compared with ET-1 group.

Fig.4 Effect of sGC003 on ET-1-induced total protein content changes in neonatal rat cardiomyocytes.See Fig.3 for the cell treatment.±s,n=5.**P<0.01,compared with normal control group;#P<0.05,compared with ET-1 control group.

Fig.5 Effect of sGC003 on ET-1-induced ANP mRNA of neonatal rat cardiomyocytes expression.See Fig.3 for the cell treatment.±s,n=3.**P<0.01,compared with normal control group;#P<0.05,compared with ET-1 group.
3 讨论
心肌肥大在初期可视为心脏对血流动力学超负荷或神经体液刺激的一种有益的代偿机制,但长时间持续的心肌肥大最终会导致心律失常、心力衰竭,甚至猝死[11]。因此,对于肥大心肌的药物保护研究一直都是心血管领域的重要课题。本研究发现,sGC003对ET-1诱导的原代心肌细胞肥大具有一定的保护作用。
尽管心肌肥大的诱因多种多样,但其典型表现为:在分子水平主要是胚胎基因ANP、β心肌肌球蛋白重链和心肌肌球蛋白轻链2等过表达及胞内蛋白质合成增加;在细胞、组织水平为心肌细胞肥大、成纤维细胞和内皮细胞等非心肌细胞增殖和以胶原沉积为主要表现的细胞外基质重建;在器官水平为心脏质量增加,心室壁增厚或心腔扩大;反映到功能上表现为心脏收缩、舒张紊乱,心脏顺应性降低。本研究选用ET-1诱导原代心肌细胞肥大排除了血流动力学负荷和其他神经体液刺激等影响因素,是常用的评价心肌肥大的离体实验模型。ET-1可激活磷脂酶C/三磷酸肌醇途径,使细胞内Ca2+浓度增加或通过激活丝裂原活化蛋白激酶(mitogenactivated protein kinases,MAPK)通路,最终启动相关基因表达从而诱导心肌细胞肥大[12]。肥大的心肌细胞客观上表现为心肌细胞体积明显增加,显微镜下可观察到细胞表面积增加;蛋白质合成速率显著升高,总蛋白质含量增加;心肌细胞胚胎基因重新表达,ANP上调是心肌细胞肥大的标志。为成功建立心肌肥大的离体实验模型,本研究观察了ET-1不同浓度及不同刺激时间对心肌细胞表面积和ANP mRNA表达的影响。结果显示,ET-1使心肌细胞表面积显著增加,并上调心肌肥大标志基因ANP mRNA表达,表明ET-1造成了心肌细胞肥大,适用于后续研究。
心肌肥大是一种由多种因素参与调节的复杂动态过程,现已证实磷脂酰肌醇3激酶/蛋白激酶B通路、钙调神经磷酸酶通路、MAPK通路、NO/cGMP通路等多条信号通路均参与其病理过程[13-16]。cGMP作为体内广泛存在的第二信使在心血管系统中发挥着重要作用,在心血管疾病的发生过程中,NO/sGC/ cGMP信号通路是紊乱的,究其原因,大多是病理条件下NO被清除,从而阻断了sGC的激活[6]。sGC003是不依赖于NO的sGC激动剂,一方面能直接刺激sGC活性,另一方面能与NO发挥协同作用,在NO供体类药物硝普钠2 μmol·L-1存在的情况下,sGC003能明显提高SD乳大鼠原代心肌细胞中cGMP的浓度,EC50为0.473 μmol·L-1,与利奥西呱相当;抗低氧诱导的大鼠肺动脉高压的有效剂量为10 mg·kg-1。本研究以ET-1刺激心肌细胞肥大,考察sGC003对肥大心肌细胞的直接作用,发现sGC003能有效地抑制ET-1引起的心肌细胞面积增加、总蛋白含量升高和ANP mRNA表达增加,其作用与阳性药利奥西呱相当,提示其能够改善ET-1诱导的心肌细胞肥大,对心肌细胞有直接保护作用,这对于sGC003适应证的选择具有重要的指导意义,也为sGC作为临床上治疗心血管疾病的靶点提供了实验依据。sGC003抑制心肌细胞肥大的具体机制有待进一步研究。
[1]Chen WW,Gao RL,Liu LS,Zhu ML,Wang W,Wang YJ,et al.The general views of report of Chinese cardiovascular disease2014[J].Chin Circ J(中国循环杂志),2015,30(7):617-622.
[2]Cotecchia S,Del Vescovo CD,Colella M,Caso S,Diviani D.The alpha1-adrenergic receptors in cardiac hypertrophy:signaling mechanisms and functional implications[J].Cell Signal,2015,27(10):1984-1993.
[3]Münzel T,Feil R,Mülsch A,Lohmann SM,Hofmann F,Walter U,et al.Physiology and pathophysiology of vascular signaling controlled by cyclic guanosine 3′,5′-cyclic monophosphatedependent protein kinase[J].Circulation,2003,108(18):2172-2183.
[4] Takimoto E.Cyclic GMP-dependent signaling in cardiac myocytes[J].Circ J,2012,76(8):1819-1825.
[5]Irvine JC,Ganthavee V,Love JE,Alexander AE,Horowitz JD,Stasch JP,et al.The soluble guanylyl cyclase activator Bay 58-2667 selectively limits cardiomyocyte hypertrophy[J].PLoS One,2012,7(11):e44481.
[6]Schmidt HHHW,Hofmann FB,Stasch JP.cGMP:Generators,Effectors and Therapeutic Implications [M].Germany:Springer,2009:485-488.
[7]Li S,Zheng ZB,Li L,Zhong W,Wang LL,Chen W,etal.Substitutedthiazolylpyrazolopyridine compound and medicinal use thereof(取代噻唑基吡唑并吡啶类化合物及其医药用途):China,CN102485724A[P].2012-06-06.
[8]Zhang C,Kong LL,Yan LD,Liang YJ,Liu KL,Gong ZH.Effect of GF063,a new selective antag⁃onist of endothelin A receptor,on cardiomyocytes hypertrophyinduced by endothelin-1[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2011,25(1):17-22.
[9]Li X,Wei XL,Meng LL,Chi MG,Yan JQ,Ma XY,et al.Involvement of tissue transglutaminase in endothelin1-inducedhypertrophyincultured neonatal rat cardiomyocytes[J].Hypertension,2009,54(4):839-844.
[10]Lee DI,Zhu G,Sasaki T,Cho GS,Hamdani N,Holewinski R,et al.Phosphodiesterase 9a controls nitric-oxide-independent cGMP and hypertrophic heart disease[J].Nature,2015,519(7544):472-476.
[11]Li H,Gao S,Ye J,Feng X,Cai Y,Liu Z,et al. COX-2 is involved in ET-1-induced hypertrophy of neonatal rat cardiomyocytes:role of NFATc3[J]. Mol Cell Endocrinol,2014,382(2):998-1006.
[12]Ito H.Endothelins and cardiac hypertrophy[J].Life Sci,1997,61(6):585-593.
[13]Heineke J,Molkentin JD.Regulation of cardiac hypertrophy by intracellular signalling pathways [J].Nat Rev Mol Cell Biol,2006,7(8):589-600.
[14]Klawitter J,Klawitter J, Agardi E,Corby K,Leibfritz D,Lowes BD,et al.Association of DJ-1/ PTEN/AKT-and ASK1/p38-mediated cell signalling with ischaemic cardiomyopathy[J].Cardiovasc Res, 2013,97(1):66-76.
[15]Liou SF,Hsu JH,Chen YT,Chen IJ,Yeh JL. KMUP-1 attenuates endothelin-1-induced cardio⁃myocyte hypertrophy through activation of heme oxygenase-1 and suppression of the Akt/GSK-3β,calcineurin/NFATc4andRhoA/ROCKpathways [J].Molecules,2015,20(6):10435-10449.
[16]Zhang M,Takimoto E,Lee DI,Santos CX,Nakamura T,Hsu S,et al.Pathological cardiac hypertrophy alters intracellular targeting of phos⁃phodiesterase type 5 from nitric oxide synthase-3 to natriuretic peptide signaling[J].Circulation,2012,126(8):942-951.
(本文编辑:齐春会)
Effect of novel agonist of soluble guanylate cyclase sGC003 on endothelin-1-induced cardiomyocyte hypertrophy
LIU Ke,YAN Ling-di,YONG Zheng,GONG Ze-hui,SU Rui-bin
(State Key Laboratory of Toxicology and Medical Countermeasures,Institute of Pharmacology and Toxicology,Academy of Military Medical Sciences,Beijing 100850,China)
OBJECTlVE To investigate the protective effect of sGC003,a novel agonist of soluble guanylate cyclase,on endothelin-1(ET-1)-induced cardiomyocyte hypertrophy.METHODS Cardiomy⁃ocytes were isolated from neonatal Sprague-Dawley rats using serial enzymatic digestion and then incubated with ET-1 10 nmol·L-1in the absence or presence of sGC003 0.01,0.1 and 1.0 μmol·L-1.Hyper⁃trophic responses including the cardiomyocyte area(Image-Pro Plus 6.0),the expression of atrial natri⁃uretic peptide gene(ANP)mRNA(RT-PCR method)and total protein content(BCA method)were detect⁃ed.RESULTS After 48 h stimulation with ET-1 10 nmol·L-1,the cardiomyocyte area increased by 80% (P<0.01),the total protein content increased by 120%(P<0.01)and the expression of ANP mRNA up-regulated by 140%(P<0.01).sGC0030.01,0.1 and 1.0 μmol·L-1elicitedantihypertrophic actions,including inhibition of ET-1-mediated increase in the cardiomyocyte area(P<0.01),raised total protein content(P<0.05)and upregulation of ANP mRNA(P<0.05).CONCLUSlON sGC003 has protective,car⁃diomyocyte-selective antihypertrophic effects in vitro.
soluble guanylate cyclase;agonist;sGC003;cardiomyocytes;endothelin-1;cardiac hypertrophy
The project supported by National Science and Technology Major Project of China(2012ZX09301-001-006)
SU Rui-bin,E-mail:ruibinsu@126.com,Tel:(010)66931607
R972
A
1000-3002-(2016)04-0338-06
国家科技重大专项(2012ZX09301-001-006)
刘 可,女,硕士研究生,主要从事新药评价研究,E-mail:liuke1991f@126.com;苏瑞斌,男,研究员,博士生导师,主要从事新药评价与神经精神药理学研究。
苏瑞斌,E-mail:ruibinsu@126.com,Tel:(010)66931607
2016-01-12接受日期:2016-03-21)

