枫蓼提取物对小鼠实验性溃疡性结肠炎的防治作用
任守忠,陈 君,苏文琴,王 宁,马志健(海南医学院.药学院,.解剖教研室,海南海口 5799;.海南省人民医院药学部,海南海口 5707)
枫蓼提取物对小鼠实验性溃疡性结肠炎的防治作用
任守忠1,陈 君2,苏文琴1,王 宁1,马志健3
(海南医学院1.药学院,3.解剖教研室,海南海口 571199;2.海南省人民医院药学部,海南海口 571017)
目的 探讨枫蓼提取物对小鼠溃疡性结肠炎的防治作用。方法 通过小肠推进实验和番泻叶致小鼠腹泻模型观察小肠推进率、稀便率及腹泻指数。用4%葡聚糖硫酸钠(DSS)建立小鼠溃疡性结肠炎模型,对正常组、模型组、美沙拉嗪组、枫蓼提取物11.7,23.4和46.8 g·kg-1剂量组小鼠进行疾病活动指数(DAI)评分,测定结肠组织中白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)、丙二醛(MDA)和一氧化氮(NO)含量及髓过氧化物酶(MPO)的活性。结果 枫蓼提取物46.8 g·kg-1能抑制小鼠小肠推进率,显著减少番泻叶致腹泻小鼠腹泻次数,降低腹泻率和腹泻指数(P<0.05)。结肠炎结果显示,与正常组比较,模型组小鼠体质量减轻,DAI评分增高(P<0.05),结肠组织中MPO活性、IL-1β、TNF-α、MDA和NO含量升高(P<0.01)。与模型组比较,枫蓼提取物46.8 g·kg-1组小鼠DAI评分降低29.1%(P<0.05);23.4和46.8 g·kg-1组结肠组织中MPO活性、TNF-α、MDA和NO含量均降低(P<0.05)。结论 枫蓼提取物能改善DSS诱导小鼠溃疡性结肠炎,可能与解痉、止泻、抗炎、抗氧化及减少炎性介质释放等有关。
枫蓼提取物;结肠炎,溃疡性
DOl:10.3867/j.issn.1000-3002.2016.04.007
溃疡性结肠炎(ulcerative colitis,UC)是一种病因和发病机制尚不十分清楚的慢性肠道非特异性炎症疾病。近年来,随着对UC发病机制研究的不断深入,关于细胞因子和氧化应激与UC的关系也越来越受到重视,在UC发病中的作用逐渐得到广泛认可。这些细胞因子主要由单核-巨噬细胞分泌,并对中性粒细胞等产生炎症趋化作用进而诱导其在肠道炎性部位聚集,最终导致局部肠道病变的发生,从而介导UC发病。UC临床主要表现为腹泻、腹痛和黏液脓血便,并发症有肠梗阻、出血、肠穿孔等[1]。临床治疗UC的传统药物包括水杨酸类、糖皮质激素类、免疫抑制剂和抗生素类等,能减轻和控制UC症状,但副作用多,不宜长期使用,迄今尚无理想的UC治疗药物[2-3]。
寻找防治UC新安全药尤为必要。传统中药在防治UC方面,具有毒性低、副作用少、复发率低等优点。枫蓼肠胃康是国家中药保护品种,由牛耳枫(Daphniphyllum calycinum Benth,虎皮楠科交让木属植物牛耳枫的干燥茎枝)和辣蓼〔(Polygonum hydropiper L.var flaccidum(Meissn.)steward,蓼科蓼属植物辣蓼的全草〕2味中药组成,具有清热除湿化滞之功效,临床上用于治疗急性胃肠炎、肠易激综合征和溃疡性结肠炎等胃肠道疾病具有良好的疗效[4-5],但有关该复方治疗结肠炎的药理作用及其机制尚不清楚。本研究采用葡聚糖硫酸钠(dex⁃tran sulfate sodium,DSS)建立小鼠溃疡性结肠炎模型,探讨枫蓼提取物对小鼠结肠炎的防治作用及可能的机制,为其临床应用提供实验依据。
1 材料与方法
1.1动物、药品、试剂和主要仪器
昆明种小鼠,清洁级,雌雄各半,体质量18~22 g,购于长沙市天勤生物技术有限公司,许可证号:SCXK(湘)2014-0011,动物自然昼夜节律光照,适应1周后进行实验。
枫蓼提取物包括牛耳枫和辣蓼,由海南医学院药学院海南省热带药用植物研究开发重点实验室制备。牛耳枫和辣蓼2∶1,水煎煮3次,滤过,合并滤液,浓缩,提取液经AB-8型大孔吸附树脂粗分,用70%乙醇洗脱,回收乙醇,得到醇洗脱物,每克相当于生药材32.18 g。DSS(分子质量40 000),南京都莱生物有限公司;美沙拉嗪肠溶片(mesalazine),葵花药业集团佳木斯鹿灵制药有限公司;番泻叶(cassia,senna)(取干燥番泻叶,粉碎后过100目筛,加蒸馏水配制成20%的混悬液,备用)海南养年堂药店;蒙脱石散(nibtnirukkibute powder),海南海力制药有限公司;丙二醛(malondialdehyde,MDA)试剂盒、一氧化氮(nitric monoxide,NO)试剂盒、大便隐血试剂盒,南京建成生物工程研究所产品;髓过氧化物酶(myeloperoxidase,MPO)试剂盒、肿瘤坏死因子1α(tumor necrosis factor-α,TNF-α)和白细胞介素1β(interleukin-1,IL-1β)酶联免疫试剂盒,购于武汉博士德生物科技有限公司。
AL104分析电子天平,梅特勒-托利系仪器(上海)有限公司;TGL-16G离心机,上海安亭科学仪器厂;T25电动匀浆机,宁波新芝生物科技股份有限公司、UV1800PC紫外-可见分光光度计,上海凤凰光学科学仪器有限公司;4MK2洗板机和MK3酶标仪,赛默飞世尔(上海)仪器有限公司。
1.2枫蓼提取物对正常小鼠小肠推进率的影响
将小鼠按体质量随机分成5组,每组10只,正常组、硫酸阿托品组(0.0003 g·kg-1)、枫蓼提取物(生药11.7,23.4和46.8 g·kg-1)组。各组小鼠均ig给予20 mL·kg-1相应药物,正常组给予同体积蒸馏水,每天1次,连续3 d。末次给药前禁食(不禁水)12 h,末次给药30 min后,各鼠均以新鲜配置的炭末混悬液灌胃,每只0.4 mL,20 min后脱颈椎处死小鼠,开腹,迅速取出小肠,分离肠系膜,测量幽门至回盲肠部全长及幽门至黑色炭末前沿的距离,以幽门至黑色炭末前沿的距离/幽门至回盲部全长的百分率为小肠推进率。
1.3枫蓼提取物对番泻叶所致小鼠泄泻的影响
昆明种小鼠60只,按体质量随机分为正常组、模型组、蒙脱石散组(6.0 g·kg-1)、枫蓼提取物(生药11.7,23.4和46.8 g·kg-1)组。每组10只。按20 mL·kg-1ig给予相应药物,连续5 d。于末次给药前禁食不禁水10 h,给药30 min后,除正常组外,其余各组小鼠均ig给予20%番泻叶混悬液30 mL·kg-1,将小鼠单个放入底部铺有滤纸的鼠盒中,连续观察5 h,不间断更换滤纸。记录开始腹泻时间、干便数、稀便数、稀便级数,并计算相应指标[8]。①稀便率:每只小鼠稀便数占总便数的百分比;②稀便级:以稀便污染滤纸形成污迹面积的大小分为4级。分级标准(污染直径cm):1(<1);2(1~ 1.9);3(2~3);4(>3),统计时先逐个统计每一堆稀便的级数,然后将该鼠所有稀便级数相加除以稀便次数即得稀便的平均级数;③腹泻指数:稀便率与稀便级的乘积。
1.4小鼠溃疡性结肠炎模型的建立、分组及给药
小鼠按体质量随机分为5组,分别为正常组、模型组、美沙拉嗪0.2 g·kg-1阳性对照组及枫蓼提取物(生药11.7,23.4和46.8 g·kg-1)组,每组10只。正常组小鼠自由饮用自来水,其他组小鼠自由饮用双蒸水配制的4%DSS(W/V)的溶液7 d制备结肠炎模型[6]。在造模当天,阳性对照组和枫蓼提取物组按20 mL·kg-1同时ig给予相应药物,正常组及模型组给予相同体积的蒸馏水,每天1次,连续7 d。
1.4.1疾病活动指数评分
实验过程中每日观察小鼠的行为活动、体质量变化、大便性状,并用粪便隐血试纸检测大便带血情况,按文献[7]方法对小鼠进行疾病活动指数(disease activity index,DAI)评分。评分标准:0分:体质量减少<1%,便血阴性,无腹泻;1分:体质量减少1%~5%,便血弱阳性,粪便松散;2分:体质量减少5%~10%,便血阳性,半成形稀便;3分:体质量减少10%~20%,便血强阳性,不成形稀便;4分:体质量少>20%,肉眼血便,水样泻。
1.4.2结肠组织中lL-1β和TNF-α含量测定
实验结束后,各组小鼠脱颈处死。剖腹分离结肠,取结肠组织,用冰生理盐水洗净粪便,滤纸拭干,匀浆,3000×g。离心10 min,取上清液,采用ELISA法测定结肠组织中IL-1β和TNF-α的含量,检测方法严格按照试剂盒说明书操作。
1.4.3检测结肠MPO活性、MDA和NO的含量
取100 mg结肠组织,去除脂肪系膜组织,加生理盐水制备10%匀浆,离心,取0.5 mL上清液按照试剂盒说明,运用硫代巴比妥酸(thiobarbituric acid,TBA)微量法测定结肠组织中MDA含量;运用硝酸还原酶法(Griess)测定结肠组织中NO含量;运用酶联免疫吸附法测定MPO活性。
1.5统计学分析
2 结果
2.1枫蓼提取物对正常小鼠小肠推进率的影响
由表1可见,与正常对照组比较,阿托品对小鼠小肠运动具有显著抑制作用(P<0.01);枫蓼提取物46.8 g·kg-1对小鼠小肠推进率具有抑制作用,能使小肠内炭末推进率降低(P<0.05);枫蓼提取物11.7和23.4 g·kg-1对小鼠小肠推进无明显影响。

Tab.1 Effect of Fengliao extract on small intestine propulsion of normal mice
2.2枫蓼提取物对番泻叶致小鼠腹泻的影响
给予番泻叶混悬液1 h后,各组小鼠均出现不同程度的精神萎靡、行动迟缓、运动减少、稀便量增加。与模型组相比(表2),蒙脱石散和枫蓼提取物各组小鼠的稀便次数均减少,腹泻指数明显下降(P<0.01,P<0.05),提取物11.7和23.6 g·kg-1组小鼠腹泻级降低(P<0.05),而46.8 g·kg-1组小鼠腹泻级则无显著差异。
2.3枫蓼提取物对DSS结肠炎小鼠DAl积分的影响
模型组小鼠从饮用4%DSS后,第4天开始体质量出现下降,同时出现血便。治疗组小鼠体质量自第5天开始出现体质量下降,而正常组体质量无降低。实验第8天,枫蓼提取物46.8 g·kg-1组和美沙拉嗪组的DAI积分比模型组分别降低29.1%和44.5%(P<0.05)(表3);11.7和23.4 g·kg-1剂量组变化无显著性差异。
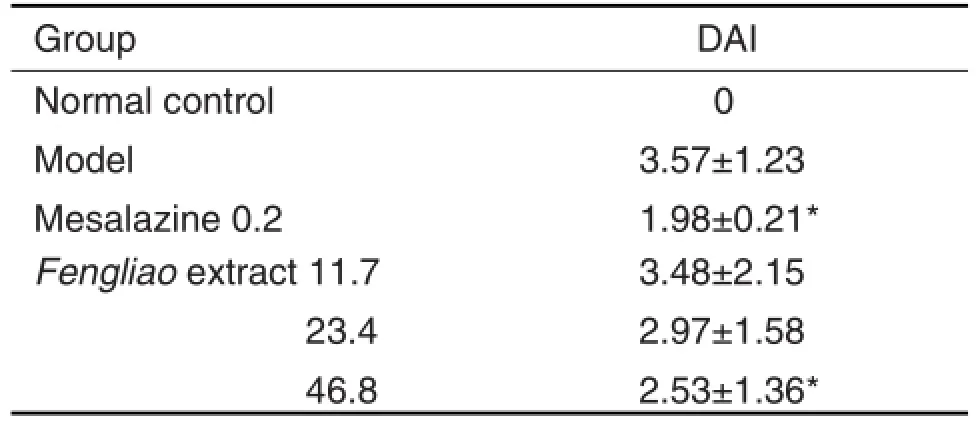
Tab.3 Effect of Fengliao extract on disease activity index(DAl)of mice with ulcerative colitis induced by dextran sulfate sodium(DSS)
2.4枫蓼提取物对DSS结肠炎小鼠结肠组织中lL-1β 和TNF-α 的影响
由表4可见,与正常组比较,模型组小鼠结肠组织中IL-1β和TNF-α水平均升高(P<0.01),提示结肠组织局部促炎因子释放增多。与模型组相比,枫蓼提取物46.8和23.4 g·kg-1组结肠组织中TNF-α水平下降(P<0.05),IL-1β变化无差异。
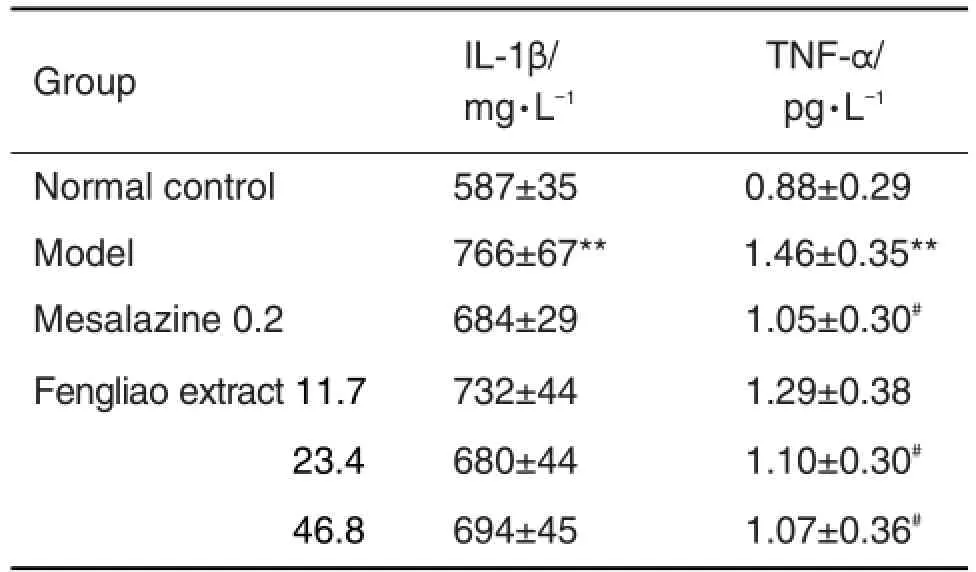
Tab.4 Effect of Fengliao extract on content of inter⁃leukin-1β (lL-1β )and tumor necrosis factor-α (TNF-α )in colon tissue of mice with ulcerative colitis induced by DSS

Tab.2 Effect of Fengliao extract on mouse diarrhea induced by cassia

Tab.5 Effect of Fengliao extract on level of myeloperoxidase(MPO),malondiadehyde(MDA)and nitric oxide (NO)in colon tissue of mice with ulcerative coloitis induced by DDS
2.5枫蓼提取物对DSS结肠炎小鼠对结肠组织中MPO活性、MDA和NO含量的影响
由表5可见,与正常组比较,模型组小鼠结肠组织匀浆中MPO活性及MDA和NO含量均显著增高(P<0.01)。与模型组比较,美沙拉嗪组小鼠结肠组织中MDA、NO含量及MPO活性均显著下降(P<0.01);枫蓼提取物23.4和46.8 g·kg-1组DSS结肠炎小鼠结肠组织匀浆中MPO活性、MDA含量明显降低(P<0.05),枫蓼提取物46.8 g·kg-1能降低小鼠结肠组织中NO水平(P<0.05);枫蓼提取物11.7 g·kg-1对MDA、NO含量及MPO活性均无显著影响。
3 讨论
小肠推进实验结果显示,枫蓼提取物具有抑制小鼠小肠推进的作用,说明其能减慢小肠蠕动作用,在一定程度对腹泻产生抑制作用。番泻叶所致小鼠急性腹泻实验结果显示,枫蓼提取物能抑制番泻叶所致小鼠湿粪颗粒增加,降低番泻叶引起的小鼠腹泻次数和腹泻指数,说明其具有较好的止泻作用。
结肠炎实验结果显示,枫蓼提取物对DSS诱导的小鼠溃疡性结肠炎有改善作用,在枫蓼提取物治疗组小鼠的一般情况良好,DAI评分降低。通过检测DSS模型组小鼠结肠中TNF-α和IL-1水平,结果显示,DSS结肠炎模型小鼠结肠黏膜中TNF-α和IL-1水平增高,二者是重要的促炎细胞因子,在UC活动期发挥重要活性,与文献报道相一致[9-10]。在UC的炎症反应中,促炎因子通过增加炎性细胞的数量来致炎,炎症细胞被反复激活,并不断地分泌促炎因子,并形成负反馈调节,肠道炎症反应周而复始,组织损伤不断地加重[11]。临床研究也发现,在UC活动期,患者血清TNF-α水平明显高于缓解期和正常对照者,反映TNF-α与UC的发病和病变活动有关[12]。本研究显示,在枫蓼提取物23.4和46.8 g·kg-1能降低结肠匀浆中TNF-α的水平,说明该复方能抑制促炎因子TNF-α释放,从而减轻结肠黏膜炎症反应。TNF-α由单核-巨噬细胞产生,是UC发病机制中重要的促炎介质,在肠道中能介导肠黏膜的损伤,还可通过激活NF-κB通路,上调促炎介质表达,促使IL-6和IL-8等细胞因子释放,形成细胞因子网络,扩大炎症级联反应,促使炎症迁延[13]。IL-1β是一种由单核细胞、肥大细胞和内皮细胞等分泌产生具有多种功能的细胞因子,是免疫与炎症启动的重要调节因子。有研究发现,UC患者IL-1β水平显著增高,随着病情的缓解,IL-1β水平又显著降低,说明IL-1β参与UC发生、发展过程[14]。本实验研究也显示,DSS模型组结肠组织中IL-1β水平升高,但枫蓼提取物虽也能降低结肠组织中IL-1β水平,但没有显著性差异。
枫蓼提取物对小鼠溃疡性结肠炎的影响可能与抗氧化、清除自由基等有关。氧化应激与UC的发生密切相关,在有害刺激下,结肠上皮炎性细胞(巨嗜细胞和中性粒细胞)增多,活化,经NADH氧化酶、NADPH氧化酶等作用释放大量·O2-,过量的·O2-,一方面直接导致肠點膜过氧化损伤,加剧巨嗜细胞活动,产生呼吸爆发,一方面又与H2O2相互反应生成·OH,使细胞膜上不饱和脂肪酸过氧化,产生丙二醛等脂质过氧化物,严重损伤肠黏膜,而组织损伤会进一步刺激ROS产生,形成一个正反馈。同时过氧化物和氧自由基还能刺激肠道分泌液体导致腹泻、炎症等[16]。其中,NO在UC的发生中扮演着双重角色,生理剂量的NO对消化系统起重要的保护作用,过量的NO则与超氧阴离子结合生成过氧化亚硝酸盐(OONO-),再转变为氧自由基,导致组织损伤[17]。丙二醛是脂质过氧化终产物,可以反映机体被脂质过氧化的程度及机体细胞受自由基攻击的程度。本研究显示DSS模型组小鼠结肠黏膜中MDA和NO的含量升高,说明小鼠饮用DSS后出现结肠粘膜组织损伤,进而引发氧化应激反应,产生过多MDA和NO,加重结肠粘膜损伤。经治疗后,枫蓼提取物46.8 g·kg-1能显著降低DSS结肠组织中MDA和NO水平,减轻结肠炎黏膜的氧化应激反应和组织损伤,结果表明该提取物具有一定的抗氧化、清除自由基的作用,能拮抗氧化应激引起的粘膜损伤。但其抗氧化作用的机制以及是否通过提高抗氧化酶如SOD和CAT等的活性来实现尚不清楚,有待进一步研究。
进一步研究发现,DSS结肠炎小鼠匀浆中的MPO活性增高,表明肠黏膜中性粒细胞浸润增加,加重肠道炎症反应。MPO是中性粒细胞中的一种酶,凡是存在中性粒细胞浸润的组织都可以通过MPO活性测定来判断细胞浸润程度,MPO活性是评价中性粒细胞在组织中浸润程度的可靠指标[18]。枫蓼提取物能降低MPO表达,抑制肠黏膜中性粒细胞浸润,达到抗结肠炎作用。
综上所述,枫蓼提取物能改善DSS诱导小鼠溃疡性结肠炎,可能与其解痉、止泻、抗炎、抗氧化和减少炎性介质释放等有关。
[1]Wang YF,Ou YQ,Hu RW,Wen ZH.Advances in study on epidemiology of inflammatory bowel dis⁃ease[J].Chin J Gastroenterol(胃肠病学),2013,18(1):48-51.
[2]Krishnareddy S,Swaminath A.When combination therapy isn′t working:emerging therapies for the management of inflammatory bowel disease[J]. World J Gastroenterol,2014,20(5):1139-1146.
[3]Cho EJ,Shin JS,Noh YS,Cho YW,Hong SJ,Park JH,et al.Anti-inflammatory effects of methanol extract of Patrinia scabiosaefolia in mice with ulcer⁃ative colitis[J].J Ethnopharmacol,2011,136(3):428-435.
[4]Hou YM,Gan AJ.Efficacy and safety of fengliao stomach granules combined with mesalazine in the treatment of recurrent ulcerative colitis[J]. Pract Pharm Clin Rem(实用药物与临床),2014,17(2):55-58.
[5]Mu GR.Effect of changweikang granules in treating diarrhea-predominantirritablebowelsyndrome [J].Chin J Integr Tradit West Med Dig(中国中西医结合消化杂志),2012,20(8):356-358.
[6]Dou W,Zhang J,Zhang E,Sun A,Ding L,Chou G,et al.Chrysin ameliorates chemically induced colitis in the mouse through modulation of a PXR/NF-κB signaling pathway[J].J Pharmacol Exp Ther,2013,345(3):473-482.
[7]Kihara N,De La Fuente SG,Fujino K,Takahashi T,Pappas TN, Mantyh CR.Vanilloidreceptor-1 containingprimarysensoryneuronesmediate dextran sulphate sodium induced colitis in rats[J]. Gut,2003,52(5):713-719.
[8]Zhou Y,Xue ZY,Li C,Liu PQ,Wang DM,Chen JW. Study on the anti-diarrhea effect of Chinese herb Babu FXN[J].J Chin Med Mater(中药材),2014,37(12):2271-2274.
[9]Sakthivel KM,Guruvayoorappan C.Protective effect of Acacia ferruginea against ulcerative colitis via modulating inflammatory mediators,cytokine profile and NF-κB signal transduction pathways[J].J Environ Pathol Toxicol Oncol,2014,33(2):83-98.
[10]Lin P,Wu Y,Huang H,Mei L.Cytokine and ulcer⁃ative colitis[J].J Hubei Inst National:Med Ed(湖北民族学院学报:医学版),2003,20(4):28-30,33.
[11]Wendelsdorf K,Bassaganya-Riera J,Hontecillas R,Eubank S.Model of colonic inflammation:immune modulatory mechanisms in inflammatory bowel disease[J].J Theor Biol,2010,264(4):1225-1239.
[12]Dinarello CA,Goldin NP,Wolff SM.Demonstration and characterization of two distinct human leukocytic pyrogens[J].J Exp Med,1974,139(6):1369-1381.
[13]Clark IA.How TNF was recognized as a key mech⁃anism of disease[J].Cytokine Growth Factor Rev,2007,18(3-4):335-343.
[14]Cao XH,Zhang XY,Zhang XN.Progress in under⁃standing the role of interleukins in the pathogenesis of ulcerative colitis[J].World Chin J Digestol(世界华人消化杂志),2011,19(30):3143-3148.
[15]Lenoir L,Rossary A,Joubert-Zakeyh J,Vergnaud-Gauduchon J,Farges MC,Fraisse D,et al.Lemonverbena infusion consumption attenuates oxidative stress in dextran sulfate sodium-induced colitis in the rat[J].Dig Dis Sci,2011,56(12):3534-3545.
[16]Kubes P,Mccafferty DM.Nitric oxide and intestinal inflammation[J].Am J Med,2000,109(2):150-158.
[17]Ge H,Sun H.Role of oxygen free radical and nitric oxideon pathogenesis of ulcerative colitis[J]. J Beihua Univ:Nat Sci(北华大学学报:自然科学版),2003,4(5):411-412.
[18]Chen JG,Deng HZ.Effects of total base of Sophora alopecuroides on expression of SOD,MDA,NO,MPO in rats with experimental colitis[J].China J Chin Mater Med(中国中药杂志),2006,31(4):323-325.
(本文编辑:贺云霞)
Effect of Fengliao extract on mice with experimental ulcerative colitis
REN Shou-zhong1,CHEN Jun2,SU Wen-qin1,WANG Ning1,MA Zhi-jian3
(1.School of Pharmacy,3.Department of Human Anatomy,Hainan Medical University Haikou 571199,China;2.Department of Pharmacy,Hainan Provincial People′s Hospital,Haikou 571017,China)
OJECTlVE To investigate the preventive effect of Fengliao extract on ulcerative colitis of mice.METHODS Using the intestinal propulsion rate experiment and senna induced diarrhea model,the intestinal propulsion rate,diarrhea rate and index of diarrhea were observed.Mice were randomly divided into normal group,model group,mesalazine hydrochloride group and Fengliao extract 11.7,23.4 and 46.8 g·kg-1group.The mouse colitis model was induced by 4%dextran sulfate sodium.The mice were administraed once daily for 7 d while the disease activity index(DAI)score was calculated and the activity of tumor necrosis factor α(TNF-α),interleukin-1β(IL-1β),myeloperoxidase(MPO)and content ofmalondialdehyde(MDA)andnitric monoxide(NO)in colon tissue were determined. RESULTS Fengliao extract 46.8 g·kg-1inhibited the intestinal propulsion rate(P<0.05),reduced the frequency of diarrhea and the diarrhea index(P<0.05).Results of colitis showed that the body mass of mice in the model group was significantly decreased but the DAI score increased compared with normal group(P<0.05).The activity of MPO and the contents of IL-1β,TNF-α,MDA and NO in colon mucosa were increased(P<0.01).Compared with the model group,Fengliao extract 46.8 g·kg-1decreased the DAI score(P<0.05)while Fengliao extract 46.8 and 23.4 g·kg-1reduced MPO activity in colonic mucosa and content of IL-1β,TNF-α,MDA and NO in colonic homogenate(P<0.05).CONCLUSlON Fengliao extract can significantly improve the DSS induced colitis in mice,which is probably associated with its antispasmodic and anti-diarrheal effect as well as the reduced release of inflammatory mediators and antioxidants.
Fengliao extract;colitis,ulcerative
The project supported by National Natural Science Foundation of China(81441137);and Talent Introduction Fund of Hainan Medical University
MA Zhi-jian,E-mail:mazhijian2000@126.com
R975.6
A
1000-3002-(2016)04-0344-06
国家自然科学基金(81441137);海南医学院引进人才科研启动经费资助
任守忠,男,博士,副教授,主要从事中药药理和毒理研究;马志健,男,副教授,主要从事动物模型研究。
马志健,E-mail:mazhijian2000@126.com
2015-08-31接受日期:2016-03-10)

