Toll样受体4配体的研究进展
朱雪坤,杨日芳,孟艳秋(.沈阳化工大学制药与生物工程学院,辽宁沈阳 04;.军事医学科学院毒物药物研究所,北京 00850)
Toll样受体4配体的研究进展
朱雪坤1,2,杨日芳2,孟艳秋1
(1.沈阳化工大学制药与生物工程学院,辽宁沈阳 110142;2.军事医学科学院毒物药物研究所,北京 100850)
Toll样受体4(TLR4)是TLR超家族的一员,主要识别细菌内毒素、革兰阴性菌细胞壁成分脂多糖和脂寡糖等物质,防止微生物入侵。TLR4被配体激活后可产生促炎症细胞因子和炎症趋化因子,调节天然免疫反应,但其异常调节会引发自身免疫性疾病。本文综述了TLR4的生物结构和配体识别机制和近几年对TLR4有调节作用的脂质A类似物、天然产物和合成小分子化合物的研究进展,讨论了配体的构效关系和复合物中配体-受体与蛋白质-蛋白质相互作用。
Toll样受体4;配体;脂多糖;天然免疫
DOl:10.3867/j.issn.1000-3002.2016.04.014
Toll样受体4(Toll-like receptor 4,TLR4)是TLR受体超家族的一员,被配体激活后可产生促炎细胞因子和炎症趋化因子,调节天然免疫,防止微生物入侵[1],但调节异常会引发自身免疫性疾病[2]。TLR4是TLR超家族中发现最早、研究最广的受体之一,以病原体相关分子模式(pathogen-associat⁃ed molecular patterns,PAMP)识别配体,如革兰阴性菌细胞壁成分的脂多糖(lipopolysaccha⁃rides,LPS)、脂寡糖(lipooligosaccharide)、细菌内毒素和病毒、真菌和霉浆菌分泌的物质[3-5]。TLR4还以危险/损害相关分子模式(danger/damageassociated molecular patterns,DAMP)识别内源性配体,如高迁移率族蛋白B1(high mobility group box protein 1,HMGB1)和β-防御素等无菌发炎时的炎症细胞因子等[5]。但迄今为止尚无直接证据能证实DAMP是TLR4的直接配体。这可能是因为在实验期间DAMP类配体蛋白在表达或纯化时被内毒素及其他配体污染而受到干扰[4]。本文综述TLR4的生物结构和配体识别机制以及近几年对TLR4有调节作用的脂质A类似物、天然产物和合成小分子化合物的研究进展,讨论了配体的构效关系、配体-受体和蛋白质-蛋白质相互作用,并对TLR4配体药物研发进行了展望。
1 TLR4 受体
1.1TLR4生物结构
TLR超家族为模式识别受体,包括胞外区、跨膜区和胞内区,胞外区为富含亮氨酸重复序列(leu⁃cine-rich repeat,LRR)[6],用于识别配体并与病原体细胞表面结合从而启动信号转导,不同TLR之间的LRR区同源性较差,提示各种TLR分子的配体有不同的结构;跨膜区是半胱氨酸重复排列区;胞内区约含200个氨基酸,与白细胞介素1受体1 (interleukin-1 receptor-1,IL-1R1)高度同源,称之为TIR(Toll/IL-1R1 homologous region,TIR)结构域,胞内的信号传导与之有关[1,6]。包含TIR结构域的蛋白质有TLR、髓样分化因子88(myeloid dif⁃ferentiation factor 88,MyD88)、TIR结构域衔接子(TIR-domain-containing adaptor,TRIF)、TRIF相关 接 头 分 子(Trif-related adaptor molecule,TRAM)等[7],它们都具有相似的信号肽衔接蛋白。配体与TLR结合后产生的信号肽与受体的TIR结构域衔接,通过多重信号通路产生并分泌细胞因子,如核因子κB(nuclear factor-κB,NF-кB、肿瘤坏死因子受体相关因子3(tumor necrosis factor receptor-associated factor 3,TRAF3)和干扰素调节因子3(interferon regulatory factor 3,IRF3)等[3]。
1.2TLR4信号通路
TLR4有两种识别配体的方式,包括MyD88依赖性途径和TRIF依赖性途径(图1)[8]。MyD88依赖性途径中,TLR4与配体结合后形成TLR4/MD-2复合物并二聚化,与MyD88的TIR结构域结合后激活MyD88,形成有活性的TLR4/MyD88复合物,激活IL-1R相关激酶4(IL-1R-associated kinase 4,IRAK4),使IRAK1和IRAK2磷酸化后与TRAF6结合,活化IκB激酶(inhibitor of nuclear factor-κB kinase,IKK),促使NF-κB抑制因子(inhibitor of nuclear factor-κB,IκB)磷酸化后从NF-κB上脱落,使NF-κB进入细胞核并激发后续反应[1,7]。
TRAM也含有TIR结构域,在TRIF依赖性途径中可通过活化TRAF3对干扰素(interferon,IFN)的转录进行调节,激活干扰素调节因子3(interferon regulatory factor 3,IRF-3)、IRF-7以及NF-κB。IRF-3激活后使IFN相关基因活化,促使机体产生炎症相关因子[1,7]。
2 潜在适应证
TLR4配体的作用广泛,与头颈癌、肺癌、肝癌、宫颈癌和卵巢癌等有密切联系[8],在福辛普利治疗脂肪沉滞性动脉硬化症时也有重要作用[9],与缺血性疾病的梗塞面积也有关[10]。抑制TLR4的表达可治疗CBV3引起的心肌炎[2]。高HMGB1-TLR4信号通路在外伤性脑损伤后可导致神经血管功能障碍[11]。TLR4抑制剂(如VGX-1027)可使人体抵抗2型糖尿病以及肾性并发症[12]。此外,TLR4还与败血症、卒中、心肌梗死和器官移植等有密切关系[5]。
3 TLR4 配体的研发

图1 Toll样受体4(TLR4)信号通路.MD-2:髓样分化蛋白-2;MyD88:髓样分化因子88;IRAK:IL-1R相关激酶;TRAF:肿瘤坏死因子受体相关因子;NF-кB:细胞核因子-κB;IκB:NF-κB抑制因子;IKK:IκB激酶;TRIF:TIR结构域衔接子;TRAM:TRIF相关接头分子;IRF3:干扰素调节因子.
TLR4通过识别病原体和内源性配体可引发促炎性固有免疫反应,但表达异常也可促进多种疾病的发生[1]。因此,TLR4是上述疾病防治的重要药物靶点。
3.1脂质A类似物
3.1.1减少脂质A(图2,化合物1)脂肪酰基链(fatty acyl group,FA)个数
脂质ⅣA(图2,化合物2)虽只有4条FA,与人髓样分化蛋白-2(human myeloid differentiation pro⁃tein-2,hMD-2)结合,抑制(脂质A/hMD-2/TLR4)形成,从而抑制TLR4活性,但与小鼠的mMD-2结合时有一条FA暴露在mMD-2表面,同脂质A与hMD-2的晶体结构非常相似。因此,脂质ⅣA可在人体内抑制TLR4活性而在小鼠体内激动TLR4[4,13]。这表明人与小鼠的mMD-2存在种属差异。
E5564(图2,化合物3)与脂质A竞争性地与hMD-2结合,抑制TLR4的活性[14],虽在前期研究中表现出抑制败血症活性,但Ⅲ期临床试验阶段未达到临床终点,已终止进一步的研究[15]。
肝素处理的人全血中,OM-174-DP(图2,化合物4)可抑制热致死大肠杆菌通过TLR4/MD-2生成TNF-α,IL-1β,IL-6,IL-8和IL-10[16]。
3.1.2单磷酸脂质A类似物
1-脱磷酸的MPLA(图2,化合物5)有6条FA,是TLR4的激动剂,毒性较低,可用作疫苗佐剂,这与其信号转导为TRIF-选择性而非MyD88-依赖性有关[4]。但1-羟烷氧基化的OM-174-MP(图2,化合物6)只有3条FA,是TLR4的拮抗剂[16]。
3.1.3单糖类脂质A类似物
单糖磷脂GLA-60(图2,化合物7)为TLR4激动剂,可作免疫佐剂[17]。CCL-34为TLR4特异性激动剂[4];其半乳糖构型须为α-构型,可为其他单糖替代,如α-岩藻糖、α-或β-葡萄糖、α-半乳糖醛酸等[18]。
乙醇胺衍生物(图2,化合物9)(R=COOH),浓度为0.1μmol·L-1即可刺激IL-6的产生[4,19]。
长链醚胺IAXO-101(图2,化合物10)可特异性地抑制TLR4[20],IAXO-102(图2,化合物11)、IAXO-103(图2,化合物12)可抑制内毒素从其与CD14形成的复合物中转出后呈递给MD-2/TLR4复合物[21],抑制与TLR4相关的症状,如鼠急性败血症和神经性疼痛[4]。IAXO-103对NF-κB的抑制作用最优[21]。
3.1.4单糖且单磷酸脂质A类似物
L-CRX-527(图2,化合物13)和D-CRX-547(图2,化合物14)为1-氨烷氧基葡胺糖-4-磷酸酯类,在葡胺糖头碳引入丝氨酸苷键,在α-氨基引入含2条FA的侧链,加上糖环上的4条FA侧链,也有6 条FA,因此也是TLR4激动剂。有趣的是,D-异构体CRX-547仅选择性地激动TRIF信号通路,而L-异构体CRX-527则对TRIF与MyD88信号通路均有激动作用。CRX-547在较宽浓度范围内都可选择性地作用于TRIF信号通路[22]。
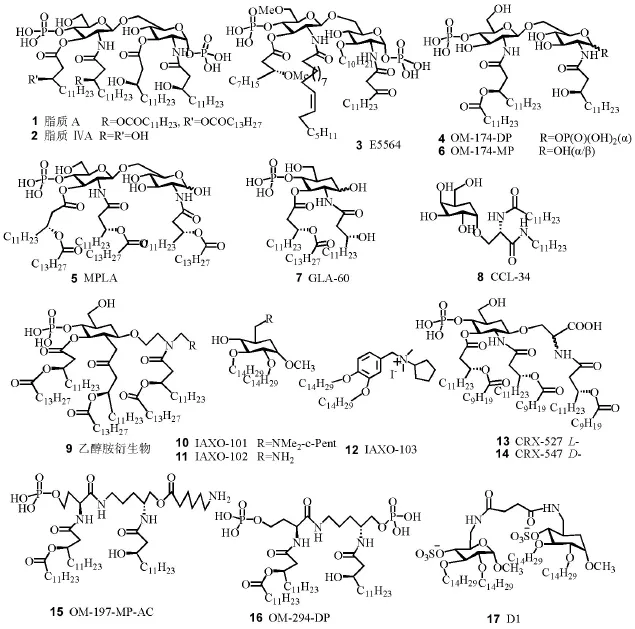
图2 脂质A类似物的结构
3.1.5非经典的脂质A结构类似物
低浓度OM-197-MP-AC(图2,化合物15)可活化TLR4,但高浓度(200 μg·L-1)时对LPS具有拮抗行为,剂量达0.9 mg·kg-1时对兔也无发热现象,可作疫苗佐剂促进Th1型免疫应答。在HEK293细胞中,OM-294-DP(图2,化合物16)抑制LPS的活性较弱,但在全血中其作用很强,可能是因为全血中具有TLR4辅助因子[15]。
结构对称的D1(图2,化合物17)具有4条FA、2个硫酸基团和(C6-C6′)琥珀酰胺连接的2个α-D-吡喃葡萄糖甲苷,亦为TLR4抑制剂[4]。
3.2天然产物
3.2.1鼠尾草酸、异硫氰类、吗啡类、紫杉酚和羽扇豆醇
鼠尾草酸(carnosic acid)可抑制3T3-L1脂细胞中TLR4的活性,从而抑制NF-κB的活化[23];由肝清除,经肠道排出[24]。异硫氰类如莱菔硫烷(sul⁃foraphane)可抑制MD-2与LPS的结合[4]。紫杉酚可活化mMD-2/TLR4通路但抑制hMD-2/TLR4通路,并改善人体内TLR4过表达引起的症状和LPS引起的肾损伤[4,15]。吗啡类可阻止IRAK与MyD88分离后与TRAF6的结合,羽扇豆醇(lupeol)可通过IRAK-M抑制MyD88依赖性通路,对抗D-半乳糖苷(D-galactosamine,GlaN)/LPS引起的暴发性肝衰竭[25]。
3.2.2含有α,β-不饱和羰基的化合物
肉桂醛可抑制LPS引起的TLR4寡聚化从而降低NF-κB和IRF3的产生,但肉桂醛饱和类似物2-苯基丙醛则无此作用,提示肉桂醛可能与MD-2的半胱氨酸共价结合[4]。甘草皂苷和异甘草素均可抑制LPS引起的(MD-2/TLR4)2的形成而抑制TLR4活性,但仅甘草皂苷抑制LPS/TLR4/MD-2复合物的形成,异甘草素则通过与TLR4或MD-2共价加成,抑制TLR4的寡聚化[4]。姜黄素在鼠BaF3细胞系中抑制MyD88依赖性TLR4信号传导,也可抑制TRIF的活性,可竞争性地抑制LPS和hMD-2结合[4,15]。
3.3合成小分子化合物
LPS类似物的相对分子质量太大,很难达到药理性质,如抑菌剂依立托伦(eritoran,E5564)虽进入Ⅲ期临床试验阶段,但无达到临床终点的药理效能。因此,高特异性和高生物利用度的小分子调节剂成为新的研究热点。
3.3.1瑞沙托维(resatorvid,TAK-242)
TAK-242[N-(2-氯-4-氟苯基)-2-乙氧羰基-2-环己烯磺酰胺]可选择性地抑制TLR4介导的细胞因子(如IL-6和TNF-α)的mRNA在鼠和人单核细胞和巨噬细胞中的表达,TAK-242虽可抑制LPS引起的细胞因子的产生,但并不抑制LPS与CD14/ TLR4/MD-2结合[26]。TLR4信号通路是NLRP3活化的第一阶段,可产生IL-1β前体(pro-IL-1β),TAK-242对TLR4的抑制作用可减少pro-IL-1β的产生,从而抑制NLRP3炎症体不适当活化引起的败血症等非传染性疾病[27]。2009年TAK-242因不能达到降低细胞因子水平的临床终点而中断了Ⅲ期临床试验,但其TLR4的选择性抑制作用对于治疗慢性炎性疾病如肥胖、2型糖尿病等仍有研究意义[28]。
3.3.2β-氨基乙醇衍生物
基于MD-2探索TLR4小分子抑制剂时发现了β-氨基乙醇衍生物(图3,化合物1),如T5342126 (1j,R=p-CH3CH2O-,R1=o-Cl,R2=H)。-OH的立体异构体的活性区别不大,去除-OH时活性变化也不大,表明-OH不是必须的,但醚键可能是必须的。R基为吸电子基团时活性较优,亲脂性增加会使活性降低,如R=Cl时EC50=16.1 μmol·L-1,R= CF3时EC50=23.7 μmol·L-1。R1为吸电子基团时(如m-Cl)活性增加,EC50由>100降至16.5 μmol·L-1,间位时活性最强[14]。药物代谢和药代动力学研究发现,浓度为5 mmol·L-1时1j有较高的血脑屏障通透性,但在肝中以较快的速度代谢;细胞色素CYP初步筛选发现,1j对主要代谢酶均有作用,表明药物结构需进一步改进。初步研究表明,1j对多种重要的激酶均无影响,其浓度达1 mmol·L-1时在全血中的溶血作用亦可忽略[14,29]。
3.3.3VGX-1027(GlT27)
VGX-1027(GIT27)[(±)-3-苯基-4,5-二氢异噁唑-5-乙酸]可通过抑制炎性抗原的加工和递呈来抑制免疫细胞的产生,因此具有治疗免疫性炎性疾病的潜能,如1型糖尿病、胸膜炎、风湿性关节炎、炎性肠病和全身性红斑狼疮等[30]。
该化合物可使患系统性红斑狼疮的NZB/ NZW F1鼠的死亡率从62.5%降低到33.3%,血清中抗双链DNA(dsDNA)自身抗体水平降低,肾炎发生减少[31],此外还可降低急性胸膜炎模型的死亡率、鼠自发型1型糖尿病累计发病率和Ⅱ型胶原诱导的关节炎的病情进展[11,31]。外伤性脑损伤4h后用此化合物治疗可明显减弱脑水肿,但预处理或创伤1h后使用则无效,这种临床上不完整的治疗窗口与TLR4在TBI后延迟应答一致,也与腹膜内给药后2h的血浆达峰浓度一致[11]。
3.3.4嘧啶[5,4-b]吲哚类化合物
取代的嘧啶[5,4-b]吲哚类化合物(图3,化合物2),如1Z105:R1=Ph,R2=c-Hex,R3=H;1Z88:R1=Ph,R2=tetrahydrofurfuryl,R3=Me)是TLR4的选择性配体,此类化合物并不受CD14的影响,而是直接与TLR4/MD-2复合物的MD-2结合[4]。
对嘧啶[5,4-b]吲哚类化合物进行结构改造,发现R2为苯基或氟、甲基取代苯时对干扰素诱导蛋白-10(interferon-inducible protein 10,IP-10)的刺激活性是R2为环己烷基时的44%~70%,对IL-6的刺激活性却为R2为环己烷基时的11%~36%,应答偏向Ⅰ型干扰素通路;当R3为短烷基链(如甲基)时活性较高,且细胞毒性较低。此类化合物有用作免疫调节剂或免疫佐剂的潜力[32]。
3.3.5euodenine A及其合成类似物EAA1
如化合物3(图3),EAA1(R=c-Pent,R1=H,R2=R3=R7=R8=Me,R4=R5=R6=H)和euodenine A (R=R7=R8=Me,R1=R2=R3=OMe,R4=R5=R6=H)是TLR4激动剂。euodenine A对hTLR4和hMD-2均有选择性。
在外周血单核细胞中,euodenine A对IL-8产生与LPS相似程度的诱导作用,对IL-12p40、IL-10 和TNF-α的诱导作用较小,抑制IL-5的活性。表明euodenine A可能拮抗IL-5引起的过敏性炎症,同时有较低的IL-12和TNF-α介导的促炎反应的风险。对其进行结构改造,测定对TLR4的活性发现,当R=H时激动TLR4的活性消失,在R2=R3=OMe,R4=H条件下将R基用较大取代基如乙基、环丙基、环戊烷基等替换甲基时活性升高,EC50=3.1-0.39 μmol·L-1,R2=R3=R4=OMe条件下,活性也升高但规律性降低,R基比环戊烷基还大或有烷基以外的基团(羰基或醚类)时,活性降低或消失,如R=COMe,EC50=10 μmol·L-1;R=CH2O-iPr,药物浓度达到300 μmol·L-1时仍无活性。R2=R3=OMe条件下,R4=H或OMe时活性相似,表明移走一个甲氧基(R4)对活性影响不大。将R3用甲基替换甲氧基时不影响活性,但用较大基团或极性基团替换时活性显著减小,如R=H,R4=iPr条件下,R3=OMe,EC50=1.0,R3= OEt,EC50=3.9;R3=OH,EC50>10 μmol·L-1。当R2为卤素时活性急剧下降,为增溶性基团(如2-羟乙氧基)时活性增加,为更大的增溶基团(如3-吗啉丙氧基)时活性反而下降,为酰氧基(如-OAc)时活性也下降。将R2、R3两个甲氧基都去除时活性急剧下降。R5为小烷基(如Me)时对大多数化合物的活性影响较小,将吡啶环上的苯环去除则活性消失。R6为甲基或甲氧基时活性都下降。移走R7、R8的任意一个甲基都会显著减少活性[33]。

图3 代表性TLR4小分子配体结构
3.3.6乙醇
TLR4或MyD88缺失或用纳洛酮抑制TLR4的活性可减弱乙醇引起的镇静和行为损伤,表明TLR4和MyD88与乙醇引起的行为有关[34]。乙醇可上调星形细胞中NLRP3的表达,使胱天蛋白酶1活化,IL-1β和IL-18释放,引起细胞死亡。抑制TLR4活性可消除乙醇对NLRP3的作用,减少细胞死亡,表明TLR4和NLRP3的相互作用在乙醇引起的大脑损伤中有重要作用[35]。
含有乙醇的饮食可抑制野生型C3H/HeOuJ小鼠体内海帕西啶(hepcidin)mRNA的转录,并激活NF-κB核转移,但在TLR4突变型C3H/HeJ小鼠体内无此效果,表明慢性摄入乙醇可通过活化TLR4信号通路和NF-κB在炎性肝脏中抑制海帕西啶mRNA转录[36]。另有研究发现,将野生型小鼠和TLR4突变小鼠ig摄入乙醇浓度为32%体积比的组织培养水后,这2种小鼠(尤其是野生型小鼠)体内促炎细胞因子的产生减少,大肠杆菌清除率降低,这可能是急性摄入乙醇使败血症预后不良的机制[35]。
3.3.7双环醇
双环醇(bicyclol)(图3,化合物4)是我国第一个具有自主知识产权的一类新药,具有减少氧自由基、保护抗氧化酶系统、抗炎、抗凋亡和抗肿瘤增殖的作用,主要用于病毒性肝炎、脂肪性肝病和药物性肝损伤的治疗。张健等[37]发现,它也能显著减轻缺血性脑卒中模型大鼠的神经损伤,减小梗死面积和水肿,下调TLR4、TLR9、TRAF6、NF-κB和基质金属蛋白酶9,上调紧密连接相关蛋白闭蛋白(Claudin-5)。因此,双环醇还可能是TLR4的抑制剂。其类似物联苯双酯(bifendate)(图3,化合物5)也可能具有相同作用[37]。
3.3.8neoseptin-3
Wang等[38]通过对约9万个化合物的库筛选,得到先导化合物neoseptin-1,对先导化合物进行优化改造,发现两个离体活性相当的候选化合物neoseptin-3与-4,其中neoseptin-3(图3,化合物6)的刺激活性有剂量依赖关系,为TLR4的选择性激动剂,EC50为18.5 mmol·L-1,被选作进一步的研发[38]。
neoseptin-3的构效关系分析中,4-位氨基、酰氨基和苯环上的酚羟基均为其激动活性所不可或缺的,酯基以叔丁基最优,酯基减小活性显著下降;酰氨基N上的H被取代、酰基的O被S取代或变为亚甲基时活性消失;4-酚羟基的邻位被取代活性下降,而酚羟基甲醚化后由激动剂反转为拮抗剂,3-取代基苯环间的连接链以二亚甲基或二亚甲基氧基为好;而S-苯丙氨酸部分的苯环可被环己基替代,其苯环4-位可为甲基、卤素、叠氮基等取代,苯环与a-碳间以二亚甲基为最好、其次为三亚甲基、再次为一或四亚甲基,但其R-对映体活性消失[38-39]。
neoseptin-3与小鼠mTLR4-MD2复合物单晶X射线衍射结果表明,它通过母核苯环间p-堆积和一分子的酰氨H与另一分子的酯羰基O形成2个分子间氢键,自组装为双分子体,与MD-2的疏水腔结合,使MD-2如Phe126环区发生类似于LPS或脂质A诱导的构象变化(面向配体位移),进而mTLR4-MD-2二聚体化(配体也提供了部分相互作用面),从而激活mTLR4,其中,一分子neoseptin-3的酚羟基与mTLR4的Ser439侧链羟基、苯胺基与mTLR4 的Ser413主链酰基形成 2个氢键,另一分子neoseptin-3的酚羟基则与mTLR4的Asp437主链酰基、苯胺基与MD2的Arg90主链酰基形成2个氢键。单晶结构进一步揭示了neoseptin-3的药效团及其类似物的构效关系[38]。
4 展望
随着对TLR4及其配体、TLR4-MD2异源二聚体研究的深入,大量具有TLR4调节作用的化合物涌现,但目前已公开报道的TLR4配体大多缺乏足够的受体选择性及通路选择性,这是今后研究需要注重的方向。TLR4作用具有广谱性,如何研发选择性TLR4配体使其在发挥相应治疗作用的同时避免副作用的发生,是取得进展的关键;此外,还要注意人源与鼠源TLR4存在的种属差异。随着不同结构小分子的TLR4配体的报道,特别是新型配体-TLR4-MD2复合物晶体结构的公开,为后续相应的研发提供了坚实的基础。以TLR4及其超家族为靶点的药物研究越来越受到重视,其研究进展特别是对TLR4及下游通路具有选择性作用的配体的发现将为新型疫苗和免疫调节剂的研发、败血症等疑难杂症的防治提供工具、方法和药物。
[1] Sasai M,Yamamoto M.Pathogen recognition re⁃ceptors:ligands and signaling pathways by Tolllike receptors[J].Int Rev Immunol,2013,32(2):116-133.
[2] Roberts BJ,Dragon JA,Moussawi M,Huber SA. Sex-specific signaling through Toll-like receptors 2and4contributestosurvivaloutcomeof Coxsackie virus B3 infection in C57Bl/6 mice[J]. Biol Sex Differ,2012,3(1):25.
[3]Kang JY,Lee JO.Structural biology of the Tolllike receptor family[J].Annu Rev Biochem,2011,80(80):917-941.
[4] Peri F,Calabrese V.Toll-like receptor 4(TLR4)modulation by synthetic and natural compounds:an update[J].J Med Chem,2014,57(9):3612-3622.
[5] Zhong JJ,Wan YY,Diao YW,Liu B,Wang ZL,Jin GY,et al.The research development of Tolllike receptors targeted drugs[J].Chin Bull Life Sci(生命科学),2015,27(4):439-444.
[6] Zhang ZQ,Yu NF.Progress in drugs targeting to Toll-like receptors[J].Cent South Pharm(中南药学),2014,12(5):457-463.
[7]Cai BG,Zhu J,Wang MR.Progress of Toll-like receptor 4 signaling pathway[J].J Med Postgrad(医学研究生学报),2015,28(11):1228-1232.
[8]Mai CW,Kang YB,Pichika MR.Should a Tolllike receptor 4(TLR-4)agonist or antagonist be designed to treat cancer?TLR-4:its expression and effects in the ten most common cancers[J]. Onco Targets Ther,2013,6:1573-1587.
[9] Yang S,Li R,Tang L,Qu X,Ge G,Ma J,et al. TLR4-mediated anti-atherosclerosis mechanisms of angiotensin-converting enzyme inhibitor-fosino⁃pril[J].Cell Immunol,2013,285(1-2):38-41.
[10] Brea D,Blanco M,Ramos-Cabrer P,Moldes O,Arias S,Pérez-Mato M,et al.Toll-like receptors 2 and 4 in ischemic stroke:outcome and thera⁃peutic values[J].J Cereb Blood Flow Metab,2011,31(6):1424-1431.
[11] LairdMD,Shields JS,Sukumari-Ramesh S,Kimbler DE,Fessler RD,Shakir B,et al.High mobility group box protein-1 promotes cerebral edema after traumatic brain injury via activation of Toll-like receptor 4[J].Glia,2014,62(1):26-38.
[12] Cha JJ,Hyun YY,Lee MH,Kim JE,Nam DH,Song HK,et al.Renal protective effects of tolllike receptor 4 signaling blockade in type 2 diabetic mice[J].Endocrinology,2013,154(6):2144-2155.
[13] Artner D,Oblak A,Ittig S,Garate JA,Horvat S,ArrieumerlouC,etal.Conformationallycon⁃strained lipid A mimetics for exploration of struc⁃tural basis of TLR4/MD-2 activation by lipopoly⁃saccharide[J].ACS Chem Biol,2013,8(11):2423-2432.
[14] Chavez SA,Martinko AJ,Lau C,Pham MN,Cheng K,Bevan DE,et al.Development of β-amino alcohol derivatives that inhibit Toll-like receptor 4 mediated inflammatory response as po⁃tential antiseptics[J].J Med Chem,2011,54 (13):4659-4669.
[15] Peri F,Piazza M.Therapeutic targeting of innate immunity with Toll-like receptor 4(TLR4)antago⁃nists[J].Biotechnol Adv,2012,30(1):251-260.
[16] Dunn-Siegrist I,Tissières P,Drifte G,Bauer J,Moutel S,Pugin J.Toll-like receptor activation of human cells by synthetic triacylated lipid A-like molecules[J].J Biol Chem,2012,287(20):16121-16131.
[17] Fox CB,Moutaftsi M,Vergara J,Desbien AL,Nana GI,Vedvick TS,et al.TLR4 ligand formula⁃tion causes distinct effects on antigen-specific cell-mediated and humoral immune responses [J].Vaccine,2013,31(49):5848-5855.
[18] Huang LD,Lin HJ,Huang PH,Hsiao WC,Reddy LV,Fu SL,et al.Synthesis of serine-based glyco⁃lipids as potential TLR4 activators[J].Org Biomol Chem,2011,9(7):2492-2504.
[19] Lewicky JD,Ulanova M,Jiang ZH.Improving the immunostimulatorypotencyofdiethanolaminecontaining lipid A mimics[J].Bioorg Med Chem,2013,21(8):2199-2209.
[20] Piazza M,Rossini C,Della Fiorentina S,Pozzi C,Comelli F,Bettoni I,et al.Glycolipids and benzyl⁃ammonium lipids as novel antisepsis agents:syn⁃thesis and biological characterization[J].J Med Chem,2009,52(4):1209-1213.
[21] Piazza M,Yu L,Teghanemt A,Gioannini T, Weiss J,Peri F.Evidence of a specific interaction between new synthetic antisepsis agents and CD14[J].Biochemistry,2009,48(51):12337-12344.
[22] Bowen WS,Minns LA,Johnson DA,Mitchell TC,Hutton MM,Evans JT.Selective TRIF-dependent signaling by a synthetic Toll-like receptor 4 agonist [J].Sci Signal,2012,5(211):ra13.
[23]Park MY,Mun ST.Carnosic acid inhibits TLR4-MyD88 signaling pathway in LPS-stimulated 3T3-L1 adipocytes[J].Nutr Res Pract,2014,8(5):516-520.
[24] Doolaege EH,Raes K,De Vos F,Verhé R,De Smet S.Absorption,distribution and elimination of carnosic acid,a natural antioxidant from Ros⁃marinus officinalis,in rats[J].Plant Foods Hum Nutr,2011,66(2):196-202.
[25] Kim SJ,Cho HI,Kim SJ,Kim JS,Kwak JH,Lee DU,et al.Protective effects of lupeol against D-galactosamine and lipopolysaccharide-induced fulminant hepatic failure in mice[J].J Nat Prod,2014,77(11):2383-2388.
[26] Ii M,Matsunaga N,Hazeki K,Nakamura K,Takashima K,Seya T,et al.A novel cyclohex⁃ene derivative,ethyl(6R)-6-[N-(2-chloro-4-fluo⁃rophenyl)sulfamoyl]cyclohex-1-ene-1-carboxyl⁃ate(TAK-242),selectively inhibits Toll-like recep⁃tor 4-mediated cytokine production through sup⁃pression of intracellular signaling[J].Mol Pharma⁃col,2006,69(4):1288-1295.
[27] Baldwin AG,Brough D,Freeman S.Inhibiting the inflammasome:a chemical perspective[J].J Med Chem,2016,59(5):1691-1710.
[28] Hussey SE,Liang H,Costford SR,Klip A,Defronzo RA,Sanchez-Avila A,et al.TAK-242,a small-molecule inhibitor of Toll-like receptor 4 signalling,unveilssimilaritiesanddifferences in lipopolysaccharide-and lipid-induced inflamma⁃tion and insulin resistance in muscle cells[J]. Biosci Rep,2013,33(1):37-47.
[29] Bevan DE,Martinko AJ,Loram LC,Stahl JA,Taylor FR,Joshee S,et al.Selection,prepara⁃tion,and evaluation of small-molecule inhibitors of Toll-like receptor 4[J].ACS Med Chem Lett,2010,1(5):194-198.
[30] Fagone P,Muthumani K,Mangano K,Magro G,Meroni PL,Kim JJ,et al.VGX-1027 modulates genes involved in lipopolysaccharide-induced Tolllike receptor 4 activation and in a murine model of systemic lupus erythematosus[J].Immunology,2014,142(4):594-602.
[31] Stojanovic I,Cuzzocrea S,Mangano K,Mazzon E,Miljkovic D,Wang M,et al.In vitro,ex vivo and in vivo immunopharmacological activities of the isoxazoline compound VGX-1027:modula⁃tion of cytokine synthesis and prevention of both organ-specific and systemic autoimmune diseases in murine models[J].Clin Immunol,2007,123 (3):311-323.
[32]Chan M,Hayashi T,Mathewson RD,Nour A,Hayashi Y,Yao S,et al.Identification of substi⁃tuted pyrimido[5,4-b]indoles as selective Tolllike receptor 4 ligands[J].J Med Chem,2013,56(11):4206-4223.
[33]Neve JE,Wijesekera HP,Duffy S,Jenkins ID,Ripper JA,Teague SJ,et al.Euodenine a:a small-molecule agonist of human TLR4[J].J Med Chem,2014,57(4):1252-1275.
[34] Pandey SC.TLR4-MyD88 signalling:a molecular target for alcohol actions[J].Br J Pharmacol,2012,165(5):1316-1318.
[35] Alfonso-Loeches S,Ureña-Peralta JR,Morillo-Bargues MJ,Oliver-De La Cruz J,Guerri C.Role of mitochondria ROS generation in ethanol-in⁃duced NLRP3 inflammasome activation and cell death in astroglial cells[J].Front Cell Neurosci,2014,8(8):216.
[36] Zmijewski E,Lu S,Harrison-Findik DD.TLR4 sig⁃naling and the inhibition of liver hepcidin expres⁃sion by alcohol[J].World J Gastroenterol,2014,20(34):12161-12170.
[37]Zhang J,Fu B,Zhang X,Chen L,Zhang L,Zhao X,et al.Neuroprotective effect of bicyclol in rat ischemic stroke:down-regulates TLR4,TLR9,TRAF6,NF-κB,MMP-9 and up-regulates clau⁃din-5 expression[J].Brain Res,2013,1528:80-88.
[38]Wang Y,Su L,Morin MD,Jones BT,Whitby LR,Surakattula MM,et al.TLR4/MD-2 activation by a synthetic agonist with no similarity to LPS [J].Proc Natl Acad Sci USA,2016,113(7):E884-E893.
[39]Beutler B,Borger DL.Neoseptins:small mole⁃cule adjuvants:WO,2014/131023[P].2014-08-28.
(本文编辑:齐春会)
Research progress in ligands of Toll-like receptor 4
ZHU Xue-kun1,2,YANG Ri-fang2,MENG Yan-qiu1
(1.Pharmaceutical and Biological Engineering College,Shenyang University of Chemical Technology,Shenyang 110142,China;2.Institute of Pharmacology and Toxicology,Academy of Military Medical Sciences,Beijing 100850,China)
Toll-like receptor 4(TLR4)is a member of the TLRs superfamily,mainly capable of identifying bacterial endotoxin,lipopolysaccharides and lipooligosaccharides of Gram-negative bacte⁃ria cell walls to prevent microbial invasion.Activation of TLR4 can induce production of proinflammato⁃ry cytokines and inflammatory chemokines and regulate natural immunity.However,dysregulation of TLR4 can lead to autoimmune diseases.This review summarized the biological structure of TLR4 and recognition mechanisms between TLR4 and its ligands,surveyed TLR4 ligands including lipid A ana⁃logues,natural products and synthetic small molecules,discussed the structure-activity relationship of TLR4 modulators and the ligand-receptor and protein-protein interactions in the complex,and outlined the prospect of future research and development of TLR4 ligands.
Toll-like receptor 4;ligands;lipopolysaccharides;innate immunity
YANG Ri-fang,E-mail:yangrf215@163.com,Tel:(010)66874611;MENG Yan-qiu,E-mail:mengyanqiu@hotmail.com
R966
A
1000-3002-(2016)04-0389-08
朱雪坤,女,硕士研究生,主要从事鼠尾草酸和其他TLR4配体的研究,E-mail:zhuxuekun@yeah.net;杨日芳,男,硕士生导师,主要从事药物合成研究;孟艳秋,女,硕士生导师,主要从事药物合成研究。
杨日芳,E-mail:yangrf215@163.com,Tel:(010)66874611;孟艳秋,E-mail:mengyanqiu@hotmail.com
2016-01-28接受日期:2016-03-26)

