大鼠动态吸入氯吡硫磷染毒模型的建立及致伤效应评价
吕 鑫,隋 昕,李万华,聂志勇,王永安(军事医学科学院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
大鼠动态吸入氯吡硫磷染毒模型的建立及致伤效应评价
吕 鑫,隋 昕,李万华,聂志勇,王永安
(军事医学科学院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
目的 建立大鼠全身暴露动态吸入有机磷农药氯吡硫磷(CPF)的染毒模型,探讨SD大鼠急性吸入CPF致伤效应。方法 通过优化气溶胶发生参数,建立大鼠急性吸入CPF的动态暴露环境;利用吸附采样-气相检测技术监测暴露舱内CPF的浓度,利用粒径监测仪实时监测暴露舱内CPF的粒径,同时考察气溶胶的浓度和粒径随时间的变化;采用Bliss法,将SPF级雄性SD大鼠置于染毒环境中进行染毒,在不同浓时积(Ct)下观察染毒过程中大鼠的症状,记录染毒后各浓度组大鼠10 d内的死亡情况;同时根据半数致死Ct (LCt50),检测不同暴露浓度染毒后不同时间点血浆胆碱酯酶(ChE)活性变化。结果 暴露舱内CPF气溶胶浓度在9个时间段的平均值为160.6 mg·m-3,变异系数(RSD)为6.9%;气溶胶粒径几何平均值为1.1 μm,几何标准偏差为1.8,符合国际经济合作与发展组织急性吸入染毒技术要求。在此染毒条件下,SD大鼠全身暴露动态吸入染毒的LCt50为1654.2 mg·m-3·h,随着染毒浓度的增加,血浆ChE活性抑制愈加明显(P<0.05)。结论 本研究成功建立了大鼠全身暴露动态吸入CPF染毒模型,为有机磷类工农业产品以及神经性毒剂吸入致伤和防治研究提供实验平台和技术支撑。
氯吡硫磷;气溶胶;半数致死浓时积
DOl:10.3867/j.issn.1000-3002.2016.04.009
氯吡硫磷(chlorpyrifos,CPF),也叫毒死蜱,是一种广谱高效、低抗药性的有机磷杀虫剂(organo⁃phosphate pesticides,OP),是全球使用量最多的农药之一,被广泛应用于防制水稻、花生、大豆和小麦等多种作物上的害虫和螨类,同时也用于庭院或居家灭虫。但是,给人们提供便利的同时,它也带来了次生和潜在的威胁。首先,CPF过量使用,尤其在发展中国家,农民普遍超高浓度进行喷洒作业,其降落在植物表面和地面的农药会产生二次挥发等次生危害[1-2]。其次,CPF广泛应用于居家环境中[3],使人群处于长期持续暴露状态,降低人群免疫力,引起哮喘[4]和迟发性神经疾病[5-6]等,这些问题正逐渐引起医学界和普通民众的关注。另外,农药在储存和运输过程中一旦发生意外泄露,或遭到恐怖袭击等[7-8]情况,会使周围人群短时间内处于高浓度有机磷农药的急性暴露环境中,使生命健康受到威胁。
建立现场模拟的吸入染毒模型,进行生物致伤效应评价及防治措施研究,是有效应对有机磷农药急性暴露等突发化学事件的一种有效手段。但由于吸入染毒对实验环境、装置及释放技术均有较高要求[9-10],且在染毒浓度上要做到均一、稳定、可控,染毒粒径要符合一定规范文件,如经济合作和发展组织(Organization for Economic Cooperation and Development,OECD)的要求,所以优效的暴露吸入染毒一直是国际性难题。本研究在前期工作[11]的基础上,通过多次优化CPF急性吸入染毒的关键性技术,建立了大鼠全身暴露动态吸入CPF染毒模型,明确了暴露舱内浓度随时间的变化趋势及粒子粒径等关键技术参数,最终确定急性吸入中毒半数致死浓时积(median lethal concentration time,LCt50);并通过检测大鼠胆碱酯酶(cholinesterase,ChE)活性进一步对其致伤效应进行评价。
1 材料与方法
1.1动物、试剂和仪器
SPF级雄性SD大鼠130只,体质量220~240 g,由北京维通利华实验动物技术有限公司提供,动物许可证号:SCXK(京)2012-0001。CPF水乳剂(40%,山东省青岛东生药业有限公司),CPF标准品(96%,北京伊诺凯科技有限公司),甲醇、甲苯和丙酮(分析纯,国药集团北京化学试剂有限公司),蒸馏水由本实验室提供。TSE全身暴露装置(process control inhalation 700400 series),700800-PA-100粒径监测仪(均德国TSE公司),GC-FID,7890A气相色谱仪-氢火焰燃烧检测器(美国安捷伦科技有限公司),气体采样器(SKC-800,德国),HRH-TIP-286液体定量推进器(惠荣和公司),SHZ-D循环水式真空泵(予华仪器有限责任公司),砂芯漏斗(100 mL-G1,河南三顺教学仪器有限公司)。
1.2CPF标准溶液的配制及工作曲线的绘制
取96%CPF标准品25 mg,溶于25 mL甲醇溶液中,配成1 g·L-1的标准溶液。分别逐级稀释为x=10,15,20,30,40和50 mg·L-1标准溶液,利用气相色谱进行检测。仪器条件:进样口温度280℃,N2流速2.5 mL·min-1,隔热吹扫3 mL·min-1,不分流进样;检测器FID温度为290℃,H2流速30 mL·min-1,空气流速400 mL·min-1,尾气吹扫25 mL·min-1,程序升温100℃保持1 min,20℃·min-1至280℃,保持1 min;每次进样1 μL,计算色谱峰面积y,绘制其与浓度关系的工作曲线。
1.3全身动态染毒吸入模型的建立
1.3.1CPF气溶胶态发生
将40%CPF水乳剂用砂芯漏斗抽滤去除其中粒径较大的杂质,用蒸馏水将其稀释至30%,用双筒液体定量推进器吸取30%CPF水乳,设置推进速率3 mL·min-1,气溶胶化速率为20 L·min-1,稀释气体速率30 L·min-1,液体气溶胶化后进入暴露舱染毒,暴露舱压力为-0.1 Pa。
1.3.2气溶胶粒径与浓度的检测
基于氦氖激光技术,应用粒径检测仪,设置采集速率为100 mL·min-1,监测CPF气溶胶粒子空气动力学参数;同时,用9 mL混合溶剂(甲醇∶甲苯∶丙酮=2∶2∶1)作为吸附剂,利用吸附采样技术,采集暴露舱内气溶胶,采集时间(t)为10 min,采集速率(r)为120 mL·min-1,采集液回收定容(V1)10 mL后用GC-FID进行检测,将测得数据代入工作曲线得到CPF溶液浓度c1(mg·L-1);根据下面公式得到暴露舱内CPF气溶胶浓度c2(mg·m-3)。公式为c2= c1V1/rt。
1.3.3半数致死量的测定
通过预实验,确定30%CPF吸入染毒最大安全时间(Dn)为5 h,全部大鼠死亡的最短时间(Dm)为20 h,在Dn和Dm间取5个浓度组,根据Bliss法,染毒浓度间公比为,采用固定染毒浓度,不同染毒时间即5,7,10,14和20 h,将50只SD雄性大鼠随机分为5组,每组10只,单笼放入舱中进行全身暴露动态吸入染毒。染毒结束后取出,观察并记录10 d内各组大鼠的死亡情况,根据各组死亡率,用Bliss法计算SD雄性大鼠CPF气溶胶吸入中毒的LCt50等致伤效应参数。
1.4ChE活性测定
将72只SD雄性大鼠随机分为3组,每组24只,分别于0.2,0.4和0.8 LCt50浓度下进行全身暴露动态吸入染毒;另取8只SD雄性大鼠作为正常对照组,正常暴露于相同温度和湿度的空气中。染毒结束后取出,分别在染毒后8 h,1,2及7 d剪尾采全血,正常对照组大鼠同样操作。血样肝素抗凝,825×g离心10 min,取上层血浆于-80℃冷冻保存。由国家北京药物安全评价研究中心检测ChE活性。
1.5统计学分析
实验结果数据以x±s表示,使用SPSS 18.0统计软件进行数据分析,两组间均数比较采用t检验,组间差异采用单因素方差分析(ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1全身动态染毒吸入模型的评价
2.1.1气溶胶粒径大小
粒径监测仪实时监测TSE全身暴露装置中CPF粒径大小和气溶胶浓度。图1结果显示,在7.7 s内,测定气溶胶总体积为12.8 mL,总粒子数为3.4×105,CPF气溶胶粒径平均值为1.3 μm,众数值为1.3 μm,几何平均值为1.1 μm,几何标准差为1.8,最高峰粒子数为15 850,无第2和第3峰值,符合正态分布规律。
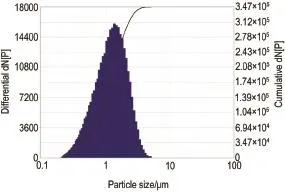
Fig.1 Particle size of chlorpyrifos(CPF)aerosol in TSE whole-body exposure chamber.
2.1.2气溶胶浓度稳定性
根据2.1.1气相色谱结果,做出工作曲线y= 7.019x-11.48,R2=0.999。将样品峰面积代入工作曲线得出CPF溶液浓度c1(mg·L-1),根据公式计算出CPF气溶胶平均浓度c2=(160.6±11.1)mg·m-3,相对标准差(relative standard deviation value,RSD)为6.9%。气溶胶态CPF不同时间内浓度及RSD如表1。
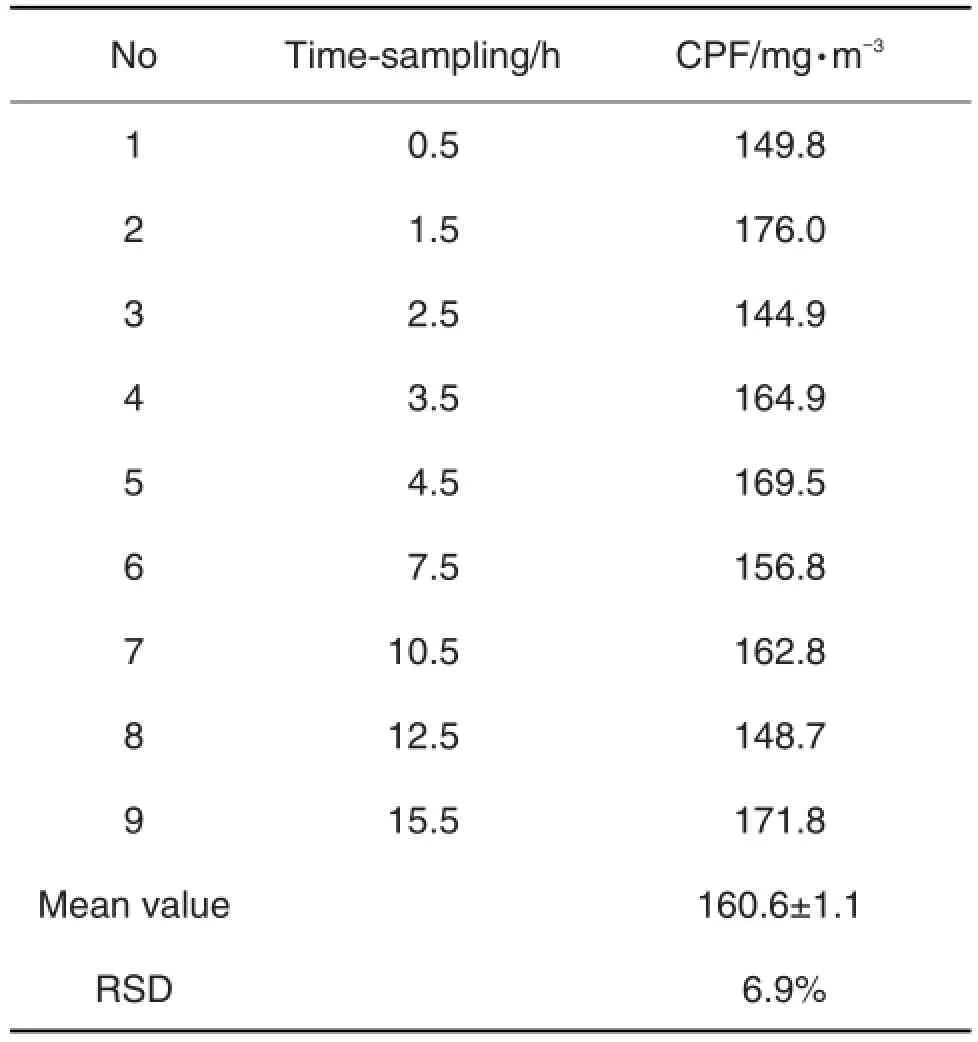
Tab.1 Concentration of CPF aerosol at different points of exposure time
2.2大鼠急性吸入CPF中毒情况
2.2.1中毒症状
实验过程中,染毒开始15 min后大鼠表现出流涎症状,随后出现流泪、精神萎靡、肌颤、行动困难等有机磷农药急性中毒体征。随着染毒时间的延长,上述症状愈明显,同时还出现眼鼻出血、呼吸困难、抽搐及死亡等现象。不同浓度染毒结束后,大鼠行动困难,无法正常进食饮水,其中5 h染毒组在24 h后饮食可恢复正常,染毒时间越长恢复愈加缓慢,各组存活大鼠在3 d后基本恢复正常活动。
2.2.2半数致死浓时积(LCt50)
不同浓度组不同时间大鼠死亡情况如表2所示。根据表2结果,利用Bliss法计算得出大鼠急性吸入CPF致伤效应参数。其中,LCt50为1654.3 mg·m-3·h,LCt50的95%可信限=1376.2~1995 mg·m-3·h-1,LCt5为907.5 mg·m-3·h,LCt95为3015.6 mg·m-3·h。
2.3大鼠急性吸入CPF后全血ChE活性变化
通过对不同LCt50下CPF染毒后各采样点测得的ChE活性分析来看,0.2,0.4和0.8 LCt503组染毒后8 h,1和2 d的ChE活性与正常对照组相比明显下降(P<0.05);第7天ChE活性恢复接近正常值。其中前2组ChE活性呈先降后升趋势,0.8 LCt50组ChE活性由最低值呈逐渐上升趋势。ChE活性的抑制和大鼠染毒后症状恢复情况相一致,随着染毒浓度的增加大鼠中毒症状逐渐加重,其中0.8 LCt50组大鼠恢复最慢(表3)。
0.2和0.4 LCt50组染毒后各采样点中ChE抑制最低值出现在染毒后第1天,抑制率分别为69.2% 和78.0%;0.8LCt50组ChE抑制最低点为染毒后8 h,抑制率为85.2%。0.8 LCt50组染毒ChE活性最低为(13.5±1.85)U·L-1,明显低于另2组ChE活性最低值分别为28±2.11和(20±2.45)U·L-1(P<0.05)。
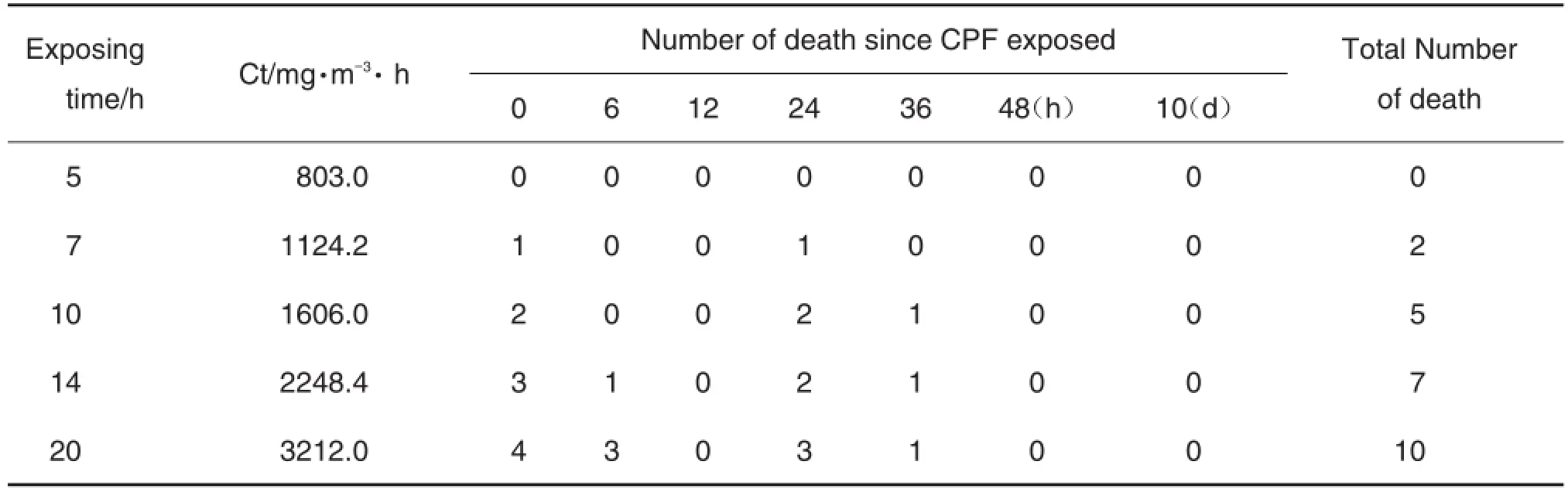
Tab.2 Deaths of rats at different concentrations after CPF acute inhalation exposure
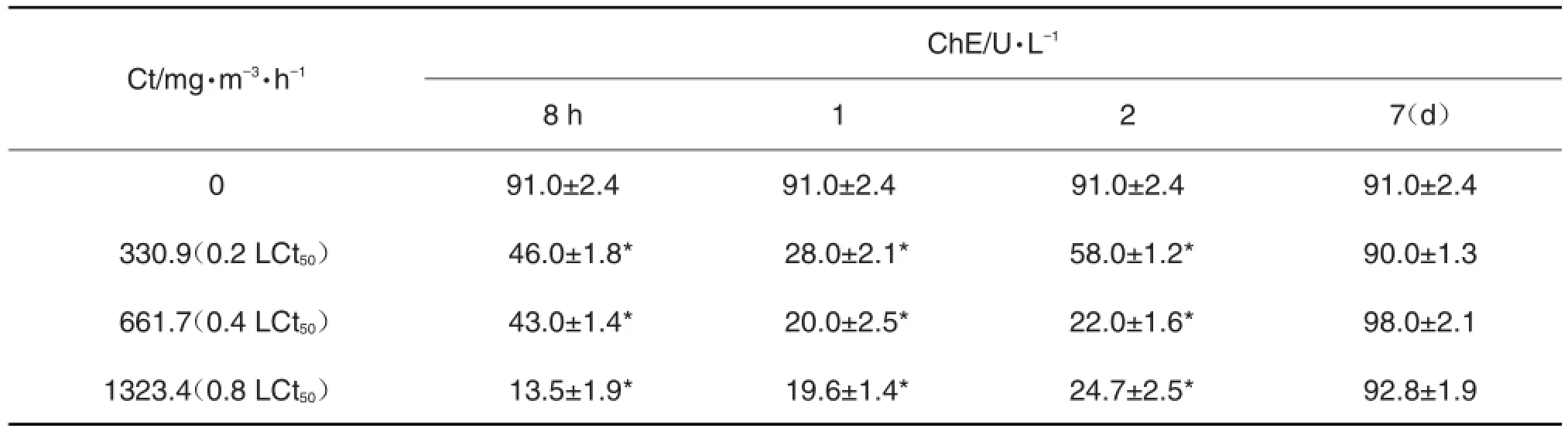
Tab.3 Plasma cholinesterase(ChE)activity of rats at different times and concentrations after CPF acute inhala⁃tion exposure
3 讨论
建立一种稳定可控的现场模拟吸入染毒模型,评价有机磷类农药的致伤效应,能更好地对其进行防治研究。本研究通过选择和调节CPF水乳剂推进速度、空气流速、气溶胶化速率等条件,实现了CPF气溶胶粒径平均值(1.3 μm)、众数值(1.3 μm)、几何平均值(1.1 μm)相近,呈正态分布规律,证明实验中粒子大小均匀,符合OECD 403/433急性吸入毒性实验指导原则要求,与前期实验结果一致[11],暴露舱内气溶胶浓度随时间的变化保持稳定(160.6± 11.1)mg·m-3,RSD<7%,证明暴露舱内气溶胶浓度达到了稳定可控。
本研究中,大鼠急性暴露动态吸入致伤效应参数结果显示,LCt5和LCt50等数值较大,一方面证明CPF是一种中低毒有机磷农药,使用安全性高;另一方面也可能与CPF进入大鼠体内后吸收代谢较快有关。美国环境保护局规定的CPF最高暴露浓度为0.6 mg·m-3,但在实际使用过程中,CPF气溶胶往往远大于此浓度。另外,泄露、恐袭等突发事件,使得有机磷类农药瞬时产生超高浓度,在短时间内威胁暴露范围内人群的健康安全,严重时甚至导致死亡,CPF急性吸入染毒模型的建立及致伤机制的研究可有效应对此类情况,并对模拟实战有一定技术支撑意义。
CPF是一种广谱有机磷杀虫剂,动物中毒后抑制ChE,使突触乙酰胆碱蓄积,主要引起神经毒性,表现胆碱能神经中毒的症状,如大量流涎、流泪、排尿、排便、共济失调和震颤等。已知研究表明,动物CPF中毒后的神经行为及ChE抑制,与急性暴露的CPF浓度有关,浓度越高,症状越明显[12]。一般情况下,当脑ChE抑制>60%时开始出现胆碱能中毒症状[13]。从浓度-效应关系分析,ChE抑制被认为是反映CPF毒性的最敏感的指标[14]。
染毒后动物血浆ChE活性呈缓慢恢复,其最佳理论峰值与机体代谢物水平有关,不同性别、日龄均有差异,因此采样时间的选择及对照组数值的测量存在一定的不确定性。本研究选取的时间点反映的ChE变化情况,有助于了解暴露于不同浓时积与动物状态及ChE值的变化趋势,一定程度上呈正相关。
本研究对0.2,0.4和0.8 LCt503个浓度下CPF气溶胶吸入染毒后8 h,1,2和7 d等4个时间点的大鼠血浆ChE活性变化进行了测定,以确定染毒时间对血浆中ChE的抑制规律,为用药治疗寻找合适时间点。0.2 LCt50和0.4 LCt50组ChE的抑制峰值出现在染毒结束后1 d;0.8 LCt50组的采样时间点是在染毒结束后8 h。但从ChE变化规律分析,理论上8 h采样点前某一时间点应有一相对高值,以后将对此作进一步研究证明。CPF 0.8 LCt50暴露水平诱导约85.2%的ChE抑制,ChE活性和CPF全身暴露水平之间存在生理药代动力学/药效学的模型关系[15]。暴露浓度影响整个机体组织的ChE抑制情况,不同部位(脑、红细胞和血浆等)ChE抑制与各种因素有关,如毒物吸收、分布、代谢、排泄及个体差异等。
本研究成功建立了CPF气溶胶吸入染毒模型,为CPF吸入染毒致伤效应及防治研究提供了染毒浓度依据,为高毒化学品及化学战剂动态暴露吸入染毒模型的建立提供了参考,并为高毒化学品吸入毒理学研究提供了技术支撑。
[1]Jiang LL,Wu YG.Research progress on environ-mental safety of chlorpyrifos[J].Pestic Sci Admin(农药科学与管理),2014,35(1):29-34.
[2]Zhang Y,Guo PF,Xu J,Feng YB.Analysis on main influencing factors of pesticide safety[J]. Pestic Sci Admin(农药科学与管理),2012,33(9):9-11.
[3]Morgan MK,Wilson NK,Chuang JC.Exposures of 129 preschool children to organochlorines,organophosphates,pyrethroids,and acid herbicides at their homes and daycares in North Carolina[J]. Int J Environ Res Public Health,2014,11(4):3743-3764.
[4]Hernandez AF,Parron T,Alarcon R.Pesticides and asthma[J].Curr Opin Allergy Clin Immunol,2011,11(2):90-96.
[5]Grandjean P, Landrigan PJ.Neurobehavioural effects of developmental toxicity[J].Lancet Neurol,2014,13(3):330-338.
[6]Saunders M,Magnanti BL,Carreira SC,Yang AL,Alamo-Hernandez U,Riojas-Rodriguez H,et al. Chlorpyrifos and neurodevelopmental effects:a literature review and expert elicitation on research and policy[J].Environ Health,2012,11(14):1-11.
[7]Wu YX,Xia SW.Field investigation and emergency rescue for occupational chemical-poisoning accidents [J].Health Educ Health Promotion(健康教育与健康促进),2013,(3):235-237.
[8]Liu F,Zhao J,Zhao J,Ding RG.A chemical terrorist attack in the post-CWC era[J].Mil Med Sci(军事医学),2014,38(4):266-269.
[9]Chen T,Jia G,Wei YJ,Li JC.Beijing ambient particle exposure accelerates atherosclerosis in ApoE knockout mice[J].Toxicol Lett,2013,223 (2):146-153.
[10]Weber WM,Kracko DA,Lehman MR,Irvin CM,Blair LF,White RK,et al.Inhalation exposure systems for the development of rodent models of sulfur mustard-induced pulmonary injury[J].Toxicol Mech Methods,2010,20(1):14-24.
[11]Nie ZY,Sui X,Sun XH,Wang XP,Wang YA. Establishment and evaluation of a whole-body dynamic inhalation exposure system[J].Mil Med Sci(军事医学),2014,38(10):780-783.
[12]Pope CN,Chakraborti TK,Chapman ML,Farrar JD,Arthun D.Comparison of in vivo cholinesterase inhibition in neonatal and adult rats by three organophosphorothioate insecticides[J].Toxicology,1991,68(1):51-61.
[13]Nostrandt AC,Padilla S,Moser VC.The relationship of oral chlorpyrifos effects on behavior,cholinesterase inhibition,and muscarinic receptor density in rat[J]. Pharmacol Biochem Behav,1997,58(1):15-23.
[14]The U.S.Environmental Protection Agency(EPA). ChlorpyrifosPreliminaryHumanHealthRisc Assessment[Z].2011,97-98.
[15]Timchalk C,Nolan RJ,Mendrala AL,Dittenber DA,Brzak KA,Mattsson JL.A physiologically based pharmacokinetic and pharmacodynamic(PBPK/ PD)model for the organophosphate insecticide chlorpyrifos in rats and humans[J].Toxicol Sci,2002,66(1):34-53.
本文编辑:齐春会)
Model establishment and injury assessment of chlorpyrifos dynamic-inhalation of rats
LYU Xin,SUI Xin,LI Wan-hua,NIE Zhi-yong,WANG Yong-an
(State Key Laboratory of Toxicology and Medical Countermeasures,Institute of Toxicology and Pharmacology,Academy of Military Medical Sciences,Beijing 100850,China)
OBJECTlVE To establish a model for chlorpyrifos(CPF)whole-body dynamic inhalation exposure in SD rats and investigate the injury effects after acute exposure by CPF.METHODS By optimizing the aerosol parameters,the animal acute dynamic inhalation exposure of CPF was established. Absorption sampling-gas phase detecting technology was used to monitor the concentration of CPF in the whole-body dynamic-inhalation exposure cabin by exploring the relationship between the concentration,particle size of CPF aerosol and the CPF inhalation time in the exposure cabin via a particle size detector. Using Bliss method,specific pathogen free SD male rats were allocated to the environment of CPFexposure at different lethal concentrations and time points.The symptoms and deaths of these SD male rats in different groups were recorded within the following 10 d.Based on the median lethal concentra⁃tion time(LCt50),the values of plasma cholinesterase(ChE)were checked at different time points after being exposed at different doses.RESULTS The mean concentrations of CPF aerosol at nine time points was 160.6 mg·m-3,the relative standard deviation value was 6.9%;the geometrical mean of aerosol particle size was 1.1 μm,and the geometric standard deviation was 1.8.The results met the technical requirements of Organization for Economic Cooperation and Development regarding acute inhalation exposure.Under these equipment conditions,the LCt50of CPF acute inhalation of SD male rats was 1654.2 mg·m-3·h,suggesting that plasma ChE inhibitory rate was higher with the increase in the exposing dose,and that there was a significant difference as compared with the controls(P<0.05).CONCLU⁃SlON The model for whole-body dynamic-inhalation exposure of CPF is applicable to rats,which can serve as an experimental platform and technical support to inhalation vulnerability and the research on prevention and cure of organophosphate industrial products and nerve agents.
chlorpyrifos;aerosol;median lethal concentration time
NIE Zhi-yong,E-mail:niezhiyong2008@163.com;WANG Yong-an,Tel:(010)66874607,E-mail:yonganw@sina.com
R966
A
1000-3002-(2016)04-0356-06
吕 鑫,女,硕士研究生,主要从事军事预防医学研究,E-mail:pinkmoonlx@163.com
聂志勇,E-mail:niezhiyong2008@163.com;王永安,Tel:(010)66874607,E-mail:yonganw@sina.com
2015-08-17接受日期:2016-04-05)(

