普仑司特对链佐星诱导的1型糖尿病小鼠记忆损害和神经损伤的影响
谈永进,董荣荣,洪 浩(.安庆医药高等专科学校,安徽 安庆 4605;.中国药科大学药理学教研室,江苏 南京 0009)
普仑司特对链佐星诱导的1型糖尿病小鼠记忆损害和神经损伤的影响
谈永进1,董荣荣2,洪 浩2
(1.安庆医药高等专科学校,安徽 安庆 246052;2.中国药科大学药理学教研室,江苏 南京 210009)
目的 研究半胱氨酰白三烯受体1(CysLT1R)拮抗剂普仑司特对链佐星(STZ)诱导的1型糖尿病小鼠记忆损害及神经炎症和凋亡的影响。方法 选用雄性ICR小鼠,尾静脉注射STZ 150 mg·kg-1制备1型糖尿病小鼠模型。糖尿病小鼠每天ig给予普仑司特,连续给药4周。Morris水迷宫检测小鼠隐藏平台潜伏期、穿台次数及目标象限停留时间;Western蛋白印迹法检测小鼠脑海马和前额叶皮质CysLT1R,NF-κB p65,白细胞介素1β(IL-1β),肿瘤坏死因子α(TNF-α),剪切胱天蛋白酶3,Bax和Bcl-2蛋白表达水平;测定小鼠的空腹血糖、血清胰岛素含量以及甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDLC)和低密度脂蛋白胆固醇(LDL-C)水平。结果 Morris水迷宫结果显示,与正常对照组比,模型组小鼠逃避潜伏期显著延长,穿台次数和目标象限探索时间均显著降低(P<0.05);给予普仑司特0.6和1.2 mg·kg-1组小鼠逃避潜伏期均显著缩短(P<0.05),穿台次数和目标象限探索时间均显著增加(P<0.05)。Western蛋白印迹结果显示,模型组小鼠海马和前额叶皮质CysLT1R,NF-κB p65,IL-1β,TNF-α和剪切胱天蛋白酶3蛋白表达以及Bax/Bcl-2比值显著升高(P<0.05);给予普仑司特0.6和1.2 mg·kg-1能显著抑制糖尿病小鼠脑内上述蛋白表达的变化(P<0.05)。但普仑司特对糖尿病小鼠高血糖、低血清胰岛素和脂质代谢紊乱无明显影响。结论 普仑司特能够改善STZ诱导的1型糖尿病小鼠学习记忆损害和神经损伤。
普仑司特;1型糖尿病;学习记忆;半胱氨酰白三烯受体1;神经炎症;细胞凋亡
DOl:10.3867/j.issn.1000-3002.2016.04.004
糖尿病患者认知障碍十分常见。临床研究显示,1型和2型糖尿病患者均伴随不同程度学习记忆损害[1],其发生率与病程长短、降血糖药的选用等因素有关。轻者表现为轻度认知损害,重者发展为痴呆。因此,寻找有效的防治糖尿病学习记忆损害药物是当前该领域研究的热点。普仑司特(pranlu⁃kast,Pran)为选择性半胱氨酰白三烯受体1(cyste⁃inyl-leukotrienes receptor 1,CysLT1R)的拮抗剂,可抑制免疫和炎症反应,改善肺功能及纤维化,抑制气管高反应性及重塑[2]。临床上主要用于治疗哮喘和过敏性鼻炎。我们前期研究发现,Pran对东莨菪碱和β淀粉样蛋白诱导的小鼠记忆损害有显著改善作用[3-4]。本研究观察Pran对链佐星(streptozocin,STZ)诱导的1型糖尿病小鼠学习记忆损害及神经损伤的影响,以进一步揭示糖尿病记忆损害的病理生理机制,发掘更有效的防治药物。
1 材料与方法
1.1药品和试剂
Pran,纯度>98%,购于江苏恒瑞医药;STZ购于美国Sigma Aldrich公司;CysLT1R抗体、白细胞介素1β(interleukin-1β,IL-1β)抗体和肿瘤坏死因子α (tumor necrosis factor-α,TNF-α)抗体购于德国Santa Cruz Biotechnology公司;Cleaved胱天蛋白酶3,Bax和Bcl-2和NF-κB p65抗体购于美国Cell Signaling Technology公司;β肌动蛋白抗体、组蛋白H3(histone H3)抗体、山羊抗兔IgG、兔抗山羊IgG抗体均购于美国Bioward Technology公司;葡萄糖试剂盒(葡萄糖氧化酶-过氧化物酶法)购于上海荣盛生物药业有限公司;胰岛素检测试剂盒购于武汉华美生物工程有限公司;甘油三脂(triglyc⁃erides,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(high density lipo⁃protein cholesterol,HDL-C)测试盒均购自南京建成生物工程研究所;其他在实验中用到的试剂为分析纯。Morris水迷宫(上海吉量软件科技有限公司);UV/V-16/18型紫外/可见分光光度计(上海美谱达仪器有限公司);RT-6000型酶标分析仪,深圳雷杜生命科学股份有限公司);TGL-16型台式高速冷冻离心机(湖南湘仪实验室开发有限公司);TP-114型Sartorius分析天平(北京赛多利斯天平有限公司);Tanon-4200凝胶成像系统(上海天能科技有限公司)。
1.2动物和1型糖尿病小鼠模型的制备
100只体质量24~26 g的雄性清洁级ICR小鼠,由扬州大学比较医学中心提供,小鼠许可证号:SCXK(苏)2012-0004,合格证编号:No.201508363。将小鼠适应性饲养3 d,禁食12 h后按体质量(22~25 g)随机挑出10只作为正常对照,其余的90只小鼠通过单次尾静脉注射STZ 150 mg·kg-1,制备1型糖尿病小鼠模型。正常对照组尾静脉注射等体积枸橼酸-枸橼酸钠缓冲液。3 d后从眼眶后静脉丛采血,测定空腹血糖(fasting blood glucose,FBG),挑选FBG≥11.1 mmol·L-1小鼠为糖尿病模型小鼠。
1.3动物分组和给药
糖尿病小鼠根据所测的FBG值随机分为正常对照组、模型组及Pran 0.3,0.6和1.2 mg·kg-1组。Pran 用0.5%羧甲纤维素钠(CMC-Na)制备成混悬液,给药体积为20 mL·kg-1,正常对照组和模型组均ig给予等体积0.5%CMC-Na。给药时间为4周。
1.4Morris水迷宫实验测定小鼠穿越原平台区次数及在目标象限探索时间
第4周给药结束后,对各组小鼠进行持续6 d的Morris水迷宫实验。第1~2天进行可见平台训练,在水迷宫第Ⅳ象限(目标象限)放置带有旗子的平台(低于水面5 mm),旗子和平台高度差为5 cm,水温控制为(23~27)℃。每天将动物分别从第Ⅰ,Ⅱ,Ⅲ和Ⅳ象限相应的标记位置背向水池轻轻放入水中,使其在迷宫中自由游动。如果小鼠90 s内爬上并停在平台10 s,结束该次测试并记下逃避潜伏期。如果小鼠90 s内未找到平台,逃避潜伏期记为90 s,并用手将动物置于平台上,放置30 s。第3~5天进行隐藏平台训练,将平台上的旗子取出,其他实验条件及方法均同可见平台训练。最后1天进行无平台空间探索实验。各组小鼠均只从第Ⅰ象限背向迷宫放入,使其自由游动90 s,Viewer 2 Tracking Software系统记录动物穿越原平台区次数及在目标象限探索时间。测试期间仍继续给药,且行为学测试于给药30 min后进行。在整个行为学实验过程中,实验环境和参照物位置等保持不变。
1.5血糖、血清胰岛素和血脂的测定
Morris水迷宫实验结束后,全部小鼠禁食12 h,按压头颈部进行眼眶取血,所得血样静置10 min后,4℃3000×g离心15 min,即可得所需血清。FBG通过葡萄糖氧化酶-过氧化物酶法测定,即10 μL血清样本与1 mL工作液37℃孵育10 min,酶标仪测定吸光度值(λmax=505 nm)并计算浓度。血样本稀释200倍后采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测血清胰岛素。血清TG和TC通过甘油磷酸氧化酶/胆固醇氧化酶-过氧化物氧化酶法测定,即96孔板每孔加入2.5 μL样本与250 μL工作液37℃孵育10 min,用酶标仪测定吸光度值(λmax=510 nm),并据标准品吸光度值计算TG和TC含量。LDL-C和HDL-C通过直接法测定,即96孔板每孔加入2.5 μL样本与相应测定试剂盒中R1工作液180 μL,37℃孵育5 min,用酶标仪测定吸光度值(λmax=546 nm);再加入60 μL R2工作液后,相同条件下孵育并测定吸光度值;并据标准品吸光度值计算LDL-C 和HDL-C含量。
1.6Western蛋白印迹法检测海马和前额叶皮质CysLT1R,NF-κ B p65,TNF-α ,lL-1β ,剪切胱天蛋白酶3,Bax和Bcl-2蛋白表达水平
①总蛋白提取:处死小鼠取脑,分离脑海马和前额叶皮质,称重。按质量(g):体积(mL)为1∶9的比例加入RIPA缓冲液(单去污裂解液:PMSF= 9∶1),制备组织匀浆,低温离心(4℃,12 000×g,5 min),收集蛋白样液,并运用BCA法测定蛋白浓度。②核蛋白提取:将海马和前额叶皮质分别用低渗裂解液进行匀浆裂解(1 mL低渗裂解液中含有5 μL磷酸酶抑制剂、10 μL PMSF和1 μL DL-二硫苏糖醇),3000×g离心5 min。沉淀再用低渗裂解液进行溶解,5000×g离心5 min获得沉降物溶于200 μL裂解液,低温处置20 min后,4℃15 000×g离心10 min吸取上清蛋白样液,行BCA法定量。配制上样液(1μL溶液含4 μg蛋白),100℃加热10 min变性后,-80℃保存备用。制备分离的电泳凝胶,每孔分别加入10 μL的蛋白样液;按电压强度为80 V进行浓缩,120 V进行分离。将所需的目的蛋白转移到PVDF膜上,并用脱脂奶粉(TBST溶解)封闭膜上未吸附蛋白区来减少非特异性结合的影响;而后用脱脂奶粉稀释的抗体孵育,即用CysLT1R抗体、TNF-α抗体、IL-1β抗体(1∶200稀释)、NF-κB p65抗体(1∶1000稀释)、剪切胱天蛋白酶3(1∶500稀释)、Bax(1∶1000稀释)、Bcl-2(1∶1000稀释)、β肌动蛋白抗体(1∶5000稀释)和组蛋白H3抗体(1∶500稀释)4℃孵育过夜,然后用TBST洗净,PDVF膜用山羊抗兔IgG或兔抗羊IgG二抗(1∶5000稀释)室温下孵育2 h后洗净,Tanon-4200凝胶成像系统显色成像。采用Gel-Pro Analyzer 4软件进行分析处理,目标蛋白与内标β肌动蛋白或组蛋白H3积分吸光度值比值表示蛋白相对表达水平。
1.7统计学分析
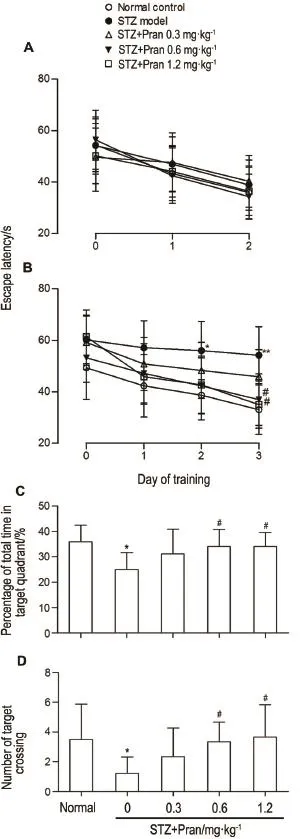
Fig.1 Effect of pranlukast(Pran)on number of platform crossings and percentage of time spent in target quad⁃rant in streptozocin(STZ)-induced type1 diabetic mice in Morris water maze(MWM)test.Type 1 diabetes mouse model was induced by injection through the tail vein with STZ 150 mg·kg-1.Diabetic mice were administered orally with Pran for 4 consecutive weeks.Day 0 represented performance on the first trial,and subsequent points represented average of all daily trials.The escape latency of mice in the 2-d visible plat⁃form(A)and 3-d hidden platform trials(B),the percentage of time spent in the target quadrant(C),the average number of times of crossing the platform(D)during the spatial probe test were recorded.x±s,n=10.*P<0.05,**P<0.01,compared with normal control group;#P<0.05,compared with STZ model group.
2 结果
2.1普仑司特改善糖尿病小鼠学习记忆能力
在水迷宫实验第1~2天的可见平台训练期间,正常组小鼠和糖尿病小鼠的上台潜伏期无显著差异,说明各组小鼠的基础活动以及对目标的识别能力均无差异(图1A)。在第3~5天隐藏平台训练中,模型组小鼠显示出更长的逃避潜伏期(P<0.05);Pran 0.6和1.2 mg·kg-1组动物逃避潜伏期均显著缩短(P<0.05),0.3 mg·kg-1组小鼠逃避潜伏期无显著差异(图1B)。空间探索实验结果显示,模型组小鼠在目标象限游动时间和穿过平台所在区域次数均较正常小鼠显著减少(P<0.05);给予Pran 0.6和1.2 mg·kg-1能显著增加糖尿病小鼠在目标象限游动时间及穿过平台所在区域次数(P<0.05)(图1C 和D)。以上结果表明,Pran 0.6和1.2 mg·kg-1能改善糖尿病小鼠学习记忆能力。
2.2普仑司特对糖尿病小鼠脑内CysLT1R表达的影响
Western蛋白印迹检测结果表明(图2),STZ诱导的糖尿病小鼠海马和前额叶皮质CysLT1R表达显著上调(P<0.01),给予Pran 0.6和1.2 mg·kg-1CysLT1R表达均显著下降(P<0.05)。上述结果提示,Pran可能通过降低糖尿病小鼠脑内CysLT1R表达而改善学习记忆损害。
2.3普仑司特对糖尿病小鼠脑内NF-κ B p65,lL-1β 和TNF-α 表达的影响
Western蛋白印迹结果(图3)显示,糖尿病小鼠神经细胞核内NF-κB p65表达显著上调(P<0.01),给予普仑司特 0.6和1.2 mg·kg-1NF-κB p65表达水平显著下降(P<0.05)。Pran 0.6和1.2 mg·kg-1还能显著抑制脑内炎症因子IL-1β和TNF-α生成(P<0.05)。说明Pran可抑制糖尿病小鼠脑内NF-κB信号转导及神经炎症反应。
2.4普仑司特对糖尿病小鼠脑内凋亡相关蛋白剪切胱天蛋白酶3,Bax和Bcl-2表达的影响
Western蛋白印迹结果(图4)显示,糖尿病小鼠脑内剪切胱天蛋白酶3水平显著上调,Bax/Bcl-2比值显著升高(P<0.01);给予Pran 0.6和1.2 mg·kg-1剪切胱天蛋白酶3和Bax/Bcl-2比值均显著下降(P<0.05)。说明Pran可减轻糖尿病小鼠脑内神经细胞凋亡。
2.5普仑司特对糖尿病小鼠体质量、血糖、血清胰岛素和血脂的影响
由表1可见,糖尿病小鼠体质量明显减轻,血糖升高,血清胰岛素水平降低,血脂代谢紊乱(TG,TC 和LDL-C升高,HDL-C降低)(P<0.01);Pran对糖尿病小鼠上述典型的代谢紊乱均无显著的改善作用。
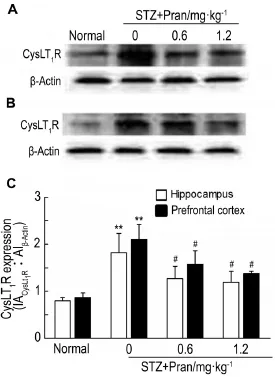
Fig.2 Effect of pranlukast on cysteinyl-leuykotrienes receptor 1(CysLT1R)expression in hippocampus(A)and prefrontal cortex(B)of diabetic mice by Western blotting.See Fig.1 for the treatment.C was the semiquantitative result of A and B.±s,n=4.**P<0.01,compared with corre⁃sponding normal control group;#P<0.05,compared with corre⁃sponding STZ model group.
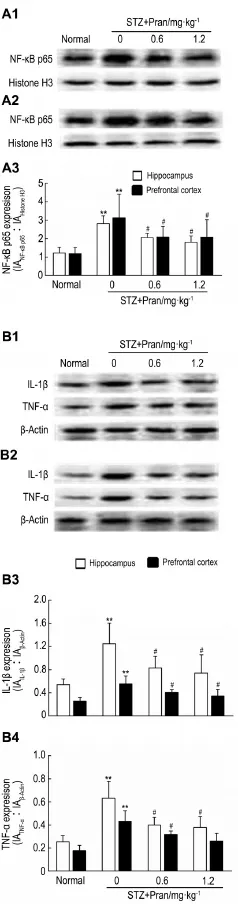
Fig.3 Effect of pranlukast on NF-κ B p65(A),interleukin-1β (lL-1β )(B)and tumor necrosis factor-α (TNF-α )(B)in hippocampus(A1,B1)and prefrontal cortex(A2,B2)of STZ-induced diabetic mice by Western blotting. See Fig.1 for the treatment.A3 was the semiquantitative result of A1 and A2;B3 and B4 were the semiquantitative results of B1 and B2.±s,n=4.**P<0.01,compared with corresponding normal control group;#P<0.05,compared with corresponding STZ model group.
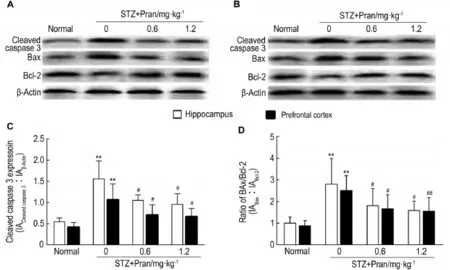
Fig.4 Effect of pranlukast on cleaved caspase 3,Bax and Bcl-2 in hippocampus(A)and prefrontal cortex(B)of STZ-induced diabetic mice by Western blotting.See Fig.1 for the treatment.C and D were the semiquantitative results of A and B.±s,n=4.**P<0.01,compared with corresponding normal control group;#P<0.05,##P<0.01,compared with corresponding STZ model group.
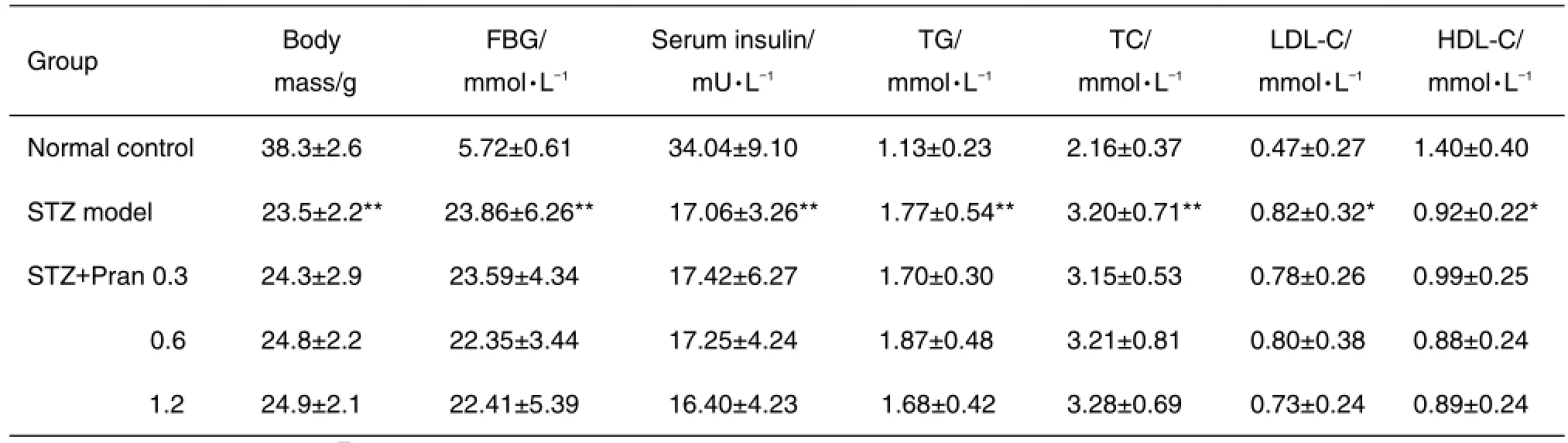
Tab.1 Effect of pranlukast on body mass,fasting blood glucose(FBG),serum insulin,triglycerides(TG),total cholesterol(TC),low density lipoprotein cholesterol(LDL-C)and high density lipoprotein cholesterol(HDL-C)in STZ-induced diabetic mice
3 讨论
本研究结果显示,学习记忆损害的糖尿病小鼠一方面外周出现糖脂代谢紊乱,另一方面脑内出现神经炎症和凋亡反应,这些变化与文献报道一致[5-6]。本研究发现,糖尿病小鼠脑内CysLT1R异常升高,给予Pran既能抑制脑内CysLT1R异常升高又能抑制神经炎症和凋亡反应,并显著改善糖尿病小鼠学习记忆损害,但对外周糖脂代谢紊乱无明显影响。据此推测,脑内CysLT1R参与糖尿病记忆损害的病理过程,Pran对糖尿病小鼠学习记忆的改善作用与其阻止脑内CysLT1R上调有关;改善糖代谢紊乱并非是干预糖尿病学习记忆损害的唯一手段,采用多环节干预可能更为有效。
关于糖尿病认知障碍发生机制有诸多学说,如神经递质与营养因子缺失、胰岛素信号转导障碍和氧化应激等,而针对这些学说的药物研究未获得实质性进展,更无确立防治糖尿病认知障碍的分子靶标[1,7]。CysLT1R是由3个膜内和3个膜外亲水环连接着7个跨膜疏水区组成的G蛋白偶联受体。CysLT1R内源性配体主要有半胱氨酰白三烯C4、半胱氨酰白三烯D4和半胱氨酰白三烯E4,它们是由5-脂氧酶催化花生四烯酸裂解产生的。过去认为,CysLT1R主要存在于外周气道平滑肌细胞和上皮细胞、血管内皮细胞以及嗜酸性粒细胞。近年发现,中枢的神经元和胶质细胞也能检测到其表达[2]。外周呼吸系统CysLT1R介导哮喘和过敏性鼻炎的病理反应,而中枢神经系统CysLT1R诱导NF-κB信号转导参与神经炎症和神经凋亡反应[8-9]。糖尿病小鼠脑内CysLT1R表达增加可能与脑内炎症介质如白三烯类物质生成增多有关,因为作为其配体可诱导激活CysLT1R表达、活化。CysLT1R活化后启动NF-κB信号通路,NF-κB p65转位至细胞核,一方面促进炎症因子IL-1β和TNF-α表达,另一方面促进凋亡相关蛋白剪切胱天蛋白酶3和Bax生成、抑制抗凋亡蛋白Bcl-2生成。本研究选用可跨越血脑屏障的CysLT1R拮抗剂Pran,可有效地阻断脑内CysLT1R,产生抗神经炎症和抗神经凋亡作用,继而改善糖尿病小鼠学习记忆损害。Pran所用剂量仅为抗哮喘病剂量的0.52%~1%,且在中枢系统中分布浓度较高[4]。
综上所述,Pran除对哮喘和过敏性鼻炎有效外,小剂量还能分布至中枢,对糖尿病性脑病产生保护作用,有望被二次开发为防治糖尿病记忆损害的药物,进而为多环节干预糖尿病记忆障碍提供新思路。
[1]Kodl CT,Seaquist ER.Cognitive dysfunction and diabetes mellitus[J].Endocr Rev,2008,29(4):494-511.
[2]Bäck M,Dahlén SE,Drazen JM,Evans JF,Serhan CN,Shimizu T,et al.International union of basic and clinical pharmacology.LXXXⅣ :leukotriene receptor nomenclature,distribution,and pathophysiological functions[J].Pharmacol Rev,2011,63(3):539-584.
[3]Tan YJ,Tang SS,Hong H.Effects of pranlukast on scopolamine-induced memory impairment in mice[J].Chin J Mod Appl Pharm(中国现代应用药学),2015,32(1):22-26.
[4]Tang SS,Ji MJ,Chen L,Hu M,Long Y,Li YQ,et al.Protective effect of pranlukast on Aβ1-42-induced cognitive deficits associated with downreg⁃ulation of cysteinyl leukotriene receptor 1[J].Int J Neuropsychopharmacol,2014,17(4):581-592.
[5]Du GT,Hu M,Mei ZL,Wang C,Liu GJ,Hu M,et al.Telmisartan treatment ameliorates memory deficits in streptozotocin-induced diabetic mice via attenuating cerebral amyloidosis[J].J Pharmacol Sci,2014,124(4):418-426.
[6]Liu LP,Yan TH,Jiang LY,Hu W,Hu M,Wang C,et al.Pioglitazone ameliorates memory deficits in streptozotocin-induced diabetic mice by reducing brainβ-amyloid through PPARγ activation[J]. Acta Pharmacol Sin,2013,34(4):455-463.
[7]Ahmad FK,He Z,King GL.Molecular targets of diabeticcardiovascularcomplications[J].Curr Drug Targets,2005,6(4):487-494.
[8]Wang XY,Tang SS,Hu M,Long Y,Li YQ,Liao MX,et al.Leukotriene D4 induces amyloid-β GenerationviaCysLT(1)R-mediatedNF-κB pathways in primary neurons[J].Neurochem Int,2013,62(3):340-347.
[9]Tang SS,Hong H,Chen L,Mei ZL,Ji MJ,Xiang GQ,et al.Involvement of cysteinyl leukotriene receptor 1 in Aβ1-42-induced neurotoxicity in vitro and in vivo[J].Neurobiol Aging,2014,35(3):590-599.
(本文编辑:乔 虹)
Effect of pranlukast on memory impairment and nerve injury in streptozocin-induced type 1 diabetic mice
TAN Yong-jin1,DONG Rong-rong2,HONG Hao2
(1.Anqing Medical and Pharmaceutical College,Anqing 246052,China;2.Department of Pharmacology,China Pharmaceutical University,Nanjing 210009,China)
OBJECTlVE To investigate the effect of pranlukast(Pran)on learning and memory impairment and neuroinflammatory and apoptotic response in streptozocin(STZ)-induced type 1 diabetic mice.METHODS Male ICR mice were injected through the tail vein with STZ(150 mg·kg-1)to inducethe type 1 diabetes model.Diabetic mice were administered orally with Pran.After 4 consecutive weeks of administration,the escape latency in hidden platform trials,number of platform crossings and time spent in the target quadrant of mice were assessed by the Morris water maze(MWM)test.Western blot was used to detect the proteins of cysteinyl-leukotrienes receptor-1(CysLT1R)and pro-inflammatory factors,nuclear factor-κB p65 subunit(NF-κB p65),interleukin-1β(IL-1β),tumor necrosis factor-α (TNF-α),and cleaved caspase 3,Bax and Bcl-2 in the hippocampus and prefrontal cortex of diabetic mice.We also determined fasting blood glucose,serum insulin and lipids such as triglyceride,total cholesterol,high density lipoprotein cholesterol,and low density lipoprotein cholesterol.RESULTS The data of the MWM test showed that untreated diabetic mice displayed a higher escape latency in hidden platform trials(P<0.05),and a smaller number of platform crossings(P<0.05)as well as shorter per⁃centage of time spent in the target quadrant(P<0.05).The data of Western blotting showed that treat⁃ment with Pran 0.6 and 1.2 mg·kg-1significantly reduced the levels of CysLT1R,nuclear NF-κB p65,IL-1β and TNF-α,cleaved caspase 3,and the ratio of Bax and Bcl-2 in the hippocampus and prefrontal cortex of diabetic mice(P<0.05).However,Pran did not improve the fasting blood glucose,serum insulin or lipid metabolism disorder in diabetic mice.CONCLUSlON Pran improves memory impairment and nerve injury in STZ-induced type 1 diabetic mice.
pranlukast;type 1 diabetes;learning and memory;cysteinyl-leukotrienes receptor 1;neuroinflammation;apoptosis
The project supported by National Natural Science Foundaiton of China(81273497)
HONG Hao,E-mail:honghao@cpu.edu.cn,Tel:(025)86185227
R971
A
1000-3002-(2016)04-0323-07
国家自然科学基金面上项目(81273497)
谈永进,男,硕士,副教授,主要从事神经药理学研究,Tel:15305563002,E-mail:tyj939@163.com
洪 浩,E-mail:honghao@cpu.edu.cn,Tel:(025)86185227
2015-12-08接受日期:2016-04-16)

