基于1H-核磁共振代谢组学研究黄药子乙醇提取物致肝损伤的潜在生物标志物
盛云华,乔靖怡,金若敏,姚广涛,周 璐,唐黎明(.上海市食品药品检验所,上海 003;.上海中医药大学药物安全评价研究中心,上海 003;3.河南中医学院,河南郑州 45006)
基于1H-核磁共振代谢组学研究黄药子乙醇提取物致肝损伤的潜在生物标志物
盛云华1,2,乔靖怡2,3,金若敏2,姚广涛2,周 璐2,唐黎明1
(1.上海市食品药品检验所,上海 201203;2.上海中医药大学药物安全评价研究中心,上海201203;3.河南中医学院,河南郑州 450016)
目的 采用基于1H-核磁共振(NMR)的代谢组学方法,分析黄药子乙醇提取物(RDB)致肝损伤大鼠血清和尿液中代谢产物随时间的动态变化,探寻RDB肝毒性早期的潜在生物标志物。方法 大鼠ig给予RDB 5 g·kg-1,连续给药28 d,于给药后3,7,14和28 d及停药后7 d(恢复期)取6只大鼠采血,进行常规血液生化分析;取肝组织,计算肝指数,并用HE染色进行肝组织病理观察。收集给药后0,3,7,14和28 d及停药后7 d血清和尿液,进行1H-NMR的代谢组学研究,采用主成分分析和正交偏最小二乘法分析对早期潜在生物标志物进行筛选和鉴别。结果 与正常对照组相比,RDB组血清总胆红素(TB)和总胆固醇(TC)于给药后3~28 d显著升高(P<0.05),总胆汁酸(TBA)于7~28 d显著升高(P<0.05),TB,TC和TBA于停药后7 d恢复正常,谷丙转氨酶和谷草转氨酶活性以及葡萄糖含量均无显著变化。RDB组给药后肝指数显著升高(P<0.01),停药后7 d恢复正常;肝组织于给药后7 d开始出现单细胞坏死和肝细胞肿大,随给药时间延长,病变程度加重;停药7 d后有所恢复。代谢组学检测显示,RDB给药早期血清脂质〔低密度脂蛋白(LDL)/极低密度脂蛋白(VLDL)〕、谷氨酸、磷酸胆碱和甘油磷酸胆碱等升高(P<0.05),尿液丙酮酸盐和N-乙酰谷氨酸等降低(P<0.05);上述代谢产物在停药7 d后均恢复正常。结论 早期肝损伤与糖脂代谢、能量代谢和胆汁淤积有关。随着RDB给药的持续,产生了组织过氧化损伤。线粒体损伤导致体内能量代谢不足。血清脂质(LDL/VLDL)、谷氨酸、磷酸胆碱和甘油磷酸胆碱,及尿液丙酮酸盐和N-乙酰谷氨酸均可作为RDB致肝损伤的早期潜在生物标志物。
黄药子;肝损伤;核磁共振;代谢组学;生物标志物
DOl:10.3867/j.issn.1000-3002.2016.04.002
近年来,中药致肝损伤的临床报道逐年增多,成为中药新药研发失败或撤市的主要原因之一[1]。因此,探索高敏感性和特异性的肝毒性的早期潜在生物标志物,对早预防早治疗有着积极的意义。黄药子(Rhizone Dioscoreae Bulbiferae,RDB)为薯蓣科属植物黄独(Dioscorea bulbifera L.)的块茎,具有解毒消肿、化痰散结和凉血止血的作用[2]。RDB的毒性成分为二萜内酯类成分,其中黄独毒B是毒性成分之一,可引起肝的一系列病理变化[3-4]。
代谢组学是研究生物体受外部刺激或内部基因改变所产生的所有内源性代谢产物动态的变化,是从整体分析内源性代谢产物的一种技术方法。代谢组学技术常采用高效液相-质谱串联(HPLC-MS/ MS)、超高压液相色谱-质谱联用(UPLC-MS)及核磁共振(1H-NMR)等方法进行体内代谢产物分析,现已用于对雄黄、金银花和芫花等药物的肝毒性特点与机制的研究[5-7]。本研究采用基于1H-NMR的代谢组学方法,结合血液生化检测和肝组织病理观察,对RDB乙醇提取物(以下简称RDB)所致肝损伤大鼠的血清和尿液进行研究,分析其代谢产物谱随时间的动态变化,以期探寻作为RDB肝毒性的早期潜在生物标志物的内源性代谢产物,为临床药物肝毒性早预警、早治疗提供实验依据,同时也为药物肝毒性早期潜在生物标志物的研究提供一种实验模式。
1 材料与方法
1.1黄药子乙醇提取物的制备
RDB由南京泽朗医药科技有限公司制备,制备工艺:按药材的8倍量加入70%乙醇,提取2次,每次提取2 h,提取液浓缩,比重为1.5,喷雾干燥后即得RDB粉末。批号:ZL-091217,产品规格:10∶1,即每克生药0.1 g提取物,每克提取物含6.7 mg黄独毒B,避光储存于阴凉干燥处。实验时,称取一定量RDB粉末,加蒸馏水配制成终浓度为RDB 0.25 g·L-1药液。
1.2动物和主要试剂
Wistar大鼠,60只,雌雄各半,SPF级,体质量100~120 g,由上海西普尔-必凯实验动物有限公司提供,动物许可证号:SCXK(沪)2008-0016。大鼠均在上海中医药大学实验动物中心SPF级饲养室饲养。饲养环境温度20~25℃,湿度40%~70%,工作照度12 h明12 h暗,自由饮食饮水。重水和3-三甲基硅烷基-2,2,3,3-四氘代丙酸钠(TSP)购自美国Cambridge Isotope Laboratories公司;谷丙转氨酶(glutamic-pyruvic transaminase,GPT)、谷草转氨酶(glutamic-oxaloacetic transaminase,GOT)、总胆固醇(total cholesterol,TC)和葡萄糖(glucose,GLU)检测试剂盒,均购自日本世诺临床诊断制品株式会社;总胆红素(total bilirubin,TB)检测试剂盒,日本和光纯药工业株式会社;总胆汁酸(total bile acid,TBA)检测试剂盒,烟台澳斯邦生物工程有限公司。
1.3给药分组和样本收集
将大鼠随机分为正常对照组和RDB组,每组30只。经预试后RDB组ig给予RDB 5 g·kg-1,给药体积为20 mL·kg-1,正常对照组ig给予等容量蒸馏水,连续给药28 d。分别于给药后3,7,14和28 d及停药后7 d(恢复期)每组大鼠各取6只,以乌拉坦溶液麻醉后,腹主动脉取血,4°C,2292×g离心15 min,取血清进行临床生化指标的检测,余下的血清-80℃冻存用于1H-NMR检测。摘肝取左内叶固定于10%甲醛溶液中用于组织病理学检查。取6只大鼠,于给药前和给药3,7,14和28 d及停药后7 d(恢复期)收集12 h尿液,收集器中加入1%叠氮钠溶液,-80℃冻存用于1H-NMR检测。
1.4生化和组织病理学检测
采用日立7080全自动生化分析仪测定血清GPT,GOT,TB,TBA和TC和GLU的水平;计算肝脏指数,肝指数=肝质量(g)/体质量(g)×100。HE染色进行肝组织病理形态检查,根据损伤程度进行病理分级评定[8]。
1.5血清和尿液的1H-NMR光谱
取血清400 μL,加入30 μL磷酸盐缓冲溶液(600 mmol·L-1,pH 7.4),再加入170 μL重水。混匀,室温5 min,4℃,13 201×g离心10 min除去杂质。取上清500 μL置于5 mm的核磁管中,用于1H-NMR谱的检测。1H-NMR实验采用Varian 600谱仪,其1H共振频率是599.93 Hz。血清1H-NMR光谱横向弛豫加权实验是用水峰抑制的Carr-Pur⁃cell-Meiboom-Gill(CPMG)序列,信号累加次数128次,弛豫延迟2.1 s。参数如下:谱宽8000.0 Hz,采集时间1.0000 s,总回波时间100 ms。
取尿液500 μL,加入100 μL含TSP的磷酸盐缓冲溶液(D2O配制,1 mol·L-1,pH 7.4)。混匀,室温5 min,然后4℃,13 201×g离心10 min。取上清500 μL置于核磁管中。尿1H-NMR光谱采用预饱和核奥添豪斯效应光谱学(nuclear-Over⁃hauser-effect spectroscopy,NOESY)序列,信号累加次数128次,弛豫延迟2.5 s。参数同血清检测。
1.6数据处理
血清NMR谱图以乳酸在1.33 ppm处的双峰定标,积分区间为9.0~0.5 ppm,积分间距为0.002 ppm。在模式识别分析前去掉5.23~4.662和4.636~4.438 ppm 2段包含尿素峰和残余的水峰,以消除溶剂峰和尿素峰的干扰。尿样NMR谱图以TSP在0 ppm处的单峰定标,积分区间为9.5~0.5 ppm,积分间距为0.005 ppm。去掉6.0~5.5 ppm 和5.36~4.50 ppm 2段包含尿素峰和残余的水峰。使用TopSpin软件(V3.0,BrukerBiospin,Germany)对谱图进行傅立叶变换、相位调整、基线校正及定标等处理,所有谱图在进行傅立叶变换时均乘以增宽因子为1 Hz的指数窗函数。
1.7模式识别分析和统计学分析
使用SIMCA-P+软件(V11.0,Umetrics AB,Umea,Sweden)对归一化后的数据进行模式识别多变量分析,依次采用主成分分析(principal component analysis,PCA)和正交偏最小二乘法分析(orthogonal partial least squares-discriminant analysis,OPLS-DA),最大化地凸显模型内部不同组别之间的差异。实验结果数据以x±s表示,采用SPSS16.0软件单因素方差分析进行组间比较。等级资料采用非参数检验。采用Ridit法对肝组织病理积分的数据进行统计分析。P<0.05认为差异有统计学意义。
2 结果
2.1黄药子乙醇提取物对大鼠临床生化和组织病理变化的影响
由图1所示,与同时间点正常对照组相比,RDB组血清TB和TC于给药后3,7,14和28 d显著升高(P<0.05,P<0.01);TBA于给药后7,14和28 d显著升高(P<0.05,P<0.01);TB,TC和TBA于停药后7 d恢复期恢复正常;血清GPT和GOT活性及GLU含量均无明显变化。RDB组肝指数显著升高(P<0.01),恢复期肝指数有所恢复(图2)。

Fig.1 Effect of ethanol extract of Rhizoma Dioscoreae Bulbiferae(RDB)on clinical chemical parameters of rat serum.Rats were ig administered with RDB 5 g·kg-1for 28 d.Blood was taken for analysis of glutamine-pyruvic transami⁃nase(GPT)(A),glutamine-oxaloacetic transaminase(GOT)(B),total bilirubin(TB)(C),total bile acid(TBA)(D),total choles⁃terol(TC)(E)and glucose(GLU)(F)by automatic biochemical analyzer at 3,7,14 and 28 d after RDB administration,as well as at 7 d after final RDB administration(recovery period),respectively.x±s,n=6.*P<0.05,**P<0.01,compared with normal control group.

Fig.2 Effect of RDB on rat liver indexes.See Fig.1 for the rat treatment.±s,n=6.**P<0.01,compared with normal control group.
光镜下观察,与同时间点正常对照组相比,在给药7 d时RDB组2/6大鼠肝组织开始出现单细胞坏死,随给药时间增加,损伤加重,在14和28 d时5/6大鼠肝组织出现单细胞坏死和肝小叶中心性肝细胞变性肿大程度加重(P<0.01);停药7 d后大鼠肝损伤有所恢复(图3,表1)。

Fig.3 Liver histomorphology of rats administrated with RDB(HE×200).See Fig.1 for the rat treatment.↑:hepatocytic necrosis;⇧:hepatocytic degeneration.
2.2.黄药子乙醇提取物对大鼠血清代谢组的影响
由图4可见,与正常对照组相比,RDB组1H-NMR谱代谢产物有的消除,有的产生;在不同时间点RDB组之间也如此。
初始PCA显示,R2X=75.1%,即第1主成分和第2主成分能解释原始总体信息的75.1%,Q2=0.725,即模型的预测能力较好,R2和Q2较为接近,均>0.4,即该模型稳定可靠(图5)。
为进一步放大各组间的差异找到含量发生改变的代谢产物,采用OPLS-DA进一步凸显区分不同组别的差异代谢产物。OPLS-DA左为得分图,右为载荷图(图6)。载荷图中标示了能区分组别的差异代谢产物。负方向则对应对照组,正方向对应RDB组。各时间点对照组和RDB组比较,出现7种显著变化的差异代谢产物(表2)。
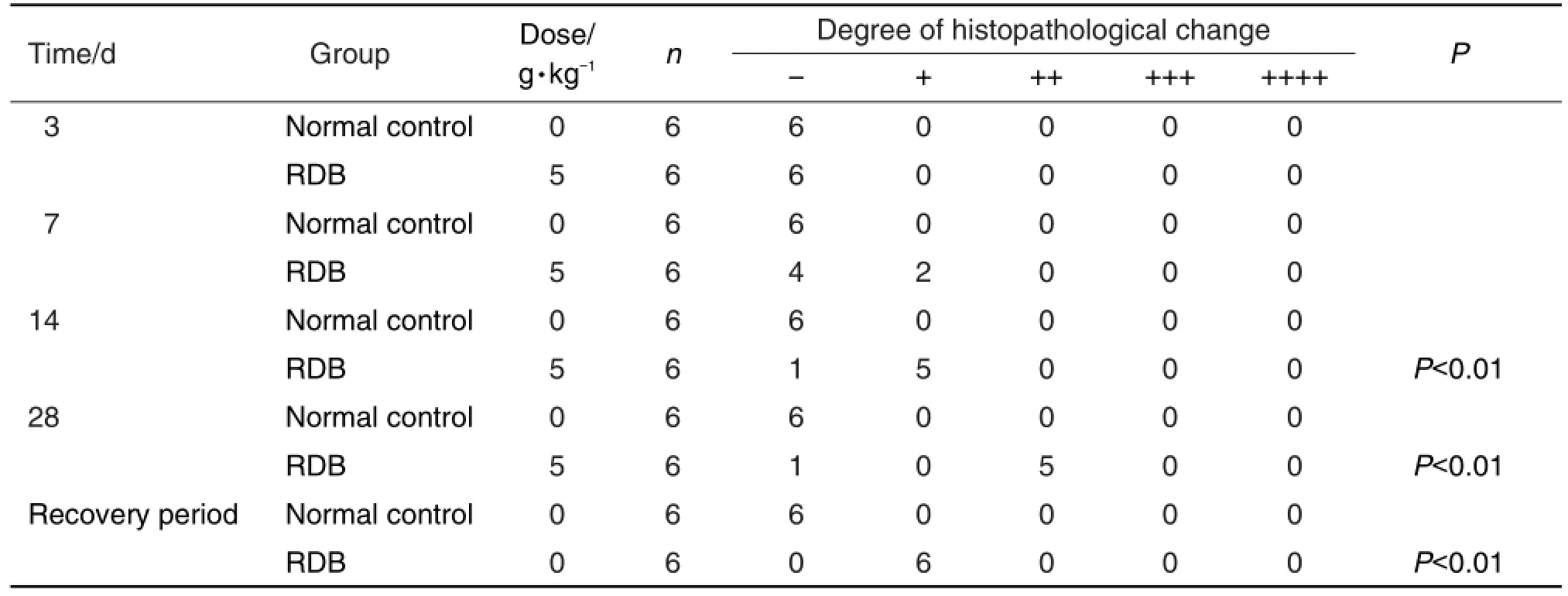
Tab.1 Ridit analysis of effect on histomorphology in rat liver adminstered with extract from RDB
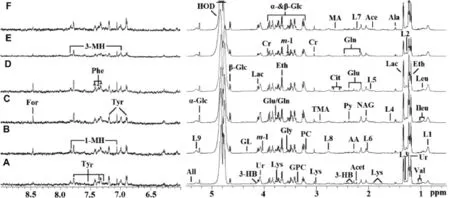
Fig.4 600 MHz1H-NMR spectra(δ 0.5-5.5 and δ 6.0-9.0)of serum obtained from normal control rats(A)and dosed rats at 3 d(B),7 d(C),14 d(D),28 d(E)and recovery period(F)following RDB administration.See Fig.1 for the rat treatment.The region of δ 6.0-9.0(in the dashed box)was magnified 64 times compared with corresponding region of δ 0.5-5.5 for clarity.1-MH:1-methylhistidene;3-HB:3-hydroxybutyrate;AA:acetoacetate;Ace:acetate;Acet:acetone;Ala:alanine;All:allantion;Cit:citrate;Cr:creatine;Eth:ethanol;For:formate;GL:glycerol of lipids;Gln:glutamine;Glu:glutamate;Gly:glycine;GPC:glycerolphosphocholine;Ileu:isoleucine;L1:low density lipoprotein/very low density lipoprotein(LDL/VLDL),L2:LDL,L3:VLDL,L4:VLDLL5:lipid,L6:lipid,L7:lipid,L8:lipid,L9:lipid,-CH=CH-;Lac:lactate;Leu:leucine;Lys:lysine;MA:methylamine;NAG:N-acetyl glycoprotein signals;PC:phosphocholine:Phe:phenylalanine;Py:pyruvate;TMA:trimethylamine;Tyr:tyrosine;Val:valine;Ur:urethane;α-Glc:α-glucose;β-Glc:β-glucose;HOD:mixture of water and deuterium oxiue;m-I:myo-inositol.
由表2可见,RDB给药后,3~28 d血清中α-葡萄糖、β-葡萄糖降低;3~28 d磷酸胆碱、甘油磷酸胆碱升高;3 d和14~28 d脂质〔低密度脂蛋白/极低密度脂蛋白,(low density lipoprotein/very low density lipoprotein,LDL/VLDL)〕升高;3~7 d和28 d三甲胺升高;7和28 d谷氨酸升高;恢复期除谷氨酸升高之外,其他代谢产物均恢复正常。
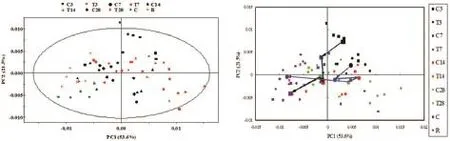
Fig.5 Principal component analysis(PCA)of1H-NMR spectra of serum obtained from normal control group and RDB treated group at various time points.See Fig.1 for the rat treatment.T3,T7,T14,T28 and R represent 3,7,14,28 d and recovery period of RDB group,respectively;C3,C7,C14,C28 and C represent 3,7,14,28 d and recovery period of normal control group,respectively.

Fig.6 Significance of metabolite variations between normal control and RDB groups at 3(A),7(B),14(C),28(D)d and recovery period(E)following RDB administration by orthogonal partial least squares-discriminant analysis (OPLS-DA)of1H-NMR spectra of serum.See Fig.1 for the rat treatment.See Fig.4 for the abbreviations.

Tab.21H-NMR spectral data of chemical shifts and changes in selective metabolites detected in serum from rats treated by RDB
2.3黄药子乙醇提取物对大鼠尿代谢组学的影响
与正常对照组相比,RDB组1H-NMR谱代谢产物有的消除,有的产生;恢复期组1H-NMR谱无明显差异(图7)。
初始PCA显示,R2X=53.0%,Q2=0.394,即第1主成分和第2主成分能解释原始总体信息的53.0%,由PCA的得分图见到与正常对照组相比,给药后各时间点的在前2个主成分上能明显区分开。从尿样的代谢轨迹图来看,大鼠的代谢呈有规律的变化,在恢复期已呈代谢转归现象(图8)。
采用OPLS-DA,对PLS-DA模型进行正交校正处理,进一步凸显区分不同组别的差异代谢产物。载荷图中标示了能区分组间差异的代谢产物(图9)。各时间点RDB组与正常对照组比较,显著变化的差异代谢产物见表3。
由表3可见,RDB给药后,3~28 d尿中m-羟基苯乙酸、苯乙酰甘氨酸、丙酮酸、丙二酸二甲酯和α-羟基丁酸降低;3~14 d丙氨酸和乙酸降低;3和14~28 d牛磺酸降低;7和28 d乙酰乙酸降低;3和14 d N-乙酰谷氨酸降低;14~28 d N-甲基烟酰胺降低。3~28 d马尿酸、α-羟基异戊酸和烟碱酸升高;3 和14~28 d p-羟基苯乙酸升高;3和14 d三甲胺和二甲胺升高;3和28 d丙二酸升高。尿液中差异代谢产物在恢复期均恢复正常。
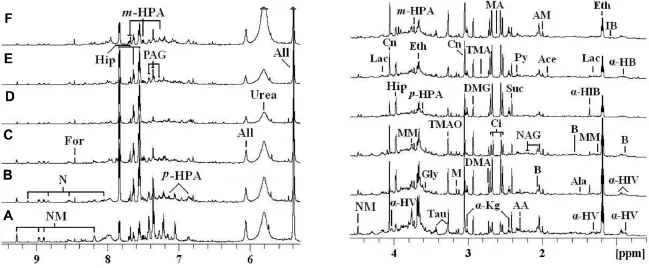
Fig.7 600 MHz1H-NMR spectra(δ 0.8-4.5 and δ 5.3-9.5)of urine at various time points following administration of RDB.See Fig.1 for the rat treatment.The region of δ 5.3-9.5(in the dashed box)was magnified 4 times compared with corre⁃sponding region of δ 0.8-4.5 for the purpose of clarity.A:normal control group;B:3 d RDB group;C:7 d RDB group;D:14 d RDB group;E:28 d RDB group;F:recovery period group.AM:acetamide;B:butyrate;Cn:creatinine;DMA:dimethylamine;DMG:dimethylglycine;Hip:hippurate;IB:isobutyrate;M:malonate;m-HPA:m-hydroxaphenylacetate;MM:methylmalonate;N:nicotinate;NM:N-methylnicotinamide;PAG:phenylacetyllycine;p-HPA:p-hydroxyphenylacetate;Suc:succinate;Tau:taurine;TMAO:trimethylamine-N-oxide;α-HB:α-hydroxybutyrate;α-HIB:α-hydrxoy-iso-butyrate;α-HIV:α-hydrxoy-iso-valerate;α-HV:α-hydroxy-nvalerate;α-Kg:α-ketoglutarate.
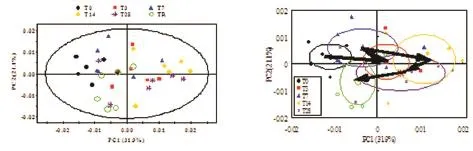
Fig.8 PCA of1H-NMR spectra of urine from rats following administration of RDB.See Fig.1 for the rat treatment.T0,T3,T7,T14,T28 and TR represent pre-treatment,3,7,14,28 d and post-treatment.The bigger symbols represent the average values in the respective group.
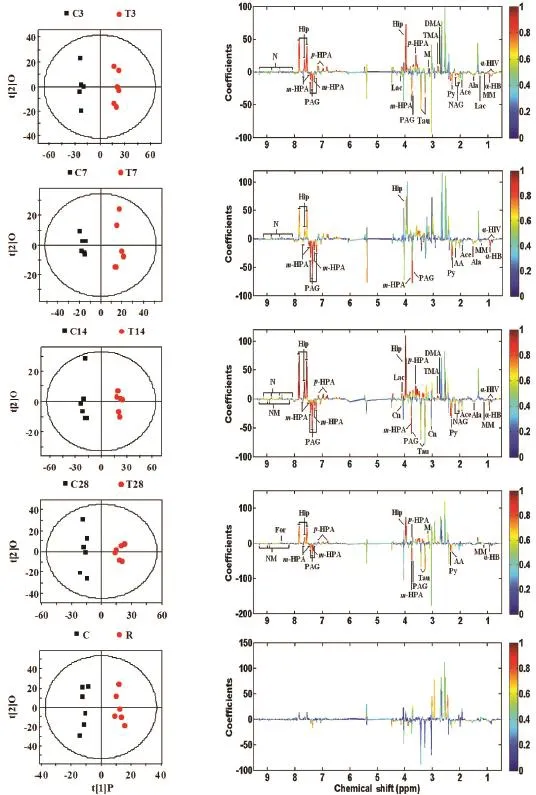
Fig.9 OPLS-DA of1H-NMR spectra of urine from rats following administration of RDB at different time points. See Fig.1 for the rat treatment.The significance of metabolites variations between the control group and RDB group at 3(A),7(B),14(C),28(D)d and recovery period(E)following the administration.See Fig.7 for the abbreviations.
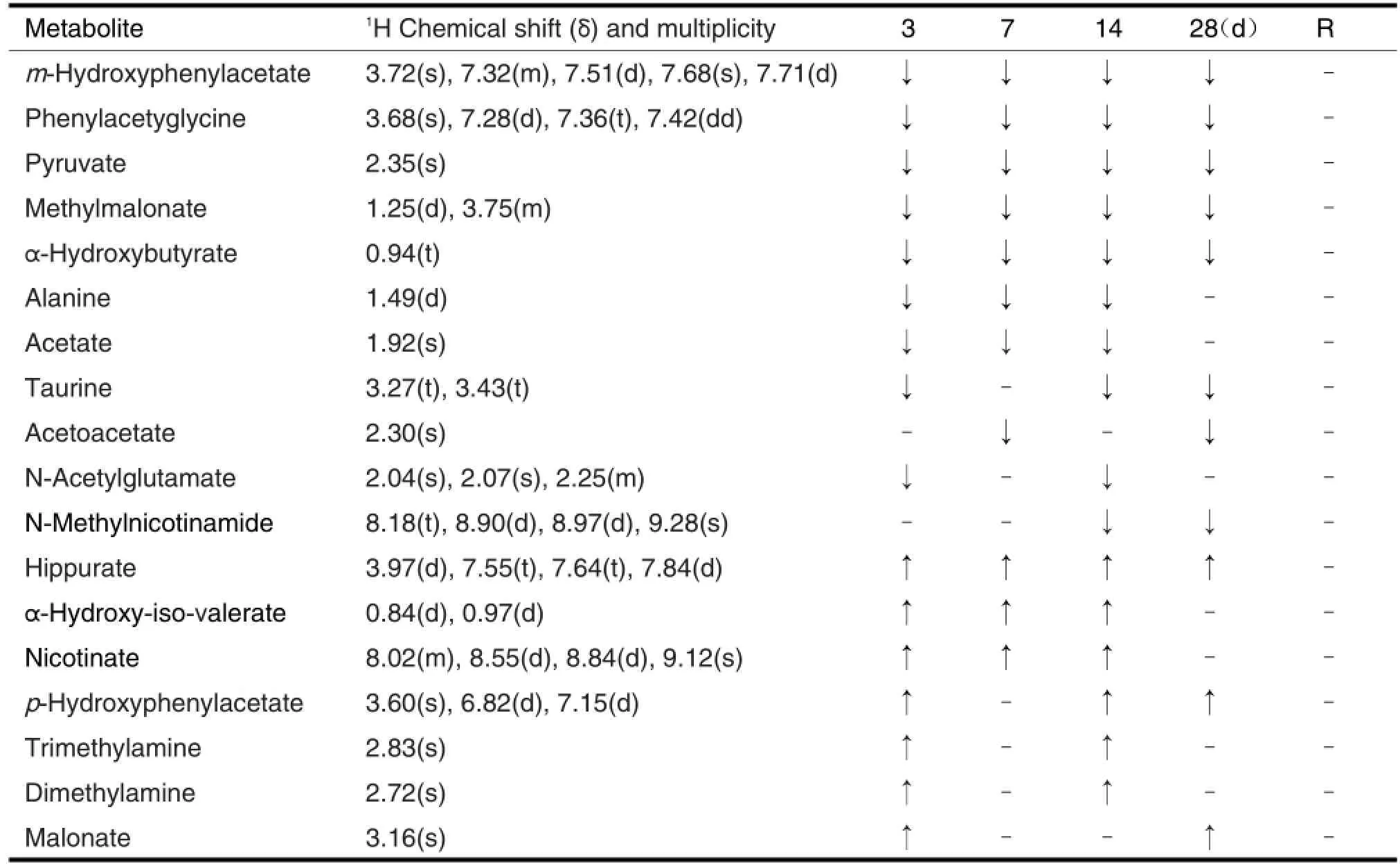
Tab.31H-NMR spectral data of chemical shifts and changes in selective metabolites in rats treated by RDB
3 讨论
本研究采用1H-NMR的检测方法,高分辨率的1H-NMR能对药物干预后大量的低分子化合物进行检测。根据前期预实验研究[9],分析RDB致肝损伤大鼠的血清和尿液代谢产物随时间的动态变化,结合血清生化和组织病理学的检测,探寻RDB肝毒性的早期潜在生物标志物。
实验结果显示,给药后肝损伤经典血清生化指标GPT和GOT无明显变化,与RDB致肝损伤胆汁淤积机制相关的TB,TBA和TC升高,肝指数升高,肝组织给药7 d开始出现单细胞坏死与肝细胞肿大,随给药时间延长,病变程度加重,上述各指标在恢复期有所恢复。代谢组学检测显示,给药后血清中α-葡萄糖、β-葡萄糖降低、磷酸胆碱、甘油磷酸胆碱、三甲胺、谷氨酸和脂质(LDL/VLDL)升高,恢复期除谷氨酸升高外,其他代谢产物均恢复正常。尿液中m-羟基苯乙酸、苯乙酰甘氨酸、丙酮酸、丙二酸二甲酯和α-羟基丁酸降低,丙氨酸、乙酸、牛磺酸、乙酰乙酸、N-乙酰谷氨酸和N-甲基烟酰胺降低,马尿酸、α-羟基异戊酸、烟碱酸、p-羟基苯乙酸、三甲胺、二甲胺和丙二酸升高。其中血清磷酸胆碱、甘油磷酸胆碱和脂质(LDL/VLDL),尿液丙酮酸、乙酰乙酸和N-乙酰谷氨酸在给药早期就发生变化。血清及尿液代谢产物的变化早于血清GPT、GOT和肝组织病理变化。
代谢组学检测显示,血中LDL和VLDL均升高。LDL是富含胆固醇的脂蛋白粒子,直径约18~25 nm,负责在血液内运载脂肪酸分子至全身供细胞使用。LDL是由肝生成的VLDL代谢而来。血浆中65%~70%的LDL是依赖LDL受体清除,一旦LDL受体缺陷,VLDL残粒由正常时大部分经肝LDL受体识别,而改为大部分转变成LDL,使血浆中LDL浓度增加。Zira等[10]报道,急性肝损伤时,血清LDL和VLDL升高。RDB给药后,各时间点血清TC含量显著升高,肝指数增大,组织病理学检查结果也显示随给药时间的延长,肝细胞变形肿大的程度加重,同时肝细胞受损,胆汁淤积,导致脂类代谢受到影响,脂类物质在肝内蓄积,肝细胞脂肪样变性引起肝肿胀,表明血清代谢产物LDL/VLDL的变化与常规检测指标结果均相吻合,反映了肝损伤。
代谢组学检测显示尿液丙酮酸盐含量降低,丙酮酸盐作为与糖脂代谢相关的中间代谢产物含量均降低,提示了糖脂代谢受阻,上述中间产物进入三羧酸循环的过程受到抑制。机体的能量代谢主要在线粒体中进行,因此三羧酸循环过程受抑提示线粒体的功能可能发生异常,这与刘树民等[11]报道的RDB致肝损伤的机制与内质网应激和线粒体途径引起的的细胞凋亡有关相一致。
血清代谢产物谷氨酸可与体内甘氨酸、半胱氨酸合成体内天然抗氧化剂谷胱甘肽,谷胱甘肽是机体内的重要的防御自由基氧化的天然抗氧化剂,其作用为保护细胞免受氧化损伤。曾有文献报道,RDB致肝损伤时肝组织中天然抗氧化剂谷胱甘肽过氧化物酶(GSH-PX)及超氧化物酸化酶(SOD)活性明显降低[12]。本研究中血清谷氨酸升高表明可能是由于药物的干预,机体加强了调节氧化与抗氧化的平衡而反馈性地增加谷胱甘肽合成,导致尿谷氨酸的含量降低,
血清代谢产物检测显示,磷酸胆碱和甘油磷酸胆碱的含量增高。胆碱类物质主要在肝肾中被氧化成甜菜碱,当肝肾受损,胆碱类物质代谢途径会受阻,从而造成胆碱成分增多,这一变化提示RDB对肝造成了损伤。
本研究中,RDB在给药期间血清GLU水平均较正常对照组偏低;在恢复期GLU水平恢复正常。血清代谢产物检测显示,在整个给药过程中,血清GLU亦降低,这与文献报道的血糖升高为急性肝损伤的标志物[13]有所不同。机体供能主要依靠GLU有氧氧化,我们推测,在RDB给药后,当肝细胞受损伤,GLU有氧氧化作用过程被抑制,肝细胞以无氧酵解来代偿能量的供应不足,因此乳酸含量增加,这与给药后血清中乳酸先降后升是一致的。同时由于丙酮酸参与糖、脂代谢,是合成丙氨酸的前体物质,检测结果显示,尿液的丙酮酸和丙氨酸下降,表明糖、脂代谢紊乱。
尿液的差异代谢产物检测显示,牛磺酸含量降低,这与文献报道的肝损伤时尿牛磺酸含量升高不一致。胆汁中胆汁酸是由甘氨酸和牛磺酸结合而来,是胆汁的主要成分。现已知RDB肝毒性的特征为胆汁淤积型,推测可能由于胆汁不能顺利排出,造成胆汁成分反流至血液,因而血清中胆汁酸增高,牛磺酸含量增加,而尿牛磺酸含量下降,这一现象尚需进一步验证。
尿液的代谢产物苯乙酸类、马尿酸、三甲胺和二甲胺在给药后降低。苯乙酸类主要是食物中蛋白经肠道菌群分解而来,马尿酸盐芳环类氨基酸的产物[15],三甲胺、二甲胺及三甲胺氧化物是由肠道菌群代谢产生,尿液的代谢产物含量降低可能是RDB对肠道菌群与机体的共生关系有所影响,提示肠道微生物菌群受到了影响。
血清脂质(LDL/VLDL)、谷氨酸、磷酸胆碱和甘油磷酸胆碱,及尿液丙酮酸盐和N-乙酰谷氨酸在给药早期就发生变化,反映了早期肝损伤与糖代谢、脂代谢、能量代谢和胆汁淤积有关,随着给药的持续,产生了过氧化损伤及线粒体损伤。代谢产物的变化早于血清GPT、GOT和肝组织病理的变化。因此提示,上述代谢产物可作为RDB致肝损伤的早期潜在生物标志物。
基于1H-NMR的代谢组学研究采用的是动物血液和尿液,结合血液生化和组织病理学常规检查,动态监测药物毒性的发生发展过程,有利于药物早期肝毒性的连续监测和预警。本研究对已公认的肝毒性中药RDB进行了肝毒性早期潜在生物标志物探索性研究,也为其他肝毒性中药研究早期潜在生物标志物的实验研究提供了阳性对照药及实验模式。
致谢:感谢上海阿趣生物科技有限公司邓军亮对实验数据分析给予的帮助。
[1]Huang JF,Jiang ZZ,Wang T,Yao JC,Zhang LY. Overview of research on drug-induced liver injury [J].Prog Pharm Sci(药学进展),2008,32(8):357-362.
[2]State Administration of Traditional Chinese Medicine 《Chinese Materia Medica》editorial.Chinese Herbal Medicine(中华本草)[M].Shanghai:Shanghai Science and Technology Press,1998:2103-2107.
[3]Tan XQ,Ruan JL,Chen HS,Wang JY.Studies on liver toxicity in Rhizoma Dioscorea Bulbifea[J]. China J Chin Mater Med(中国中药杂志),2003,28 (7):661-663.
[4]Wang JZ,Liu SM,Zhao Y,Tang Q.Experimental studies on liver cell injury induced by diterpene lactones extracted from Dioscorea bulbifer[J]. Adverse Drug Reactions J(药物不良反应杂志),2009,11(1):13-16.
[5]Wei L,Liao P,Wu H,Li X,Pei F,Li W,et al. Metabolic profiling studies on the toxicological effects of realgar in rats by1H NMR spectroscopy[J]. Toxicol Appl Pharmacol,2009,234(3):314-325.
[6]Sun C,Teng Y,Li G,Yoshioka S,Yokota J,Miyamura M,et al.Metabonomics study of the protective effects of Lonicera japonica extract onacute liver injury in dimethylnitrosamine treated rats [J].J Pharm Biomed Anal,2010,53(1):98-102.
[7]Chen Y,Duan JA,Guo J,Shang E,Tang Y,Qian Y,et al.Yuanhuapine-induced intestinal and hepatotoxicity were correlated with disturbance of amino acids,lipids,carbohydrate metabolism and gut microflora function:a rat urine metabonomic study[EB/OL].(2015-08-28)[2016-03-28]http:// www.sciencedirect.com/science/article/pii/S15700-23215301525.
[8]Sheng YH,Li FJ,Zhou Q,Jin RM.Study on the hepatotoxicity and pathological change induced by Radix et Rhizoma Sophorae Tonkinensis in mice [J].Chin J Exp Tradit Med Form(中国实验方剂学杂志),2010,16(6):144-146.
[9]Ma YB,Ji LL,Wang SC,Shi SS,Wang ZT.Protec⁃tion of Grateloupia filicina polysaccharide against hepatotoxicity induced by Dioscorea bulbifera L. [J].Acta Pharm Sin(药学学报),2013,48(8):1253-1258.
[10] Zira A,Kostidis S,Theocharis S,Sigala F,Engelsen SB,Andreadou I,et al.1H NMR-Based metabonomics approach in a rat model of acute liver injury and regeneration induced by CCl4adminis⁃ tration[J].Toxicology,2013,303:115-124.
[11]Liu SM,Cui LR,Yu DH,Jin Y,Dong WR.Protective effect of Angelica in liver ultrastructure damage induced by Dioscorea bulbifera L.[J].Liaoning J Tradit Chin Med(辽宁中医杂志),2010,37(9):1823-1824.
[12]Li YJ,Liu SM,Luo MM,Liu HF.The express and principlestudyoflivertoxicityofDioscorea bulbifera L.[J].Chin J Exp Tradit Med Form(中国实验方剂学杂志),2005,11(1):40-42.
[13]Liang Q,Ni C,Yan XZ,Xie M,Zhang YX,Zhang Q. Comparative study on metabonomics and on liver and kidney toxicity of Aristolochia fangchi and Stephania tetrandra[J].China J Chin Mater Med(中国中药杂志),2010,35(21):2882-2888.
[14]Skordi E,Yap IK,Claus SP,Martin FP,Cloarec O,Lindberg JA,et al.Analysis of time-related meta⁃bolic fluctuations induced by ethionine in the rat [J].J Proteome Res,2007,6(12):4572-4581.
[15]Waters NJ,Waterfield CJ,Farrant RD,Holmes EA. Metabonomic deconvolution of embedded toxicity:application to thioacetamide hepato-and nephro⁃toxicity[J].Chem Res Toxicol,2005,18(4):639-654.
(本文编辑:齐春会)
Metabonomic study on early biomarkers of hepatic injury induced by ethanolic extract from Rhizoma Dioscoreae Bulbiferae in rats based on1H-NMR
SHENG Yun-hua1,2,QIAO Jing-yi2,3,JIN Ruo-min2,YAO Guang-tao2,ZHOU Lu2,TANG Li-ming1
(1.Shanghai Institute for Food and Drug Control,Shanghai 201203,China;2.Drug Safety Evaluation and Research Center,Shanghai University of Traditional Chinese Medicine,Shanghai 201203,China;3.Henan University of Traditional Chinese Medicine,Zhengzhou 450016,China)
OBJECTlVE Dynamics of serum and urine metabolites in hepatic injury rats induced by ethanolic extract from Rhizoma Dioscoreae Bulbiferae(RDB)was investigated by1H-NMR-based metabo⁃nomic methods in order to discover early biomarkers of liver toxicity induced by RDB.METHODS Rats were ig adminisetred with RDB at a dose of 5 g·kg-1for 28 d.Rats were sacrificed 3,7,14 and 28 d af⁃ter RDB administration,as well as after a recovery period,respectively.Blood was taken for routine bio⁃chemical analysis by an automatic biochemical analyzer.Liver/body mass indexes were calculated,and liver pathological changes were observed with hematoxylin-eosin staining.Urine samples were collected before and 3,7,14 and 28 d after RDB administration,respectively,as well as after withdrawal.Metabo⁃nomic analysis was carried out for serum and urine samples.Principal component analysis and orthogonal partial least squares-discriminant analysis were used for screening and identifiying early biomarkers.RESULTS Compared with the control group,total bilirubin(TB)and total cholesterol(TC)values were increased in 3-28 d in RDB group(P<0.05,P<0.01).Total bile acid(TBA)was elevated in 7-28 d (P<0.05,P<0.01).TB,TC and TBA became normal after discontinuation with RDB.There was no significant difference between RBD-treated group and control group in the activity of glutamic-pyruvic transaminase and glutamic-oxaloacetic transaminase,and the content of glucose also was not different between the two groups.The ratio of liver/body mass was elevated at 3-28 d(P<0.01)but returned to normal after withdraval of RDB.The enlargement and necrosis of hepatocytes were observed 7 d after RDB administration,and lesion degree was aggravated with the extension of RDB delivery time.Meta⁃bonomic analysis showed that the serum lipids(low density lipoprotein/very low density lipoprotein (LDL/VLDL),glutamic acid,choline phosphate and glycerolphosphatecholine were increased in the early stage.Pyruvate and N-acetylglutamate were decreased in urine.These metabolites became normal 7 d after discontinuation with RDB.CONCLUSlON The serum lipids(LDL/VLDL),glutamic acid,glycerol phosphate choline,as well as urine pyruvic acid salt and N-acetyl glutamate may be used as the early biomarkers for liver toxicity induced by RDB.
Rhizoma Dioscoreae Bulbiferae;liver injury;nuclear magnetic resonance;metabo⁃nomics;biomarker
The project supported by National Key Basic Research and Development Program(973 Program)(2009CB522807);and National Science and Technology Major Project of China(2009ZX0902-002)
JIN Ruo-min,E-mail:rmj801@126.com,Tel:(021)51322401
R965
A
1000-3002-(2016)04-0306-11
国家重点基础研究发展计划(973计划)(2009CB522807);国家科技重大专项(2009ZX0902-002)
盛云华,博士研究生,从事药检药理与毒理研究;金若敏,研究员,博士生导师,从事中药新药及毒理学研究。
金若敏,E-mail:rmj801@126.com
2016-03-31接受日期:2016-04-10)

