顺铂通过抑制转移抑制基因1-细胞外信号调节激酶及丝氨酸/苏氨酸激酶激活抑制HeLa细胞增殖
张 思,刘元林,李 雪,周向东,赵 岳,张萍萍,童 英,,张 毅(.解放军医学院妇产科,北京 0085;.空军总医院妇产科,北京 00;.军事医学科学院基础医学研究所细胞生物学研究室,北京 00850;.包头市九原区医院,内蒙古包头 0060)
顺铂通过抑制转移抑制基因1-细胞外信号调节激酶及丝氨酸/苏氨酸激酶激活抑制HeLa细胞增殖
张 思1,刘元林3,李 雪3,周向东2,赵 岳4,张萍萍2,童 英1,2,张 毅3
(1.解放军医学院妇产科,北京 100853;2.空军总医院妇产科,北京 100142;3.军事医学科学院基础医学研究所细胞生物学研究室,北京 100850;4.包头市九原区医院,内蒙古包头 014060)
目的 研究顺铂(DDP)抑制HeLa细胞增殖的分子机制。方法 用顺铂0.02~75 μmol·L-1处理HeLa细胞24或48 h,CCK-8法检测细胞存活,划痕实验检测细胞迁移力,流式细胞仪检测细胞周期,实时荧光定量PCR(q-PCR)检测转移抑制基因1(MTSS1)基因的表达,Western蛋白质印迹法检测磷酸化细胞外信号调节激酶(p-ERK)、磷酸化丝氨酸/苏氨酸激酶(p-AKT)和转移抑制基因1(MTSS1)蛋白水平。结果 不同浓度DDP处理HeLa细胞24或48 h,可明显抑制HeLa细胞增殖(P<0.05),细胞的半数抑制浓度(IC50)值分别为4.14和11.82 μmol·L-1;DDP处理组HeLa细胞较对照组迁移能力下降(P<0.05);DDP使HeLa细胞周期阻滞于S期;DDP抑制HeLa细胞MTSS1的基因表达,存在明显的浓度效应关系(r24 h=-0.965,P<0.01;r48 h=-0.953,P<0.01);p-ERK,p-AKT及胞内MTSS1蛋白表达水平均随DDP浓度增加显著下降(p-ERK:r24 h=-0.875,P<0.01;r48 h=-0.966,P<0.01;p-AKT:r24 h=-0.831,P<0.01;r48 h=-0.863,P<0.01;MTSS1:r24 h=-0.969,P<0.01;r48 h=-0.988,P<0.01)。结论 DDP可能通过下调MTSS1的表达水平并抑制ERK和AKT信号通路的激活而抑制宫颈癌HeLa细胞增殖和迁移。
顺铂;HeLa细胞;细胞外信号调节激酶;丝氨酸/苏氨酸激酶;转移抑制基因1
DOl:10.3867/j.issn.1000-3002.2016.04.008
宫颈癌是女性最常见的恶性肿瘤之一,近年来其发病呈现上升及年轻化趋势[1],并且癌症的复发及转移仍是宫颈癌治疗最大难题。因此,研究宫颈癌的发病机制尤为重要。细胞外信号调节激酶(extracellular signal-regulatedkinase,ERK)是丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)家族成员之一,磷酸化ERK (p-ERK)具有介导并促进细胞增殖与分化、维持细胞形态、抑制细胞凋亡等功能,在细胞癌变及肿瘤的发生发展中发挥重要作用[2]。除MAPK家族,蛋白激酶丝氨酸/苏氨酸激酶(serine-threonine kinase,AKT)的磷酸化可阻止细胞凋亡的发生[3],这2种信号通路均为表皮生长因子(epidermal growth factor,EGF)信号通路的下游通路,都可影响肿瘤细胞产生特定的生物学效应。转移抑制基因1(metastasis suppressor 1,MTSS1)又称转移遗失基因(missing in metastasis),定位于染色体8q24.1。MTSS1可通过多途径调控肌动蛋白参与肿瘤的浸润和转移[4-8],从而在恶性肿瘤的生物学行为中发挥重要作用。有研究指出,该基因与宫颈癌的发生发展密切相关[9]。
本研究观察顺铂(cisplatin,DDP)不同浓度和作用时间对宫颈癌HeLa细胞增殖、p-ERK和p-AKT蛋白及MTSS1基因表达的影响,探讨DDP调控HeLa细胞增殖的作用机制,为临床应用提供实验依据。
1 材料与方法
1.1细胞、试剂和仪器
人宫颈癌HeLa细胞由军事医学科学院基础医学研究所细胞生物学研究室保存。DMEM培养基购自美国Gibco公司;胎牛血清,购自奥地利PAALaboratories公司;DDP购自齐鲁制药有限公司;CCK-8试剂购自日本Dojindo公司;PI试剂购于美国BD Pharmingin公司;RNA提取试剂Trizol购自美国Sigma公司;逆转录试剂盒及荧光定量PCR试剂盒均购自北京康为世纪公司;鼠源MTSS1抗体购自美国Abcam公司;兔源p-ERK,ERK,p-AKT及AKT抗体购自美国CST公司;羊抗鼠和羊抗兔二抗购自美国SANTA CRUZ公司。二氧化碳培养箱购自美国Thermo公司;Immunoskan 340型酶标仪购自英国BDSL公司;FC500 Mcl型流式细胞仪购自美国Beckman Coulter公司;Western蛋白质印迹实验相关仪器购自美国Bio-Rad公司;实时荧光定量PCR仪购自美国Applied Biosystems公司。
1.2细胞培养和药物配制
HeLa细胞培养于含10%胎牛血清的DMEM培养基(青霉素100 kU·L-1和链霉素0.1 g·L-1),置于5%CO2,37℃饱和湿度的培养箱中培养至对数生长期,然后进行相关实验。DDP用PBS配制成浓度为1 mmol·L-1的贮存液,过滤除菌,分装后4℃避光贮存,使用时用DMEM培养基稀释至所需浓度。
1.3CCK-8法检测细胞存活
0.25%胰酶消化对数生长期HeLa细胞,离心后在96孔板中配制100 μL的细胞悬液,每孔1×104细胞。将96孔板放入培养箱孵育24 h,分别加入DDP 0,0.02,0.1,0.5,2.5,12.5,25,50和75 μmol·L-1,空白对照组不加细胞和药物。继续孵育24或48 h,弃去原培养基,每孔加入新DMEM培养基100 μL和CCK-8溶液10 μL,培养箱中孵育2 h,酶标仪测定波长450 nm处吸光度值(A450nm)。计算各组24和48 h细胞增殖抑制率。细胞增殖抑制率(%)=〔(A对照孔-A空白孔)-(A加药孔-A空白孔)/(A对照孔-A空白孔)〕×100%,每个浓度设3复孔,实验重复3次。
1.4划痕实验检测细胞迁移力和侵袭力
取对数生长期HeLa细胞,消化接种6孔板,孵育24 h后,用200 μL枪头在6孔板底沿直线划痕,PBS冲洗3次,加入无血清单纯培养基,分别加入DDP 0,0.02,0.1,0.5,2.5和12.5 μmol·L-1,加药后0,24和48 h于倒置显微镜下观察细胞划痕愈合情况并拍照分析。以划痕面积为基准,24和48 h后分别量取与划痕区域相同面积,采用Image J软件检测划痕愈合前后划痕区域灰度值,计算划痕愈合率。划痕愈合率(%)=〔(0 h划痕区灰度值-24划痕区灰度值/48 h划痕区灰度值)/0 h划痕区灰度值〕× 100%。
1.5流式检测细胞周期
取对数生长期HeLa细胞,细胞生长融合度约50%,分别加入DDP 0,0.02,0.1,0.5,2.5和12.5 μmol·L-1,孵育24和48 h,然后消化离心收集细胞,258×g离心5 min,弃上清,1 mL PBS清洗,258×g离心5 min,去上清,加入500 μL PI染液(含RNA酶),室温避光染色30 min,流式细胞仪检测细胞周期,实验重复3次。
1.6q-PCR检测基因MTSS1 mRNA表达水平
DDP 0,0.02,0.1,0.5,2.5和12.5 μmol·L-1分别处理HeLa细胞24和48 h,按Trizol说明书步骤提取细胞RNA,定量后逆转录为cDNA。根据荧光定量PCR试剂说明书进行PCR扩增,MTSS1引物序列:上游引物5′-TAGTGTTTAAGAAAGCAAGCAAGTC-3′,下游引物5′-GAGGGTTCGGTCAGAAATGTG-3′;内参β肌动蛋白引物序列:上游引物5′-GCTGTCACCTTCACCGTTC-3′,下游引物5′-CCATCGTCCACCGCAAAT-3′;q-PCR反应程序:95℃10 min预热,95℃15 s,60℃1 min,共40个循环后,95℃ 15 s,60℃1 min,95℃15 s,60℃15 s绘制溶解曲线,实验所得数据使用2-ΔΔCt法进行相对定量分析。
1.7Western蛋白质印迹法检测p-ERK,p-AKT和MTSS1蛋白表达
DDP 0,0.02,0.1,0.5,2.5和12.5 μmol·L-1分别处理HeLa细胞24和48 h,收集并裂解细胞,提取总蛋白,由BCA试剂盒定量蛋白质浓度。取蛋白质样品60 μg进行SDS-PAGE,然后转移至纤维素膜上,经过含5%脱脂牛奶的TBST封闭1 h,孵育相关蛋白的一抗(设β肌动蛋白为内参),4℃摇床摇匀过夜,再与相应的辣根过氧化物酶标记二抗室温孵育1 h,TBST洗膜3次,每次5 min,ECL化学发光法进行显色,X线胶片于暗室曝光,随后显影并定影。用Quantity One软件进行积分吸光度值分析,以目的蛋白与内参蛋白积分吸光度比值表示目的蛋白的相对表达水平。
1.8统计学分析
2 结果
2.1顺铂对HeLa细胞存活的影响
CCK-8实验结果(图1)表明,DDP 0.02~75 μmol·L-1对HeLa细胞存活具有抑制作用(P<0.05),随着药物浓度的升高,其抑制细胞存活也显著增强,作用24和48 h IC50值分别为4.14和11.82 μmol·L-1。提示DDP对HeLa细胞增殖具有抑制作用,且呈浓度依赖性(r24 h=0.993,P<0.01;r48 h=0.993,P<0.01)。
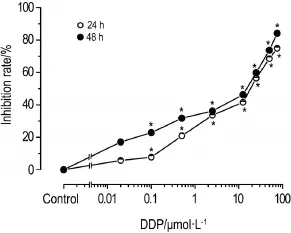
Fig.1 lnhibitory effect of cisplatin(DDP)on HeLa cell proliferation detected by CCK-8 assay.HeLa cells were treated with DDP for 24 and 48 h,respectively.±s,n=3.*P<0.05,compared with corresponding control group.

Fig.2 Effect of DDP on migration and invasion of HeLa cells.HeLa cells were treated with DDP for 24 or 48 h.±s,n=3.*P<0.05,compared with corresponding control group.

Tab.1 Effect of DDP on HeLa cell cycle
2.2顺铂对HeLa细胞迁移和侵袭能力的影响
细胞对照组48 h后划痕处有显著的细胞迁移。随着DDP浓度升高,肉眼可见漂浮死细胞逐渐增多,细胞迁移能力显著下降(P<0.05),其中DDP 12.5 μmol·L-1处理组在48 h内迁移能力最弱。提示高浓度DDP对HeLa细胞的迁移和侵袭能力有显著的抑制作用(图2)。
2.3顺铂对HeLa细胞周期的影响
由表1显示,随着DDP浓度升高和作用时间延长,HeLa细胞G0/G1期百分率逐渐降低(P<0.05),S期和G2/M期细胞百分率逐渐增加(P<0.05)。表明DDP严重干扰HeLa细胞周期,使其阻滞于S期和G2/M期。
2.4顺铂对HeLa细胞MTSS1基因表达的影响
q-PCR实验结果显示,DDP与HeLa细胞作用24和48 h,随着浓度升高,HeLa细胞MTSS1 mRNA表达逐渐减少(r24 h=-0.965,P<0.01;r48 h=-0.953,P<0.01)(图3A)。Western蛋白质印迹法结果表明,随着DDP浓度升高,MTSS1蛋白表达也随之下降(r24 h=-0.969,P<0.01;r48 h=-0.988,P<0.01)(图3B和C)。

Fig 3.Metastasis suppressor 1(MTSS1)expression in HeLa cells treated with DDP for 24 or 48 h.A:rela⁃tive quantification of MTSS1 mRNA was detected by q-PCR;B and C:expression of protein was detected by Western blotting,C was the relative expression level of MTSS1 protein showed as integrated absorption(IA)Target protein/IAβ-Actin.±s,n=3.*P<0.05,com⁃pared with corresponding control group.
2.5顺铂对HeLa细胞p-ERK及p-AKT蛋白水平的影响
Western蛋白质印迹法检测结果(图4)表明,随着DDP浓度升高,HeLa细胞中p-ERK和p-AKT蛋白水平逐渐下降,呈明显的浓度依赖性(p-ERK:r24 h=-0.875,P<0.01;r48 h=-0.966,P<0.01;p-AKT: r24 h=-0.831,P<0.01;r48 h=-0.863,P<0.01)。
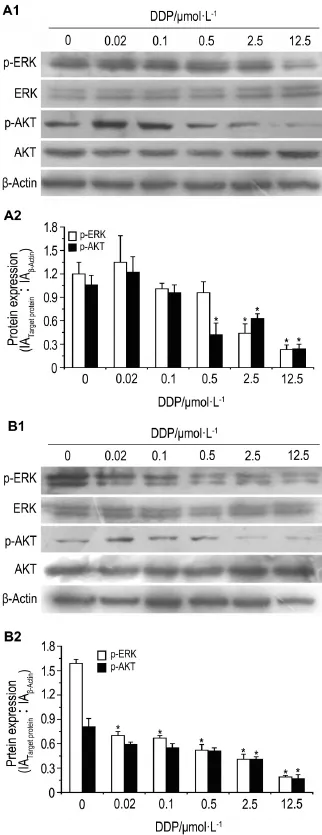
Fig.4 Phosphorylated-extracellular signal-regulated kinase(p-ERK)and phosphorylated-serine-threonine kinase(p-AKT)levels in HeLa cells treated with DDP for 24(A)or 48 h(B).A2 and B2 were the semi-quantitive results of A1 and B1,respectively.±s,n=3.*P<0.05,compared with cor⁃responding control group.
3 讨论
DDP作为临床应用极为广泛的含铂类化疗药物,是细胞周期非特异性抗肿瘤药物[10]。该药已用于多种实体肿瘤的治疗,是目前较为有效的化疗药物[11-12]。本研究利用DDP处理HeLa细胞并检测其对ERK及AKT这2种信号通路和MTSS1基因表达的影响。DDP处理HeLa细胞24或48 h,划痕实验检测细胞迁移力和侵袭力的改变。结果显示,HeLa细胞的迁移力及侵袭力随DDP浓度升高而明显减弱。CCK-8实验结果进一步证实DDP对HeLa细胞存活具有明显抑制作用。在细胞周期检测结果中,DDP 0.5~12.5 μmol·L-1作用24和48 h,HeLa细胞明显被阻滞于S期,呈浓度依赖性。可见DDP不但抑制HeLa细胞增殖,抑制细胞迁移及侵袭的能力,并能有效阻滞HeLa细胞的细胞周期。
Dawson等[13]研究发现,MTSS1通过调控表皮生长因子(epidermal growth factor,EGF)受体定位到细胞膜而调控EGF信号通路的激活,并影响细胞内p-ERK和p-AKT蛋白水平。本研究Western蛋白质印迹检测结果表明,高浓度DDP处理使HeLa细胞内p-ERK和p-AKT水平下调,并伴有MTSS1蛋白水平下调。q-PCR结果提示,DDP浓度越高,作用时间越长,MTSS1基因表达越低,与Western蛋白质印迹检测到细胞中MTSS1蛋白水平的变化相一致。据此推断,DDP通过干扰MTSS1蛋白表达,以及阻断ERK和AKT信号通路的激活,从而抑制HeLa细胞的增殖和转移过程。MTSS1表达水平与DDP浓度呈显著的负相关,提示该分子可作为临床DDP治疗效果的监测指标,此结果与Zhang等[9]利用免疫组化方法研究宫颈癌组织中MTSS1表达水平的结果相一致。MTSS1可能成为临床检测癌症发展的指标和癌症治疗效果的监测指标。
综上所述,本研究发现,DDP可能通过下调MTSS1的表达水平及抑制ERK和AKT信号通路的激活而抑制宫颈癌HeLa细胞增殖与迁移。关于MTSS1与ERK和AKT信号通路间的具体调控机制及三者在癌症发生发展及治疗过程中的详细分子机制仍需进一步探讨。
[1]Siegel R,Naishadham D,Jemal A.Cancer statis⁃tics,2013[J].CA Cancer J Clin,2013,63(1):11-30.
[2]Ramos JW.The regulation of extracellular signalregulated kinase(ERK)in mammalian cells[J]. IntJBiochem Cell Biol,2008,40(12):2707-2719.
[3]Siegfried Z,Bonomi S,Ghigna C,Karni R.Regu⁃lation of the Ras-MAPK and PI3K-mTOR signalling pathways by alternative splicing in cancer[J].Int J Cell Biol,2013:568931.
[4]Lee YG,Macoska JA,Korenchuk S,Pienta KJ. MIM,a potential metastasis suppressor gene in bladder cancer[J].Neoplasia,2002,4(4):291-294.
[5]Lee SH,Kerff F,Chereau D,Ferron F,Klug A,Dominguez R.Structural basis for the actin-binding functionofmissing-in-metastasis[J].Structure,2007,15(2):145-155.
[6]Dawson JC,Bruche S,Spence HJ,Braga VM,Machesky LM.Mtss1 promotes cell-cell junction assembly and stability through the small GTPase Rac1[J].PLoS One,2012,7(3):e31141.
[7]Yan MD,YaoCJ,ChowJM,ChangCL,Hwang PA,Chuang SE,et al.Fucoidan elevates MicroRNA-29b to regulate DNMT3B-MTSS1 axis and inhibit EMT in human hepatocellular carcinoma cells[J].Mar Drugs,2015,13(10):6099-6116.
[8]Mertz KD,Pathria G,Wagner C,Saarikangas J,Sboner A,Romanov J,et al.MTSS1 is a metastasis driver in a subset of human melanomas[J].Nat Commun,2014,5:3465.
[9]Zhang J,Tong Y,Ren L,Li CD.Expression of metastasis suppressor 1 in cervical carcinoma and the clinical significance[J].Oncol Lett,2014,8(5):2145-2149.
[10]Wang D,Lippard SJ.Cellular processing of platinum anticancer drugs[J].Nat Rev Drug Discov,2005,4(4):307-320.
[11]Choudhury A,Cuddihy A,Bristow RG.Radiation and new molecular agents.PartⅠ:targeting ATMATR checkpoints,DNA repair,and the proteasome [J].Semin Radiat Oncol,2006,16(1):51-58.
[12]Muggia F.Platinum compounds 30 years after the introduction of cisplatin:implications for the treatment of ovarian cancer[J].Gynecol Oncol,2009,112 (1):275-281.
[13]Dawson JC,Timpson P,Kalna G,Machesky LM. Mtss1 regulates epidermal growth factor signaling in head and neck squamous carcinoma cells[J]. Oncogene,2012,31(14):1781-1793.
Corresponding authors:TONG Ying,E-mail:tongying7326@sina.com;ZHANG Yi,E-mail:zhangyi5643@163.com
(本文编辑:齐春会)
Cisplatin inhibites HeLa cell proliferation by suppressing activation of metastasis suppressor gene 1-extracellular signal-regulated kinase/serine-threonine kinase
ZHANG Si1,LIU Yuan-lin3,LI Xue3,ZHOU Xiang-dong2,ZHAO Yue4,ZHANG Ping-ping2,TONG Ying1,2,ZHANG Yi3
(1.Department of Obstetrics and Gynecology,Medical School of Chinese PLA,Beijing 100853,China;2.Department of Obstetrics and Gynecology,Air Force General Hospital,Beijing 100142,China;3.Department of Cell Biology,Institute of Basic MedicalSciences,Academy of Military Medical Sciences,Beijing 100850,China;4.Baotou Jiuyuan District Hospital,Baotou 014060,China)
OBJECTlVE To study the molecular mechanism of cisplatin(DDP)by which HeLa cell growth and proliferation are inhibited.METHODS Cultured HeLa cells were treated with DDP 0.02-75 μmol·L-1for 24 or 48 h.CCK-8 assay was used to determine the cell proliferation.The wound scratch assay was used to detect the cell migration and invasion.Flow cytometry was used to detect the cell cycle arresting.q-PCR was used to test the expression of metastasis suppressor gene 1 (MTSS1)mRNA.Western blot was used to determine protein levels of MTSS1,phosphorylated-extra⁃cellular signal-regulated kinase(p-ERK)and phosphorylated-serine-threonine kinase(p-AKT).RESULTS Following the treatment with DDP for 24 or 48 h,the proliferation of HeLa cells was inhibited significantly (P<0.05),the value of the half inhibitory concentration(IC50)of cells was 4.14 and 11.82 μmol·L-1. Migration and invasion activity of HeLa cells were reduced according to the wound scratch assay(P<0.05).Flow cytometry results showed that the cell cycle was arrested at S phase.q-PCR results showed that MTSS1 mRNA expression changed with DDP in a concentration-dependent manner(r24 h=-0.965,P<0.01;r48 h=-0.953,P<0.01).Western blot showed that the protein levels of MTSS1,p-ERK and p-AKT expression declined significantly with the increase in DDP concentrations(p-ERK:r24 h=-0.875,P<0.01;r48 h=-0.966,P<0.01.p-AKT:r24 h=-0.831,P<0.01;r48 h=-0.863,P<0.01.MTSS1:r24 h=-0.969,P<0.01;r48 h=-0.988,P<0.01).CONCLUSlON DDP treatment inhibits HeLa growth and proliferation by interfering with the MTSS1 expression and disturbing the activation of ERK and AKT signaling pathways.
cisplatin;HeLa cells;extracellular signal-regulated kinase;serine-threonine kinase;metastasis suppressor gene 1
The project supported by National Natural Science Foundation of China(31070996);and Air Force General Hospital Scientific Research Fund(kz2013011)
R979.1
A
1000-3002-(2016)04-0350-06
国家自然科学基金(31070996);空军总医院科研基金课题(kz2013011)
张 思,女,硕士研究生,主要从事宫颈癌发病机制研究;童 英,女,主任医师,硕士生导师,主要从事妇科恶性肿瘤研究;张 毅,女,研究员,博士生导师,主要从事细胞生物学研究。
童 英,E-mail:tongying7326@sina.com;张 毅,E-mail:zhangyi5643@163.com
2015-11-18接受日期:2016-03-16)

