白藜芦醇诱导前列腺癌细胞系PC-3凋亡的实验研究
郭 勇,田晓丽,范琼瑛,任秋霞,吴亚坤,苏军华*
(1.河北省石家庄市第一医院泌尿外科,河北 石家庄 050011;2.河北医科大学第二医院检验科,河北 石家庄 050000;3.中国人民解放军白求恩国际和平医院脑内科,河北 石家庄 050082)
·论著·
白藜芦醇诱导前列腺癌细胞系PC-3凋亡的实验研究
郭勇1,田晓丽2,范琼瑛1,任秋霞3,吴亚坤2,苏军华2*
(1.河北省石家庄市第一医院泌尿外科,河北 石家庄 050011;2.河北医科大学第二医院检验科,河北 石家庄 050000;3.中国人民解放军白求恩国际和平医院脑内科,河北 石家庄 050082)
[摘要]目的探讨白藜芦醇诱导前列腺癌细胞系PC-3细胞凋亡的作用。方法采用MTT比色法检测白藜芦醇对前列腺癌细胞系PC-3细胞的增殖抑制情况;采用流式细胞术检测前列腺癌细胞系PC-3细胞周期阻滞、诱导凋亡情况;采用RT-PCR法检测相关凋亡基因mRNA表达的情况。结果 B、C、D组PC-3细胞均有不同程度的抑制。24、48、72 h C、D组细胞生长抑制率高于B组,D组细胞生长抑制率高于C组(P<0.05)。B、C、D组48、72 h细胞生长抑制率高于24 h,72 h细胞生长抑制率高于48 h(P<0.05)。S期、G2/M期细胞比例明显下降,G0/G1期细胞比例明显上升, 且随药物浓度的增加,凋亡率明显上升,差异有统计学意义(P<0.05)。C、D组PC-3细胞bcl-2表达水平低于A组,D组低于B组(P<0.05);B、C、D组PC-3细胞bax表达水平高于A组,C、D组高于B组,D组高于C组(P<0.05)。结论白藜芦醇具有诱导细胞凋亡、抑制细胞增殖、阻滞细胞周期等作用,能达到很好的抗肿瘤效果,值得临床上广泛应用。
[关键词]前列腺癌;白藜芦醇;PC-3;细胞凋亡
doi:10.3969/j.issn.1007-3205.2016.07.025
前列腺癌好发于老年男性,在我国发现时常为晚期,失去手术机会。由于目前没有彻底有效的治愈方法,因此研究新的治疗前列腺癌的方法显得尤为重要。白藜芦醇是从藜芦的根部分离而得,已发现在72种植物中可以获得。白藜芦醇的作用非常广泛,包括抗菌、免疫调节、抗癌、神经保护、心血管保护等多方面。在临床方面,白藜芦醇对多种恶性晚期肿瘤的治疗都有一定的效果[1-3]。本研究对白藜芦醇诱导前列腺癌细胞系PC-3凋亡的作用进行探讨,现报告如下。
1 资料与方法
1.1主要试剂与仪器 白藜芦醇(购自美国Sigma公司),前列腺癌细胞系PC-3细胞(来自河北医科大学第二医院实验室),RPMI1640培养液(Gibcobrl公司),PCR提取及扩增试剂盒(购自Takara 公司)。Biorad凝胶成像分析系统(江苏捷达公司)。
1.2方法
1.2.1细胞培养及白藜芦醇工作液配制将前列腺癌细胞系PC-3细胞接种于RPMI 1640培养基中(含10%胎牛血清和100 U/mL青霉素、100 U/mL链霉素),培养液中含300 mg/L谷氨酰胺、10%新生牛血清,5%CO2培养箱为37 ℃饱和湿度温箱。每天更换培养液,待细胞培养约85%贴壁时,2 d传1代。白藜芦醇用双蒸水100%二甲基亚砜溶解后,灭菌,离心,取上清分别配制浓度为0.2、0.5、0.8 g/L白藜芦醇工作液,置于4 ℃冰箱避光保存。
1.2.2实验分组实验分为对照组(A组)和实验组(B、C、D组)。B组为加入浓度0.2 g/L白藜芦醇后的PC-3细胞,C组为加入浓度0.5 g/L白藜芦醇后的PC-3细胞,D组为加入浓度0.8 g/L白藜芦醇后的PC-3细胞。
1.2.3MTT比色法检测白藜芦醇对前列腺癌细胞系PC-3细胞的增殖抑制情况。取对数期人前列腺癌PC-3细胞株接种120孔板,每孔100 μL。A组接种10孔在37 ℃,5%CO2培养箱内常规培养24、48、72 h;B组接种30孔,其中10孔使药物作用24 h,10孔使药物作用48 h,10孔使药物作用72 h;C组接种30孔,其中10孔使药物作用24 h,10孔使药物作用48 h,10孔使药物作用72 h;D组接种30孔,其中10孔使药物作用24 h,10孔使药物作用48 h,10孔使药物作用72 h。24、48、72 h后每孔加入MTT 50 μL,孵育4 h后去除培养液 ,再加入二甲基亚砜100 μL,振荡10 min,使絮状物完全溶解。590 nm波长酶联免疫检测仪上分别测定吸光度(optical density,OD)值,实验重复3次,取均值,并计算细胞生长抑制率=(对照组平均OD值-实验组平均OD值)/对照组平均OD值×100%。
1.2.4流式细胞术检查前列腺癌细胞系PC-3细胞周期阻滞、诱导凋亡情况。A、B、C、D 4组细胞各30孔,均采用70%冷乙醇固定,PBS液冲洗2次,过夜,之后用PBS液冲洗1次,加入RNA酶酶切、碘化丙啶染色后, 室温避光孵育15 min,采用流式细胞仪检测细胞周期,结果用细胞周期拟合软件Modfit分析,得出细胞凋亡比例及周期分布。G2/M阻滞用G2期细胞所占比率表示[4]。
1.2.5RT-PCR法检测相关凋亡基因mRNA的表达情况。经白藜芦醇作用24 h后,用胰蛋白酶适度消化、收集PC-3细胞, TRIzol法提取细胞总mRNA;NanoDrop(Thermo)联合琼脂糖凝胶电泳检测RNA的质量。随后根据PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)所提供的方法对提取出的RNA进行反转录,反转录体系为20 μL。bax:sense 5′-TTTCTGACGGCAACTTCAACTG-3′, antisense 5′-CAACCACCCTGGTCTTGGAT-3′;bcl-2:sense 5′-CGCAGAGGGGCTACGAGT-3′, antisense 5′-GTTGACGCTCTCCACACACAT-3′。反应条件:94 ℃ 2 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 45 s,30个循环后,72 ℃延伸10 min。进行RT-PCR,反应后的PCR产物于1.2%的琼脂糖凝胶中电泳,用Biorad凝胶图像采集与分析系统进行扫描分析,用Chemi-Imager5500 软件测定OD值。
1.3统计学方法应用SPSS 13.0软件包进行数据处理。计量资料比较分别采用单因素方差分析和q检验;等级资料比较采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1细胞生长抑制率比较A组无细胞生长抑制,B、C、D组PC-3细胞均有不同程度的抑制。24、48、72 h C、D组细胞生长抑制率高于B组,D组细胞生长抑制率高于C组(P<0.05)。B、C、D组48、72 h细胞生长抑制率高于24 h,72 h细胞生长抑制率高于48 h(P<0.05)。随白藜芦醇浓度增加及时间的延长,PC-3细胞生长抑制率明显升高,差异有统计学意义(P<0.05)。见表1。
表1各组细胞生长抑制率比较
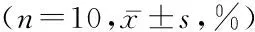
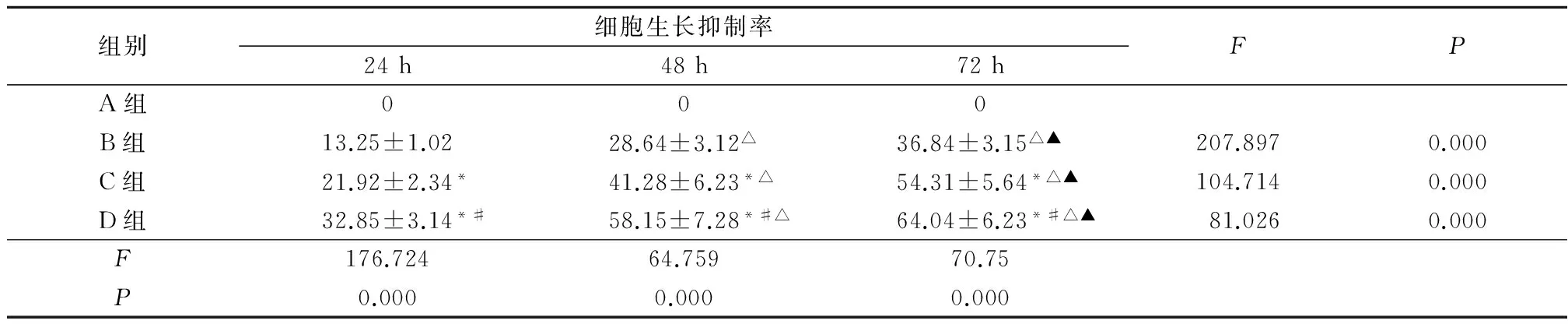
组别细胞生长抑制率24h48h72hFPA组000B组13.25±1.0228.64±3.12△36.84±3.15△▲207.8970.000C组21.92±2.34*41.28±6.23*△54.31±5.64*△▲104.7140.000D组32.85±3.14*#58.15±7.28*#△64.04±6.23*#△▲81.0260.000F176.72464.75970.75P0.0000.0000.000
*P<0.05与B组比较#P<0.05与C组比较△P<0.05与24 h比较▲P<0.05与48 h比较(q检验)
2.2细胞周期分布及诱导凋亡情况比较S期、G2/M期PC-3细胞比例明显下降,G0/G1期细胞比例明显上升;随药物浓度的增加,凋亡率明显上升,差异有统计学意义(P<0.05)。见表2 。

表2 各组细胞周期分布及诱导凋亡情况比较 (n=30,例数,%)
*P<0.05与A组比较(秩和检验)
2.3凋亡相关基因表达比较4组bcl-2和bax差异有统计学意义(P<0.05)。C、D组PC-3细胞bcl-2表达水平低于A组,D组低于B组;B、C、D组的PC-3细胞bax表达水平高于A组,C、D组高于B组,D组高于C组,差异有统计学意义(P<0.05)。见表3。
表3各组PC-3细胞bcl-2、bax蛋白表达水平比较
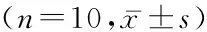
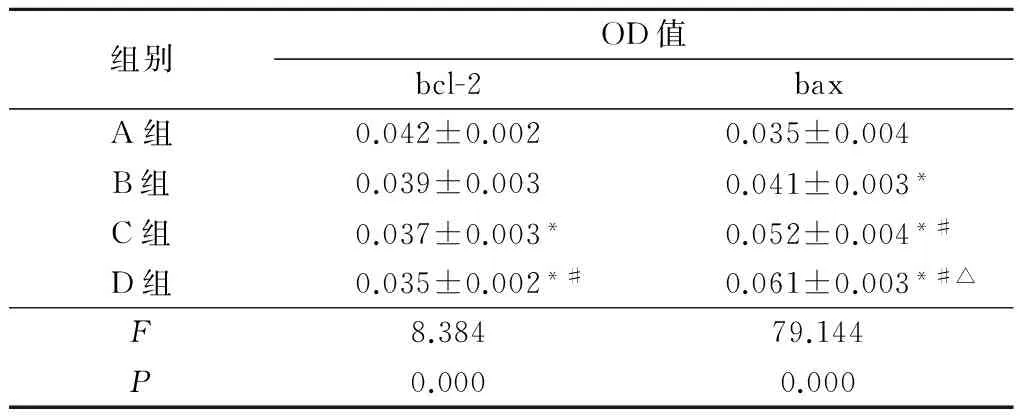
组别OD值bcl-2baxA组0.042±0.0020.035±0.004B组0.039±0.0030.041±0.003*C组0.037±0.003*0.052±0.004*#D组0.035±0.002*#0.061±0.003*#△F8.38479.144P0.0000.000
*P<0.05与A组比较#P<0.05与B组比较△P<0.05与C组比较(q检验)
3 讨 论
前列腺癌是中老年男性发病率较高的肿瘤之一,是引起美国男性死亡的第二大癌症,而在我国前列腺癌发病率也在迅速增加[5-6]。由于前列腺癌的发病机制极其复杂,目前并无有效的药物能够根治。有研究证实,黄酮和多酚类化合物能够很好地预防、治疗前列腺癌[7]。
白藜芦醇属于多酚类化合物,具有广泛的生物学作用,如抗肿瘤、抑制血小板聚集、免疫调节作用、调节肿瘤相关酶、抗炎、心血管保护等[8]。此外,白藜芦醇还具有抗肝纤维化、治疗休克、抗衰老、抗氧化、减肥、美容等多种功效。临床大量研究均表明,在治疗如肝癌[9]、卵巢癌[10]、乳腺癌[11]、肺癌[12]等多种晚期恶性肿瘤患者时,应用化疗药物联合白藜芦醇临床疗效显著。针对胃肠道等消化系统恶性肿瘤,白藜芦醇能抑制肿瘤增殖,可综合性多靶位地调节肿瘤细胞的各个层次的分子,起到调节平衡的作用[13-14]。还能抑制转移性前列腺癌细胞PC-3M-IE8增殖和减弱肿瘤侵袭能力。本研究结果显示,在前列腺癌系PC-3细胞中,加入0.8 g/L的白藜芦醇作用72 h后,PC-3细胞生长抑制率能达到(64.04±6.23)%。充分证实了白藜芦醇抑制细胞增殖的作用。
细胞凋亡是在多种基因调控下,细胞启动预定的凋亡程序,发生生理死亡的过程,又称程序性死亡,在细胞衰老、肿瘤的发生中起重要作用[15]。而诱导肿瘤细胞凋亡是抗癌药物的重要机制,也是治疗肿瘤的重要途径之一。细胞周期阻滞能抑制肿瘤细胞增殖且会诱导肿瘤细胞凋亡[16],细胞G2/M期受到阻滞能阻止DNA受损伤的细胞进入有丝分裂,因此细胞G2/M期的阻滞是药物抗肿瘤机制的重要靶点。白藜芦醇能诱导前列腺癌细胞的凋亡,一定程度上能抑制肿瘤增殖,减慢肿瘤进展、转移。本研究结果显示,未加入白藜芦醇的PC-3细胞,G2/M期细胞比例为26.67%,加入0.8 g/L白藜芦醇的PC-3细胞,G2/M期细胞比例为6.67%,表明白藜芦醇具有显著的增殖抑制作用和抑制集落生长作用,能够抑制增殖和细胞周期阻滞;采用流式细胞术检测白藜芦醇诱导前列腺癌PC-3细胞是否进入G2/M阻滞,加入不同浓度白藜芦醇作用24 h后,S期、M期比例明显下降,G0/G1期细胞比例明显上升,表明白藜芦醇能降低DNA的合成,抑制肿瘤细胞增殖。
bax和bcl-2是bcl2家族中重要的调控凋亡的基因,细胞凋亡或增殖是由二者的相互作用决定的,其中bax促进细胞凋亡,bcl-2抑制细胞凋亡[17]。bax主要分布在细胞基质中,通过促进PT孔通道开放,使色素细胞C从线粒体释放入细胞质,从而激活caspase级联反应诱导细胞凋亡。bcl-2属于膜结合蛋白定位于线粒体的外膜中,一般以同源二聚体的形式存在,可以抑制细胞凋亡。本研究结果显示,白藜芦醇可以抑制基因(bax、bc1-2)的表达,而且随着浓度增加,抑制作用增强。表明白藜芦醇主要是使凋亡促进基因bax上调,同时使凋亡抑制基因bcl-2下调,进而使bcl-2/bax比值下降,最终达到诱导细胞凋亡的目的。
综上所述,白藜芦醇具有诱导前列腺癌细胞系PC-3细胞凋亡、阻滞细胞周期、抑制PC-3细胞基因的表达增殖等作用,高浓度的白藜芦醇的抑制作用更强,能达到很好的抗肿瘤作用,可能是抗前列腺癌的机制之一。白藜芦醇在人前列腺癌治疗中具有广阔的应用前景。
[参考文献]
[1]Novelle MG,Wahl D,Diéguez C,et al. Resveratrol supplementation,where are we now and where should we go[J]. Ageing Res Rev,2015,21:1-15.
[2]Singh CK,Ndiaye MA,Ahmad N. Resveratrol and cancer:Challenges for clinical translation[J]. Biochim Biophys Acta,2014,1852(6):1178-1185.
[3]Gu Y,Chen X,Shang C,et al. Fusarochromanone induces G1 cell cycle arrest and apoptosis in COS7 and HEK293 cells[J]. PLoS One,2014,9(11):e112641.
[4]李永军,李巍伟,王鑫,等.白藜芦醇对葡萄球菌抗菌活性研究[J].中国实验诊断学,2008,12(1):58-60.
[5]江涛,胡华刚,徐斯凡.SATB1与前列腺癌的研究进展[J].中国医药导报,2014,11(16):159-161.
[6]王启林,李瑞乾,金从国,等.蛋白磷酸酶2A的癌性抑制因子在前列腺癌中的表达及意义[J].中国医药导报,2014,11(9):45-47.
[7]Spatafora C,Tringali C. Natural-derived polyphenols as potential anticancer agents[J]. Anticancer Agents Mgents Med Chem,2012,12(8):902-918.
[8]胡凌云,王海钠,裴俊俊,等.白藜芦醇防癌抗癌作用及其分子机制研究进展[J].山东医药,2010,50(5):111-112.
[9]Sun J,Zhang C,Bao YL,et al. Parthenolide-induced apoptosis, autophagy and suppression of roliferation in HepG2 cells[J]. Asian Pac J Cancer Prev,2014,15(12):4897-4902.
[10]Kwak SW,Park ES,Lee CS. Parthenolide induces apoptosis by activafing the mitochondrial and death receptor pathways and inhibits FAK-mediated cell invasion[J]. Mol Cell Biochem,2014,385(1/2):133-144.
[11]徐杰,许晓群,邹志孟,等.白藜芦醇对不同乳腺癌细胞增殖的抑制作用[J].国际肿瘤学杂志,2013,40(3):232-235.
[12]何萍,张敏,袁芳,等.肺癌患者肿瘤异常蛋白的检测意义[J].河北医科大学学报,2012,33(10):1225-1226.
[13]王伟,李覃,陈虹,等.白藜芦醇调节STAT3抗急性髓性白血病作用的研究[J].中国药理学通报,2010,26(3):346-352.
[14]陈洋,李岩,刘新莉,等.TRAIL联合白藜芦醇对乳腺癌MDA-MB-231细胞凋亡影响的研究[J].中华肿瘤防治杂志,2011,18(1):14-17,39.
[15]顾万,赵新阁,张幸.芒柄花黄素通过调节Bax和Bcl-2蛋白表达诱导SKOV3细胞凋亡[J].四川生理科学杂志,2014,36(2):60-62.
[16]Weng H,Tan ZJ,Hu YP,et al. Ursolic acid induces cellcycle arrest and apoptosis of gallbladder carcinoma cells[J]. Cancer Cell Int,2014,14(1):96.
[17]Correia S,Alves MR,Cavaco JE,et al. Estrogenic regulation of testicular expression of stem cell factor and c-kit:implications in germ cell survival and male fertility[J]. Fertil Steril,2014,102(1):299-306.
(本文编辑:赵丽洁)
[收稿日期]2016-02-24;[修回日期]2016-07-04
[作者简介]郭勇(1976-),男,河北石家庄人,河北省石家庄市第一医院副主任医师,医学学士,从事泌尿外科疾病诊治研究。 *通讯作者:E-mail:1120237924@qq.com
[中图分类号]R737.25
[文献标志码]B
[文章编号]1007-3205(2016)07-0838-04

