相反转法制备聚乳酸载青藤碱微胶囊及其性能表征
张华,张凤,张雯,张喜悦(1.天津工业大学 天津市先进纤维与储能技术重点实验室,天津 300387;2.天津工业大学 材料科学与工程学院,天津 300387)
相反转法制备聚乳酸载青藤碱微胶囊及其性能表征
张华1,2,张凤1,2,张雯1,2,张喜悦1,2
(1.天津工业大学 天津市先进纤维与储能技术重点实验室,天津 300387;2.天津工业大学 材料科学与工程学院,天津 300387)
采用相反转法,以二氯甲烷为溶剂,以Span 80、Tween 80为复合乳化剂,以明胶为稳定剂,成功制备了聚乳酸载青藤碱微胶囊,并利用扫描电子显微镜、傅里叶变换红外光谱仪、粒度分析仪等对微胶囊进行了表征;对微胶囊的载药量、包封率、缓释性能及靶向吸收功效进行了测定.结果表明:制备的微胶囊表面光滑,粒径随着乳化剂比例的增大而减小,载药量及包封率在乳化剂比例为5%的条件下达到了最大值,分别为8.9% 和89.2%,且具有缓释功效和肠道靶向吸收功能.
相反转法;微胶囊;青藤碱;聚乳酸;缓释
青藤碱(sinomenine)是从中药防己科植物青风藤中提取的一种生物碱单体,具有镇痛镇静、镇咳局麻、降血压、抗炎等药理作用,临床上主要用于对类风湿性关节炎等各种风湿病以及心律失常的治疗[1].但其半衰期短,对光热不稳定,易分解,且对胃粘膜具有刺激性[2-4],微胶囊化技术可以有效地克服以上缺陷.
聚乳酸以其优良的生物相容性、生物降解性及低免疫原性、低毒性和较好的机械强度[5-7]成为药物微胶囊壁材首选.以其为壁材、青藤碱为芯材制备的微胶囊,能有效地克服青藤碱的光热不稳定性及刺激性,并且具备低毒、缓释的功效.
传统制备微胶囊的方法多为高能乳化法,为得到较小粒径的胶囊,需要对体系输入较高的机械能,或是增加乳化剂的比例来减少界面的拉普拉斯压力[8],这种方法需要很高的剪切速率,过多的乳化剂会造成乳液体系粘度过大,具有一定的缺陷.相反转法作为一种低能乳化法[9-12],在相对较低的乳化剂比例及剪切速率下,能够得到分散性较好、粒径较均一的乳液.在相反转法制备水包油的乳液过程中,随着水相的滴加出现双连续相,在该处体系的表面张力最小,容易形成粒径相对较小的乳滴,从而得到较小粒径的微胶囊.利用相反转法制备聚乳酸载药胶囊的研究鲜有报道.
本文利用相反转法,以聚乳酸为壁材、青藤碱为芯材,以Span 80、Tween 80为复合乳化剂,以二氯甲烷为溶剂制备聚乳酸载青藤碱微胶囊,并进一步对其药物释放性能进行研究.
1 实验部分
1.1试剂与仪器
试剂:聚乳酸,外消旋,分子质量为20 ku,济南岱罡生物工程有限公司产品;盐酸青藤碱,质量分数为98.00%,西安飞达生物技术有限公司产品;氯甲烷,分析纯,天津市光复精细化工研究所产品;Span 80、Tween 80、明胶,化学纯,天津市光复精细化工研究所产品;胃蛋白酶、脂肪酶、胰蛋白酶,北京索莱宝科技有限公司产品.
仪器:HitachiS-4800型扫描电子显微镜(SEM),日本日立公司产品;UECIOR-22型傅里叶变换红外光谱仪,德国布鲁克公司产品,波长范围为500~4 000 cm-1;LA-300型粒度分析仪,日本掘扬公司产品;TU-1901型双光束紫外可见分光光度计,北京普析通用仪器有限责任公司产品.
1.2青藤碱的提纯
称取1 g盐酸青藤碱溶于200 mL水中,向该水溶液中缓慢滴加0.1 mol/L的氨水,待沉淀不再产生后,过滤得到沉淀下来的青藤碱,加20 mL二氯甲烷溶解,加水反复萃取洗涤至上层水清液为中性,取下层二氯甲烷青藤碱溶液,蒸发掉二氯甲烷,得到纯化后的青藤碱.
1.3微胶囊的制备
准确称取1.0 g聚乳酸、0.1 g青藤碱溶于20 mL二氯甲烷,于三口烧瓶中搅拌至完全溶解后,加入1 mL Span 80,继续搅拌,得到均一的油相.称取2 g明胶溶于100 mL蒸馏水,加入5 mL Tween 80,搅拌至溶解完全,得到水相,备用.
将水相于恒压滴液漏斗中以0.5 mL/min的速率滴加到油相中.室温下搅拌蒸发掉有机溶剂二氯甲烷,离心,干燥,得到聚乳酸载青藤碱微胶囊.
1.4载药量和包封率的测定
1.4.1青藤碱标准溶液线性回归方程的建立
精确称取一系列不同质量的青藤碱溶于1 mL二氯甲烷,与49 mL无水乙醇混合,得到不同浓度的青藤碱标准溶液.按照中国药典[13],在265 nm波长处对标准浓度样品液中青藤碱的含量进行测定.以青藤碱浓度C对吸光度值进行线性回归,在青藤碱质量浓度为10~100 μg/mL范围内,所得线性回归方程为:
A=0.016 89 C-0.006 36,相关系数r=0.998.
1.4.2包封率与载药量的测定
精确称取载药微胶囊10 mg,溶于1 mL二氯甲烷,与49 mL无水乙醇混合.取上清液在265 nm波长处进行吸光度值的测定,将吸光度值代入1.4.1中青藤碱标准溶液线性回归方程,计算出载药微胶囊中药物青藤碱的总含量,根据公式(1)和公式(2)分别计算载药量和包封率.
载药量=(微胶囊中青藤碱的总量/微球总量)×100%(1)
包封率=(微球中青藤碱的总量/投药量)×100%(2)
1.5体外模拟人体胃、肠液药物释放实验
1.5.1标准溶液方程的建立
体外模拟胃液的制备:将3.1 g NaCl、1.1 g KCl、0.15 g CaCl·2H2O、0.6 g NaHCO3溶于1 L去离子水,用0.1 mol/L的HCl调至pH=1.5,加入250 mg胃脂肪酶、236 mg胃蛋白酶、1 mol/L的醋酸钠溶液10 mL,溶解后用0.1 mol/L的HCl调至pH=1.5,于4℃下保存备用[14].
体外模拟肠液的制备:将5.4 g NaCl、0.65 g KCl、0.33 g CaCl·2H2O溶于1 L去离子水,用0.1 mol/L的NaOH调至pH为6.8,加入130 mg胰蛋白酶,溶解后用0.1 mol/L的NaOH调至pH为6.8,于4℃下保存备用[14].
按1.4.1中方法,以青藤碱浓度C对吸光度值进行线性回归,在青藤碱质量浓度为10~100 μg/mL时,模拟胃液中的线性回归方程为:A=0.01536C+0.001789,相关系数r=0.997;模拟肠液中的线性回归方程为:A=0.015 18C-0.010 09,相关系数r=0.999.
1.5.2体外模拟人体胃、肠液药物释放
(1)精确称取2份载药微胶囊各200 mg,分别放入透析袋中.
(2)将透析袋分别置于100 mL模拟胃、肠液中,37℃摇床上进行药物释放实验,分别在0.5 h、1 h、2 h、3 h、4 h、6 h、8 h、10 h、12 h、24 h、48 h、72 h、96 h时移取4 mL溶液于4℃下保存,每次取完后分别各补加4 mL新鲜的模拟胃、肠液.
(3)将各个时间段移取的溶液在265 nm波长下分别测其相应的吸光度值,根据1.5.1中的两线性回归方程分别计算出相应的青藤碱含量,计算累积释放量,并做药物释放曲线.
2 结果与讨论
2.1微胶囊的表面形貌分析
图1为乳化剂质量分数分别为3%、4%、5%、6%、7%条件下制备的微胶囊扫描电镜照片.从图1中可以看出,微胶囊表面相对光滑,未出现破裂现象,这说明微胶囊化效率较高,完整的壳层对芯材具有较好的保护作用[15],有效地避免了青藤碱与外界环境的接触,提高了其稳定性;微胶囊表面未出现粘连现象,分散性较好,粒径相对较均一,且随着乳化剂比例的增加,微胶囊粒径更趋变于小且均一,这说明乳化剂对微胶囊的表面形态及粒径具有重要作用.

图1 制备的载药微胶囊的扫描电镜照片Fig.1 SEM of microcapsules with different proportions of emulsifier
2.2微胶囊的红外谱图(FT-IR)分析
图2为聚乳酸、青藤碱、聚乳酸载青藤碱微胶囊的红外吸收谱图.由图2可见,波数3 414 cm-1处是芯材青藤碱中酚羟基的伸缩振动吸收峰,1 755 cm-1处是壁材聚乳酸中羰基的伸缩振动峰,1 637 cm-1处是青藤碱中苯环的吸收峰,1 401 cm-1处是青藤碱中氰基的吸收峰,1 181 cm-1处是聚乳酸中醚键的对称伸缩振动峰.从以上数据分析可以看出,芯材药物青藤碱已被成功包覆于壁材聚乳酸内.
2.3乳化剂比例对微胶囊粒径分布的影响

图2 聚乳酸、青藤碱、聚乳酸载青藤碱微胶囊的红外吸收谱图Fig.2 FT-IR spectra of microcapsules of PLA,sinomenine,PLA micocapsules loaded with sinomenine
图3所示为乳化剂质量分数为3%、4%、5%、6%、 7%时对应的微胶囊粒径分布图.由图3可见,对应的微胶囊粒径分别大约为13 μm、9 μm、9 μm、7 μm、5 μm,从以上数据可以看出微胶囊的粒径总体上随着乳化剂比例的增大而减小.乳化剂比例为4%、5%时,两者粒径均在9 μm左右,但是乳化剂比例为5%条件下的微胶囊粒径分布明显比4%时窄,且峰值处粒径所占的比例也明显高.当乳化剂比例为7%时,粒径分布最窄,峰值处粒径所占比例最大.这说明在一定乳化剂比例范围内,乳化剂比例的增大有助于形成更小粒径的微胶囊.
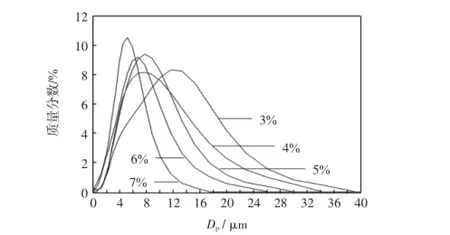
图3 不同乳化剂比例条件下微胶囊的粒径分布图Fig.3 Particle size distribution of microcapsules with different proportions of emulsifier
2.4乳化剂比例对载药量和包封率的影响
不同乳化剂比例对微胶囊载药量和包封率的影响如表1所示.
从表1中可以看出,当乳化剂质量分数从3%增加到5%时,微胶囊的载药量和包封率呈现逐步增大的趋势,载药量从6.8%逐渐增大到了8.9%,包封率从67.5%增加到了89.2%;当乳化剂质量分数为6%和7%时,载药量和包封率有所减小,载药量分别为8.7%、7.5%,包封率分别为86.7%、74.5%,造成这种现象的原因可能是随着乳化剂含量的增大,所得到的乳液体系粘度上升,芯材分子不易扩散,部分青藤碱不能被包裹,造成了载药量和包封率的下降,这说明乳化剂含量不能无限制的增大,过多的乳化剂反而对微胶囊的载药量和包封率有负面影响.
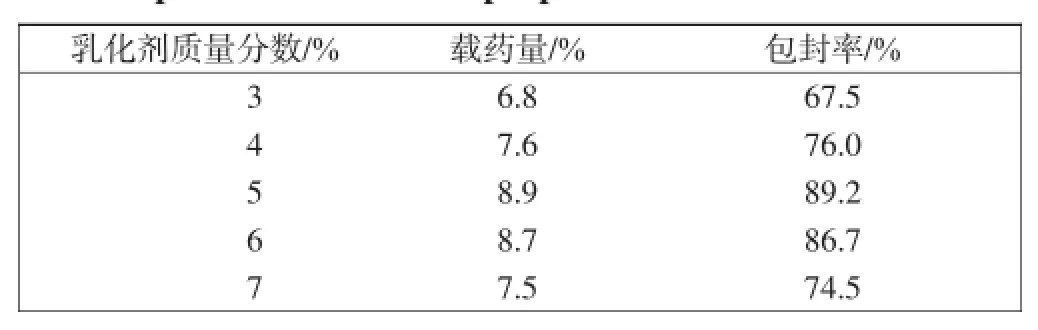
表1 不同乳化剂比例对微胶囊载药量和包封率的影响Tab.1 Drug content and encapsulation efficiency of microcapsules with different proportions of emulsifier
2.5体外模拟人体胃肠液药物释放
图4为载药微胶囊在体外模拟人体肠液、胃液药物释放曲线.图4中:A曲线是载药微胶囊在模拟肠液中的药物释放曲线;B曲线是载药微胶囊在模拟胃液中的药物释放曲线.
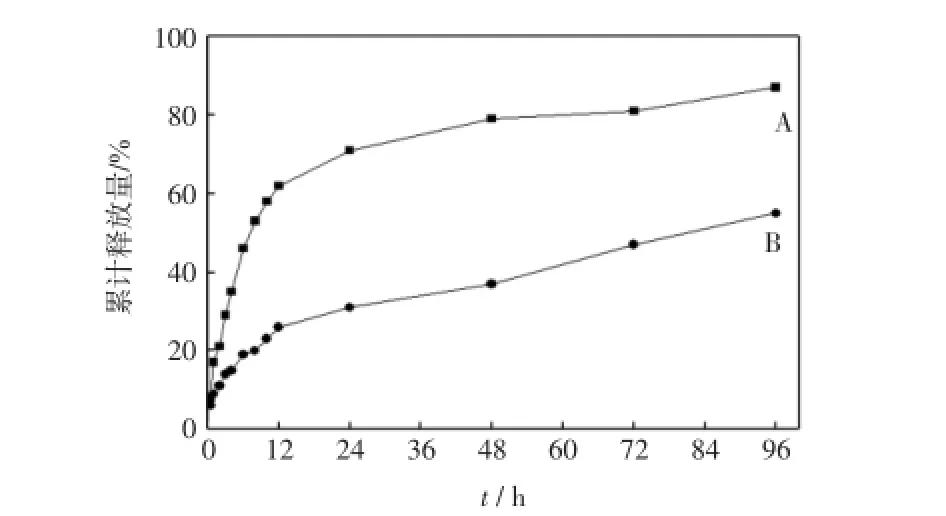
图4 载药微胶囊在体外模拟人体肠液、胃液药物释放曲线Fig.4 Drug release characteristics of drug-loaded microcapsules
由图4可见,在药物释放0.5 h时,载药微胶囊在2种模拟体液中的药物释放量没有太大的差异,均在7%左右,这应该是微胶囊表面药物的释放.释放1 h时模拟肠液环境中的药物释放达到了17%左右,释放3 h时达到了30%左右,该时间段内产生了药物突释现象,释放的药物来源于微胶囊表面和浅层结构的青藤碱[1];而在模拟胃液中,释放3 h时仅达到了13%左右.此后随着时间的延长,在释放12 h时,模拟肠液中的药物释放达到了60%左右,模拟胃液中的药物释放仅为20%左右.释放12 h后,曲线上升趋于平缓,微胶囊进入了药物缓释阶段.当药物释放到96 h时,模拟肠液中的释放量达到了85%左右,而在胃液中的药物释放量仅为50%左右.从以上数据可以推断,制备的微胶囊具有缓释功效,并且微胶囊内部药物在pH= 1.5的模拟胃液环境中不易释放,而在pH=6.8的模拟肠液中可以有效地释放,说明聚乳酸载青藤碱微胶囊具有肠道靶向吸收的功效,减少了青藤碱对胃粘膜的刺激,在制备口服药物制剂方面具有良好的前景.
3 结论
采用相反转法,在Span 80和Tween 80作为复合乳化剂、二氯甲烷为溶剂、明胶为稳定剂条件下,成功制备了聚乳酸载青藤碱微胶囊.微胶囊表面光滑,几乎没有团聚现象,粒径相对均一,且粒径随着乳化剂的增多而减少;载药量和包封率相对较高,当乳化剂质量分数为5%时达到了最大,分别为8.9%和89.2%;制备的微胶囊具有缓释功效,可以有效地控制药物的释放速度,并且在模拟人体胃、肠液的环境下,在模拟胃液条件下的释放量要明显小于在模拟肠液条件下的释放量,这说明聚乳酸载青藤碱微胶囊有pH敏感性,具有肠道靶向吸收的功效,能够有效地减少内部青藤碱释放对人体胃粘膜的刺激,在口服药制剂方面具有良好的前景.
[1]张雯,张兴祥.可生物降解聚乳酸载青风藤总碱微球的制备工艺[J].高分子材料科学与工程,2011,27(5):174-176.
ZHANG W,ZHANG X X.Optimization of preparation technology of biodegradable PLA(polylactic acid)containing chinese medicine herbs[J].Polymer Materials Science&Engineering,2011,27(5):174-176(in Chinese).
[2]黎炼,罗志刚.青藤碱的免疫抑制作用机制的研究进展[J].中南医学科学杂志,2015,43(1):86-89.
LI L,LUO Z G.Research progress in immunosuppression mechanism of sinomenine[J].Medical Science Journal of Central South China,2015,43(1):86-89(in Chinese).
[3]孙霞,于晓佳,邱明丰,等.青风藤药理与临床研究进展[J].中国中西医结合外科杂志,2005,11(4):363-364.
SUN X,YU X J,QIU M F,et al.Pharmacological and clinical research of caulis sinomenii[J].Chinese Journal of Surgery of Integrated Traditional and Western Medicine,2005,11(4):363-364(in Chinese).
[4]李乐,张彩玲,宋必卫.青藤碱的药理研究与临床应用[J].中药新药与临床药理,2006,17(4):310-313.
LI L,ZHANG C L,SONG B W.Pharmacological research and clinical application of sinomenine[J].Traditional Chinese Drug Research&Clinical Pharmacology,2006,17(4):310-313(in Chinese).
[5]郭生伟,赵越.聚合物微胶囊的研究进展[J].高分子材料科学与工程,2010,26(12):152-155.
GUO S W,ZHAO Y.Research progress of polymer microcapsules[J].Polymer Materials Science&Engineering,2010,26 (12):152-155(in Chinese).
[6]BRIGGER I,DUBERNET C,COUVREUR P.Nanoparticles in cancer therapy anddiagnosis[J].Adadvanced Drug Delivery Reviews,2002,54(5):631-651.
[7]GILLPS,ESPINABM,MUGGIAF,etal.PhaseI/IIclinical and pharmacokinetic evaluation ofliposomal danuorubicin[J].Journal of Clinical Oncology,1995,13(4):996-1003.
[8]FERNANDEZ Patrick,ANDR′E Val′erie,RIEGER Jens,et al.Nano-emulsion formation by emulsion phase inversion[J].J ColloidsandSurfacesA:PhysicochemEng,2004,251:53-58.
[9]LIU W R,SUN D J,LI C F,et al.Formation and stability of par-affin oil-in-water nano-emulsions prepared by the emulsion inversion point method[J].Colloid Interface Sci,2006,303(2):557-563.
[10]LI C F,MEI Z,LIU Q,et al.Formation and properties of paraff in wax submicronemulsions prepared by the emulsion inversion point method[J].Colloid Surf A,2010,356(1/2/3):71-77.
[11]MEI Z,XU J,SUN D J.O/W nano-emulsions with tunable PIT induced by inorganic salts[J].Colloids Surf A,2011,375 (1/2/3):102-108.
[12]JOHANNA G A,VERONIQUE S,LIONEL C,et al.Viscous oil emulsification by catastrophic phase inversion:Influence of oilviscosityandprocessconditions[J].IndEngChemRes,2011,50(9):5575-5583.
[13]国家药典委员会.ISBN978-7-5067-4439-3中国药典二部[S].北京:中国医药科技出版社,2010.
State Pharmacopoeia Commission.Chinese Pharmacopoeia(Ⅱ)[S].Beijing:Chinese Medicine Pharmaceutical Technology Publisher,2010(in Chinese).
[14]HU Jie-lun,NIE Shao-ping,MIN Fang-fang,et al.Artificial simulated saliva,gastric and intestinal digestion of polysaccharide from the seeds of plantagoasiatica L[J].Carbohydrate Polymers,2013,92:1143-1150.
[15]马云标,周惠明,朱科学.VE微胶囊的制备及性质研究[J].食品科学,2010(2):1-5.
MA Y B,ZHOU H M,ZHU K X.Preparation and properties of microencapsulated vitamin E[J].Food Science,2010(2):1-5(in Chinese).
Fabrication and characterization of PLA microcapsules loaded with sinomenine prepared by phase inversion method
ZHANG Hua1,2,ZHANG Feng1,2,ZHANG Wen1,2,ZHANG Xi-yue1,2
(1.Tianjin Municipal Key Laboratory of Advanced Fiber and Energy Storage,Tianjin Polytechnic University,Tianjin 300387,China;2.School of Materials Science and Engineering,Tianjin Polytechnic University,Tianjin 300387,China)
The PLA microcapsules loaded with sinomenine were successfully prepared by phase inversion method using methylene chloride as solvent,Span 80 and Tween 80 as emulsifier,gelatin as stabilizer.The properties of the microcapsules were characterized by scanning electron microscope,Fourier transform infrared spectrometer and particle size analyzer.Drug loading,encapsulation efficiency as well as drug release properties and targeted absorption effect were also determined.The results show that the microcapsules have smooth surface and the particle size is reduced with the increase of the emulsifier ratio.Drug loading and encapsulation efficiency reach the maximum when the emulsifier ratio is at 5%,and the maximum are 8.9%and 89.2%,respectively.Also,the microcapsules have obviously sustained efficacy and targeting intestinal absorption features.
phase inversion method;microcapsules;sinomenine;polylacetic acid;sustained release
TS102.6
A
1671-024X(2016)03-0006-04
10.3969/j.issn.1671-024x.2016.03.002
2016-01-07
国家自然科学基金资助项目(51573135、51203113);天津市高等学校科技发展基金计划项目(20140305);国家级大学生创新创业训练计划项目(201410058012)
张华(1961—),女,博士,教授,主要研究方向为生物医学材料.E-mail:hua1210@126.com

