纳米氧化石墨烯控释载药体系研究现状
钱文昊, 苏俭生
1.上海市牙组织修复与再生工程技术研究中心,同济大学口腔医学院口腔修复学教研室,上海 200072 2.上海市徐汇区牙病防治所,上海 200032
·综述·
纳米氧化石墨烯控释载药体系研究现状
钱文昊1,2, 苏俭生1*
1.上海市牙组织修复与再生工程技术研究中心,同济大学口腔医学院口腔修复学教研室,上海200072 2.上海市徐汇区牙病防治所,上海200032
[摘要]纳米氧化石墨烯(NGO)具有生物相容性好、抗菌、促进干细胞成骨分化等特性,有望作为一种新型的涂层材料应用于疾病预防和治疗,因此是目前研究的热点之一。本文综述了近年来NGO用于载药及其生物安全性方面的研究进展。
[关键词]纳米氧化石墨烯;涂层;载药
石墨烯(graphene)于2004年由英国曼彻斯特大学Geim和Novoselov研究小组发现。石墨烯是由碳原子以sp2杂化连接的单层,厚度仅0.35 nm,是世界上最薄的新型二维纳米材料。石墨烯优异的电学、力学和热学性质使其成为复合材料、传感器、能源等领域研究的热点[1]。纳米氧化石墨烯(nano-graphene oxide,NGO)具有大的比表面积,并且其2个基面都可用来负载药物,可以与芳香环类药物通过较强的物理吸附作用非共价结合。NGO能运输多种水溶性较差的药物,对大部分难溶性药物的转运具有重要意义。NGO具有生物相容性好、抗菌、促进干细胞成骨分化等特性,是目前研究的热点之一。本文综述了近年来NGO在载药及其生物安全性方面的最新研究进展。
1NGO的肿瘤靶向药物传递潜能及抗菌效能研究
NGO通过化学方法氧化天然石墨而得到,结构与石墨烯基本相同,仅在由碳原子构成的二维空间无限延伸的平面上连有-OH、-COOH、-O-、C=O等含氧官能团。这些功能性基团赋予氧化石墨烯(graphene oxide,GO)分散性、亲水性等特性,同时有利于化学功能化修饰接枝不同的化合物(或共价负载药物),在生物医学领域表现出很大的应用潜力[2]。NGO具有较强的增强滞留与渗透(enhanced permeability and retention,EPR)效应和肿瘤被动靶向性[3]。sp2杂化碳原子使NGO具有高比表面积和大π共轭结构,其两面都可通过共价、非共价作用与药物结合,因此药物负荷量较高。此外,NGO制备简便、成本低[4]。总之,NGO具有多重优势,是肿瘤靶向药物传递潜在的理想纳米载体材料。
目前,GO作为纳米药物传输载体的研究[5-15]已经很多。Yun等[16]通过改变连接碳链的长度,合成一系列不同的银纳米粒子修饰石墨烯的复合材料(GO-Cx-Ag,HS-(CH2)x-SH﹦Cx,x﹦0、2、4),见图1。该研究中,透射电镜(transmission electron microscopy,TEM)和X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)显示,GO-C2-Ag中银纳米粒子粒径最小且能均匀负载在石墨烯片层表面上;抗菌试验表明,对鼠伤寒沙门菌(Salmonellatyphimurium)、铜绿假单胞菌(Pseudomonasaeruginosa)及金黄色葡萄球菌(Staphylococcusaureus),GO-C2-Ag比GO-C0-Ag和GO-C4-Ag表现出更强的抗菌性能。
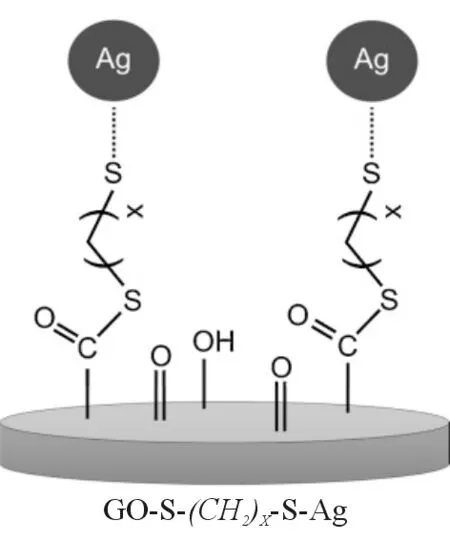
图1 GO-CX-Ag合成示意图(x﹦0、2、4)
Li等[17]设计了1种用胍基聚合物(polyhexa-
methylene guanidine hydrochloride,PHGC)和聚乙二醇(polyethylene glycol,PEG)共修饰GO(GO-PEG-PHGC)的简便方法(图2)。结果显示,GO-PEG-PHGC对大肠杆菌(Escherichiacoli)和Staphylococcusaureus均表现出很好的抗菌效果;同GO、GO-PEG和GO-PHGC相比,GO-PEG-PHGC具有更好的抗菌效果,提示PEG使GO-PEG-PHGC具有更好的分散性。
Huang等[18]通过在聚乳酸中添加一定质量分数的负载氧化锌纳米粒子的GO,制备出1种新型纳米复合材料薄膜。该薄膜具有较强的机械强度、抗紫外线和抗菌性能,在光照条件下抗菌率尤其高,可达97%。Chen等[19]采用十六烷基三甲基溴化铵辅助的水热合成法,合成由钨酸铋(bismuth tungstate,Bi2WO6)与GO组成的层状纳米复合材料(BWO/GO),见图3。该复合材料除了具有较强的吸附能力和较高的光催化性能外,在可见光照射条件下还表现极好的抗菌效果。BWO/GO受到光照时产生的氧自由基能有效破坏细菌的细胞结构使其增殖终止,从而达到抗菌效果。
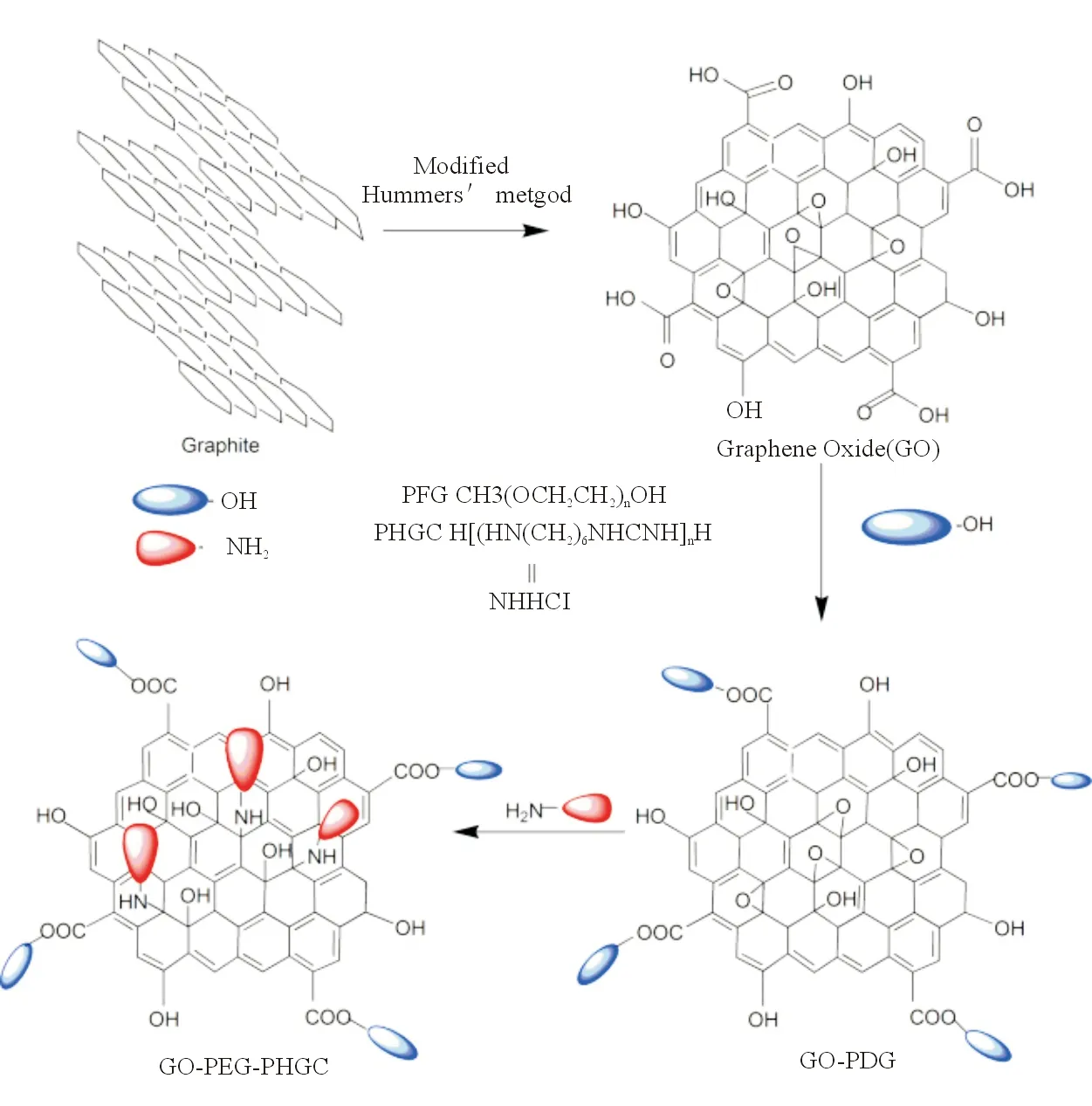
图2 GO-PEG-PHGC的合成示意图
Zhang等[20]通过原位同时还原GO和银离子一步法制备出银米粒子修饰的石墨烯片层,再通过热驱动自组装得到石墨烯/银纳米粒子杂化材料薄膜(RGO/AgNP hybrid film)。该薄膜具有很高的抗菌活性和生物相容性。同银纳米粒子相比,该杂化材料中银纳米粒子得到充分均匀的分散,提高了银纳米粒子同细菌接触的有效面积,从而有效提高其抗菌能力。Qi等[21]则将还原氧化石墨烯(reduced graphene oxide,rGO)与硼掺杂金刚石(boron-doped diamond,BDD)阳极一同用于三电极电化学氧化体系(图4),发现两者具有很好的协同抗菌效果。其通过TEM观测不同条件下大肠杆菌的形态后认为,rGO片层具有萃取细菌细胞膜上磷脂使其失活进而刺穿细胞膜的作用,而BDD则能在电解过程中腐蚀细菌的细胞膜,由此,两者发挥协同抗菌作用。
He等[22]研究发现,GO对引起牙科疾病的病原体有很好的杀灭效果,用GO的水溶液对变形链球菌(Streptococcusmutans)、具核梭杆菌(Fusobacterium
nucleatum)和牙龈卟啉单胞菌(Porphyromonasgingivalis)进行处理,结果表明,当GO浓度高时,其杀菌效果也提高;用TEM对病原体进行观测,发现细菌的细胞壁和细胞膜GO纳米片层破坏,细胞质外泄。故其认为在牙科临床治疗中,GO是一种非常有应用前景的灭菌材料。Shahnawaz Khan等[23]在同1只小鼠背部皮肤同时制造3个伤口并用Staphylococcusaureus进行感染,发现同时用近红外激光热疗和GO处理的伤口愈合速度和愈合效果优于两者单独应用,说明两者具有良好的协同抗菌效果。
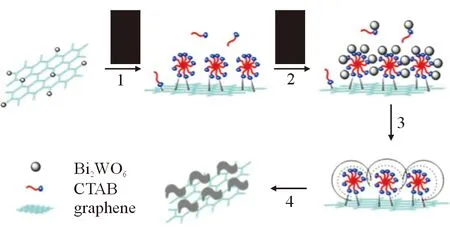
图3 BWO/GO纳米复合材料的设计

图4 BDD-rGO抗菌机制示意图
A:促进大肠杆菌向rGO表面迁移;B:大肠杆菌3个死亡机制,a:电荷转移;b:细胞膜被rGO锋利的边缘破坏;c:被·OH氧化
2NGO作为药物载体的生物安全性研究
作为医药载体的石墨烯及其衍生物应用于临床的生物安全性十分关键[24]。目前已有大量的实验在细胞水平,包括细菌、不同类型人源细胞系(肺上皮细胞、成纤维细胞、巨噬细胞、神经细胞等),对其毒性进行评价,结果显示,石墨烯和GO可能通过破坏细胞质膜、产生超氧、诱导凋亡等破坏细胞。但是,研究表明,表面被PEG[5-8]、壳聚糖[9]、透明质酸[10]等多聚物修饰、功能化的GO几乎没有细胞毒性。
石墨烯及其衍生物在体的内毒性研究得到与细胞毒性分析相似的结果。用188Re标记无修饰的NGO经静脉注射后主要在肺部组织长时间滞留[11,25],引起肺组织炎症反应[12];但表面适当的功能化,如PEG、葡聚糖(dextran,DEX)或羧基化等可提高石墨烯的生物相容性,而消除石墨烯引起的的不良反应[13-15,26]。例如,PEG修饰的GO在生理环境中的稳定性较好,静脉注射后未引起小鼠明显不良反应,发现其在网状内皮系统和肺组织的蓄积减少;而在无靶肽段存在的情况下,肿瘤被动靶向效果明显增加[13]。用125I标记的NGO-PEG和NGO-DEX经静脉注射后早期在肝、肾等器官短暂蓄积,随后逐渐经尿和大便排泄[13,15]。上述研究为NGO功能化修饰的必要性、在体内的生物安全性研究提供了依据。然而,目前NGO及表面修饰后的衍生物与机体各系统之间的相互关系仍不明确,如何优化功能化修饰并确保复合体的肿瘤靶向富集依然值得探讨。
Matsumura等[27]于1986年首次报道,67Ga标记的铁转运蛋白在实体瘤组织具有被动富集的EPR效应。肿瘤细胞属于无序生长,肿瘤组织内部非常致密,压力也随着深度越来越大,因此,一般的药物传输系统只能在肿瘤表面起作用,很难深入肿瘤组织内部发挥疗效;而50~200 nm的脂质体、高分子材料、纳米粒子对肿瘤组织具有EPR效应,可渗入到肿瘤组织内部并聚集,具有被动靶向性,这一原则也被作为高分子和纳米药物制剂研制的首要准则[3,28]。NGO具有石墨烯的特有性质,比如单个原子厚度、大型二维平面结构、稳定、大小可控制(50~200 nm),且具有较强的EPR效应和肿瘤被动靶向性[29]。
3总结和展望
当前的NGO体系主要是通过非共价物理吸附载药,载药量不稳定,在体内的载药稳定性更值得探讨;而在肿瘤被动靶向性基础上增加主动靶向也应成为NGO研究的重点。叶酸受体在多种细胞表面高表达,而叶酸具有病灶主动靶向能力,能够提高纳米材料的靶向性。因此,可用叶酸对NGO进行生物靶向基团修饰,使其具有更强的靶向性。此外,通过优化NGO的大小、PEG的接入量等条件,进一步改善NGO体系的体内行为,最大程度地降低在正常组织的滞留,以期为病灶靶向治疗提供理想的NGO药物载体。总之,石墨烯及其衍生物在纳米生物医学领域的应用前景良好,但作为病灶靶向制剂载体的研究仍处于探索阶段,还需要进一步提高其生物相容性、安全性。
参考文献
[1]Allen MJ,Tung VC,Kaner RB.Honeycomb carbon:a review of graphene[J].Chem Rev, 2009,110(1):132-145.
[2]Feng L,Liu Z.Graphene in biomedicine:opportunities and challenges[J].Nanomedicine(Lond),2011,6(2):317-324.
[3]Maeda H.Toward a full understanding of the EPR effect in primary and metastatic tumors as well as issues related to its heterogeneity[J].Adv Drug Deliv Rev,2015,91:3-6.
[4]Peng C,Hu W,Zhou Y,et al.Intracellular imaging with a graphene-based fluorescent probe[J].Small,2010,6(15):1686-1692.
[5]Qi X,Pu KY,Li H,et al.Amphiphilic graphene composites[J].Angew Chem Int Ed Engl,2010,49(49):9426-9429.
[6]Zhu S,Zhen H,Li Y,et al.PEGylated graphene oxide as a nanocarrier for podophyllotoxin[J].J Nanopart Res,2014,16(8):1-11.
[7]Xu Z,Wang S,Li Y,et al.Covalent functionalization of graphene oxide with biocompatible poly(ethylene glycol) for delivery of paclitaxel[J].ACS App Mater Interfaces,2014,6(19):17268-17276.
[8]Xu Z,Zhu S,Wang M,et al.Delivery of paclitaxel using PEGylated graphene oxide as a nanocarrier[J].ACS Appl Mater Interfaces,2015,7(2):1355-1363.
[9]Zeng Q,Cheng JS,Liu XF,et al.Palladium nanoparticle/chitosan-grafted graphene nanocomposites for construction of a glucose biosensor[J].Biosens Bioelectron,2011,26(8): 3456-3463.
[10]Li F,Park S,Ling D,et al.Hyaluronic acid-conjugated graphene oxide/photosensitizer nanohybrids for cancer targeted photodynamic therapy[J].J Mater Chem B,2013,1(12):1678-1686.
[11]Zhang X,Wang S,Xu L,et al.Biocompatible polydopamine fluorescent organic nanoparticles:facile preparation and cell imaging[J].Nanoscale,2012,4(18):5581-5584.
[12]Park S,Mohanty N,Suk JW,et al.Biocompatible,robust free-standing paper composed of a TWEEN/graphene composite[J].Adv Mater,2010,22(15):1736-1740.
[13]Yang K,Wan J,Zhang S,et al.In vivo pharmacokinetics,long-term biodistribution,and toxicology of PEGylated graphene in mice[J].ACS Nano,2010,5(1):516-522.
[14]Liu X,Tao H,Yang K,et al.Optimization of surface chemistry on single-walled carbon nanotubes for in vivo photothermal ablation of tumors[J].Biomaterials,2011,32(1):144-151.
[15]Zhang S,Yang K,Feng L,et al.In vitro and in vivo behaviors of dextran functionalized graphene[J].Carbon,2011,49(12):4040-4049.
[16]Yun H,Ahmed MS,Lee K,et al.Potential enhancement of antibacterial activity of graphene oxide-silver nanocomposite by introducing C2carbon chain linkage[J].App Sur Sci,2016,360:915-920.
[17]Li P,Sun S,Dong A,et al.Developing of a novel antibacterial agent by functionalization of graphene oxide with guanidine polymer with enhanced antibacterial activity[J].Appl Surf Sci,2015,355:446-452.
[18]Huang Y,Wang T,Zhao X,et al.Poly(lactic acid)/graphene oxide-ZnO nanocomposite films with good mechanical,dynamic mechanical,anti-UV and antibacterial properties[J].J Chem Technol Biotechnol,2015,90(9):1677-1684.
[19]Chen C,Cao S,Yu W,et al.Adsorption,photocatalytic and sunlight-driven antibacterial activity of Bi2WO6/graphene oxide nanoflakes[J].Vacuum,2015,116:48-53.
[20]Zhang P,Wang H,Zhang X,et al.Graphene film doped with silver nanoparticles:self-assembly formation,structural characterizations,antibacterial ability,and biocompatibility[J].Biomater Sci,2015,3(6):852-860.
[21]Qi X,Wang T,Long Y,et al.Synergetic antibacterial activity of reduced graphene oxide and boron doped diamond anode in three dimensional electrochemical oxidation system[J].Sci Rep,2015,5:10388.
[22]He J,Zhu X,Qi Z,et al.Killing dental pathogens using antibacterial graphene oxide[J].ACS App Mater Interfaces,2015,7(9):5605-5611.
[23]Shahnawaz Khan M,Abdelhamid HN,Wu HF.Near infrared(NIR) laser mediated surface activation of graphene oxide nanoflakes for efficient antibacterial,antifungal and wound healing treatment[J].Colloids Surf B Biointerfaces,2015,127:281-291.
[24]Yang K,Li Y,Tan X,et al.Behavior and toxicity of graphene and its functionalized derivatives in biological systems[J].Small,2013,9(9-10):1492-1503.
[25]Wang K,Ruan J,Song H,et al.Biocompatibility of graphene oxide[J].Nanoscale Res Lett,2011,6(8):1-8.
[26]Liu Z,Chen K,Davis C,et al.Drug delivery with carbon nanotubes for in vivo cancer treatment[J].Cancer Res,2008,68(16):6652-6660.
[27]Matsumura Y,Maeda H.A new concept for macromolecular therapeutics in cancer chemotherapy:mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs[J].Cancer Res,1986,46(12 Pt 1):6387-6392.
[28]Yang K,Zhang S,Zhang G,et al.Graphene in mice:ultrahigh in vivo tumor uptake and efficient photothermal therapy[J].Nano Lett,2010,10(9):3318-3323.
[29]Prabhakar U,Maeda H,Jain RK,et al.Challenges and key considerations of the enhanced permeability and retention effect for nanomedicine drug delivery in oncology[J].Cancer Res,2013,73(8):2412-2417.
[本文编辑]姬静芳
[收稿日期]2016-01-13[接受日期]2016-05-08
[基金项目]国家自然科学基金(81371949、81572114),上海市生物医药科技重点项目(13411951200). Supported by the National Natural Science Foundation of China ( 81371949, 81572114) and Shanghai Scientific Technological Innovation Project (13411951200).
[作者简介]钱文昊, 博士生, 副主任医师. E-mail: pingyanlaoto@163.com *通信作者(Corresponding author). Tel: 021-56032686, E-mail: sjs@tongji.edu.cn。
[中图分类号]R 988.2
[文献标志码]A
Research status of controlled release drug delivery system of nano graphene oxide
QIAN Wen-hao1,2, SU Jian-sheng1*
1. Shanghai Engineering Research Center of Tooth Restoration and Regeneration, Department of Prosthodontics, School of Stomatology, Tongji University, Shanghai200072, China 2. Shanghai Xuhui District Dental Center, Shanghai200032, China
[Abstract]Nano graphene oxide (NGO) has the characteristics of good biocompatibility, antibacterial activity, and promoting the osteogenic differentiation of stem cells. As a new type of coating material it is expected to be used in the prevention and treatment of diseases, so it is one of the hot spots in present study. This paper summarizes the latest research progress of NGO application in drug delivery and its biological safety.
[Key Words]nano graphene oxide; coating; drug delivery

