牛蒡子中牛蒡苷元纳米载药体系的研究
刘斯文,史 锐,刘苗苗,丛龙娇,黄晓彤
(辽宁中医药大学药学院,辽宁 大连 110000)
近年来,恶性肿瘤是导致人类死亡的主要原因,是严重威胁人类生命健康的主要疾病之一[1]。目前,中药以多靶点、低毒性等优点在抗肿瘤方面发挥了重要作用[2]。但中药的溶解性、生物利用度低等问题亟待解决。纳米载药系统因具有缓控释[3-4]、靶向性[5-6]、提高生物利用度[7]、降低药物毒副作用[8]、避免蛋白类药物降解[9]、能够高选择性地到达癌细胞并作用于癌细胞内外的小分子或基因物质等优点,显示了强大的抗癌作用[10]。
中药牛蒡子具有抗炎[11-12]、抑制肿瘤细胞[13-14]、抑菌[15]、抗病毒[16]等作用。牛蒡苷元(arctigenin,ARG)是牛蒡子的主要活性成分之一[17],在抗炎、抗病毒、降血糖、扩张血管及免疫调节等方面具有独特的药理作用。Chae等[18]研究发现,木脂素类化合物中牛蒡苷元的抗炎作用最明显。Awale等[19]研究发现,牛蒡子的二氯甲烷提取物(50 μg·mL-1)对营养缺乏的癌细胞具有细胞毒性,其显示毒性的浓度为0.01 g·mL-1,对裸鼠胰腺癌细胞株(PANC-1)生长具有显著的抑制作用。Hausott等[20]研究表明,牛蒡苷元可通过诱导结肠直肠癌细胞凋亡,进而起到抑制结肠直肠癌的作用。
基于此,作者对介孔二氧化硅纳米颗粒(mesoporous silica nanoparticles,MSN)进行叶酸(FA)和氧化锌(ZnO)双重修饰,制备装载牛蒡苷元的载药体系FA@ZnO-MSN-ARG,通过SEM、TEM、XRD和N2吸附-脱附分析对其进行表征,并对载药体系的载药性能和释药性能进行评价。
1 实验
1.1 材料、试剂与仪器
载药体系:MSN-ARG、FA-MSN-ARG、FA@ZnO-MSN-ARG-GSH,自制。
牛蒡苷元标准品,上海同田生物技术有限公司;十六烷基三甲基溴化铵(CTAB)、正硅酸乙酯(TEOS)、二硫苏糖醇(DTT)、十二烷基硫酸钠(SDS)、PBS缓冲溶液、3-氨丙基三乙氧基硅烷(APS)、3-巯基丙基三甲氧基硅烷(MPTS)、无水甲苯、叶酸(FA)、二甲基亚砜(DMSO)、N,N-二甲基甲酰胺(DMF)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、N-羟基丁二酰亚胺(NHS)、无水乙酸锌、乙酸镁四水合物、氢氧化钠、氨水、谷胱甘肽(GSH),国药集团化学试剂有限公司。
SX2-12-12D型马弗炉,上海和呈仪器制造有限公司;FTIR-650型傅立叶变换红外光谱仪,广州科晓科学仪器有限公司;SNE-4500M型扫描电子显微镜(SEM)、小角X-射线粉末衍射仪,深圳方特科技有限公司;Tecnai G2型透射电子显微镜(TEM),FEI公司;高性能多通道全自动比表面积及孔隙度分析仪,麦克莫瑞提克(上海)仪器有限公司。
1.2 牛蒡苷元检测波长的确定及标准曲线的绘制
配制一定浓度的牛蒡苷元甲醇标准溶液,以无水甲醇作空白对照,发现其在249 nm处有最大吸收峰,故选择249 nm作为检测波长。
精确称取6.0 mg牛蒡苷元,加无水甲醇溶解后转移至25 mL容量瓶中定容,得0.24 mg· mL-1牛蒡苷元标准溶液;分别移取该标准溶液0 mL、0.2 mL、0.6 mL、1.0 mL、1.4 mL、1.8 mL、2.2 mL至10 mL容量瓶中,加无水甲醇定容;以无水甲醇作空白对照,利用紫外分光光度计测定249 nm处吸光度,以吸光度为纵坐标、浓度为横坐标绘制牛蒡苷元的标准曲线。
1.3 载药体系的制备
1.3.1 MSN的制备
以CTAB为模板剂、TEOS为硅源,在碱性条件下与氨水在室温下搅拌,即得MSN。
1.3.2 MSN的表面修饰
称取少量MSN,将其分散在含有巯基硅烷偶联剂MPTS和氨基硅烷偶联剂APS(1∶1)的无水甲苯中(MSN与偶联剂总量1∶1混合),超声处理,在80 ℃水浴中搅拌12 h,冷却,产物抽滤,用无水乙醇洗涤2次,60 ℃真空干燥,即得改性产物NH2@SH-MSN。
1.3.3 MSN表面的FA修饰
将100 mg EDC和100 mg NHS溶于DMSO/DMF(体积比1∶3)中,在室温下搅拌至完全溶解后,加入200 mg FA,继续搅拌24 h,活化FA的-COOH;再加入适量NH2@SH-MSN,在室温、避光条件下搅拌12 h,离心分离,即得FA@SH-MSN。
1.3.4 ZnO纳米粒子的制备及巯基化修饰
将适量的无水乙酸锌和乙酸镁四水合物(10∶1)在剧烈搅拌下溶于60 mL热无水乙醇中。将0.2 g NaOH溶于20 mL热无水乙醇中。在冰浴条件下,将NaOH溶液快速滴入含有乙酸锌和乙酸镁的乙醇溶液中,并在室温、避光条件下搅拌至反应完全,得到白色的ZnO纳米粒子,紫外灯照射,在365 nm波长下发出黄绿色荧光。以正己烷作为沉淀剂,离心分离ZnO纳米粒子。
将制得的ZnO纳米粒子溶于DMF中,滴加MPTS(1∶1),高温搅拌,离心,用DMF洗涤3次;将颗粒分散于蒸馏水中,得到无色澄清ZnO纳米粒子溶液,避光放置,备用。
1.3.5 载药体系FA@ZnO-MSN-ARG的制备
将20 mg FA@SH-MSN分散于含有5 mg DTT的5 mL PBS缓冲溶液(pH=7.4,下同)中,加入500 μL ZnO纳米粒子溶液,室温避光搅拌24 h,离心分离,PBS缓冲溶液洗涤3次,60 ℃真空干燥,即得FA@ZnO-MSN。
精确称取20 mg牛蒡苷元,溶于15 mL无水乙醇中,加入50 mg FA@SH-MSN,超声溶解,室温搅拌24 h,沉淀,离心,用无水乙醇洗去残留在FA@SH-MSN表面的牛蒡苷元,得到FA@SH-MSN-ARG。将20 mg FA@SH-MSN-ARG分散于含有5 mg DTT的5 mL无水乙醇中,加入500 μL ZnO纳米粒子溶液,室温避光搅拌24 h后,离心分离,并用无水乙醇洗涤几次,60 ℃真空干燥,得到载药体系FA@ZnO-MSN-ARG。按式(1)计算载药率(%):

(1)
1.4 载药体系FA@ZnO-MSN-ARG的释药性能
分别称取10 mg载药体系FA-MSN-ARG、FA@ZnO-MSN-ARG和FA@ZnO-MSN-ARG-GSH(GSH浓度为2 mmol·L-1)置于透析袋中密封,将其悬浮于500 mL含1%SDS的PBS缓冲溶液(pH=7.4)中,在(37.0±0.5) ℃恒温摇床中100 r·min-1下进行透析,每隔一段时间取出5 mL PBS缓冲溶液,同时补充相应量的新鲜PBS缓冲溶液,采用紫外分光光度计测定249 nm处吸光度。根据牛蒡苷元的标准曲线方程计算得到缓冲溶液中牛蒡苷元浓度,以累积释药量为纵坐标、时间为横坐标绘制体外释药曲线。按式(2)计算释药率(%):

(2)
2 结果与讨论
2.1 牛蒡苷元的标准曲线(图1)
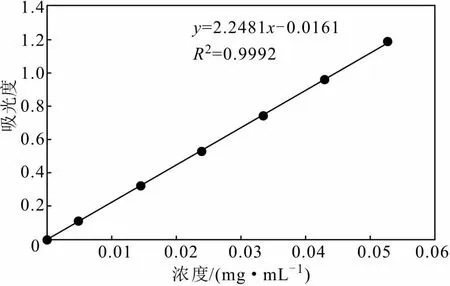
图1 牛蒡苷元的标准曲线Fig.1 Standard curve of arctigenin
经拟合得线性回归方程:y=2.2481x-0.0161,R2=0.9992。表明牛蒡苷元浓度在0~0.05 mg·mL-1范围内与吸光度线性关系良好。
2.2 载药体系FA@ZnO-MSN-ARG的表征
2.2.1 SEM分析(图2)

图2 MSN(a)、FA@ZnO-MSN-ARG(b)的SEM照片Fig.2 SEM images of MSN(a) and FA@ZnO-MSN-ARG(b)
从图2可知,未经修饰的MSN的均匀性相对较好,粒径约为100 nm,形态几乎为球形(图2a);经修饰、载药后,FA@ZnO-MSN-ARG纳米颗粒的均匀性也相对较好,粒径增大至150 nm左右,出现大量椭球形颗粒,表面略粗糙(图2b)。
2.2.2 TEM分析(图3)

图3 FA@ZnO-MSN(a)、FA@ZnO-MSN-ARG(b)的TEM照片Fig.3 TEM images of FA@ZnO-MSN(a) and FA@ZnO-MSN-ARG(b)
从图3可知,载药前,FA@ZnO-MSN纳米颗粒中存在大量相对有序的通孔(图3a);载药后,FA@ZnO-MSN-ARG纳米颗粒中有序贯穿孔道变少,甚至几乎不可见(图3b)。这是因为,在载药体系的制备过程中大量牛蒡苷元吸附到MSN的孔中,且ZnO纳米粒子作为分子开关也堵在MSN的孔口。
2.2.3 XRD分析(图4)
从图4可知,FA@ZnO-MSN-ARG纳米颗粒在2θ为2.5°左右有一个较强的衍射峰,该峰对应于(100)晶面,是六方结构介孔材料最主要的特征峰,该衍射峰较强,表明制备的材料有序度较高,结构比较稳定,骨架没有崩塌,说明MSN经修饰和载药后依然能够保持较高的结晶性;与未经修饰的MSN相比,FA@ZnO-MSN-ARG纳米颗粒在2θ为4°~5°之间的(100)和(200)衍射峰削弱了很多,说明MSN的修饰和载药效果已经达成,且没有破坏整体结构,仍然具有MSN纳米介孔材料结构的特征。

图4 FA@ZnO-MSN-ARG的XRD图谱Fig.4 XRD pattern of FA@ZnO-MSN-ARG
2.2.4 N2吸附-脱附曲线(图5)

图5 FA@ZnO-MSN-ARG的N2吸附-脱附曲线(a)和孔径分布曲线(b)Fig.5 N2 adsorption-desorption curve(a) and pore size distribution curve(b) of FA@ZnO-MSN-ARG
从图5a可知,FA@ZnO-MSN-ARG的BET比表面积为104.98 m2·g-1,其比表面积相对载药前降幅较大。此外还可以观察到,FA@ZnO-MSN-ARG的N2吸附-脱附曲线为Ⅳ型,具有介孔材料的吸附-脱附曲线特征,载药后的结构仍然比较稳定,整体结构没有被破坏。从图5b可知,经修饰、载药后,FA@ZnO-MSN-ARG的孔径分布较窄,主要在1.93~2.56 nm之间,平均孔径为1.96 nm。
2.3 载药体系FA@ZnO-MSN-ARG的载药性能
分2组检测(即牛蒡苷元与载体比例R为0.5和1.0)3个载药体系MSN-ARG、FA-MSN-ARG、FA@ZnO-MSN-ARG的载药率和包封率,结果见表1。
从表1可知,随着牛蒡苷元与载体比例的增加,载药体系MSN-ARG、FA-MSN-ARG、FA@ZnO-MSN-ARG的载药率升高,其中FA@ZnO-MSN-ARG的载药率最高;但随着牛蒡苷元与载体比例的增加,载药体系MSN-ARG、FA-MSN-ARG的包封率下降,FA@ZnO-MSN-ARG的包封率升高。

表1 不同载药体系的载药率和包封率Tab.1 Drug loading ratio and encapsulation efficiency of different drug delivery systems
2.4 载药体系FA@ZnO-MSN-ARG的释药性能(图6)

图6 FA-MSN-ARG、FA@ZnO-MSN-ARG、FA@ZnO-MSN-ARG-GSH在pH值7.4下的体外释药曲线Fig.6 In vitro drug release curves of FA-MSN-ARG,FA@ZnO-MSN-ARG,and FA@ZnO-MSN-ARG-GSH at pH value of 7.4
从图6可知,载药体系FA-MSN-ARG因为没有封堵,释药速率较快,在0~16 h释药率达到48.30%;而后释药率缓慢升高,在24 h达到最高,为50.50%,具有一定的缓释作用,但考虑到药物在传递过程中释放的损耗,真实作用于肿瘤细胞的药物含量会大大降低。载药体系FA@ZnO-MSN-ARG在0~6 h释药速率较快,释药率达到16.92%;在36 h时释药率达到最高,仅为19.05%,而后保持不变。模拟载药体系进入细胞内释药情况,在载药体系FA@ZnO-MSN-ARG中加入GSH,发现牛蒡苷元的释药率明显升高,在12 h内释药速率较快,较载药体系FA@ZnO-MSN-ARG明显加快,在36 h时释药率达到最高,为39.25%。
3 结论
通过溶胶-凝胶法成功制备了装载牛蒡苷元的纳米载药体系FA@ZnO-MSN-ARG,随着牛蒡苷元与载体比例的增加,载药体系MSN-ARG和FA-MSN-ARG的载药率升高、包封率降低,载药体系FA@ZnO-MSN-ARG的载药率和包封率远高于MSN-ARG、FA-MSN-ARG;在载药体系FA@ZnO-MSN-ARG中加入谷胱甘肽(GSH),牛蒡苷元的释药率明显升高,在12 h内释药速率较快,在36 h时释药率达到最高,为39.25%。该载药体系具有缓释、控释效果,为牛蒡子的进一步开发利用提供了理论依据。

