燕麦纤维改善高脂饮食诱导的肥胖小鼠胰岛素抵抗的机制研究
叶碧娴,徐思源,窦永会,王园园,荣向路
(1广州中医药大学,广州 510006;2无限极中草药免疫研究中心,广州 510000;3广东药学院/广东省代谢病中西医结合研究中心,广州 510006;4广东省代谢性疾病中医药防治重点实验室,广州 510006)
燕麦纤维改善高脂饮食诱导的肥胖小鼠胰岛素抵抗的机制研究
叶碧娴1,徐思源1,窦永会1,王园园2,荣向路3,4
(1广州中医药大学,广州510006;2无限极中草药免疫研究中心,广州510000;3广东药学院/广东省代谢病中西医结合研究中心,广州510006;4广东省代谢性疾病中医药防治重点实验室,广州510006)
摘要:目的:研究燕麦纤维对高脂饮食诱导小鼠胰岛素抵抗的影响。方法:采用8w龄C57BL/6J雄性小鼠高脂喂养16w,同时预防性给药,监测血液生化指标,进行糖耐量实验,ELISA法测胰岛素并计算HOMR-IR指数,解剖分离小鼠的内脏脂肪组织并称重,以及取部分组织做HE染色进行形态学观察,研究燕麦纤维对高脂诱导小鼠肥胖和胰岛素抵抗的影响。结果:与模型组比较,阳性药小檗碱组与燕麦纤维组的血糖(GLU)、甘油三酯(TG)、游离脂肪酸(FFA)、总胆固醇(TC)均能显著降低;燕麦纤维组低密度脂蛋白胆固醇(LDL-C)也显著降低,血浆胰岛素水平极显著降低,能增强胰岛素敏感性,改善胰岛素抵抗;血浆中炎症因子TNF-α、IL-6、L-1β及MCP-1显著降低,分别降低了27%、81%、31%、50%。小鼠体质量和内脏脂肪显著减少。脂肪细胞面积减小。结论:燕麦纤维通过减少小鼠内脏脂肪,减少FFA和炎症因子的分泌,改善由高脂饮食诱导的胰岛素抵抗,增加胰岛素敏感性。
关键词:燕麦纤维;内脏脂肪;胰岛素抵抗;炎症因子
近年来研究发现[1-4],燕麦纤维有利于调节机体的糖脂代谢。董吉林等[5]研究发现,燕麦纤维有明显减肥降脂的效果,但其对糖脂代谢的作用机制尚不明确。本研究采用45%Fat高脂饲料长期喂饲小鼠,诱导形成肥胖代谢紊乱模型[6],从内脏脂肪及炎症因子的变化进一步探究燕麦纤维对高脂饮食小鼠胰岛素抵抗的影响。本研究主要选取其中一个有效剂量探讨燕麦纤维对高脂饮食引起小鼠糖脂代谢紊乱的改善作用以及可能的作用机制,丰富其应用意义,为燕麦纤维改善机体胰岛素抵抗及糖脂代谢提供科学依据。
1材料与方法
1.1实验动物
8w龄雄性C57BL/6J小鼠,SPF级,体质量18~20g,购自广东省医学实验动物中心,实验动物合格证编号:SYXK(粤)2013-0085。动物饲养地点:广州中医药大学实验动物中心SPF级动物房;动物饲养条件:饲养温度:20~25℃、湿度:40%~70%、采用12h:12h昼夜间断照明;自由进食饮水,饮用水为实验动物中心制备的蒸馏水。
1.2药物与试剂
燕麦纤维:由无限极中国有限公司提供,产品批号:07555120924;阳性药盐酸小檗碱:广州市齐云生物技术有限公司,产品批号:2S02263013G。
葡萄糖测定试剂盒(批号:20130402147)、甘油三酯测定试剂盒(批号:20130301121)、总胆固醇测定试剂盒(批号:20130502146)、低密度脂蛋白胆固醇测定试剂盒(批号:20130101124),均为上海荣盛生物药业有限公司;游离脂肪酸试剂盒,和光纯药工业株式会社,批号:AMJ6133。小鼠胰岛素测定酶联免疫试剂盒:武汉华美生物工程有限公司,批号:C02019552;小鼠炎症因子抗体芯片试剂盒(AAM-INF-1-8):美国RayBiotech,批号:1114147100。
1.3仪器
1510 Thermo全波长酶标仪(赛默飞世尔科技中国公司);JA1203N型分析天平(上海精密仪器有限公司);1-15k 型冷冻离心机(上海天美科学仪器有限公司)。
1.4方法
1.4.1动物分组及给药小鼠适应性饲养1w后,乙醚麻醉,眼底静脉丛取血,肝素抗凝,4℃离心(3 000 r/min,15 min)分离血浆,测定血浆葡萄糖(GLU)、总胆固醇(TC)、甘油三酯(TG) 作为该批小鼠的基础生化值,再根据体质量、GLU、TG、TC水平随机分层分为正常组、模型组、阳性药小檗碱组、燕麦纤维组。除正常组给予标准饲料外,其余各组动物给予高脂纯化配方饲料。同时各组动物按10 mL/(kg·d)灌胃给药,正常组、模型组给予等容积的蒸馏水;燕麦纤维剂量参照预试验的结果选择300 mg/(kg·d),连续给药16w。末次取血后迅速脱颈椎处死小鼠,解剖分离肾周脂肪和附睾周围脂肪等组织,精密称质量。
1.4.2血液生化的测定动物经乙醚麻醉,眼底静脉丛取血,肝素抗凝,4℃离心(3 000 r/min,15 min)分离血浆,测定血浆中GLU、TG、FFA、TC、LDL-C,遵照试剂盒操作方法与步骤,通过Thermo全波长酶标仪测定血浆中GLU、TG、FFA、TC、LDL-C水平。
1.4.3口服糖耐量试验小鼠禁食不禁水12h后,给予2g/kg葡萄糖灌胃,分别收集灌服葡萄糖之前以及灌服葡萄糖后20、60、120min的血样,检测血糖。绘制血糖-时间曲线并计算曲线下面积(Area Under Curve,AUC)。
1.4.4酶联免疫法(ELISA)测定小鼠胰岛素采用双抗体夹心法。遵照试剂盒操作方法。HOMA-IR指数[7,8]=( FBG*FINS)/22.5,其中,BG代表空腹血糖水平,mmol/L、FINS代表空腹胰岛素水平,mIU/L。1.4.5蛋白质芯片技术测小鼠炎症因子采用双抗体夹心法。遵照试剂盒操作方法与步骤。Quantity One图像分析软件分析蛋白芯片膜上的印迹,计算各炎症因子对应的灰度值,其余各组与模型组灰度值之比表示相对表达量。
1.4.6脂肪组织病理形态学观察 处死小鼠后迅速分离脂肪组织,置于中性甲醛中固定,石蜡包埋,切片,HE染色,进行病理形态学观察分析。
2结果与分析
2.1燕麦纤维对小鼠体质量的影响
各组小鼠的进食量均处于较为平稳的趋势,分别为:正常组(3.369±0.151g)、模型组(2.661±0.171 g)、阳性药小檗碱组(2.549±0.174 g)、燕麦纤维组(2.768±0.142 g)。正常组的进食量大于模型组,可能是由于高脂饲料的脂质含量较高影响动物的食欲,从第2w开始至实验结束,模型组体质量较正常对照组显著增加;与模型组比较,第3w开始至实验结束,阳性药小檗碱组以及燕麦纤维组体质量明显降低,12w后,2组的体质量增长量较模型组明显减少,表明燕麦纤维有抑制体重过快增长的作用(图1)。

图1 各组小鼠体质量增长曲线 注:与正常组比较,*P<0.05、**P<0.01、***P<0.0001;与模型组比较,#P<0.05、##P<0.01。
2.2燕麦纤维对小鼠糖耐量的影响
给药10w后,进行口服糖耐量试验。在灌服葡萄糖后20、60min时,模型组GLU均显著高于正常组,与正常组比较,模型组曲线下面积(AUC)明显升高,表明模型组出现糖耐量异常;与模型组比较,阳性药小檗碱组20min时的GLU及AUC明显降低;20min时,燕麦纤维组GLU较模型组显著降低,AUC明显降低(图2)。

图2 燕麦纤维对高脂喂养的小鼠糖耐量的影响 注:与正常组比较,*P<0.05、**P<0.01;与模型组比较,#P<0.05、##P<0.01。
2.3燕麦纤维对小鼠糖代谢的影响
给药16w后,与正常组比较,模型组空腹GLU及胰岛素明显升高,HOMA-IR指数明显增加,表明模型小鼠出现胰岛素抵抗(IR);与模型组相比,小檗碱组空腹GLU以及HOMA-IR指数显著降低;燕麦纤维组空腹GLU及胰岛素显著降低,HOMA-IR指数极显著减少。燕麦纤维组血浆胰岛素水平明显减少,可能是由于IR导致模型小鼠胰岛素分泌增加,而燕麦纤维能增强胰岛素敏感性,减少胰岛素分泌仍能较好地控制血糖。

表1 燕麦纤维对高脂喂养的小鼠糖代谢的影响 , n=8)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05、##P<0.01、###P<0.000 1。
2.4燕麦纤维对小鼠脂代谢的影响
给药16w后,与正常组比较,模型组空腹血浆TG、FFA、TC、LDL-C均显著升高。与模型组相比,小檗碱组TG、FFA、TC显著降低;燕麦纤维组TG、FFA、TC、LDL-C均显著降低。表明燕麦纤维有明显降血脂作用(表2)。
表2燕麦纤维对高脂喂养的小鼠脂代谢的影响
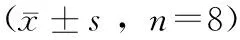

组别剂量(mg/kg)TG(mmol/L)FFA(mEq/L)TC(mmol/L)LDL-C(mmol/L)正常组-0.586±0.1180.667±0.1012.175±0.2651.586±0.234模型组-0.938±0.262**0.807±0.122*2.775±0.162***2.364±0.181***小檗碱组1000.646±0.147#0.608±0.086##2.602±0.106#2.223±0.279燕麦纤维组3000.496±0.095##0.461±0.091##2.197±0.466##1.722±0.402##
注:与正常组比较,*P<0.05、**P<0.01、***P<0.0001;与模型组比较,#P<0.05、##P<0.01。
2.5燕麦纤维对小鼠内脏脂肪的影响
与正常组比较,模型组附睾周围脂肪及肾周脂肪均明显增加,附睾周围脂肪及肾周脂肪系数相应增加,差异有统计学意义;与模型组比较,小檗碱组和燕麦纤维组附睾周围脂肪、肾周脂肪及对应的脏器系数均显著减少(表3)。
表3燕麦纤维对高脂喂养的小鼠内脏脂肪的影响


组别剂量(mg/kg)脏器重量(g)脏器系数(%)附睾周围脂肪肾周脂肪附睾周围脂肪系数肾周脂肪系数正常组-0.531±0.1310.191±0.0410.019±0.0050.007±0.001模型组-1.030±0.263**0.477±0.200**0.031±0.007**0.015±0.006**小檗碱组1000.664±0.152##0.265±0.055#0.022±0.006#0.009±0.002#燕麦纤维组3000.541±0.081##0.232±0.044##0.018±0.002##0.008±0.001##
注:与正常组比较,*P<0.05、**P<0.01、***P<0.000 1;与模型组比较,#P<0.05、##P<0.01。
2.6燕麦纤维对小鼠脂肪组织的影响
模型组附睾周围脂肪细胞面积明显大于正常组。通过Image Pro Plus软件进一步测量和分析脂肪细胞面积可知,高脂饮食引起了小鼠脂肪细胞面积的增大;与模型组相比,小檗碱以及燕麦纤维改善了由高脂饮食引起的脂肪细胞面积增大,具有统计学意义(图3)。
2.7燕麦纤维对小鼠血浆炎症因子水平的影响
以模型组炎症因子的表达量作参照,将其余各组与模型组进行比较分析。与正常组比较,模型组的TNF-α、IL-6、IL-1β及MCP-1表达量均明显增加。与模型组比较,燕麦纤维组的TNF-α、IL-6、IL-1β及MCP-1的表达量显著减少,分别降低了27%、81%、31%、50%(图4)。

图3 燕麦纤维对小鼠脂肪组织的影响 (HE,×400)注:与正常组比较,***P<0.0001;与模型组比较,###P<0.0001。

图4 燕麦纤维对血浆炎症因子水平的影响 注:与正常组比较,*P<0.05、**P<0.01;与模型组比较、#P<0.05、##P<0.01
3讨论
本实验采用单纯高脂纯化饲料造模,其特点是与人类肥胖最为接近的营养性肥胖代谢紊乱模型[9]。高脂喂养2w后,高脂饲料组小鼠的体质量均显著高于标准饲料组。模型小鼠血浆TG、FFA、TC及LDL-C较正常小鼠明显升高。高脂喂养10w,模型小鼠已出现糖耐量异常及IR。长期高脂饮食刺激下,机体未及时消耗过量脂质,脂肪储存越多,脂肪细胞逐渐增大,当不能满足脂质存储需要时,则出现FFA溢出,进入血液循环,在外周的非脂肪组织堆积,刺激炎症因子分泌增加,甚至会对机体造成非常严重的损害[10]。脂质异位沉积多发生在肝脏、肌肉和心脏等,造成局部及全身IR[11,12]。本实验结果显示,燕麦纤维的干预能抑制动物体质量过快增长,内脏脂肪明显减少,降低血浆GLU,改善胰岛素抵抗。临床研究发现,随着肥胖患者体脂分布异常,胰岛素敏感性下降,IR加重,腹型肥胖者尤为显著[13]。内脏脂肪相对于皮下脂肪对胰岛素敏感性差,脂质分解释放FFA速度较快,过多的FFA进入循环,降低6-磷酸果糖激酶-1(PFK)的活性,抑制糖酵解及葡萄糖摄取,是引起胰岛素抵抗的主要部位[14]。本研究发现,燕麦纤维能改善高脂饮食引起的附睾周围脂肪细胞肥大,降低血浆TG、FFA、TC及LDL-C。有研究表明,高脂饮食影响脂肪细胞的形态、大小、脂肪组织数量及细胞形态学与生化指标密切相关,当体质量减轻时,脂肪细胞面积也会随之减小[15]。
本研究结果显示,燕麦纤维能减少循环中TNF-α、IL-6、MCP-1 和IL-1β水平,改善机体炎症状态。高脂饮食诱导的肥胖和代谢综合症与脂肪组织、肝脏和肌肉等组织中炎症因子表达量增加有关。高脂饮食引起体内炎症因子分泌增加,如IL-1、TNF-α、MCP-1 和IL-6 等,都参与破坏胰岛素功能和胰岛素抵抗形成的过程[16,17]。高脂饮食增加循环中FFA浓度,高FFA水平会激活巨噬细胞和脂肪细胞Toll样受体,促进炎症因子TNF-α、MCP-1等的分泌,同时使脂肪细胞肥大[18,19]。TNF-α水平上升,能够促进胰岛素受体底物I(IRS-1)的丝氨酸位磷酸化,导致IRS-1对胰岛素敏感性下降,阻碍胰岛素信号传导;TNF-α和IL-6下调脂肪组织中葡萄糖转运体4的表达,减少葡萄糖的转运,从而引发胰岛素抵抗[20]。
综上所述,燕麦纤维能改善高脂饮食引起的脂肪细胞肥大,减少炎症因子水平,可能的原因是燕麦纤维具有控制体质量和减少脂肪积聚的作用。内脏脂肪数量减少,降低血浆脂质水平,使炎症因子IL-6、TNF-α、MCP-1 和IL-1β的分泌也减少,从而改善机体代谢紊乱。本实验从内脏脂肪和炎症因子的角度探讨了燕麦纤维改善胰岛素抵抗的作用,为燕麦纤维的应用提供一定的参考依据,而组织中炎症因子表达与循环中炎症因子水平不一定一致,燕麦纤维影响炎症因子的具体机制还需做进一步研究。◇
参考文献
[1]Heilbronn LK,Campbell LV.Adipose tissue macrophages,low grade inflammation and insulin resistance in human obesity [J].Curr Pharm Des,2008,14(12): 1225-1230.
[2]Xu Y,et al.Prevalence and control of diabetes in Chinese adults [J].JAMA,2013,310(9): 948-958.
[3]Queenan KM,et al.Concentrated oat beta-glucan,a fermentable fiber,lowers serum cholesterol in hypercholesterolemic adults in a randomized controlled trial [J].Nutr J,2007,6:6.
[4]Nancy B,Revista B,Josep B,et al.Dietary fibre: influence on body weight,glycemic control and plasma cholesterol profile [J].Nutrition Hospitalaria,2010,25(3): 327-340.
[5]董吉林,等.燕麦膳食纤维对食源性肥胖小鼠降脂减肥作用研究[J].中国粮油学报,2015,30(9):24-28.
[6]周云枫,李沙,苏文,等.不同脂肪含量的高脂纯化配方饲料对大、小鼠代谢综合征发生的影响 [J].基础医学与临床,2012,32(3): 273-277.
[7]Matthews DR,et al.Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man [J].Diabetologia,1985,28:412-419.
[8]Haffner SM1,Kennedy E,Gonzalez C,et al.A prospective analysis of the HOMA model.The Mexico City Diabetes Study [J].Diabetes Care,1996,19(10):1138-1141.
[9]Turner N,et al.Distinct patterns of tissue-specific lipid accumulation during the induction of insulin resistance in mice by high-fat feeding [J].Diabetologia,2013,56(7):1638-1648.
[10]Henao-Mejia J,Elinav E,Jin C,et al.Inflammasome-mediated dysbiosis regulates progression of NAFLD and obesity [J].Nature,2012,482(7384):179-185.
[11]Viljanen AP,et al.Effects of weight loss on visceral and abdominal subcutaneous adipose tissue blood-flow and insulin-mediated glucose uptake in healthy obese subjects [J].Ann Med,2009,41(2):152-160.
[12]Ryan MC,et al.The Mediterranean diet improves hepatic steatosis and insulin sensitivity in individuals with non-alcoholic fatty liver disease [J].J Hepatol,2013,59(1):138-143.
[13]Bluher M.Adipose tissue dysfunction contributes to obesity related metabolic diseases [J].Best Pract Res Clin Endocrinol Metab,2013,27(2): 163-177.
[14]Tran TT,et al.Beneficial effects of subcutaneous fat transplantation on metabolism [J].Cell Metab,2008,7(5):410-420.
[15]Despres JP,Lemieux I.Abdominal obesity and metabolic syndrome [J].Nature,2006,444(7121):881-887.
[16]Mauer J,et al.Signaling by IL-6 promotes alternative activation of macrophages to limit endotoxemia and obesity-associatedresistance to insulin [J].Nat Immunol,2014,15(5):423-430.
[17]Bruun JM,et al..Monocyte chemoattractant protein-1 release is higher in visceral than subcutaneous human adipose tissue (AT): implication of macrophages resident in the AT [J].Clin Endocrinol Metab,2005,90(4): 2282-2289.
[18]Suganami T1,et al.Role of the Toll-like receptor 4/NF-kappaB pathway in saturated fatty acid-induced inflammatory changes in the interaction between adipocytes and macrophages [J].Arterioscler Thromb Vasc Biol,2007,27(1):84-91.
[19]Kratz M,et al.Metabolic dysfunction drives a mechanistically distinct proinflammatory phenotype in adipose tissue macrophages [J].Cell Metab,2014,20(4):614-625.
[20]Arruda AP,et al.Low-grade hypothalamic inflammation leads to defective thermogenesis,insulin resistance,and impaired insulin secretion [J].Endocrinology,2011,152(4):1314-1326.
(责任编辑李婷婷)
基金项目:国家自然科学基金面上项目(项目编号:81274156);教育部“新世纪优秀人才计划”(项目编号:NECT-11-0916);广东省高等学校高层次人才项目(项目编号:51439003);广州市科技计划项目(项目编号:2012J4100095)。
作者简介:叶碧娴(1990—),女,硕士,研究方向:代谢性疾病中医药防治基础与应用。
通讯作者:荣向路(1972—),男,博士,教授,研究方向:代谢性疾病中医药防治基础与应用。
Mechanism of Oat Fiber Improving Insulin Resistance in High-fat Diet-induced Obese Mice
YE Bi-xian1,XU Si-yuan1,DOU Yong-hui1,WANG Yuan- yuan2,RONG Xiang-lu3,4
(1School of Chinese Materia Medica,Guangzhou University of Chinese Medicine,Guangzhou 510006,China;2Infinite Immune Research Center of Chinese Herbal Medicine,Guangzhou 510006,China;3Guangdong Pharmaceutical University,Guangdong Metabolic Diseases Research Center of Integrated Chinese and Western Medicine,Guangzhou 510006,China;4Guangdong TCM Key Laboratory for Metabolic Diseases,Guangzhou 510006,China)
Abstract:【Objective】 To investigate the effects of oat fiber on high-fat diet-induced insulin resistance in mice.【Method】 In this study,at the age of 8 weeks,male C57BL/6J mice were fed high-fat diet (HFD) for 16 weeks.In the oat fiber treatment group,8-week-old male C57BL/6J mice were fed HFD,administered oat fiber simultaneously.Measuring blood biochemical parameters,glucose tolerance test,the method of ELISA to measure insulin and calculate HOMR-IR index,dissecting the mouse visceral adipose tissue and weighed ,and the sections were stained with hematoxylin-eosin (H-E) for histological analysis to investigate the effects of oat fiber on high-fat diet-induced obesity and insulin resistance in mice.【Result】 Compared with model group,berberine treatment had reduced plasma glucose、 TG、FFA and TC in mice ;while oat fiber administered mice had a certain downward trend about plasma GLU,reduced plasma TG、FFA、TC、LDL-C and plasma insulin levels significantly,enhanced insulin sensitivity and improve insulin resistance.Body weight and visceral fat were reduced significantly.Improved histology of adipose tissue,and the size of fat cells were reduced.【Conclusion】Oat fiber improved high-fat diet-induced insulin resistance in mice by reducing visceral fat,decreased the secretion of FFA and inflammatory cytokines,increased insulin sensitivity.
Keywords:oat fiber;visceral fat;insulin resistance(IR);inflammatory cytokines

