绣球菌多糖提取方法的比较研究
楚 杰,刘守志,张 涛,何秋霞,刘可春
(山东省科学院生物研究所,济南 250014)
绣球菌多糖提取方法的比较研究
楚杰,刘守志,张涛,何秋霞,刘可春
(山东省科学院生物研究所,济南250014)
摘要:对绣球菌多糖提取方法做了初步研究,通过热浸、超声、剪切、高压等单一或复合处理方法,摸索出提取的最佳方法:剪切高压法,提取条件为高速剪切乳化机内10 000r/min剪切10min,高压30min后,其提取率达到5.106%。
关键词:绣球菌;多糖;提取法
绣球菌(Sparassiscrispa),又名花椰菜菇、花瓣茸,是一种非常珍稀名贵的药食两用菌,含有十分丰富的多糖,具有很好的保健作用和较高的药用价值。研究表明,绣球菌多糖有抗肿瘤作用[1-3],可用于治疗各种癌症,此外,绣球菌多糖还可以提高动物的造血功能[4]、加强白细胞介素-6的生成,能诱导动物产生干扰素[5-7]、抑制爱滋病毒-1逆转录超过50%等功能[8],由于其如此多的功能,逐渐成为研究的热点。绣球菌多糖存在于其菌丝体和子实体中,但因绣球菌子实体生长缓慢,人工栽培周期太长,采用液体深层发酵法培养,周期短、成本低,能大大提高多糖的产量。因此本试验针对绣球菌菌丝体多糖的提取工艺进行了比较研究,为绣球菌多糖开发利用提供科学依据。
1仪器与材料
1.1菌种
绣球菌,引自韩国朝鲜大学。
1.2试剂
氯仿、正丁醇、无水乙醇、36%HCl、NaOH(分析纯,天津市科密欧化学试剂有限公司)。
1.3仪器
SG-500高剪切乳化机(上海尚贵有限公司);XW-80A旋转混合仪(上海沪西分析仪器厂有限公司);RE-6000 旋转蒸发器(上海亚荣生化仪器厂); SHB-B95循环水式多用真空泵(郑州长城科工贸有限公司);BILON-2000CTG恒温超声波提取机(西安比朗生物科技有限公司);SBA-40D生物传感分析仪(山东省科学院生物所)。
1.4绣球菌多糖含量的测定[9]
取提取液1mL(或多糖1g),加入5%盐酸30mL,100℃水解5h,水解后冷却至室温,调节pH至中性,定容到100mL,用SBA-40D生物传感器测定其葡萄糖含量,同时测定各提取液水解前样品的葡萄糖含量为空白对照,计算多糖含量。
2方法与步骤
2.1绣球菌的培养
2.1.1培养基(1)斜面培养基:PDF培养基。(2)液体发酵培养基:20%土豆汁、0.1%硫酸镁、0.3%磷酸二氢钾、2%的淀粉、0.3%的蛋白胨、0.01%的复合维生素B1,pH 5.5。
2.1.2绣球菌菌丝体的培养与收集将绣球菌斜面菌块接种于液体发酵培养基中,25℃培养至菌丝球长满为止,5 000r/min离心,将菌丝体收集,存4℃冰箱保存备用。
2.2绣球菌多糖的提取
2.2.1热浸法准确称取菌丝体10g于锥形瓶中,加水100mL,振荡混匀,然后85℃水浴1h,5 000r/min离心15min, 将残渣再次加入100mL的水,振荡混匀, 85℃水浴1h,二次浸提,将浸提液合并到一起,旋转蒸发器减压浓缩,取浓缩液,氯仿:正丁醇=4∶1等体积加入,混匀后,10 000r/min离心15min,去除杂蛋白。取上清液,加入80%的无水乙醇,醇沉后离心,沉淀部分烘干即多糖。称重并按1.3方法测定多糖含量。
2.2.2热浸剪切超声法准确称取菌丝体10g于锥形瓶中,加水100mL,振荡混匀,85℃水浴1h,再放入高速剪切乳化机中10 000r/min剪切10min,最后放入超声波提取机中超声30min(超声2.0s,间隙2.0,时长30min)取出,5 000r/min离心15min,取上清液,旋转蒸发器减压浓缩,取浓缩液,氯仿:正丁醇=4∶1等体积加入,10 000r/min离心15min去除杂蛋白。取上清液,加入80%的无水乙醇醇沉,烘干。称重并按1.3方法测定多糖含量。
2.2.3剪切超声热浸法取菌丝体10g,加水100mL,振荡混匀,10 000r/min剪切10min;超声30min(超声2.0s,间隙2.0,时长30min);85℃恒温水浴1h。离心取上清液,旋转蒸发器减压浓缩,取浓缩液,氯仿:正丁醇=4∶1等体积加入,10 000r/min离心15min去除杂蛋白。取上清液,加入80%的无水乙醇醇沉,烘干。称重并按1.3方法测定多糖含量。
2.2.4剪切热浸法取菌丝体10g,加水100mL,振荡混匀,高速剪切乳化机10 000rpm剪切10min;85℃恒温水浴1h。5 000r/min离心15min,取上清液,旋转蒸发器减压浓缩,取浓缩液,氯仿∶正丁醇=4∶1等体积加入,10 000r/min离心15min去除杂蛋白。取上清液,加入80%的无水乙醇醇沉,烘干。称重并按1.3方法测定多糖含量。
2.2.5剪切超声法取菌丝体10g,加水100mL,振荡混匀,高速剪切乳化机10 000r/min剪切10min;恒温超声波提取机超声30min(超声2.0s,间隙2.0,时长30min)。离心取上清液,旋转蒸发器减压浓缩,取浓缩液,氯仿:正丁醇=4∶1等体积加入,10 000r/min离心15min去除杂蛋白。取上清液,加入80%的无水乙醇醇沉,烘干。称重并按1.3方法测定多糖含量。
2.2.6剪切高压法取菌丝体10g,加水100mL,振荡混匀,高速剪切乳化机10 000r/min剪切10min;然后121℃ 30min。离心取上清液,旋转蒸发器减压浓缩,取浓缩液,氯仿:正丁醇=4∶1等体积加入,10 000r/min离心15min去除杂蛋白。取上清液,加入80%的无水乙醇醇沉,烘干。称重并按1.3方法测定多糖含量。
2.3试验数据的处理

图1 热浸剪切超声法与剪切超声热浸法比较
2.3.1热浸剪切超声法与剪切超声热浸法比较 由图1数据可知,热浸剪切超声法收率为0.492 3g,其含糖量365mg/g;在相同质量菌丝体条件下,剪切超声热浸法的收率为0.5078g,其含糖量每克870mg/g。从数据看出,虽然步骤一样,但前后顺序不一样,对多糖的提取结果影响很大,先剪切超声再热浸,更加有利于绣球菌多糖的浸出,这是因为经剪切超声后菌丝体细胞壁破碎,经过热浸,多糖被充分浸出,提高了多糖的溶出率,而先热浸再剪切超声,破碎后细胞内多糖并没有完全溶出,因此,剪切超声热浸法比热浸剪切超声法提取效率高。
2.3.2剪切超声法与剪切超声热浸法比较由图2可知,在采用相同质量菌丝体下,剪切超声法收率为0.304 7g,其糖含量为640mg/g;剪切超声热浸法收率为0.507 8g,其糖含量为870mg/g。因此,剪切超声热浸法收率和糖含量均比剪切超声法要高。这是因为剪切超声后,虽然菌丝体细胞破碎,但多糖并没有完全得到释放,只有再经过热浸后多糖才能完全被提取出来。

图2 剪切超声法与剪切超声热浸法比较
2.3.3剪切超声法,剪切热浸法和剪切高压法由图3可知,在采用相同质量菌丝体下,剪切超声法收率为0.304 7g,其糖含量为640mg/g;剪切热浸法收率为0.472 8g,糖含量为790mg/g;剪切高压法收率为0.600 7g,收率为850mg/g。3种方法收率呈现递增趋势,糖含量也呈现递增趋势。剪切高压法的提取收率最高, 因为细胞经剪切后,细胞壁破碎,超声法只是起到进一步破碎的作用,多糖并没有溶出;热浸起到了多糖溶出的作用;而高压既有进一步破碎细胞的作用,又能使多糖组分溶出。

图3 剪切超声法、剪切热浸法和剪切高压法
2.3.4热浸法与剪切热浸法由图4可知,在采用相同质量菌丝体下,热浸法为0.394 2g,其糖含量为365mg/g;剪切热浸法收率为0.472 8g,糖含量为790mg/g。说明在剪切的基础上再热浸能更好的释放胞内多糖。
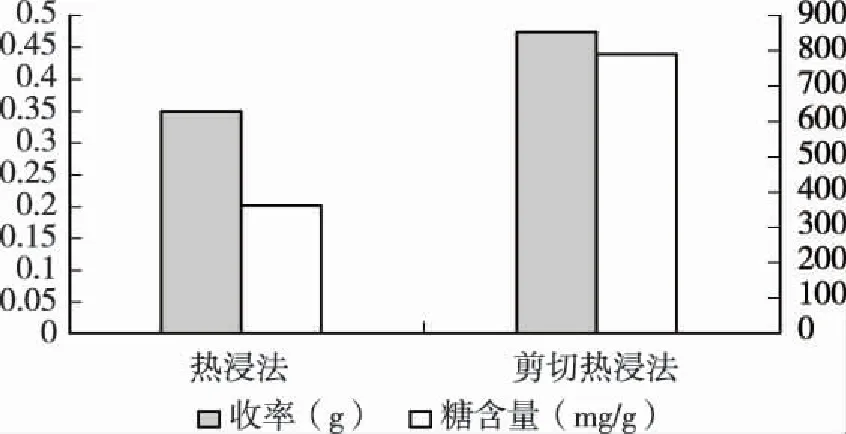
图4 热浸法与剪切热浸法
3结论
本试验为能更好地提取绣球菌菌丝体多糖,对从绣球菌菌丝体中提取多糖的方法进行了比较研究,选用剪切、热浸、超声、高压等做为提取多糖的方法,通过单一或复合处理,采用生物传感器测定多糖含量,对比了不同处理方法的提取效果,得出剪切高压法提取效果最好。剪切高压法利用剪切乳化机的剪切作用对绣球菌细胞壁的破坏与高压对绣球菌菌丝体细胞壁结构进一步破坏并使多糖充分溶出,使其对多糖的提取收率增加,其提取率最高,达到5.106%,且含糖含量也高,因此是一种理想的提取绣球菌多糖的方法。◇
参考文献
[1]何荣华.中国首次绣球菌研究栽培成功[J].中国食用菌,2005,25(1):45.
[2]黄建成,李开本,应正河,等.绣球菌蛋白质的有营养评价[J].菌物研究,2007,5(1):51-62.
[3]王伟科,袁卫东,周祖法.不同碳、氮源对绣球菌菌丝生长的影响研究[J].浙江农业科学,2007,1:47-49.
[4]Ohno N,Miura NN,Nakajima M,et al.Antitumor 1.3-β-D-glucan from cultured fruit body of sparassis crispa[J].Biol Pharm Bull,2000,23(7):866-872.
[5]HaradaT,KawaminamiH,Miura NN, et,al.Cell to cell contact through ICAM-1-LFA-1and TNF-αsynergistically contributes to GM-CSF and subsequent cytokine synthesis in DBA/2 mice induced by 1.3-β-D-Glucan SCG[J].J Interferon Cytokine Res,2006,26(4):235-247.
[6]HaradaT,Miura NN, AdachiY, et,al.IFN-rinduction by SCG 1.3-β-D-glucan from sparassis crispa in DBA/2 mice in vitro [J].J Interferon Cytokine Res,2005,25(3):125-130.
[7]HaradaT,Miura NN, AdachiY, et,al.Granulocyte-macrophage colony-stimulating factor(GM-CSF)regulates cytokine induction by 1.3-β-D-glucan SCG in DBA /2 mice in vitro[J].J Interferon cytokine Res,2004,24(8):478-489.
[8]Wang Z,et,al.Phylogenetic relationships of sparassis inferred from nuclear and mitochondrial ribosomal DNA or RNA Polymerase sequences[J].Mycologia,2004,96(5):1015-1029.
[9]王子辉,楚杰,王君高,刘可春.酶电极法测定海藻糖含量[J].食品工业科技,2010,11:366-368.
(责任编辑李燕妮)
作者简介:楚杰(1965—),女,学士,研究员,研究方向:生物研究。
Comparative Study on Extraction Methods of Hydrangea Polysaccharide
CHU Jie,LIU Shou-zhi,ZHANG Tao,HE Qiu-xia,LIU Ke-chun
(Institute of Biology,Shandong Academy of Sciences,Jinan 250014,China)
Abstract:The extraction methods of hydrangea polysaccharide was preliminarily studied and through the contrast including hot dipping,ultrasonic,shear,high-pressure and using single or complex treatment method, we explored the best extraction method were cut and high-pressure treatment, cut 10min at 10 000r/min, and high pressure treatment 30min,its extraction rate could reach 5.106%.
Keywords:Sparassis crispa;polysaccharide;extraction method

