载5-氟尿嘧啶壳聚糖/明胶微粒的制备及药物释放性能
贺宝元,张宝艳,李珊,薛海燕(陕西科技大学资源与环境学院,陕西 西安700;陕西科技大学食品与生物工程学院,陕西 西安 700)
研究开发
载5-氟尿嘧啶壳聚糖/明胶微粒的制备及药物释放性能
贺宝元1,张宝艳2,李珊2,薛海燕2
(1陕西科技大学资源与环境学院,陕西 西安710021;2陕西科技大学食品与生物工程学院,陕西 西安 710021)
摘要:壳聚糖及明胶是生物相容性良好的高分子药物载体,制备载5-氟尿嘧啶壳聚糖/明胶微粒,并进行体外释药研究。以石蜡油为外相,壳聚糖/明胶为内相,用乳化交联法制备微粒,以吸附药量为指标,采用正交设计实验优化获得最佳制备条件,用红外光谱、SEM对最佳条件下制备的微粒进行表征。结果表明壳聚糖/明胶微粒的最佳制备条件如下:水油比1∶7,壳聚糖/明胶浓度比1∶3,乳化剂100.7mmol/L,乳化5min,乳化温度60℃,交联剂戊二醛用量5.5mmol/L,交联时间1h。在此条件下,载药微粒的载药量为34.93%,包封率为38.36%。红外光谱图表明壳聚糖/明胶微粒已负载5-氟尿嘧啶,SEM表明微粒成球状,表面较光滑。模拟胃肠释放表明,微粒具有一定的缓释性能。采用乳化交联法制备载5-氟尿嘧啶壳聚糖/明胶微粒方法简单,重现性好,且其体外释放实验显示出明显的缓释作用。
关键词:制备;优化设计;载体;壳聚糖;明胶;5-氟尿嘧啶;体外释药
5-氟尿嘧啶是一种抗癌药物,用于消化道恶性肿瘤的治疗。目前已证实5-氟尿嘧啶对人舌鳞癌ca8113中肿瘤干细胞具有富集作用[1]。但由于5-氟尿嘧啶的血浆半衰期非常短,仅为10~20min,需要频繁给药,而且对人体毒副作用大[2]。近年来高分子载药微球新剂型发展迅速,包囊后可提高药物的生物利用率和生物稳定性。明胶具有良好的水溶性、无毒、无抗原等特点,被应用于药物载体,但是其质脆,难以成膜,不耐水,潮湿环境中易受细菌侵蚀而变质[3],壳聚糖具有良好的生物相容性及抗菌防腐的功能[4]。将壳聚糖和明胶共混,可以使两种材料的生理功能协同增效以及材料自身的理化性质得以改善[5]。本研究以石蜡油为外相、壳聚糖/明胶为内相,采用乳化交联法制备壳聚糖/明胶载5-氟尿嘧啶的微粒,以吸附药量为指标,正交试验优化制备工艺条件,并且对载药微粒的体外释药性能进行研究。
1 材 料
明胶,药用,天津市天力化学试剂有限公司;壳聚糖,90%脱乙酰度,浙江金壳药业有限公司;Span-80,化学纯,天津市福晨化学试剂厂;5-氟尿嘧啶,98%纯品,上海源叶生物科技有限公司;5-氟尿嘧啶标准品,国家药品标准物质,中国食品药品检定研究院;磷酸氢二钠,分析纯,天津市红岩化学试剂厂;蒸馏水,食品级,西安哇哈哈桶装水有限公司;氯化钠,分析纯,天津市河东区红岩试剂厂;磷酸二氢钾,分析纯,天津市河东区红岩试剂厂;其余试剂均为分析纯,天津市天力化学试剂有限公司。
HH系列数显恒温水浴锅,金坛市科析仪器有限公司;精密增力电动搅拌器,常州国华电器有限公司;电子天平,北京赛多利斯仪器系统有限公司;752型紫外分光光度计,上海光谱仪器有限公司;101-2A型电热鼓风干燥箱,天津市泰斯特仪器有限公司;SC-3610低速离心机,科大创新股份有限公司中佳分公司;SHB-3型循坏水多用真空泵,郑州杜甫仪器厂;倒置显微镜;恒温震荡器;VERTEX80傅里叶变换红外光谱仪,德国布鲁克公司;扫描电子显微镜,荷兰FEI。
2 方 法
2.1 载药微粒的制备
称取一定量的 5-氟尿嘧啶溶于壳聚糖的3%乙酸溶液,与明胶溶液混合,用该混合液作为水相。量取油相液体石蜡和表面活性剂span-80加入到三口烧瓶中,在60℃水浴恒温中均匀搅拌,20min后,再滴加入水相,乳化至显微镜下液滴均匀稳定,使温度达到15℃以下,加入一定量戊二醛(50%)固化微球。产物在1000r/min下离心15min,去除上层油相,用异丙醇、丙酮分别润洗3次,抽滤真空干燥即得到载药微粒[6]。
2.2 5-氟尿嘧啶标准曲线的测定
精密称取5-氟尿嘧啶对照品2.5mg,用0.1mol/L的盐酸溶液溶解,稀释定容50 mL,吸取0.75mL、1.0mL、1.25mL、1.5mL、2.0mL、2.5mL于 10mL容量瓶中,用0.1mol/L的盐酸溶液定容,以0.1mol/L的盐酸溶液做空白,在265nm处用石英比色皿测定吸光度,经线性拟合得到标准曲线方程[7]。
2.3 壳聚糖/明胶微粒最佳制备条件的正交试验优化
水油比过大时分散在油相中的液滴增多,液滴之间的油层隔膜相对变薄,搅拌时容易打碎隔膜,制备的微粒相互之间发生碰撞,容易发生团聚和粘连,粒径分布不均匀的现象;水油比过小时,黏度太大,会使载药量和包封率下降且成本高。乳化时间太短反应不充分,但是乳化时间太长会使乳液黏度逐渐下降,不利于包载药物。壳聚糖/明胶的浓度比直接影响到微粒壁的厚度从而影响包封率和载药量,所以对微粒制备工艺条件影响比较大的因素水油比(A)、乳化时间(B)和壳聚糖/明胶浓度比(C)3个因素,每个因素做3水平,采用L9(34)正交试验以吸附药量作为评价指标,优化制备条件,其中戊二醛用量 5.5mmol/L,交联时间 1h,表面活性剂span-80用量100.7mmol/L。
2.4 载药量和包封率测定
精密称取 20 mg载药微粒于烧杯中,加入0.1mol/L盐酸溶液 20mL,在 60℃水浴中充分反应[8],过滤,吸取滤液0.5mL用0.1mol/L盐酸溶液定容至5mL,在265nm处测定吸光度,根据5-氟尿嘧啶标准曲线计算浓度。
载药量和包封率按式(1)、式(2)计算。

2.5 显微镜和SEM检测
在最佳指标条件下,取乳化结束后的乳液滴加至载玻片上,使其分布均匀,用倒置显微镜观察。取适量干燥后的微粒喷金处理后用 SEM进行分析检测。
2.6 红外光谱检测
用无水酒精清洗玛瑙碾具,将壳聚糖/明胶微粒与干燥的溴化钾混合,载药微粒和干燥的溴化钾混合,分别研细后压片,用傅里叶红外色谱仪在400~4000cm–1处测样[9]。
2.7 体外释药试验方法
2.7.1 人工胃液的配制
取10g胃蛋白酶溶于500mL水中,加盐酸调节pH为1.2左右,加入2gNaCl,将溶液稀释至1000mL制成人工胃液[10]。
2.7.2 PBS溶液中体外释放度的测定方法
参照文献[11]中体外释放度测定方法,每隔30min取样10mL,滤除微粒,检测滤液中药物浓度,计算累积释放率。
2.7.3 模拟人工胃液中体外释放度的测定方法
精密称取10mg载药微粒,将上述在PBS溶液换成模拟人工胃液,测定模拟人工胃液体外的释放度。取样同上。
3 结果与分析
3.1 5-氟尿嘧啶的检测标准曲线
采用紫外吸收法测定5-氟尿嘧啶,制作标准曲线。用测得的吸光度对浓度回归,作标准曲线和计算回归方程。结果如图1所示。由图1可以看出,5-氟尿嘧啶标准曲线线性回归方程为y=0.0645x-0.0044,R2=0.9991,5-氟尿嘧啶在 3~15μg之间有良好的线性关系。
3.2 正交设计优化载药微粒制备工艺
对载药微粒的制备工艺条件进行正交试验优化。正交试验结果如表1所示。
以吸附药量为评判标准,由表1正交试验结果可知,水油比(A)、乳化时间(B)和壳聚糖/明胶浓度比(C)3个因素的对载药量的影响R2>R3>R1,因此在微粒的制备过程中,影响因素最大的是乳化时间,其次是壳聚糖/明胶浓度比,最后影响因素最小的是水油比。试验最佳组合为A1B1C2,根据影响因素的大小和成本确定工艺条件:水油比1∶7,乳化时间5min,壳聚糖/明胶浓度比1∶3,乳化温度60℃,戊二醛用量5.5mmol/L,交联时间1h,表面活性剂用量100.7mmol/L。经验证,在此条件下,载药微粒的载药量为6.986mg,制备的载药微粒载药量为34.93%,包封率为38.36%。
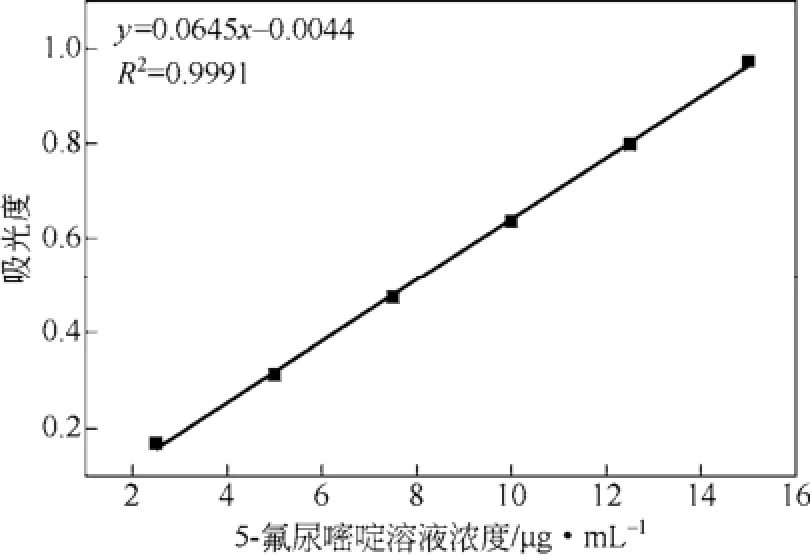
图1 5-氟尿嘧啶的检测标准曲线
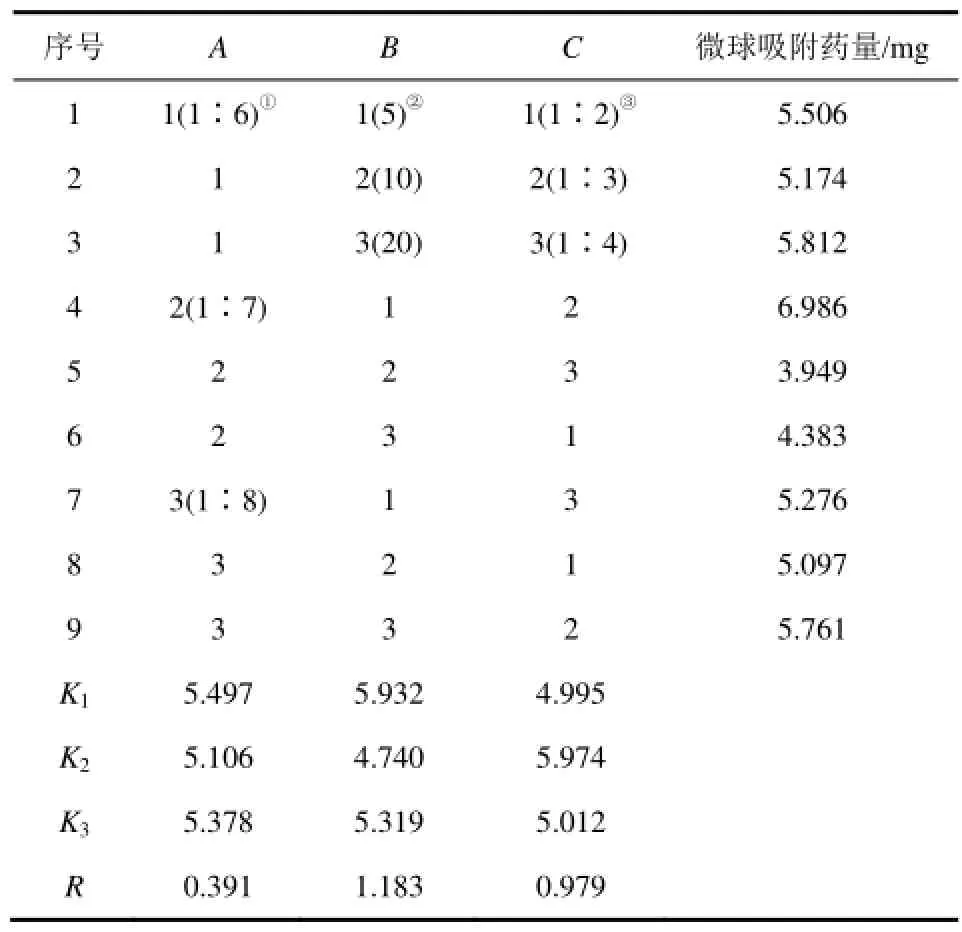
表1 载药微球制备最佳工艺条件正交试验结果
3.3 载药乳液和SEM微粒形态
用倒置显微镜观察乳液形态,如图2(a)所示。用电子扫描显微镜对载药微粒进行形态观察,如图2(b)所示。
由图2(a)可以看出,载药乳液表面光滑,相对比较均匀,成球状。由图2(b)可看出载药微粒成球状,形态比较均匀,表面光滑。

图2 载药乳液及载药乳液的形态
3.4 5-氟尿嘧啶以及载药微粒的红外图谱分析
5-氟尿嘧啶的红外图谱如图3(a),壳聚糖/明胶微粒及载药微粒的红外图谱如图3(b)所示。
由图 3(a)所示 5-氟尿嘧啶的 IR谱中3068.57cm–1为 C=C 的伸缩振动吸收峰,1662.01cm–1为 C=O 的伸缩振动吸收峰,1430.92cm–1为—CF—CH—中的C—H的面内弯曲振动,877.55cm–1—CF—CH—中的C—H的面外弯曲振动吸收峰,814.06cm–1和 752.01cm–1为—CF—CH—中的 C—H 的面外变形振动,1246.71cm–1为C—N的伸缩振动吸收峰。由图3(b)中载5-氟尿嘧啶壳聚糖/明胶微粒IR谱中存在5-氟尿嘧啶的特征吸收峰[12],例如,1666.65cm–1,C=O 和C=C伸缩振动的重合吸收峰;1450.47cm–1,—CF—CH—中的 C—H的面内弯曲振动;1244.95cm–1,C—N伸缩振动。在901.77cm–1处出现了5-氟尿嘧啶中的—CF—CH—中的C—H的面外弯曲振动蓝移的吸收峰,这说明了5-氟尿嘧啶经壳聚糖包裹后,壳聚糖削弱了5-氟尿嘧啶分子之间的作用力,使吸收峰红移。壳聚糖明胶微粒的特征吸收峰出现在1666.65cm–1,C=O伸缩振动,1539.65cm–1,C=N伸缩振动,这是壳聚糖明胶被戊二醛交联后所形成的席夫碱的特征结构,1405.67cm–1,—CH2—弯曲振动,1076.01cm–1和1033.34cm–1,壳聚糖吡喃环中C—H的弯曲振动[9]。因此,由红外光谱可知,载药微粒中存在5-氟尿嘧啶。

图3 5-氟尿嘧啶及壳聚糖/明胶微粒与载药微粒的红外图谱
3.5 载药微粒的体外释药分析
3.5.1 载药微粒在PBS溶液中的释药分析
载药微粒在PBS溶液中的累积释放曲线如图4所示。
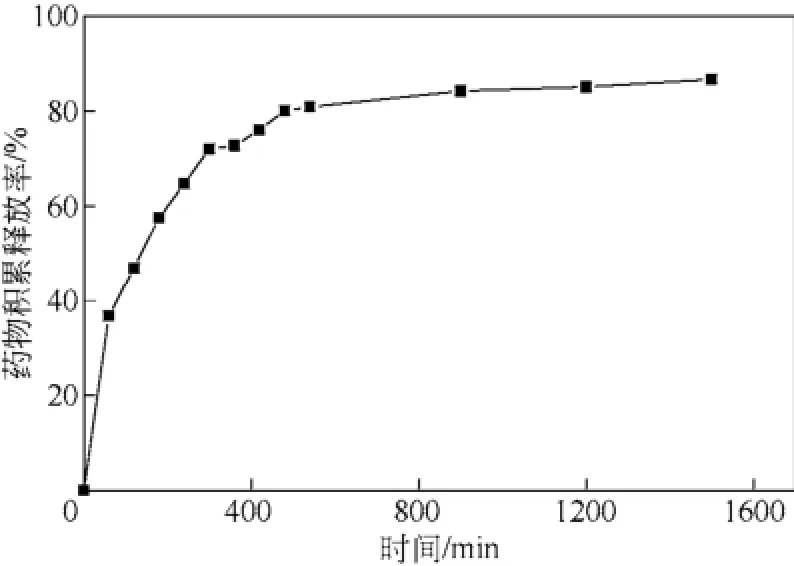
图4 载药微粒在PBS溶液中的累积释放曲线
由图4可知,载药微粒的释药前期出现了一定程度的突释现象。在5h时,累积释药量达到70%,其主要原因可能是由于壳聚糖主链的疏水作用和5-氟尿嘧啶的亲水作用,使链状壳聚糖5-氟尿嘧啶在水溶液中有自聚成团的趋势,这样就导致亲水性的药物部分在团外,有利于药物分子的渗透和扩散[13]。另外,5-氟尿嘧啶本身的水溶性也有利于自身的溶解作用。因此,在前10h表现为一定程度的突释现象。后阶段释放很缓慢,趋于平缓。这除了受浓度减小的影响外,还有可能与5-氟尿嘧啶与壳聚糖之间的作用力有关。由于5-氟尿嘧啶中的强电负性原子,O、N、F与壳聚糖分子中的—OH氢原子形成了比较强的氢键或者 5-氟尿嘧啶中的—NH—中氢原子与壳聚糖分子中的氧原子和氮原子之间形成了氢键,从而使5-氟尿嘧啶与壳聚糖之间的结合比较强,5-氟尿嘧啶难从微粒中释放出来,但是在水分子的不断作用下,氢键被破坏,5-氟尿嘧啶又从微粒中缓慢地释放出来,直至释放完全。
3.5.2 载药微粒在人工胃液中的释药分析
载药微粒在人工胃液中的累积释放曲线如图 5所示。
由图5可知,载药微粒在pH为1.2的人工胃液中前60min释放较快,累积释放量为70%,而后药物释放速度较慢,这可能是在强酸环境中H+与微粒表面的—NH2很快结合形成—NH,使微粒表面较快溶胀并释放药物,60min后微粒溶胀速度变缓慢,5-氟尿嘧啶原料药在 45min内累计释药达到了100%[13],因此载药微粒明显表现出缓释现象,6h后药物累积释放量接近90%。
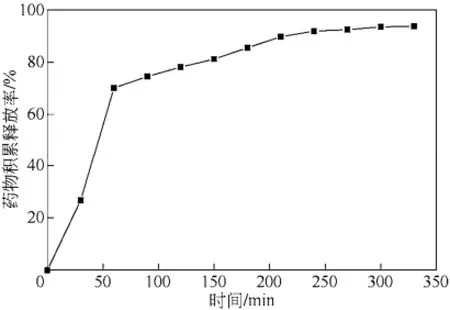
图5 载药微粒在模拟人工胃液中的累积释放曲线
4 结 论
采用乳化交联法初步制备了 5-氟尿嘧啶壳聚糖/明胶的载药微粒,通过正交试验确定了最佳制备工艺条件为:水油比1∶7,壳聚糖与明胶浓度比1∶3,乳化时间 5min,乳化温度 60℃,戊二醛用量5.5mmol/L,交联时间1h,乳化剂用量100.7mmol/L。在此条件下,载药微粒的载药量为34.93%,包封率为38.36%。微球在显微镜下光滑,均匀。载药微粒的红外光谱图表明壳聚糖负载5-氟尿嘧啶。在PBS缓冲溶液中8h累积释药量为80%,在模拟人工胃液中3h累积释药量为85%,体外释药性能表明微粒具有明显的缓释作用,但微囊的体内缓释效果还有待于进一步用动物试验验证。
参考文献
[1] 徐望,季平.5-氟尿嘧啶对人舌鳞癌 Tca8113中肿瘤干细胞的富集作用[J].中国组织工程研究,2015,19(10):1482-1487
[2] 孟晓荣,张邵文,高晨光,等.5-氟尿嘧啶/琥珀酰化壳聚糖偶联载药体的合成与表征[J].功能材料,2013,44(22):3239-3242.
[3] WU Hong,LU Xia,LI Xianshi,et al. Enhancing structural stability and pervaporation performance of composite membranes by coating gelatin onto hydrophilicallymodified support layer[J].Chinese Journal of Chemical Engineering,2014,22(1):19-27.
[4] 李明春,许涛,辛梅华.壳聚糖及其衍生物的抗菌活性研究进展[J].化工进展,2011,30(1):203-209.
[5] 宋慧君,孟春丽,汤克勇.明胶-壳聚糖复合膜的制备与性能[J].高分子材料科学与工程,2011,27(8):165-167,171.
[6] 吴静,冯芳,林香春,等.羧甲基壳聚糖载药微粒的制备及其释药效能[J].中国现代医学杂志,2011,21(21):2584-2587.
[7] 马素英,尚校军,马伟伟,等.阿奇霉素微囊的制备与质量控[J].中国药房,2010,21(33):3135-3137.
[8] 侯遂林,伏晓.5-氟尿嘧啶-壳聚糖微囊的制备和体外释放的研究[J].医学信息,2010,5(7):1869-1870.
[9] 刘婕,曹文杰,朱志谦.红外光谱测定烃类航空润滑油中 2,6-二叔丁基对甲酚含量影响因素研究[J].石油化工应用,2013,32 (10):122-124.
[10] 金邻豫,白颖,赵辉,等.5-氟尿嘧啶-壳聚糖微囊体外释放度测定方法的建立[J].河南大学学报(医学版),2010,29(4):259-260.
[11] 刘艳,张志鹏,索绪斌,等.缓控释制剂体外释放度的研究进展[J].时珍国医国药,2011,22(3):701-703.
[12] 高书涛,邱红,刘彦钦,等.新型间氯苯基卟啉-5-氟尿嘧啶及其锌配合物的合成及光谱特征[J].河北师范大学学报(自然科学版),2009,33(4):497-501.
[13] 毕秀增,潘伟华,南开辉,等.5-氟尿嘧啶缓释剂制备及体外释药性能比较[J].中国组织工程研究,2012,16(8):1430-1434.
第一作者:贺宝元(1977—),男,博士,讲师,研究方向为生物功能材料开发。联系人:张宝艳,硕士研究生。E-mail zhangbaoyan163@163.com。
中图分类号:O 636
文献标志码:A
文章编号:1000-6613(2016)07-2151-05
DOI:10.16085/j.issn.1000-6613.2016.07.031 Preparation of 5-fluorouracil loaded chitosan/gelatin particles and its’drug release properties HE Baoyuan1,ZHANG Baoyan2,LI Shan2,XUE Haiyan2
收稿日期:2015-11-06;修改稿日期:2016-02-04。
基金项目:国家自然科学基金(31301405)、陕西省科技统筹计划(2013KTZB02-02-05(2))、西安市科技计划(CXY1434(4))及陕西省教育厅专项(16JK1088)项目。
(1School of Resource and Environment,Shaanxi University of Science and Technology,Xi’an 710021,Shaanxi,China;2School of Food and Biological Engineering,Shaanxi University of Science and Technology,Xi’an 710021,Shaanxi,China)
Abstract :Chitosan and Gelatin are good biocompatible polymers and are suitble for drug carriers.Preparation of 5-fluorouracil loaded chitosan/gelatin particles and in vitro release were performed using emulsion crosslinking method with paraffin oil as external phase and chitosan/gelatin as internal phase,and the optimal formulations were verified by orthogonal design.The drug loading,encapsulation efficiency,the microscopic morphology and release behavior of drug loaded particles in vitro were examined.The optimal preparation conditions were:the ratio of water to oil 1∶7,the ratio of chitosan/gelatin concentration 1∶3,emulsifying time 5min,emulsifying temperature 60℃,glutaraldehyde dosage 5.5mmol/L,reaction time 1h,and emulsifier dosage 100.7mmol/L.Under these conditions,the drug loading of particles was 34.96% and encapsulation efficiency was 38.36%.Infrared spectroscopy showed that chitosan/gelatin microparticles have loaded 5-Fu.Microparticles were spherical with smooth surface.5-Fu can be encapsuoed in chitosan/gelatin by emulsion crosslinking method.This method was simple and reproducible and drug release performance in vitroshowed that the microparticles had obviously sustained release effect.
Key words:preparation;optimal design;support;chitosan;gelatin;5- fluorouracil;in vitro drug release

