施马伦贝格病毒核衣壳蛋白的表达及单克隆抗体制备
张永宁,宋姗姗,吴绍强,林祥梅
(中国检验检疫科学研究院 动物检疫研究所,北京 100029)
施马伦贝格病毒核衣壳蛋白的表达及单克隆抗体制备
张永宁#,宋姗姗#,吴绍强,林祥梅*
(中国检验检疫科学研究院 动物检疫研究所,北京 100029)
为表达与纯化具有天然构象的施马伦贝格病毒(Schmallenberg virus,SBV)核衣壳(N)蛋白,并制备其单抗(McAb),本研究在SBV-N基因的N端加入6个组氨酸(6×His)标签后,将其克隆至杆状病毒表达载体pFastBacTM1中,构建重组供体质粒pFastBac-His-SBV-N。将pFastBac-His-SBV-N转化DH10BacE.coli,通过蓝白斑筛选获得重组杆粒rBacmid-His-SBV-N。将rBacmid-His-SBV-N转染Sf9昆虫细胞制备表达His-SBV-N融合蛋白的重组杆状病毒,借助Ni-NTA琼脂糖纯化重组杆状病毒感染Sf9细胞中的His-SBV-N蛋白。以纯化的His-SBV-N免疫BALB/c小鼠制备McAb,利用ELISA叠加试验检测McAb抗原识别位点的异同,并采用高碘酸钠法对识别不同抗原表位的McAb进行辣根过氧化物酶(HRP)标记。最终获得了4株识别不同抗原表位的McAb(2A11、2E1、4H11和6E12)并进行了HRP标记;亚型鉴定表明,2A11为IgG1亚型,2E1、4H11和6E12均为IgG2b亚型;间接免疫荧光试验证实,4株McAb均能够识别稳定表达SBV-N蛋白的BHK-21细胞系;Western blot进一步表明,HRP标记的4株McAb均与His-SBV-N蛋白发生特异性反应。His-SBV-N融合蛋白及其McAb的成功制备,为施马伦贝格病血清学检测方法的建立提供了良好的生物材料。
施马伦贝格病毒;核衣壳蛋白;杆状病毒表达载体;昆虫细胞;单克隆抗体
施马伦贝格病是由布尼亚病毒科(Bunyaviride)正布尼亚病毒属(Orthobunyavirus)的施马伦贝格病毒(Schmallenberg virus,SBV)引起的一种以发热、腹泻、产奶量下降及孕畜流产、产死胎或畸形胎为主要临床症状的虫媒病[1-2],传播媒介为库蠓[3],主要感染绵羊、牛和山羊等反刍动物[1-2]。公开资料显示,目前该病主要流行于欧洲地区,而且呈现出向其他国家传播的趋势[4-6]。
SBV为单股负链的RNA病毒,基因组分为L、M和S三个基因节段[1,7]。S基因核苷酸序列相对保守,编码核衣壳(N)蛋白和非结构蛋白NSs[7];N蛋白由702个核苷酸编码,相对分子质量约为26 ku[7-8]。N蛋白是SBV病毒粒子中含量丰富、免疫原性强的蛋白质,能够刺激动物机体产生早期抗体,成为SBV诊断的靶抗原[9-10]。
作者利用昆虫杆状病毒表达系统表达SBV-N蛋白,并制备其McAb(monoclonal antibody),进而筛选识别不同抗原表位的McAb进行HRP标记,以期为施马伦贝格病血清学检测方法的建立提供生物材料。
1 材料与方法
1.1材料
1.1.1主要试剂Ni-NTA琼脂糖和质粒提取试剂盒为Qiagen公司产品;EcoRⅠ和NotⅠ为New England Biolabs公司产品;Sf-900 Ⅱ SFM、Grace昆虫细胞培养基和Cellfectin®Ⅱ转染试剂盒均为Invitrogen公司产品;ECL化学发光底物试剂盒为Thermo Scientific公司产品;Protein G Sepharose购自GE Healthcare公司;罗丹明(TRITC)标记山羊抗小鼠IgG(IgG-TRITC)、HRP标记山羊抗小鼠IgG(IgG-HRP)、高碘酸钠和鼠McAb分型试剂盒购自Sigma公司。
1.1.2质粒、载体和细胞pET-28a-SBV-N重组质粒[11]、pFastBacTM1杆状病毒表达载体、DH5α、DH10BacE.coli、Sf9昆虫细胞、SP2/0细胞、稳定表达SBV-N蛋白的BHK-21细胞(BHK-21-EGFP-SBV-N)[12]均由中国检验检疫科学研究院动物检疫实验室制备和/或保存。
1.1.3实验动物6周龄雌性BALB/c小鼠购自北京维通利华实验动物技术有限公司。
1.2SBV-N基因的扩增与纯化
根据GenBank中SBV的N基因序列(登录号HE649914)设计1对引物,并在上游引物5′端引入EcoRⅠ识别位点和6×His编码序列(斜体部分),下游引物5′端引入NotⅠ的识别位点。上游引物为:5′ -CGGAATTCATGCATCACCATCACCATCACATGTCAAGCCAATTCATT-3′(下划线处为EcoR Ⅰ识别位点),下游引物为:5′-TTTATAG-CGGCCGCTTAGATGTTGATACCGAATTGCTGCAAG-3′(下划线处为NotⅠ识别位点),预期扩增片段大小为745 bp。以pET-28a-SBV-N为模板,68 ℃的退火温度PCR扩增N基因序列。PCR产物进行回收与纯化。
1.3重组供体质粒的构建
对PCR回收产物和pFastBacTM1载体分别进行EcoRⅠ/NotⅠ双酶切(37 ℃,2 h),利用T4 DNA连接酶连接两者的回收片段。将连接产物转化DH5αE.coli,过夜培养,挑取单菌落摇菌进行测序鉴定,将鉴定为阳性的重组质粒命名为pFastBac-His-SBV-N。
1.4重组杆粒的构建
将pFastBac-His-SBV-N转化至含有杆状病毒穿梭载体(杆粒)的DH10BacE.coli,涂布于含卡那霉素(50 μg · mL-1)、四环素(10 μg · mL-1)和庆大霉素(7 μg · mL-1)、Bluo-gal(100 μg · mL-1)和IPTG(40 μg · mL-1)的LB琼脂板上,37 ℃培养48 h,借助蓝白斑筛选,挑取白色单菌落进行测序鉴定,将鉴定为阳性的重组杆粒命名为Bacmid-His-SBV-N。
1.5重组杆状病毒的制备
按照Invitrogen Cellfectin®Ⅱ转染试剂说明书,将rBacmid-His-SBV-N转染Sf9昆虫细胞,27 ℃培养96 h左右,待细胞生长停滞、形成出芽囊泡、直至细胞发生解离甚至崩解时,离心(500×g,5 min)收集细胞上清液,即为第1代(P1)重组杆状病毒,置4 ℃避光保存。将P1代重组杆状病毒接种Sf9细胞获得第2代(P2)重组杆状病毒;以相同的方式获得第3代(P3)重组杆状病毒。同时设置pFastBacTM1空载体重组杆粒(rBacmid)转染的Sf9细胞为阳性对照。
1.6重组His-SBV-N蛋白的纯化
收集P3代重组杆状病毒感染的Sf9细胞(约9×107个),利用RIPA裂解液裂解细胞,离心(4 ℃,12 000×g,5 min)收集蛋白质上清液,利用Ni-NTA琼脂糖纯化其中的重组His-SBV-N蛋白,具体操作参照文献[12]。
1.7重组His-SBV-N蛋白McAb的制备与纯化
以纯化的His-SBV-N蛋白为免疫原免疫6周龄BALB/c小鼠,采用常规的方法建立稳定分泌McAb的杂交瘤细胞株,利用Protein G Sepharose从小鼠腹水中纯化McAb,参考文献[13]操作。
1.8McAb抗原识别位点的分析
将His-SBV-N蛋白以2 μg · mL-1的量包被ELISA板,经过洗涤、封闭,将各株McAb分别稀释至饱和稀释度后,向每孔加入100 μL,37 ℃反应30 min;洗涤后两两组合加入另一株McAb,37 ℃反应30 min;洗涤后向每孔加入100 μL工作浓度的山羊抗小鼠IgG-HRP,37 ℃反应30 min;洗涤后加底物显色,测定OD450 nm值;按照文献[14]给出的公式计算两种McAb叠加后的相加指数,藉此判定McAb识别抗原位点的异同。
1.9McAb的亚型鉴定
利用Sigma公司的鼠McAb分型试剂对McAb进行亚型鉴定,按照试剂盒说明书进行操作。
1.10McAb的间接免疫荧光试验
制备BHK-21-EGFP-SBV-N细胞爬片,以制备的McAb为一抗、山羊抗小鼠IgG-TRITC为二抗对细胞进行荧光染色,利用荧光显微镜进行检测,操作参照文献[12]。
1.11McAb的HRP标记及效价测定
称取5 mg HRP溶于1 mL蒸馏水,加入0.2 mL新配的0.1 mol · L-1高碘酸钠溶液,室温避光搅拌20 min;将溶液装入透析袋中,置1 mmol · L-1(pH4.4)乙酸钠缓冲液中4 ℃过夜透析;取出HRP溶液,用0.2 mol · L-1(pH9.5)碳酸盐缓冲液将pH值调整至9.0~9.5,立即加入5 mg纯化的McAb,室温避光反应2 h;加入0.1 mL 4 mg · mL-1的硼氢化钠溶液,室温避光反应2 h;将上述液装入透析袋,利用PBS(pH7.4)4 ℃过夜透析,透析期间换液2次。
利用间接ELISA测定McAb效价。将纯化的SBV-N蛋白以2 μg · mL-1浓度包被ELISA板,100 μL · 孔-1,将HRP标记的McAb从1∶500开始作2倍比稀释,以免疫前的小鼠血清作为阴性对照,以P/N≥2.1的最大稀释度作为McAb效价。
1.12HRP标记McAb的Western blot鉴定
将纯化后的His-SBV-N蛋白从12% SDS-PAGE胶中转印至PVDF膜上,以HRP标记的McAb为二抗进行Western blot检测。
2 结 果
2.1His-SBV-N目的基因的扩增
以pET-28a-SBV-N为模板,利用设计的特异性引物PCR扩增目的基因。琼脂糖凝胶电泳结果显示,PCR扩增获得一条约745 bp的目的片段(图1),与预期相符。

1.阴性对照;2.DNA相对分子质量标准;3.pET-28a-SBV-N重组质粒1.Negative control;2.DL2000 DNA marker;3.The recombinant pET-28a-SBV-N plasmid图1 PCR扩增产物的琼脂糖凝胶电泳分析Fig.1 Agarose gel electrophoresis analysis of the PCR amplification product
2.2pFastBac-His-SBV-N的构建与鉴定
回收PCR产物,经EcoRⅠ/NotⅠ酶切后,将其克隆至杆状病毒表达载体pFastBacTM1中构建pFastBac-His-SBV-N。质粒测序结果表明,N基因序列、插入位置以及阅读框均准确无误(图略)。
2.3rBacmid-His-SBV-N的筛选与鉴定
将pFastBac-His-SBV-N转化DH10BacE.coli,经过抗性和蓝白斑筛选,pFastBac-His-SBV-N与DH10BacE.coli内含有的杆粒进行位点特异性转座,最终形成rBacmid-His-SBV-N。抽提质粒进行测序鉴定,结果证实His-SBV-N基因已经成功转座至Bacmid中(图略),说明rBacmid-His-SBV-N构建成功。
2.4重组杆状病毒的制备与滴度测定
抽提rBacmid-His-SBV-N,转染对数生长期的Sf9昆虫细胞。与正常Sf9细胞对照相比(图2A),转染rBacmid-His-SBV-N(图2B)和rBacmid(图2C)的细胞,出现细胞间隙增大,细胞体积变大、变圆,并形成出芽囊泡,部分细胞脱落漂浮,于转染后120 h左右出现细胞崩解等现象(图2D)。滴度测定结果表明,P1、P2和P3代重组杆状病毒的滴度分别为6×106、7×107和6×108空斑形成单位· mL-1。
2.5重组His-SBV-N蛋白的纯化
提取P3代重组杆状病毒感染的Sf9细胞总蛋白,利用Ni-NTA对其中的重组His-SBV-N蛋白进行纯化。SDS-PAGE结果显示,His-SBV-N蛋白得以成功纯化,其纯度达90%以上(图3,泳道5),质量浓度约为0.1 mg · mL-1。
2.6McAb的筛选与亚型鉴定
借助ELISA叠加试验检测每株McAb抗原识别位点的异同,最终获得了4株识别不同抗原表位的McAb,分别命名为2A11、2E1、4H11和6E12。亚型鉴定表明,2A11为IgG1亚型,2E1、4H11和6E12均为IgG2b亚型。SDS-PAGE显示,4株McAb的纯度均在95%以上,抗体的重链(Mr为56 000)和轻链(Mr为28 000)清晰可辨(图4)。

A.正常Sf9细胞;B.转染rBacmid-His-SBV-N 96 h的Sf9细胞;C.转染rBacmid 96 h的Sf9细胞;D.转染rBacmid-His-SBV-N 120 h的Sf9细胞A.Normal Sf9 cells;B.Sf9 cells transfected with the rBacmid-His-SBV-N for 96 h;C.Sf9 cells transfected with the rBacmid for 96 h;D.Sf9 cells transfected with the rBacmid-His-SBV-N for 120 h图2 重组杆状病毒在Sf9昆虫细胞中的增殖(60×)Fig.2 Proliferation of the recombinant baculoviruses in Sf9 insect cells (60×)
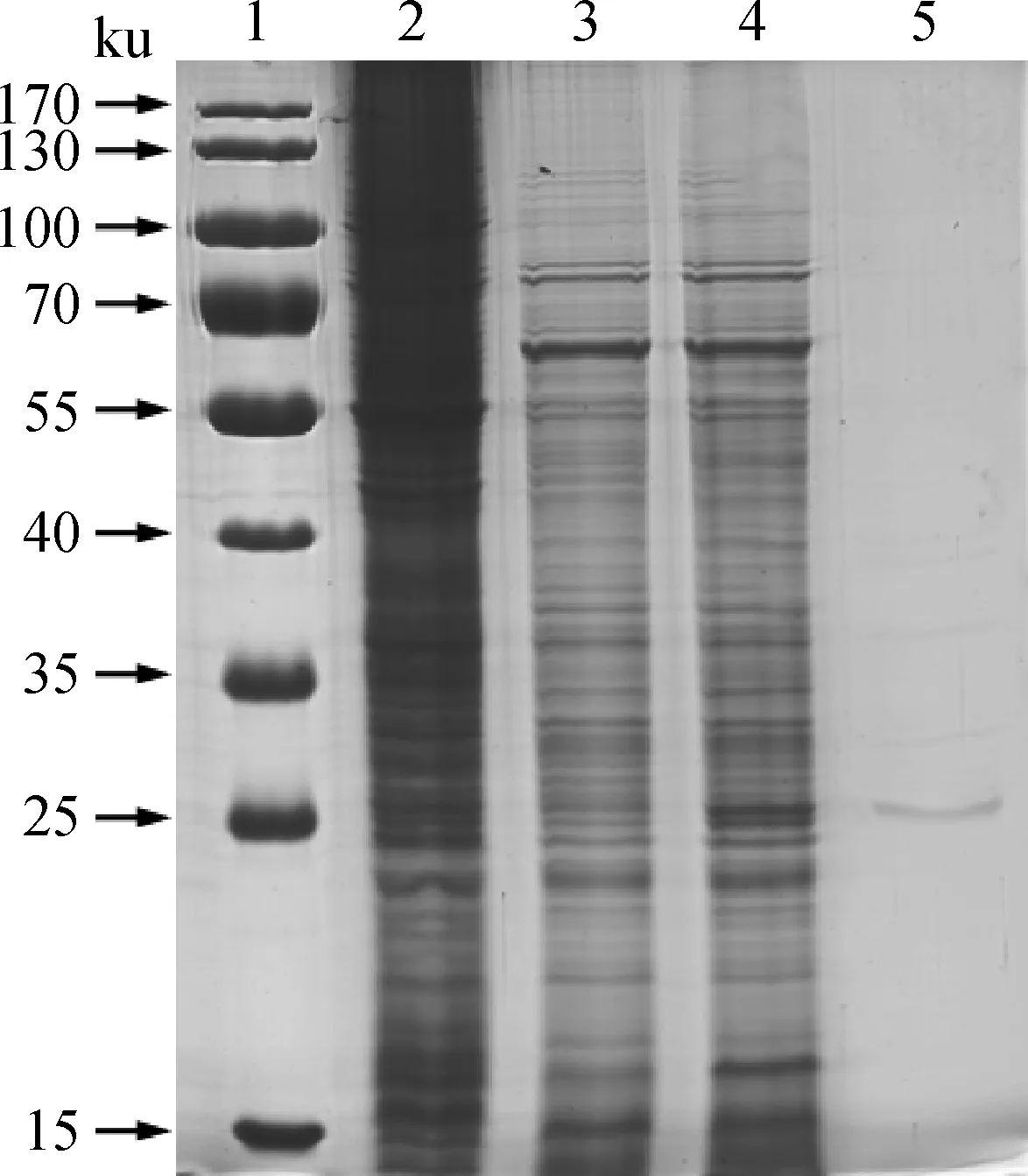
1.蛋白质相对分子质量标准;2.rBacmid转染的Sf9细胞总蛋白质;3.正常Sf9细胞总蛋白质;4.rBacmid-His-SBV-N转染的Sf9细胞总蛋白质;5.经Ni-NTA纯化的重组His-SBV-N蛋白1.Prestained protein marker;2.Total cellular proteins extracted from Sf9 cells transfected with the rBacmid;3.Total cellular proteins extracted from normal Sf9 cells;4.Total cellular proteins extracted from Sf9 cells transfected with the rBacmid-His-SBV-N;5.The recombinant His-SBV-N protein purified by Ni-NTA agarose图3 重组His-SBV-N蛋白的SDS-PAGE分析Fig.3 SDS-PAGE analysis of the recombinant His-SBV-N protein

M.蛋白质相对分子质量标准;1.单抗2E1;2.单抗2A11;3.单抗4H11;4.单抗6E12M.Prestained protein marker;1.McAb 2E1;2.McAb 2A11;3.McAb 4H11;4.McAb 6E12图4 纯化后的单克隆抗体的SDS-PAGE分析Fig.4 SDS-PAGE analysis of the purified McAbs
2.7McAb的免疫荧光分析
分别以McAb 2A11、2E1、4H11和6E12为一抗,山羊抗小鼠IgG-TRITC为二抗对BHK-21-EGFP-SBV-N细胞进行间接免疫荧光检测。结果表明,细胞质内的绿色点状荧光信号(自发信号)能够与红色点状荧光信号(染色信号)发生共定位(图5A),证实McAb 2A11能够识别SBV-N蛋白;其他3株McAb亦能与BHK-21-EGFP-SBV-N细胞发生特异性反应(图略)。但腹腔注射SP2/0骨髓瘤细胞的BALB/c小鼠的腹水与BHK-21-EGFP-SBV-N不反应(图5B)。
2.8HRP标记McAb的鉴定与效价测定
利用高碘酸钠氧化法对4株McAb进行HRP标记,通过Western blot检测HRP标记的McAb与His-SBV-N蛋白的反应情况。结果表明,HRP标记的4株McAb均可特异性地识别His-SBV-N蛋白(图6)。间接ELISA证实,4株HRP标记McAb的效价均在1∶512 000以上。
A.单抗2A11与BHK-21-EGFP-SBV-N细胞反应情况分析;B.McAb (-)与BHK-21-EGFP-SBV-N细胞反应情况分析[McAb (-)表示腹腔注射SP2/0骨髓瘤细胞的BALB/c小鼠腹水]A.The reactivity of McAb 2A11 with BHK-21-EGFP-SBV-N cell line;B.The reactivity of McAb (-) with BHK-21-EGFP-SBV-N cell line [McAb (-) indicates the ascitic fluid of a BALB/c mouse which was intraperitoneally injected with SP2/0 myemola cells]图5 纯化后的单克隆抗体的间接免疫荧光分析Fig.5 Indirect immunofluorescence assay of the purified McAbs

M.蛋白质相对分子质量标准;1.HRP标记的单抗2E1;2.HRP标记的单抗2A11;3.HRP标记的单抗4H11;4.HRP标记的单抗6E12M.Prestained protein marker;1.HRP-conjugated McAb 2E1;2.HRP-conjugated McAb 2A11;3.HRP-conjugated McAb 4H11;4.HRP-conjugated McAb 6E12图6 HRP标记的单克隆抗体的Western blot分析Fig.6 Western blot analysis of the HRP-conjugated McAbs
3 讨 论
施马伦贝格病的暴发已经给有关国家的畜牧业生产造成了较大的经济损失[15-17]。虽然欧盟从自身经济利益的考量而坚称该病对畜牧业生产影响有限,但是有关研究表明SBV对家畜和野生动物的危害重于蓝舌病病毒[18]。2014年夏季以来,德国疫区内的某些养殖场再度暴发施马伦贝格病疫情[19],说明该病对畜牧业的危害仍然不容小觑。截至目前,我国尚未出现相关疫情[6],做好应对该病的技术储备意义重大。
近年来,杆状病毒表达系统凭借其高表达水平及翻译后的良好修饰功能等优点而被广泛应用于疫病诊断抗原的制备[20]。利用该系统可以获得大量抗原性、免疫原性较好,结构与功能接近天然蛋白质的可溶性重组蛋白质[21]。作者成功构建了表达SBV-N蛋白的重组杆状病毒,通过感染Sf9昆虫细胞获得了重组SBV-N蛋白。为方便蛋白质纯化,在构建重组供体质粒时将His标签编码序列引入SBV-N基因的N端,最终获得了N端带有6×His标签的SBV-N融合蛋白质。为探索Ni-NTA琼脂糖对该蛋白质的纯化效果,作者通过渐进式提高洗涤缓冲液中的咪唑浓度最终获得了高纯度的重组SBV-N蛋白。并以此为基础进一步制备了SBV-N蛋白的McAb,借助ELISA叠加试验筛选了4株识别不同抗原表位的McAb,为施马伦贝格病双抗体夹心ELISA的建立提供了必需的生物材料。此外,作者对获得的4株McAb进行了HRP标记,以进一步提高检测效率。
施马伦贝格病是一种外来与新发动物疫病,国内缺乏病原材料而难以验证McAb与天然SBV-N蛋白的反应情况。鉴于此,本研究利用间接免疫荧光分析了McAb与稳定表达SBV-N蛋白的BHK-21细胞系的反应性,结果表明4株McAb均能够识别具有空间构象的SBV-N蛋白。此外,Western blot进一步表明4株McAb能够与SBV-N蛋白发生反应,说明制备的McAb具有良好的应用潜力。
4 结 论
His-SBV-N融合蛋白及其McAb的成功制备,为施马伦贝格病血清学检测方法的建立提供了有价值的生物材料。
[1]HOFFMANN B,SCHEUCH M,HÖPER D,et al.Novel orthobunyavirus in cattle,Europe,2011 [J].EmergInfectDis,2012,18(3):469-472.
[2]HERDER V,WOHLSEIN P,PETERS M,et al.Salient lesions in domestic ruminants infected with the emerging so-called Schmallenberg virus in Germany[J].VetPathol,2012,49(4):588-591.
[3]RASMUSSEN L D,KRISTENSEN B,KIRKEBY C,et al.Culicoids as vectors of Schmallenberg virus [J].EmergInfectDis,2012,18(7):1204-1206.
[4]LIEVAART-PETERSON K,LUTTIKHOLT S,PEPERKAMP K,et al.Schmallenberg disease in sheep or goats:Past,present and future [J].VetMicrobiol,2015,181(1-2):147-153.
[5]WERNIKE K,CONRATHS F,ZANELLA G,et al.Schmallenberg virus-two years of experiences [J].PrevVetMed,2014,116(4):423-434.
[6]张永宁,吴绍强,林祥梅.施马伦贝格病研究进展 [J].畜牧兽医学报,2014,45(7):1029-1037.
ZHANG Y N,WU S Q,LIN X M.The research progress of Schmallenberg disease [J].ActaVeterinariaetZootechnicaSinica,2014,45(7):1029-1037.(in Chinese)
[7]DOCEUL V,LARA E,SAILLEAU C,et al.Epidemiology,molecular virology and diagnostics of Schmallenberg virus,an emerging orthobunyavirus in Europe [J].VetRes,2013,44:31.
[8]WERNIKE K,BROCCHI E,CORDIOLI P,et al.A novel panel of monoclonal antibodies against Schmallenberg virus nucleoprotein and glycoprotein Gc allows specific orthobunyavirus detection and reveals antigenic differences [J].VetRes,2015,46:27.
[9]BRÉARD E,LARA E,COMTET L,et al.Validation of a commercially available indirect ELISA using a nucleocapside recombinant protein for detection of Schmallenberg virus antibodies [J].PLoSOne,2013,8(1):e53446.
[10]BILK S,SCHULZE C,FISCHER M,et al.Organ distribution of Schmallenberg virus RNA in malformed newborns [J].VetMicrobiol,2012,159(1-2):236-238.
[11]张永宁,吴绍强,吕继洲,等.施马伦贝格病毒核衣壳蛋白的原核表达、纯化及多克隆抗体的制备[J].畜牧兽医学报,2013,44(10):1629-1636.
ZHANG Y N,WU S Q,LYU J Z,et al.Prokaryotic expression and purification of the nucleocapsid protein of Schmallenberg virus and preparation of its polyclonal antibodies [J].ActaVeterinariaetZootechnicaSinica,2013,44(10):1629-1636.(in Chinese)
[12]ZHANG Y,WU S,SONG S,et al.Preparation and characterization of a stable BHK-21 cell line constitutively expressing the Schmallenberg virus nucleocapsid protein [J].MolCellProbes,2015,29(4):244-253.
[13]ZHANG Y,WU S,WANG J,et al.Expression and purification of the nucleocapsid protein of Schmallenberg virus,and preparation and characterization of a monoclonal antibody against this protein [J].ProteinExprPurif,2013,92(1):1-8.
[14]FRIGUET B,DJAVADI-OHANIANCE L,PAGES J,et al.A convenient enzyme-linked immunosorbent assay for testing whether monoclonal antibodies recognize the same antigenic site.Application to hybridomas specific for the beta 2-subunit ofEscherichiacolitryptophan synthase [J].JImmunolMethods,1983,60(3):351-358.
[15]DOMINGUEZ M,HENDRIKX P,ZIENTARA S,et al.Preliminary estimate of Schmallenberg virus infection impact in sheep flocks-France [J].VetRec,2012,171(17):426.
[16]MARTINELLE L,DAL POZZO F,GAUTHIER B,et al.Field veterinary survey on clinical and economic impact of Schmallenberg virus in Belgium [J].TransboundEmergDis,2014,61(3):285-288.
[17]VELDHUIS A M,SANTMAN-BERENDS I M,GETHMANN J M,et al.Schmallenberg virus epidemic:impact on milk production,reproductive performance and mortality in dairy cattle in the Netherlands and Kleve district,Germany [J].PrevVetMed,2014,116(4):412-422.
[18]ROSSI S,VIAROUGE C,FAURE E,et al.Exposure of wildlife to the Schmallenberg virus in France (2011-2014):higher,faster,stronger (than Bluetongue)[J].TransboundEmergDis,2015.doi:10.1111/tbed.12371.
[19]WERNIKE K,HOFFMANN B,CONRATHS F J,et al.Schmallenberg virus recurrence,Germany,2014 [J].EmergInfectDis,2015,21(7):1202-1204.
[20]MACHADO A M,MACHADO A R,MORELI M L,et al.Expression of recombinant Araraquara Hantavirus nucleoprotein in insect cells and its use as an antigen for immunodetection compared to the same antigen expressed inEscherichiacoli[J].VirolJ,2011,8:218.
[21]CONTRERAS-GMEZ A,SNCHEZ-MIRN A,GARCA-CAMACHO F,et al.Protein production using the baculovirus-insect cell expression system [J].BiotechnolProg,2014,30(1):1-18.
(编辑白永平)
Expression of the Nucleocapsid Protein of Schmallenberg Virus Using the Bac-to-Bac®Baculovirus Expression System and Preparation of Monoclonal Antibodies against This Protein
ZHANG Yong-ning#,SONG Shan-shan#,WU Shao-qiang,LIN Xiang-mei*
(InstituteofAnimalQuarantine,ChineseAcademyofInspectionandQuarantine,Beijing100029,China)
The objective of this study was to express and purify the nucleocapsid (N) protein of Schmallenberg virus (SBV) with the native conformation,and to prepare its monoclonal antibodies (McAbs).To this end,the SBV-N gene with an inserted coding sequence for an N-terminal hexahistidine (6×His) tag was cloned into the pFastBacTM1 vector.The resulting recombinant donor plasmid,pFastBac-His-SBV-N,was then transformed into DH10BacE.colicompetent cells.After selection with the blue/white screen,the recombinant bacmid,rBacmid-His-SBV-N,was transfected into Sf9 insect cells to generate recombinant baculoviruses that express the His-SBV-N fusion protein.After amplifying the recombinant baculoviral stocks on Sf9 cells,His-SBV-N fusion protein was purified using nickel nitrilotriacetic acid (Ni-NTA) agarose.The purified protein was then used to immunize BALB/c mice to prepare SBV-N-specific McAbs,and an indirect double-antibody binding ELISA was applied to detect whether the generated McAbs recognize different antigenic sites.The screened McAbs that recognize different antigenic sites were labeled with horseradish peroxidase (HRP) using the sodium periodate oxdization method.Finally,four McAbs (2A11,2E1,4H11 and 6E12) recognizing different antigenic sites were successfully obtained and labeled with HRP.The results of isotype identification demonstrated that 2A11 belongs to IgG1,and 2E1,4H11 and 6E12 belong to IgG2b.Indirect immunofluorescence assays revealed that all of the four McAbs reacted with the BHK-21 cell line stably expressing the SBV-N protein (BHK-21-EGFP-SBV-N).Western blot analyses further showed that the four HRP-conjugated McAbs reacted positively with the His-SBV-N fusion protein.Taken together,the successful preparation of His-SBV-N fusion protein and its McAbs provide valuable biological materials that can be used in the serological diagnosis of Schmallenberg disease.
Schmallenberg virus (SBV);nucleocapsid (N) protein;baculovirus expression vector;insect cells;monoclonal antibody (McAb)
10.11843/j.issn.0366-6964.2016.06.026
2015-08-19
“十二五”国家科技支撑计划课题(2013BAD12B01);中国检验检疫科学研究院“青年英才计划”项目(CAIQ-YC-20140205);国家质检总局科技计划项目(2013IK054)
张永宁(1980-),男,山东日照人,副研究员,博士,主要从事外来动物疫病检疫研究,E-mail: zhangyn@caiq.gov.cn;宋姗姗(1986-),女,山东德州人,硕士,主要从事外来动物疫病检疫研究,E-mail: 2005203776@163.com。二者为共同第一作者
林祥梅,E-mail:linxm@caiq.gov.cn
S852.659.5
A
0366-6964(2016)06-1280-07

