microRNA调控动物毛色和肤色的研究进展
巫小倩,刘辰东,堵晶晶,罗 嘉,朱 砺,张顺华
(四川农业大学动物科技学院,成都 611130)
microRNA调控动物毛色和肤色的研究进展
巫小倩,刘辰东,堵晶晶,罗嘉,朱砺*,张顺华*
(四川农业大学动物科技学院,成都 611130)
黑色素细胞对于毛色和肤色的形成具有至关重要的作用。黑色素细胞由胚胎时期的神经嵴干细胞分化而来,在成熟黑色素细胞内通过一系列复杂的酶催化反应最终生成黑色素,从而决定动物的毛色和肤色。黑色素的生成过程复杂,受到一些转录因子、激素、信号通路分子协同调控。microRNA(miRNA)是一类长约22 nt的内源性非编码RNA,主要通过抑制转录后的翻译过程来调控基因表达。越来越多的研究表明,miRNA与黑色素生成相关。本文对黑色素沉积相关的miRNAs的挖掘和鉴定工作以及miRNAs调控毛色和肤色的研究进展进行综述。
microRNA;黑色素细胞;黑色素;毛色;肤色
毛色和肤色是脊椎动物最容易被观察到的重要表型特征,可用于区分动物亚种(或品种)[1]。一般哺乳动物毛色和肤色与吸引异性、躲避天敌、通讯交流等相关[2-4]。而对于羊驼、绵羊等毛用动物而言,毛色则是最重要的经济性状[5-6]。因此,动物表皮色素沉积一直受到人们的广泛关注,对肤色和毛色形成研究具有重要的经济价值。 miRNA是广泛存在于真核细胞的进化高度保守的单链非编码RNA,可以在转录后水平调控靶基因表达,从而参与细胞增殖、分化、凋亡等多种生物学过程。大量研究表明,miRNA可以作为一种重要的调控因子参与黑色素形成。迄今为止,鉴定出大量miRNAs参与调控脂肪沉积、心肌纤维化以及细胞衰老等过程[7-9],而miRNA调控毛色和肤色的研究却十分欠缺。亟待持续挖掘与黑色素形成相关的miRNA。
1 miRNA的研究背景
miRNA是一类长约22 nt的内源非编码RNA,可以在转录后水平调控基因表达[10]。R.C.Lee等[11]发现第一个miRNA—lin-4,它可以调节秀丽隐杆线虫幼虫阶段性发育。目前已经有超过28 645个miRNA被发现和鉴定(http://www.mirbase.org/)。miRNA参与调控细胞增殖、分化、凋亡等多种生物学过程,对维持机体正常的生理功能有至关重要的作用[12-13]。miRNA基因在RNA聚合酶II作用下形成初级转录物pri-miRNA,随后Drosha酶和伴侣蛋白DGCR8组成的复合物将pri-miRNA剪切成为具有茎环结构的前体pre-miRNA,pre-miRNA被转运蛋白Exportin-5转运到胞质中并由Dicer酶加工形成长约20 nt的双链miRNA,然后解链产生成熟的miRNA和其互补链miRNA*[14]。早期对于miRNA*的功能知之甚少,近年来研究发现,miRNA*能与AGO2形成RISC复合体发挥类似siRNA的作用[15-16]。在无脊椎动物中存在一种新的miRNA合成机制,称为 “mitron”途径,它形成具有套索结构的中间体,不依赖Dicer酶的剪切作用,最终产生成熟的miRNA[17-18]。在哺乳动物体内,miRNA可以与核糖核蛋白AGO结合生成沉默复合体 (RNA-induced silencing complex,RISC),miRNA的2~8位种子序列与mRNA的3′-UTR区或ORF互补结合,随后RISC介导mRNA降解或抑制翻译从而抑制靶基因表达[10,14]。有研究发现,let-7、miR-125b可以加速mRNA脱腺苷,降低细胞内mRNA有效含量[19-20]。而某些植物中,miRNA可以介导自身基因座或靶基因甲基化,在表观水平调控基因表达[21-22]。
2 黑色素生成
2.1黑色素细胞的起源
动物毛囊和皮肤基底层的黑色素细胞能够合成黑色素,黑色素沉积的种类和含量共同决定动物的毛色和肤色。除视网膜色素细胞外,所有黑色素细胞起源于胚胎时期的躯干神经嵴细胞[23]。神经嵴细胞短暂存在于神经胚形成期间,在神经管闭合前后开始分散迁移,沿背侧迁移的神经嵴细胞分化为成黑色素细胞。成黑色素细胞继续迁移至胚胎真皮,并随着胚胎的发育渐布于全身,且穿过基膜到达表皮[24-25]。大多数成黑色素细胞聚集于发育的毛囊中,部分成黑色素细胞分化为Kit阳性细胞、多巴胺阳性细胞,最终分化为成熟的黑色素细胞[26]。另有少数成黑色素细胞分化为黑色素细胞存留于表皮基底层。
2.2黑色素生成
黑色素主要由黑色素细胞合成产生。黑色素小体是黑色素细胞特有的细胞器,它是合成黑色素的主要场所。黑色素的合成经过4个阶段[27]:Ⅰ、Ⅱ 阶段在高尔基体-内质网-溶酶体复合体(GERL-complex)内形成暂无活性的黑色素小体,此时的黑色素小体无法合成黑色素。酪氨酸酶由核糖体合成后经高尔基体转运活化进入黑色素小体,同时酪氨酸也通过膜的主动运输进入黑色素小体,黑色素小体有产生黑色素的能力,黑色素合成进入Ⅲ、Ⅳ阶段。在黑色素小体内,酪氨酸在活化的酪氨酸酶的作用下羟化为多巴,多巴进一步氧化生成高度活跃的中间产物多巴醌。当酪氨酸酶充足时,多巴醌经过一系列氧化反应最终生成吲哚苯醌,形成真黑色素(Eumelanin);当酪氨酸酶缺乏时,由半胱氨酸或谷胱甘肽提供巯基使多巴醌转化成半胱氨酰多巴,最终生成褐黑色素(Pheomelanin)[28]。黑色素小体内形成的黑色素被黑色素细胞以胞突的方式释放。动物的肤色和毛色主要由棕色或黑色的真黑色素和黄色或微红棕色的褐黑色素的比例决定。
2.3黑色素生成重要转录因子——MITF
黑色素生成过程复杂,受到许多转录因子调控[29-31],其中,小眼畸形相关转录因子(Microphthalmia-associated transcription factor,MITF)对于黑色素形成非常重要[11]。MITF于1942年被发现,且研究表明,MITF失活能够导致小鼠、斑马鱼几乎完全失去黑色素细胞[32]。MITF是黑色素细胞发育和功能的关键调控基因,对黑色素细胞的存活、迁移、增殖和分化都起着不可或缺的作用[33]。MITF能够调控一些与色素形成相关基因的活性从而决定黑色素的种类与数量,如酪氨酸酶基因(Tyrosinase,Tyr)、酪氨酸酶相关蛋白1基因(Tyrosinase-related protein 1,Tyrp1)、酪氨酸酶相关蛋白2基因(Tyrosinase-related protein 2,Tyrp2)等[34]。某些转录因子可作用于MITF的启动子区域,从而促进MITF的表达,如β连环蛋白(beta-catenin,β-catenin)、盒基因 3(Paired box 3,PAX3)、SOX10基因(SRY-box containing gene 10,SOX10)等[35]。研究表明,MITF的表达和活性与黑色素细胞的命运息息相关。
3 miRNA调控黑色素沉积研究进展
越来越多的研究表明,miRNA可以调控黑色素形成相关的基因、转录因子和重要的信号分子从而影响黑色素生成[36]。近年来,已经有一些调控黑色素生成的miRNA被发现,同时,miRNA调控黑色素生成的网络正在逐步形成(图1)。
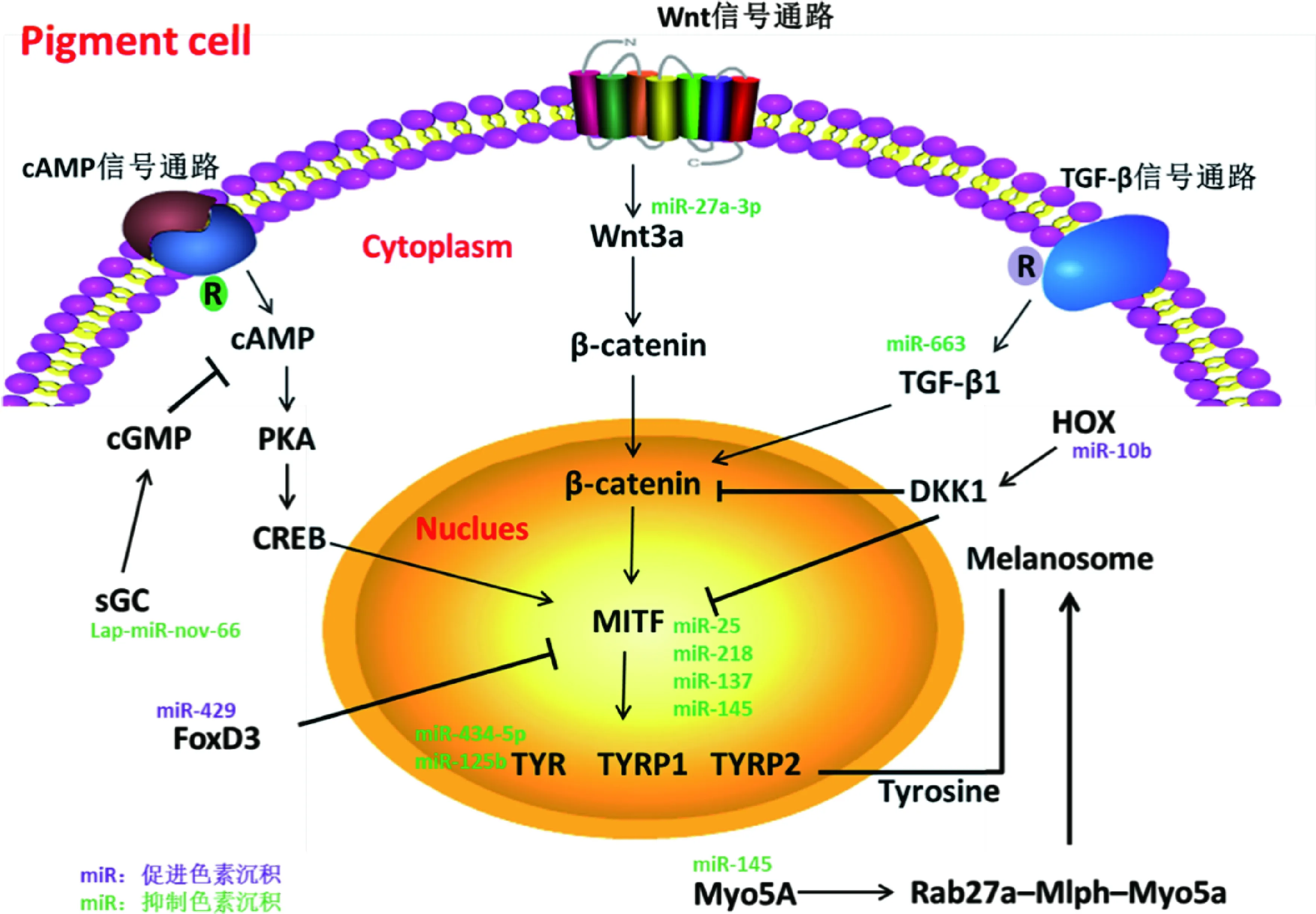
图1 miRNA调控黑色素生成网络图Fig.1 The network of miRNA regulates melanogenesis
3.1黑色素形成的miRNA表达谱测定
挖掘和鉴定与黑色素沉积相关miRNA是研究miRNA调控黑色素沉积的前提。高通量技术在挖掘miRNA上表现出巨大优势,能够发现不同毛色或肤色表型动物中差异表达miRNA的种类和丰度,从而推动miRNA在色素沉积上的相关研究。近几年,研究者对不同毛色、肤色的农业经济动物进行miRNA测序,发现大量与黑色素形成相关的miRNA,为miRNA调控皮肤色素沉积奠定基础。X.Tian等[37]利用Illumina 测序从棕色和白色羊驼皮肤中分别发现267和272个保守的miRNA(包含22个新鉴定出的miRNA),其中35个miRNA在白色羊驼中高表达,13个miRNA在棕色羊驼中高表达,miR-202、miR-542-5p、miR-424、miR-370和 miR-22-3p 等高表达于白色羊驼,miR-211、miR-184、miR-486、miR-885和miR-451 高表达于棕色羊驼。B.Yan等[38]利用Solexa测序研究红色和白色鲤鱼皮肤的miRNA表达谱,共发现13个差异表达的miRNA,其中10个差异表达miRNA在红色和白色罗非鱼中存在相同的差异表达模式。P.Dynoodt等[39]用毛喉素和紫外线处理小鼠黑色素细胞,从正常组和处理组中发现16个差异表达miRNA,13个在正常组中高表达,3个在处理组中高表达。Z.Wu等[40]对杂毛山羊的黑毛和白毛毛囊miRNA测序,得到205个保守的miRNA以及9个新的miRNA,共存在6个差异表达miRNA,其中5个在黑毛毛囊中高表达,这5个miRNA能作用于大量与毛色形成相关的信号通路,包括MAPK信号通路[41]。利用高通量测序找到大量与色素沉积相关的miRNA,但是这种相关需要进一步被验证,从而形成miRNA调控色素沉积的网络。
3.2miRNA对MITF转录因子的调控作用
MITF是黑色素形成过程中最重要的转录因子,miRNA可以通过调控MITF的表达从而调节动物黑色素形成。Z.Zhu等[42]和J.Guo等[43]研究发现,miR-25和miR-218能够直接作用于MITF的3′UTR,过表达miR-25和miR-218均能够降低MITF及其下游基因的表达,如Tyr、Tyrp1、Tyrp2抑制黑色素形成。C.Dong等[44]首次利用转基因小鼠研究miRNA影响动物毛色,发现转基因小鼠毛色与miR-137的表达量相关,miR-137能够直接作用于MITF,下调MITF及下游基因表达[45]。随着miR-137表达量增加,小鼠毛色由黑逐渐变黄,毛干中黑色素含量减少[44]。miR-429能够直接作用于叉头蛋白D3基因(Forkhead box D3,FoxD3)的3′UTR,FoxD3与神经脊干细胞的迁移相关,能够下调分化相关基因的表达[46]。miR-429沉默导致FoxD3表达量显著升高,MITF及其下游基因的表达被抑制,鲤鱼皮肤中黑色素减少、颜色改变[38]。miR-429在鲤鱼发育过程中存在很强的时空特异性表达,miR-429随着鲤鱼发育在皮肤中表达量逐渐增加,鲤鱼发育出具有颜色的皮肤。miR-10b在山羊黑毛毛囊中高表达[40],miR-10b能抑制HOX基因家族表达,HOXA10能够上调毛色相关基因DKK1(Dickkopf 1,DKK1)的表达,DKK1能够通过抑制β-catenin以及MITF的表达抑制黑色素形成[47-49]。
3.3miRNA对Wnt/TGF-β/cAMP信号通路的调控作用
miRNA还可以与信号转导通路中关键分子的mRNA结合,通过影响细胞信号通路的传递间接调控黑色素细胞的色素沉积。Wnt/β-catenin通路对于细胞命运、增殖、分化和迁移具有重要的作用[50-53]。Wnt3a不仅能够促进神经脊干细胞分化为黑色素细胞,而且能够通过维持MITF的表达促进成黑素细胞分化为黑色素细胞[54-55]。Y.Zhao等[56]利用小鼠黑色素细胞研究发现,miR-27a-3p能够与Wnt3a的3′UTR结合,抑制Wnt3a蛋白以及下游基因β-catenin的表达,抑制和过表达miR-27a-3p,发现miR-27a-3p的表达量与黑色素细胞中黑色素含量呈负相关。转化生长因子-β1(Transforming growth factor-β1,TGF-β1)信号转导主要由其下游Smads分子介导[57]。TGF-β/Smad信号通路与Wnt /β-catenin信号通路间存在着交互调节作用,TGF-β1可间接活化β-catenin,进一步激活Wnt /β-catenin信号通路[58]。贾小云等[59]利用羊驼黑色素细胞研究miR-663对黑色素沉积的影响,发现miR-663能够靶向作用于TGF-β1基因,从而抑制TGF-β1的表达,影响TGF-β/Smad和Wnt /β-catenin信号通路,抑制羊驼黑色素细胞中的黑色素生成。X.Tian等[37]对白色和棕色羊驼测序发现大量新的miRNA,lap-miR-nov66在白色羊驼皮肤中高表达。lap-miR-nov66能够作用于可溶性鸟苷酸环化基因(Soluble guanylate cyclase,sGC)的CDS区域,上调sGC的表达量,导致cGMP表达量上升,而cAMP表达量降低,从而通过PKA通路作用于MITF转录因子,抑制黑色素生成[60]。
3.4miRNA对其他因子的调控作用
miRNA除调控MITF和一些信号通路影响色素沉积外,还可作用于其他基因影响黑色素形成。小鼠注射pre-MiR-434-5p能够导致其皮肤中Tyr表达量降低,小鼠毛色变白,且合成的miR-434-5p类似物miR-Tyr与甘油混合涂抹于人皮肤表面,使人皮肤变白变亮[61]。K.H.Kim等[62]研究发现,miR-125b能够作用于DCT和Tyr基因抑制黑色素沉积,黑色素细胞中,miR-125能够通过启动子高度甲基化,降低miR-125b的表达,促进黑色素生成。P.Dynoodt等[39]研究发现,miR-145能够通过不同途径影响黑色素的沉积。miR-145能够作用于小鼠和人Myo5a基因的3′UTR,而Myo5A、Mlph以及Rab27a能形成复杂的Rab27a-Mlph-Myo5a三联体蛋白[63],同时,miR-145高表达能够使与黑色素沉积相关基因表达量降低,如MITF、Myo5A、Rab27a、Tyr等[39]。
4 展 望
动物毛色和肤色是极为重要的表型特征,与吸引异性、躲避天敌等紧密相关。对毛用动物而言,毛色更是重要的经济性状。近年来,大量与毛色形成相关基因已经被发现和鉴定,其中MITF不仅能够影响黑色素细胞的存活、迁移、增殖和分化,还能够调控黑色素形成相关基因的活性。目前已经发现一些调控黑色素沉积的miRNA,它们作用于黑色素沉积相关的转录因子和信号通路,共同调控色素沉积,miRNA调控色素沉积网络正逐渐形成。但miRNA对色素沉积调控网络仅初步形成,尚需深度挖掘,进一步补充、完善。研究黑色素沉积的分子机制,构建miRNA对色素沉积的调控网络,利用miRNA定向改变动物毛色以及将miRNA应用于美容行业将会成为未来研究miRNA调控色素沉积的新方向。
[1]HANNA L L,SANDERS J O,RILEY D G,et al.Identification of a major locus interacting with MC1R and modifying black coat color in an F2Nellore-Angus population[J].GenetSelEvol,2014,46:4.
[2]CARO T.The adaptive significance of coloration in mammals[J].BioScience,2005,55(2):125-136.
[3]MIYAGI R,TERAI Y.The diversity of male nuptial coloration leads to species diversity in Lake Victoria cichlids[J].GenesGenetSyst,2013,88(3):145-153.
[4]TAKAHASHI A.Pigmentation and behavior:potential association through pleiotropic genes in Drosophila[J].GenesGenetSyst,2013,88(3):165-174.
[5]CHANDRAMOHAN B,RENIERI C,LA MANNA V,et al.The alpaca agouti gene:genomic locus,transcripts and causative mutations of eumelanic and pheomelanic coat color[J].Gene,2013,521(2):303-310.
[6]DENG W D,SHU W,YANG S L,et al.Pigmentation in Black-boned sheep (Ovisaries):association with polymorphism of the MC1R gene[J].MolBiolRep,2009,36(3):431-436.
[7]张进威,罗毅,王宇豪,等.MicroRNA 调控动物脂肪细胞分化研究进展[J].遗传,2015,37(12):1175-1184.
ZHANG J W,LUO Y,WANG Y H,et al.microRNA regulates animal adipocyte differentiation[J].Hereditas(Beijing),2015,37(12):1175-1184.(in Chinese)
[8]王世强,李丹,李博雅,等.microRNA 调控心肌纤维化研究进展[J].生命的化学,2015,35(4):565-570.
WANG S Q,LI D,LI B Y,et al.Research progress of myocardial fibrosis regulated by microRNA [J].ChemistryofLife,2015,35(4):565-570.(in Chinese)
[9]吴刚,王丹,黄毅,等.衰老相关 microRNAs 研究进展[J].生物化学与生物物理进展,2014,41(3):273-287.
WU G,WANG D,HUANG Y,et al.The research progress of microRNAs in aging[J].ProgressinBichemistryandBiophysics,2014,41(3):273-287.(in Chinese)
[10]BARTEL D P.microRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[11]LEE R C,FEINBAUM R L,AMBROS V.The C.elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J].Cell,1993,75(5):843-854.
[12]TANG Y,ZHENG J,SUN Y,et al.microRNA-1 regulates cardiomyocyte apoptosis by targeting Bcl-2[J].IntHeartJ,2009,50(3):377-387.
[13]SHENOY A,BLELLOCH R H.Regulation of microRNA function in somatic stem cell proliferation and differentiation[J].NatRevMolCellBiol,2014,15(9):565-576.
[14]TREIBER T,TREIBER N,MEISTER G.Regulation of microRNA biogenesis and function[J].ThrombHaemost,2012,107(4):605-610.
[15]YANG J S,PHILLIPS M D,BETEL D,et al.Widespread regulatory activity of vertebrate microRNA* species[J].RNA,2011,17(2):312-326.
[16]马圣运,白玉,韩凝,等.miRNA*生物合成及其功能研究的新发现[J].遗传,2012,34(4):383-388.
MA S Y,BAI Y,HAN N,et al.Recent research progress of biogenesis and functions of miRNA*[J].Hereditas(Beijing),2012,34(4):383-388.(in Chinese)
[17]AMERES S L,ZAMORE P D.Diversifying microRNA sequence and function[J].NatRevMolCellBiol,2013,14(8):475-488.
[18]WESTHOLM J O,LADEWIG E,OKAMURA K,et al.Common and distinct patterns of terminal modifications to mirtrons and canonical microRNAs[J].RNA,2012,18(2):177-192.
[19]DJURANOVIC S,NAHVI A,GREEN R.miRNA-mediated gene silencing by translational repression followed by mRNA deadenylation and decay[J].Science,2012,336(6078):237-240.
[20]WU L,FAN J,BELASCO J G.microRNAs direct rapid deadenylation of mRNA[J].ProcNatlAcadSciUSA,2006,103(11):4034-4039.
[21]MATZKE M A,MOSHER R A.RNA-directed DNA methylation:an epigenetic pathway of increasing complexity[J].NatRevGenet,2014,15(6):394-408.
[22]WU L,ZHOU H,ZHANG Q,et al.DNA methylation mediated by a microRNA pathway[J].MolCell,2010,38(3):465-475.
[23]LABONNE C,BRONNER-FRASER M.Induction and patterning of the neural crest,a stem cell-like precursor population[J].JNeurobiol,1998,36(2):175-189.
[24]BAKER C V,BRONNER-FRASER M,LE DOUARIN N M,et al.Early- and late-migrating cranial neural crest cell populations have equivalent developmental potentialinvivo[J].Development,1997,124(16):3077-3087.
[25]文琴.发育神经生物学[M].北京:科学出版社,2007.
WEN Q.Developmental neurobiology[M].Beijing:Science Press,2007.
[26]HIROBE T.Histochemical survey of the distribution of the epidermal melanoblasts and melanocytes in the mouse during fetal and postnatal periods[J].AnatRec,1984,208(4):589-594.
[27]RILEY P A.Melanin[J].IntJBiochemCellBiol,1997,29(11):1235-1239.
[28]ITO S,NAKANISHI Y,VALENZUELA R K,et al.Usefulness of alkaline hydrogen peroxide oxidation to analyze eumelanin and pheomelanin in various tissue samples:application to chemical analysis of human hair melanins[J].PigmentCellMelanomaRes,2011,24(4):605-613.
[29]GUENTHER C A,TASIC B,LUO L,et al.A molecular basis for classic blond hair color in Europeans[J].NatGenet,2014,46(7):748-752.
[30]VÅGE D I,NIEMINEN M,ANDERSON D G,et al.Two missense mutations in melanocortin 1 receptor (MC1R) are strongly associated with dark ventral coat color in reindeer (Rangifertarandus)[J].AnimGenet,2014,45(5):750-753.
[31]ABITBOL M,LEGRAND R,TIRET L.A missense mutation in the agouti signaling protein gene (ASIP) is associated with the no light points coat phenotype in donkeys[J].GenetSelEvol,2015,47:28.
[32]UONG A,ZON L I.Melanocytes in development and cancer[J].JCellphysiol,2010,222(1):38-41.
[33]WHITE R M,ZON L I.Melanocytes in development,regeneration,and cancer[J].CellStemCell,2008,3(3):242-252.
[34]YASUMOTO K,YOKOYAMA K,SHIBATA K,et al.Microphthalmia-associated transcription factor as a regulator for melanocyte-specific transcription of the human tyrosinase gene[J].MolCellBiol,1994,14(12):8058-8070.
[35]BONDURAND N,PINGAULT V,GOERICH D E,et al.Interaction among SOX10,PAX3 and MITF,three genes altered in Waardenburg syndrome[J].HumMolGenet,2000,9(13):1907-1917.
[36]MIONE M,BOSSERHOFF A.microRNAs in melanocyte and melanoma biology[J].PigmentCellMelanomaRes,2015,28(3):340-354.
[37]TIAN X,JIANG J,FAN R,et al.Identification and characterization of microRNAs in white and brown alpaca skin[J].BMCGenomics,2012,13:555.
[38]YAN B,LIU B,ZHU C D,et al.microRNAs regulation of skin pigmentation in fish[J].JCellSci,2013,126(Pt 15):3401-3408.
[39]DYNOODT P,MESTDAGH P,VAN PEER G,et al.Identification of miR-145 as a key regulator of the pigmentary process[J].JInvestDermatol,2013,133(1):201-209.
[40]WU Z,FU Y,CAO J,et al.Identification of differentially expressed miRNAs between white and black hair follicles by RNA-sequencing in the goat (Caprahircus)[J].IntJMolSci,2014,15(6):9531-9545.
[41]AHN J H,JIN S H,KANG H Y.LPS induces melanogenesis through p38 MAPK activation in human melanocytes[J].ArchDermatolRes,2008,300(6):325-329.
[42]ZHU Z,HE J,JIA X,et al.microRNAs-25 functions in regulation of pigmentation by targeting the transcription factor MITF in alpaca (Lamapacos) skin melanocytes[J].DomestAnimEndocrinol,2010,38(3):200-209.
[43]GUO J,ZHANG J F,WANG W M,et al.microRNAs-218 inhibits melanogenesis by directly suppressing microphthalmia-associated transcription factor expression[J].RNABiol,2014,11(6):732-741.
[44]DONG C,WANG H,XUE L,et al.Coat color determination by miR-137 mediated down-regulation of microphthalmia-associated transcription factor in a mouse model[J].RNA,2012,18(9):1679-1686.
[45]马淑慧,薛霖莉,徐刚,等.黑色素细胞中过量表达 miR-137 对 TYRP-1 和 TYRP-2 的影响[J].中国农业科学,2013,46(16):3452-3459.
MA S H,XUE L L,XU G,et al.The influences of over-expressing miR-137 on TYRP-1 and TYRP-2 in melanocytes[J].ScientiaAgriculturaSinica,2013,46(16):3452-3459.(in Chinese)
[46]ABEL E V,APLIN A E.FOXD3 is a mutant B-RAF-regulated inhibitor of G1-S progression in melanoma cells[J].CancerRes,2010,70(7):2891-2900.
[47]MAGNUSSON M,BRUN A C,MIYAKE N,et al.HOXA10 is a critical regulator for hematopoietic stem cells and erythroid/megakaryocyte development[J].Blood,2007,109(9):3687-3696.
[48]YAMAGUCHI Y,PASSERON T,HOASHI T,et al.Dickkopf 1 (DKK1) regulates skin pigmentation and thickness by affecting Wnt/β-catenin signaling in keratinocytes[J].FASEBJ,2008,22(4):1009-1020.
[49]YAMAGUCHI Y,PASSERON T,WATABE H,et al.The effects of dickkopf 1 on gene expression and Wnt signaling by melanocytes:mechanisms underlying its suppression of melanocyte function and proliferation[J].JInvestDermatol,2007,127(5):1217-1225.
[50]CLEVERS H,LOH K M,NUSSE R.Stem cell signaling.An integral program for tissue renewal and regeneration:Wnt signaling and stem cell control[J].Science,2014,346(6205):1248012.
[51]MILLER J R.The wnts[J].GenomeBiol,2002,3(1):REVIEWS3001.
[52]MOON R T,BROWN J D,TORRES M.WNTs modulate cell fate and behavior during vertebrate development[J].TrendsGenet,1997,13(4):157-162.
[53]SETHI J K,VIDAL-PUIG A.Wnt signalling and the control of cellular metabolism[J].BiochemJ,2010,427(1):1-17.
[54]DUNN K J,BRADY M,OCHSENBAUER-JAMBOR C,et al.WNT1 and WNT3a promote expansion of melanocytes through distinct modes of action[J].PigmentCellRes,2005,18(3):167-180.
[55]JIN E J,ERICKSON C A,TAKADA S,et al.Wnt and BMP signaling govern lineage segregation of melanocytes in the avian embryo[J].DevBiol,2001,233(1):22-37.
[56]ZHAO Y,WANG P,MENG J,et al.microRNAs-27a-3p inhibits melanogenesis in mouse skin melanocytes by targeting Wnt3a[J].IntJMolSci,2015,16(5):10921-10933.
[57]PARK S H.Fine tuning and cross-talking of TGF-β signal by inhibitory Smads[J].JBiochemMolBiol,2005,38(1):9-16.
[58]GUO X,WANG X F.Signaling cross-talk between TGF-β/BMP and other pathways[J].CellRes,2009,19(1):71-88.
[59]贾小云,金雷皓,苗潋涓,等.miR-663 通过靶向 TGF-β1 调控羊驼黑色素细胞的黑色素生成[J].中国农业科学,2015,48(1):165-173.
JIA X Y,JIN L H,MIAO Y J,et al.Melanin synthesis of alpaca melanocytes regulated by miR-663 through targeting TGF-β1[J].ScientiaAgriclturaSinica,2015,48(1):165-173.(in Chinese)
[60]YANG S,FAN R,SHI Z,et al.Identification of a novel microRNA important for melanogenesis in alpaca (Vicugnapacos) [J].JAnimSci,2015,93(4):1622-1631.
[61]WU D TS,CHEN J S,CHANG D C,et al.miR-434-5p mediates skin whitening and lightening[J].ClinlCosmetInvestigDermatol,2008,1:19-35.
[62]KIM K H,BIN B H,KIM J,et al.Novel inhibitory function of miR-125b in melanogenesis[J].PigmentCellMelanomaRes,2014,27(1):140-144.
[63]VAN GELE M,DYNOODT P,LAMBERT J.Griscelli syndrome:a model system to study vesicular trafficking[J].PigmentCellMelanomaRes,2009,22(3):268-282.
(编辑程金华)
Research Progress of the Role of microRNAs in the Regulation of Animal Coat and Skin Color
WU Xiao-qian,LIU Chen-dong,DU Jing-jing,LUO Jia,ZHU Li*,ZHANG Shun-hua*
(CollegeofAnimalScienceandTechnology,SichuanAgriculturalUniversity,Chengdu611130,China)
Melanocyte,generated from embryonic neural crest stem cells,plays important roles in coat and skin color formation.Melanin,the product of a series of enzyme catalyzed reactions in melanocyte,determines animal coat and skin color.Melanogenesis is a complex process involving coordinated regulation of some transcription factors,hormones and signaling pathway molecules.microRNA (miRNA) is a class of endogenous,non-coding,small RNA molecule (about 22 nt),which regulates gene expression mainly at the post-transcription level.More and more evidences demonstrated that miRNA involve in the regulation of melanogenesis.Herein,it was reviewed in this paper the studies on the discovery and identification of melanin-associated miRNAs,and the research progress of how miRNAs regulate animal coat and skin color.
microRNA;melanocyte;melanin;coat color;skin color
10.11843/j.issn.0366-6964.2016.06.002
2015-12-22
四川省科技支撑计划项目(2013NZ0041;2013NZ0056);四川省科技富民强县专项行动计划项目
巫小倩(1991-),女,四川什邡人,硕士生,主要从事猪遗传育种研究,E-mail:1097377344@qq.com
朱砺,教授,博士生导师,主要从事猪遗传育种研究,E-mail:zhuli7508@163.com; 张顺华,博士,硕士生导师,主要从事猪遗传育种研究,E-mail:363445986@qq.com
Q343
A
0366-6964(2016)06-1086-07

