定量蛋白质组学技术分析猪繁殖与呼吸综合征病毒感染肺泡巨噬细胞的差异表达蛋白质
刘 龙,陈红英
(西北农林科技大学生命科学学院,杨凌 712100)
定量蛋白质组学技术分析猪繁殖与呼吸综合征病毒感染肺泡巨噬细胞的差异表达蛋白质
刘龙,陈红英*
(西北农林科技大学生命科学学院,杨凌 712100)
作者采用定量蛋白质组学方法,对猪繁殖与呼吸综合征病毒(PRRSV)感染猪肺泡巨噬细胞(PAMs)和正常PAMs的蛋白质组进行差异分析。通过高效液相色谱和电喷雾串联质谱仪定量分析PRRSV感染细胞与未感染对照细胞间的差异表达蛋白质,并运用Max-Quant 1.0.7.4软件结合蛋白质数据库PaxDb进行鉴定。与对照组相比,感染组共鉴定出39个差异表达蛋白质,其中30个蛋白质表达上调,9个蛋白质表达下调。通过Western blot和ELISA验证了感染的PAMs中SPP1、IFIT3、STAT3及IL-8的表达情况与质谱鉴定结果一致。通过液相色谱—串联质谱联用(LC-MS/MS)技术,筛选得到多个与PRRSV感染相关的差异表达蛋白质,为PRRSV发病的分子机制分析提供了新依据。
猪繁殖与呼吸综合征病毒;猪肺泡巨噬细胞;差异表达蛋白质;感染
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)俗称蓝耳病,是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种高度传染性疾病,其主要特征是引起妊娠母猪严重的繁殖障碍和仔猪呼吸困难及高死亡率[1],近年来给全球范围的养猪业造成了巨大经济损失。PRRSV主要通过呼吸道和生殖道侵入猪体内,其靶细胞为肺泡巨噬细胞(PAMs)和血液中的巨噬细胞[2]。PRRSV感染PAMs后,病毒蛋白质和宿主细胞蛋白质会产生复杂的相互作用[3]。其中,已有体外试验证明:PRRSV核衣壳蛋白(N)和其非结构蛋白9(NSP9)能够与多种宿主细胞蛋白质发生相互作用[4-5]。但是,很难评价单个病毒蛋白质在生理条件下对细胞蛋白质的表达量和生物学功能的影响。因此,需要综合考虑PRRSV感染宿主细胞后对其生理状态的影响。
定量蛋白质组学能够精确测量样本在不同生理条件下多种蛋白质表达量的变化,可以实现同时对上千个蛋白质的定量和定性分析,为探究疾病的药物靶标蛋白质提供重要依据[6]。目前,在鉴定PRRSV感染PAMs或Marc-145细胞差异表达蛋白质的研究中,大多是利用常规2-D电泳分离结合图像软件找出差异蛋白质点后再经质谱鉴定[7-8]。作者应用液相色谱对样品中蛋白质的肽段进行分离,然后进行质谱鉴定,全面准确地定量分析PRRSV感染的PAMs中相对于未感染细胞的差异表达蛋白质,以期探究PRRSV与宿主的相互作用及其致病机制。
1 材料与方法
1.1 病毒株及试验动物
本研究所用的PRRSV毒株为美洲型强毒株TA-12(GenBank收录号:HQ416720.1),由本校动物医学院周恩民教授实验室分离保存;PAMs取自1头6周龄的PRRSV抗原阴性健康长白仔猪,购自陕西杨凌饲养场。采集的PAMs用含10%胎牛血清的RPMI-1640培养基于5% CO2、37 ℃的培养箱中培养。
1.2主要试剂
二硫苏糖醇(DTT)、碘乙酰胺(IAA)、碳酸氢铵、SDS、Tris-HCl、Tris碱、甘氨酸、丙烯酰胺、N,N′-甲叉双丙烯酰胺、过硫酸铵、TDMED、抗生素等均购自生工生物公司,RapiGest SF购自Waters公司,SPP1(Cat# AB21078a)、STAT3(Cat# AB20083a)一抗购自生工生物公司,IFIT3一抗(Cat# 15201-1-AP)购自Proteintech,羊抗兔IgG 、ECL发光液购自康为世纪公司,猪IL-8 ELISA试剂盒购自R&D公司,PDVF膜购自BioRad公司。RPMI-1640培养基、胎牛血清等购自Thermo scientific公司。
1.3PAMs采集
打开小猪胸腔,分离肺,用无菌生理盐水清洗表面后放入生物安全柜,通过无菌PBS灌洗小猪肺,收集肺泡灌洗液。1 500 r·min-1离心10 min,在超净工作台中弃去上清,加入PBS悬浮沉淀,再次离心后用RPMI-1640培养基重悬,调整PAMs密度分装入细胞冻存管,细胞量5×106·管-1,于液氮中冻存备用。
1.4样品制备
将原代PAMs铺于6孔细胞培养板,细胞数目约2.5×106·孔-1,置于37 ℃含5% CO2的培养箱中过夜培养。当单层细胞密度达到约80%时,用PRRSV以MOI=1感染PAMs,在感染30 h后收集细胞。未感染的PAMs作为阴性对照。1 500 r·min-1离心5 min,无菌PBS重悬,重复三次,用等体积的含0.1% RapiGest SF的碳酸氢铵(pH 7.8)稀释。冻融后涡旋5 min,重复三次,然后将样品于80 ℃加热10 min。将样品转移到1.5 mL离心管,取出一份样品检测蛋白质浓度。向样品中加入终浓度为3 mmol·L-1的二硫苏糖醇,于60 ℃孵育10 min,冷却至室温。加入终浓度为9 mmol·L-1的碘乙酰胺,于黑暗中室温孵育30 min。然后将样品冻于-80 ℃冰箱备用。
1.5LC-MS/MS
蛋白质样品通过胰酶消化为肽段,使用纳升级液相色谱系统Ultimate U3000 (Dionex Corporation) 进行分离,然后利用电喷雾串联质谱仪 (Thermo Fisher Scientific Inc.) 进行鉴定。所得到的质谱数据使用Max-Quant 1.0.7.4 (Cox and Mann) 软件查询PaxDb蛋白质数据库进行定量和定性分析。感染组样品和对照组样品进行三次独立的鉴定。
1.6Western blot
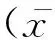
1.7ELISA
收集PRRSV感染30 h或未感染的PAMs细胞和上清培养液,上清中的细胞通过200 g离心去除,细胞碎片成分通过14 000 g,4 ℃高速离心去除。IL-8通过双抗夹心法检测。纯化的IL-8抗体包被于微孔板上,加样后于37 ℃温育30 min,洗涤后加入酶标试剂50 μL,温育后洗涤,体积比1∶1加入显色液A与显色液B,37 ℃避光显色15 min,加入终止液终止反应,然后于450 nm处检测各样品的吸光度。具体操作步骤参考猪IL-8 ELISA试剂盒说明书。检测进行三次重复,统计学分析参照步骤“1.6”。
1.8生物信息学分析
将质谱鉴定的蛋白质提交到String (version 10,http://string-db.org/) 数据库,分析差异表达蛋白质的互作网络,通过Gene Ontology (http://geneontology.org/) 对差异表达基因进行生物学功能聚类与通路分析,通过IPA软件 (version 01-04,试用版) 进行调控效应分析。
2 结 果
2.1LC-MS/MS鉴定差异表达蛋白质
本研究利用蛋白质组学方法鉴定PRRSV感染30 h的PAMs与未感染细胞之间的差异表达蛋白质。将感染组与对照组的PAMs总蛋白质分别进行定量质谱分析,通过查询PaxDb数据库进行三次独立筛选,最终鉴定出感染组与对照组间的差异蛋白质645个。其中已知蛋白质437个,未知蛋白质208个。对筛选出的蛋白质以柱状图方式进行定量分析(图1A),从图1可知,其蛋白质呈正态分布,大多数蛋白质感染组/对照组的表达量比值(Ratio)分布于log2(Ratio) = [-1,1]之间。
应用以下标准定义一种蛋白质在两组间表现为差异蛋白质:(1)当Ratio大于2.0或小于0.5,即log2(Ratio)大于1或小于-1,可定义为感染组的上调蛋白质或下调蛋白质;(2)三次试验重复出现且蛋白质至少由2个或2个以上的肽段组成。最终,筛选出39个表达差异的蛋白质,其中表达上调的蛋白质有30个(图1B,up-regulation框内),表达下调的蛋白有9个(图1B,down-regulation框内)。筛选出的蛋白质种类及差异表达情况见表1。
2.2String分析差异蛋白质的定位与互作网络
为了进一步分析鉴定出的差异蛋白质在PRRSV感染PAMs中的作用,采用String和GO数据库对这39个蛋白质进行数据挖掘。根据GO数据库分析39个差异表达蛋白质的亚细胞定位情况(图2),其中,19个蛋白质定位于细胞质(49%),6个蛋白质定位于细胞核(15%),7个蛋白质为质膜蛋白质(18%),另外 5个蛋白质属于细胞间隙蛋白质(13%),还有2个蛋白质为分泌型蛋白质(5%)。
将39个差异表达蛋白质的UniProt 登录号提交到String数据库,选择种源为Sus scrofa,数据库根据已有文献报道的蛋白质互作信息,生成差异表达蛋白质的互作网络(图3)。这些蛋白质按功能主要分为两部分:一部分参与核苷酸代谢(图3左),一部分参与机体天然免疫应答(图3右)。
2.3表达差异蛋白质的生物学功能与通路分析
由于IPA软件识别的蛋白数据库里没有Susscrofa物种的数据,且鉴定得到的蛋白质少于100个,这里作者使用String数据库的Enrichment功能,对这39个差异表达基因进行生物学功能与通路分析。根据GO功能聚类及KEGG通路分析,可知与PRRSV感染相关的差异基因具有多个生物学功能,其中得分最高的十个功能为(图4A):GO:0042288 MHC class I protein binding、GO:0046933 proton-transporting ATP synthase activity、GO:0044822 poly(A) RNA binding、GO:0003723 RNA binding、GO:0042287 MHC protein binding、GO:0046961 rotational mechanism、GO:0044769 ATPase activity、GO:0036442 hydrogen-exporting ATPase activity、GO:0016853 isomerase activity和GO:0003725 double-stranded RNA binding。与PRRSV感染最相关的十个生物学通路为(图4B):5016 Huntington’s disease、5144 Malaria、5012 Parkinson’s disease、5010 Alzheimer’s disease、4620 Toll-like receptor signaling pathway、5160 Hepatitis C、5162 Measles、190 Oxidative phosphorylation、5143 African trypanosomiasis和5164 Influenza A。柱状图的高低代表PRRSV感染后差异表达基因与该功能或通路相关性的大小,-log10(P-value) 数值越大,表示其相关性越强。该结果显示:鉴定出的差异表达蛋白质主要行使抗原呈递、ATP合成和结合RNA 等功能,主要参与Toll样受体(TLR)信号通路、疟疾和病毒感染等生物学通路。

A.差异表达蛋白数量统计图;B.差异表达蛋白分布散点图。log2(Ratio)表示差异值,-log10(P-value)表示相关性A.The number statistics of differential proteins;B.The distribute scatter graph of differential proteins.log2(Ratio) means the difference and -log10(P-value) means the correlation图1 PRRSV感染PAMs表达差异蛋白质分布Fig.1 Distribution of differential proteins in PRRSV infected PAMs
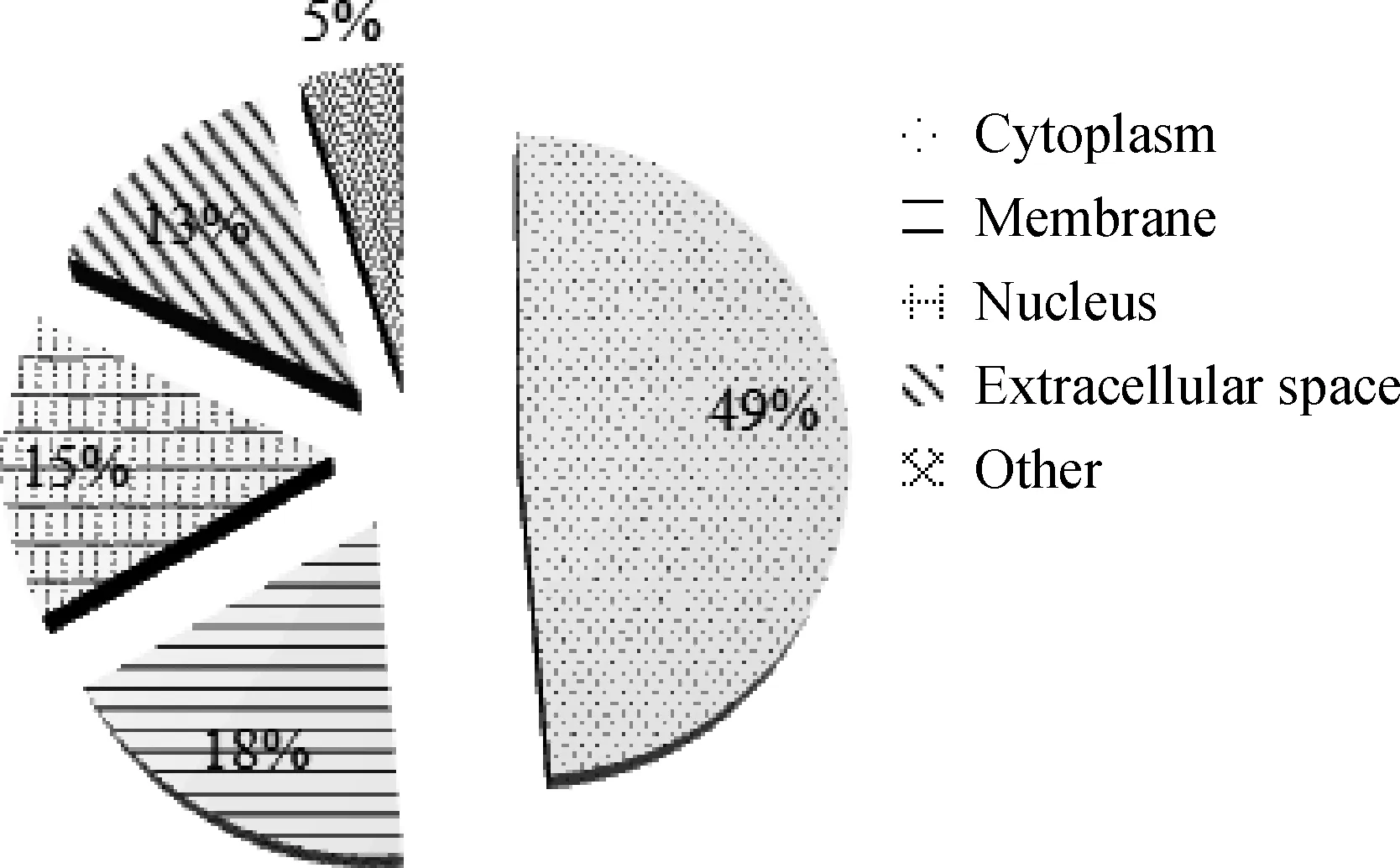
图2 PRRSV感染PAMs表达差异蛋白质亚细胞定位Fig.2 Subcellular location analysis of differential proteins in PRRSV infected PAMs
2.4Western blot验证差异表达蛋白质
为了进一步验证质谱鉴定出的差异蛋白质,通过Western blot检测感染30 h后分泌型磷蛋白(SPP1)、IFN诱导蛋白3(IFIT3)和信号转导及转录激活因子3(STAT3)的表达量。未感染病毒的PAMs细胞蛋白质样品作为对照(图5)。检测发现,对照样品中几乎不能检测到SPP1蛋白,PRRSV感染30 h PAMs中SPP1的量约是对照组的2倍(P<0.05)。而IFIT3的表达量在感染后约达到对照组的5倍(P<0.01)。蛋白STAT3作为转录激活因子,在PRRSV感染后表达下调,检测到其表达量在感染30 h后仅为对照组的四分之一(P<0.01)。这三个蛋白质的Western blot检测结果与质谱鉴定结果一致。
表1LC-MS/MS鉴定出的差异表达蛋白质
Table 1Differential expression proteins were identified by LC-MS/MS

基因名称GenenameUniProt收录号UniProtaccession差异值log2(Ratio)P值P-value相关性-log10(P-value)比值Ratio上调Up-regulated IL-1BP268892.3677494450.000549573.2599767805.16135350 IL-8P268941.9291586030.000413033.3840200483.80833028 ATP5A1F1RPS81.8249978930.041579161.3811242593.54306490 HIST1H1DQ53DY51.7635702390.010184911.9920430173.39537340 SPP1P142871.6311335090.003714452.4301049853.09756275 THEMIS2F1STM81.6204382920.047990691.3188430033.07468431 ERAP2F1RNU01.4521237820.025001121.6020404842.73610535 CD97F1SD421.4047860700.040622351.3912349212.64778517 GLOBINF1RGX41.3743766040.016879721.7726346452.59255861 ANXA5F2Z5C11.2915748810.000634063.1978711722.44795134 OAS2F1RKA71.2725443130.030316891.5183154102.41587249 ANKRD22F1SCY91.2625292970.001123812.9493074392.39915987 IFIT3F1SCY21.2225594340.006901742.1610414762.33360347 PGCPF1S0L61.1835528680.009915222.0036976512.27135446 NUCB2F1S9A41.1750440050.032166101.4926016282.25799768 SERPINB2F1SMW71.1737573750.002110422.6756312772.25598484 PGRMC1Q952501.1632312170.000359903.4438146262.23958468 SRSF3F1RY921.1319567590.006087112.2155891432.19155785 SLC25A12F1S0861.1299315900.042272931.3739376232.18848363 TOP1F1SDV71.0994617970.009735592.0116376192.14274742 NUDFV2F1SM981.0879596710.035476651.4500574232.12573193 SLC25A4F1RZQ61.0788999740.015969531.7967079442.11242479 FKBP11F1SPN11.0665848460.037140931.4301471732.09446946 STIM1F1SUZ41.0665502230.046838111.3294006532.09441919 DLATF1SMB21.0655019730.040190561.3958759062.09289796 ATP5BF1SLA01.0565724490.003500892.4558217652.07998403 NIPSNAP3AF1SP561.0475992100.008206082.0858641512.06708714 TFAMQ5D1441.0220136930.006234682.2051856552.03075148 ERP29F1RJM21.0106741990.003079002.5115905172.01485246 ACADLP792741.0026746410.026715541.5732359872.00371128下调Down-regulated PGAM1F1S8Y5-1.0130159570.032947311.4821800250.49550930 RBM3I3L5X7-1.0410301900.020179841.6950823650.48598032 STAT3Q19S50-1.1233912060.017850821.7483418610.45901360 TXNRD1F1SG38-1.1521358840.027877291.5547494700.44995858 PYGLF1SFF8-1.2697427810.022467701.6484414140.41473371 TFRCD7RK08-1.3168526840.015228701.8173371500.40140968 COMMD9F1SHG3-1.3323626130.029752611.5264749700.39711737 YARSI3L5T8-1.4598376470.015217651.8176524740.36353404 PSMB6F1RFV5-1.6823036500.009017222.0449274060.31158471
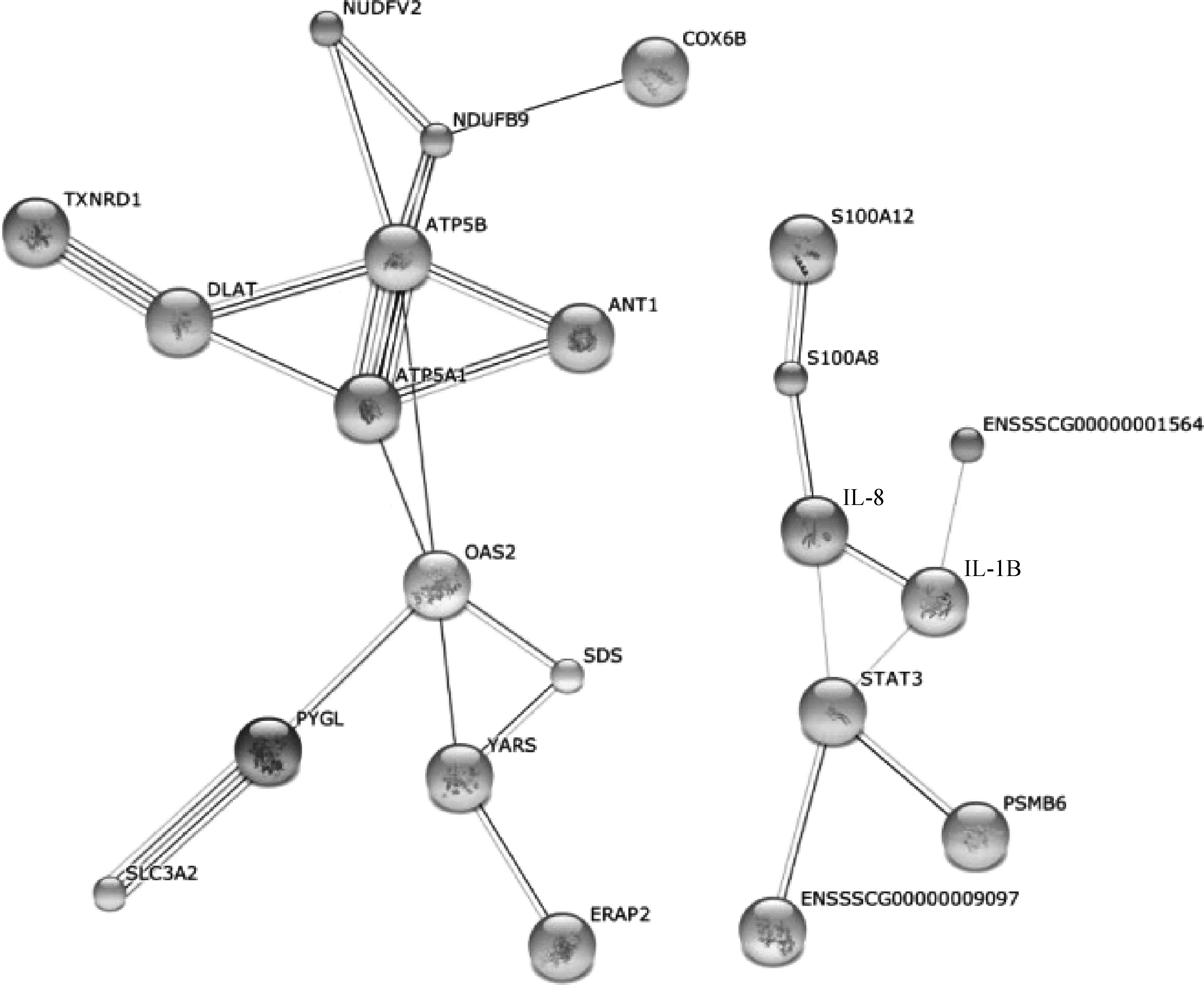
图3 PRRSV感染PAMs表达差异蛋白质的互作网络Fig.3 The interaction network of differential proteins in PRRSV infected PAMs
A.与PRRSV感染最相关的十个生物学功能;B.与PRRSV感染最相关的十个生物学通路。Ratio表示满足指定生物学功能初始值的基因数与该功能总基因数的比值,-log10(P-value)表示差异表达基因与该功能或通路的相关性A.The top ten functions related to PRRSV infection;B.The top ten pathways related to PRRSV infection.Ratio means genes in a given function that meet cutoff criteria were divided by total genes that make up that function,-log10(P-value) means the correlation between differential genes with the biological function or pathway图4 差异表达基因的生物学功能与通路分析Fig.4 Function and pathway analysis of differential expression genes

A.Western blot验证PRRSV感染30 h后的PAMs差异表达蛋白质;B.感染样品中蛋白质相对于对照PAMs细胞蛋白质的灰度比值,β-actin作为内参校正蛋白质上样量。*.P<0.05,差异显著;**.P<0.01,差异极显著A.Western blot assays of differential expression PAMs proteins at 30 h post infection;B.The relative levels of protein expression,the protein levels in the uninfected sample were normalized to 1 using β-actin as the internal control.*.P<0.05 and significant difference;**.P<0.01 and extreme difference图5 Western blot鉴定表达差异蛋白质SPP1、IFIT3和STAT3Fig.5 Identification of the expression level of SPP1,IFIT3 and STAT3 by Western blot
2.5ELISA检测IL-8的表达量
白介素8(IL-8)是炎性细胞因子,属于分泌型蛋白。作者用ELISA方法定量检测感染后PAMs培养上清中的IL-8含量。首先根据标准品作出IL-8浓度与吸光值的标准曲线y=252.330x2+99.214x+48.701,在50~900 pg·μL-1浓度范围内线性关系良好,样品线性回归与IL-8预期浓度相关系数为0.999(图6A)。然后分别检测PAMs细胞和培养上清的吸光值,根据标准曲线计算出IL-8的浓度(图6B)。发现PRRSV感染30 h的PAMs细胞内IL-8的浓度相比对照细胞没有显著差异(P>0.05),基本稳定在100~110 pg·μL-1;而培养上清中IL-8的浓度在感染30 h后达到165 pg·μL-1,相比对照细胞上清上升了大约40%(P<0.05)。

A.标准曲线;B.感染30 h PAMs细胞内和上清中的IL-8浓度。*表示P<0.05,差异显著;n.s.表示P>0.05,差异不显著A.Standard curve;B.The concentrations of IL-8 in cell and supernatant of PAMs at 30 h post infection.*means P<0.05 and significant difference;n.s.means P>0.05 and no significant图6 ELISA检测PAMs合成IL-8的含量Fig.6 The levels of IL-8 in PAMs were detected by ELISA
3 讨 论
利用定量质组学全面科学地分析PRRSV感染的PAMs中差异表达的蛋白质,有助于进一步理解PRRSV的致病机制。本研究中,作者成功鉴定出39个PAMs差异表达的蛋白质,利用生物数据库分析了这些差异蛋白质的亚细胞定位、生物学功能和参与的信号通路。其中,参与TLR信号通路的蛋白包括IL-1β、IL-8和SPP1,参与流感病毒和丙型肝炎病毒感染通路的蛋白质包括IL-8和STAT3。随后作者用Western blot和ELISA的方法,分别验证了SPP1、IFIT3、 STAT3和IL-8在感染细胞中的表达情况。
SPP1是一种分泌型的磷酸化糖蛋白,其主要定位于细胞膜外,是一个功能活跃的蛋白质,主要参与细胞黏附、PI3K-Akt信号通路和Toll样受体信号通路等[9]。体外研究表明SPP1通过影响巨噬细胞的活性而在天然免疫过程中发挥重要作用[10]。而在巨噬细胞中,SPP1的表达需要TLR诱导型PI3K、JNK、ERK和AP-1的激活,TLR信号能够进一步上调内源性SPP1的表达,从而抑制巨噬细胞中IFN-β的合成[11]。本研究中作者检测到PRRSV感染能够上调PAMs中SPP1表达,提示PRRSV感染可能通过TLR信号通路抑制IFN-β的合成,参与病毒逃逸宿主的天然免疫。
IFIT3属于IFIT家族蛋白,在抗病毒和免疫调节中发挥着重要作用[12]。有报道称IFIT3能增强单核巨噬细胞在LPS刺激下多种细胞因子的表达与炎症通路的活化,而且IFIT3通过NF-κB通路参与趋化因子的表达调控[13]。在作者的定量质谱数据中,感染30 h的PAMs中IFIT3上调表达,其含量达到对照组的2.3倍,这与通过iTRAQ标记的定量蛋白组学检测PAMs差异表达蛋白质的结果一致[14]。提示PRRSV感染可能通过激活IFIT3的表达,上调一些炎症因子的表达,从而导致机体出现炎症。另有报道表明PRRSV感染的Marc-145细胞中,IFIT3的激活能够抑制PRRSV的复制[15]。因此,作者推测 PAMs中IFIT3的上调表达对病毒复制也有抑制作用,但其作用机制还有待进一步研究。
STAT3在细胞生长发育和凋亡、病毒感染和细胞免疫应答等多个环节具有重要的调节作用[16]。研究发现在CoV感染的Vero E6细胞中,STAT3第705位的酪氨酸发生去磷酸化而定位到细胞质,从而失去转录激活活性[17];而在VZV和HBV等病毒感染后,磷酸化的STAT均上调表达[18-19]。因此,STAT3对病毒感染和复制的影响是一种病毒特异性的生物学过程,不同病毒感染对STAT3的影响有不同表现。另外,有报道表明STAT3能够通过抑制蛋白激酶R的活性,从而抑制细胞自噬[20]。在本试验中,作者检测到在PRRSV感染的PAMs中STAT3下调表达,提示PRRSV感染可能会通过抑制STAT3的表达而抑制PAMs的增值,并促进细胞凋亡或自噬。
IL-8,又名CXCL8,是一种多源性的细胞因子,对中性粒细胞有强烈的趋化作用。细胞因子IL-1、TNF、内毒素和病毒感染均能诱导多种细胞合成和分泌IL-8,包括单核细胞、巨噬细胞和成纤维细胞等[21]。通过生物学通路分析,作者了解到参与TLR信号通路的细胞因子IL-8和IL-1β在感染PRRSV后都上调表达。TLR信号通路作为抗病毒的靶通路,其中TLR3和TLR9激活髓样分化因子(MyD88)依赖型途径,随后NF-κB游离释放进入细胞核协同其他转录因子诱导IL-1β、IL-6和IL-8等炎性因子的表达[22],IL-1β和IL-8进一步激活T淋巴细胞,参与细胞的天然免疫应答(图7),同时IL-1β促进巨噬细胞的凋亡。有研究表明在PRRSV感染前期,血清中高浓度的IL-8表现出较强的抗PRRSV活性[23],另外有研究也发现IL-8、IL-1β和IFN-γ与猪体内PRRSV的清除有关[24]。这提示PRRSV感染过程中细胞可能通过IL-8与IL-1β等细胞因子的上调表达共同参与机体的抗病毒免疫反应。

图7 IPA软件分析细胞因子IL-1β和IL-8的调控效应Fig.7 The regulation effect of cellular factors IL-1β and IL-8 was analyzed by IPA
4 结 论
应用高通量蛋白质组学技术研究PRRSV感染PAMs和正常PAMs的蛋白质组差异,鉴定出39个差异表达蛋白质:其中有30个表达上调,另外9个表达下调。同时,通过Western blot或ELISA验证了感染后SPP1、IFIT3、STAT3和IL-8的差异表达情况与质谱鉴定结果一致。分析在PRRSV感染后,一方面病毒可借助SPP1等细胞蛋白质的差异表达逃逸宿主的天然免疫;另一方面宿主上调表达IL-8等多个细胞因子共同参与机体的抗病毒免疫反应,同时一些差异表达的蛋白质(如STAT3的下调表达,IFIT3的上调表达)可能促进细胞凋亡或导致宿主机体出现炎症等病理性反应。
[1]WENSVOORT G,TERPSTRA C,POL J M,et al.Mystery swine disease in The Netherlands:the isolation of Lelystad virus[J].VetQ,1991,13(3):121-130.
[2]DUAN X,NAUWYNCK H J,PENSAERT M B.Virus quantification and identification of cellular targets in the lungs and lymphoid tissues of pigs at different time intervals after inoculation with porcine reproductive and respiratory syndrome virus (PRRSV)[J].VetMicrobiol,1997,56(1-2):9-19.
[3]DING Z,LI Z J,ZHANG X D,et al.Proteomic alteration of Marc-145 cells and PAMs after infection by porcine reproductive and respiratory syndrome virus[J].VetImmunolImmunopathol,2012,145(1-2):206-213.
[4]LI J N,GUO D W,HUANG L,et al.The interaction between host Annexin A2 and viral Nsp9 is beneficial for replication of porcine reproductive and respiratory syndrome virus[J].VirusRes,2014,189:106-113.
[5]LIU L,LEAR Z,HUGHES D J,et al.Resolution of the cellular proteome of the nucleocapsid protein from a highly pathogenic isolate of porcine reproductive and respiratory syndrome virus identifies PARP-1 as a cellular target whose interaction is critical for virus biology[J].VetMicrobiol,2015,176(1-2):109-119.
[6]钱小红.定量蛋白质组学分析方法[J].色谱,2013,31(8):719-723.
QIAN X H.The analytical method of quantitative proteomics[J].ChineseJournalofChromatography,2013,31(8):719-723.(in Chinese)
[7]YANG Y,AN T,GONG D,et al.Identification of porcine serum proteins modified in response to HP-PRRSV HuN4 infection by two-dimensional differential gel electrophoresis[J].VetMicrobiol,2012,158(3-4):237-246.
[8]ZHANG H,GUO X,GE X,et al.Changes in the cellular proteins of pulmonary alveolar macrophage infected with porcine reproductive and respiratory syndrome virus by proteomics analysis[J].JProteomeRes,2009,8(6):3091-3097.
[9]李铁求,滕伊漓,邹亚光,等.基于基因芯片的前列腺癌转移高表达基因SPP1的生物信息学分析[J].中华男科学杂志,2014,20(11):984-990.
LI T Q,TENG Y L,ZOU Y G,et al.The highly expressed secreted phosphoprotein 1 gene in prostate cancer metastasis:A microarray-based bioinformatic analysis[J].NationalJournalofAndrology,2014,20(11):984-990.(in Chinese)
[10]ROLLO E E,DENHARDT D T.Differential effects of osteopontin on the cytotoxic activity of macrophages from young and old mice[J].Immunology,1996,88(4):642-647.
[11]ZHAO W,WANG L,ZHANG L,et al.Differential expression of intracellular and secreted osteopontin isoforms by murine macrophages in response to toll-like receptor agonists[J].JBiolChem,2010,285(27):20452-20461.
[12]MIETTINEN J J,MATIKAINEN S,NYMAN T A.Global secretome characterization of herpes simplex virus 1-infected human primary macrophages[J].JVirol,2012,86(23):12770-12778.
[13]扶琼.SLE相关基因IFIT3的功能及分子机制研究[D].上海:上海交通大学,2008.
FU Q.A study on biological functions and molecular mechanisms of a lupus related gene IFIT3[D].Shanghai:Shanghai Jiaotong University,2008.(in Chinese)
[14]LU Q,BAI J,ZHANG L,et al.Two-dimensional liquid chromatography-tandem mass spectrometry coupled with isobaric tags for relative and absolute quantification (iTRAQ) labeling approach revealed first proteome profiles of pulmonary alveolar macrophages infected with porcine reproductive and respiratory syndrome virus[J].JProteomeRes,2012,11(5):2890-2903.
[15]ZHANG L,LIU J,BAI J,et al.Poly(I:C) inhibits porcine reproductive and respiratory syndrome virus replication in MARC-145 cells via activation of IFIT3[J].AntiviralRes,2013,99(3):197-206.
[16]LEE H,HERRMANN A,DENG J H,et al.Persistently activated Stat3 maintains constitutive NF-κB activity in tumors[J].CancerCell,2009,15(4):283-293.
[17]MIZUTANI T,FUKUSHI S,MURAKAMI M,et al.Tyrosine dephosphorylation of STAT3 in SARS coronavirus-infected Vero E6 cells[J].FEBSLett,2004,577(1-2):187-192.
[18]HILL E R,KOGANTI S,ZHI J,et al.Signal transducer and activator of transcription 3 limits Epstein-Barr virus lytic activation in B lymphocytes[J].JVirol,2013,87(21):11438-11446.
[19]HUANG S C,RAGHAVARAJU G,LIU H S.High expression of vascular endothelial growth factor in EV71-infected patients does not originate from EV71-infected cells[J].Intervirology,2010,53(6):394-401.
[20]SHEN S,NISO-SANTANO M,ADJEMIAN S,et al.Cytoplasmic STAT3 represses autophagy by inhibiting PKR activity[J].MolCell,2012,48(5):667-680.
[21]STRIETER R M,CHENSUE S W,BASHA M A,et al.Human alveolar macrophage gene expression of interleukin-8 by tumor necrosis factor-α,lipopolysaccharide,and interleukin-1β[J].AmJRespirCellMolBiol,1990,2(4):321-326.
[22]BARTON G M,MEDZHITOV R.Toll-like receptor signaling pathways[J].Science,2003,300(5625):1524-1525.
[23]PETRY D B,LUNNEY J,BOYD P,et al.Differential immunity in pigs with high and low responses to porcine reproductive and respiratory syndrome virus infection[J].JAnimSci,2007,85(9):2075-2092.
[24]LUNNEY J K,FRITZ E R,REECY J M,et al.Interleukin-8,interleukin-1β,and interferon-γ levels are linked to PRRS virus clearance[J].ViralImmunol,2010,23(2):127-134.
(编辑白永平)
Analysis of Differential Expression Proteins in Porcine Reproductive and Respiratory Syndrome Virus Infected Pulmonary Alveolar Macrophage by Quantitative Proteomics
LIU Long,CHEN Hong-ying*
(CollegeofLifeSciences,NorthwestA&FUniversity,Yangling712100,China)
The purpose of our research was to study the differential expression proteins of Porcine reproductive and respiratory syndrome virus (PRRSV) infected porcine alveolar macrophage (PAMs) relative to the un-infected control PAMs.Differential proteins in response to PRRSV infection were analyzed by High Performance Liquid Chromatography coupled with tandem mass spectrometry,and then identified using software Max-Quant 1.0.7.4 combining with the protein database PaxDb.Thirty-nine differential proteins were identified in the PRRSV infected group,including thirty up-regulated proteins and nine down-regulated proteins.The up-regulation of SPP1,IFIT3 and IL-8,and down-regulation of STAT3 in PRRSV infected PAMs were verified by Western blot and ELISA.This study provides new evidences for further studies on the molecular mechanism of PRRSV pathogenesis by using LC-MS/MS.
porcine reproductive and respiratory syndrome virus;porcine alveolar macrophage;differential expression proteins;infection
10.11843/j.issn.0366-6964.2016.06.018
2015-12-17
中央高校基本科研业务费创新重点项目(QN2011065)
刘龙(1988-),男,陕西山阳人,博士,主要从事PRRSV蛋白与宿主蛋白相互作用的研究,Tel:029-87092687,E-mail: liulong2015@outlook.com
陈红英, E-mail: chenhy@nwsuaf.edu.cn
S858.285.3
A
0366-6964(2016)06-1222-10

