共表达3种纤维素降解酶的转基因小鼠模型的建立与分析
何祖勇,刘志国,孙燕霞,丛佩清,陈瑶生*
(1.中山大学生命科学学院,有害生物控制与资源利用国家重点实验室,广州 510006;2.中国农业科学院北京畜牧兽医研究所,北京 100193)
共表达3种纤维素降解酶的转基因小鼠模型的建立与分析
何祖勇1#,刘志国1,2#,孙燕霞1,丛佩清1,陈瑶生1*
(1.中山大学生命科学学院,有害生物控制与资源利用国家重点实验室,广州 510006;2.中国农业科学院北京畜牧兽医研究所,北京 100193)
本研究旨在应用转基因技术制作能特异性分解纤维素和木质素的转基因单胃动物,对于培育高饲料转化率的家畜具有重要的研究意义。利用2A肽策略构建由EF1α启动子驱动的可同时表达3种能够降解纤维素和木质素的酶(EGXA、BGL4和XYNB)的真核表达载体,并通过原核显微注射技术获得同时表达3种酶的转基因小鼠。经检测发现,2A肽能够介导3种酶同时在HEK293A细胞中正常表达。通过酶活分析、Western blot和免疫组织化学等检测发现,3种酶均能在转基因小鼠消化系统各组织中表达,并且具有正常活性。本研究结果表明,在EF1α启动子的控制下,2A肽能够在小鼠中介导EGXA、BGL4和XYNB的正常表达,并成功建立表达外源纤维素酶和木质素酶的转基因小鼠模型,为培育具有高饲料转化率的动物奠定研究基础。
β-葡萄糖苷酶;纤维素酶;共表达;转基因小鼠;木聚糖酶;2A肽
纤维素和木质素作为植物细胞壁的主要组成成分,是自然界中含量最为丰富的干物质。但是单胃动物,如猪和禽类动物,因自身不能合成和分泌降解纤维素和木质素所需的水解酶而无法利用这两种物质,却会因此增加肠道中食糜的黏稠度,严重抑制营养物质的吸收,降低饲料转化率[1-2],此外还会导致排泄物中的残余营养物质增多,造成环境污染。在动物饲料中人工添加纤维素酶和木聚糖酶虽然可以部分解决这个问题[3],但是这无疑会增加动物的养殖成本,并且在饲料的生产、储存和运输等过程中还有可能发生酶活丧失的问题[4],因此培育能稳定表达纤维素酶和木聚糖酶的转基因动物,利用自身合成分泌的酶来消化饲料中的纤维素和木质素,从而无需在饲料中额外添加酶,可能是一种更有效的解决方法。有研究证明,在转基因动物中表达微生物酶的可行性[5-11],但是纤维素的完全水解过程比较复杂,至少需要3种酶的协同作用:内切-β-1.4-葡糖聚酶(endo-β-1,4-glucanase (EC3.2.l.4)),外切-β-1.4-D-葡糖聚酶(exo-β-1,4-D-glucanase或称为β-1,4-D-glucan cellobilhydrolase (EC3.2.1.91))以及β-1.4-葡糖苷酶( β-1,4-glucosidase (EC3.2.1.21))。因此,为了有效降解植物细胞壁,必须在转基因动物体内同时表达至少3种酶。多功能纤维素酶EGXA源于软体动物福寿螺(Ampullariacrossean)[12],同时具有内切-β-1,4-葡聚糖酶、外切-β-1,4-葡聚糖酶和内切-β-1,4-木聚糖酶3种活性,可水解微晶纤维素、羧甲基纤维素以及木聚糖。相对于大多来源于细菌的纤维素酶基因,EGXA具有更高的水解活力以及在更好的低pH环境下的稳定性[13]。BGL4 是一种源于灰质腐霉(Humicolagrisea)的葡糖苷酶[7],不仅具有非常高的酶活力,而且热稳定性好,并同时具有一定的β-半乳糖苷酶(β-galactosidase)活性。木聚糖酶XYNB是从橄榄绿链霉菌A1(StreptomycesolivaceoviridisA1)中克隆得到的,具有优良的酶学性质、热稳定性和金属离子抗性,且经过胃蛋白酶和胰蛋白酶处理后仍能保持大部分活性[14]。因此,选择这3种酶作为制作转纤维素酶转基因动物的外源基因。
2A肽(2A peptide)的应用为多基因共表达提供了一个比较有效的方法。2A肽是在研究病毒剪切的过程中发现的一类具有自剪切功能的短肽,可以介导连接在其上下游的基因以相同的表达水平进行表达。2A肽由18~22个氨基酸组成,因其分子量较小,在表达载体中占用空间较小,从而留给外源功能基因更大的空间。本研究应用2A肽策略构建由EF1α启动子驱动的EGXA、BGL4、XYNB基因共表达载体,在HEK293A细胞系中检测3个基因的共表达情况;进一步通过原核显微注射技术制备转EGXA、BGL4、XYNB基因小鼠,并分析3种外源基因在组织中的表达情况。
1 材料与方法
1.1质粒、内切酶等试剂
真核表达质粒pBluescript Ⅱ SK+、pBudCE4.1分别购自上海生工生物工程技术有限公司和Life Technology公司。限制性内切酶NheⅠ、BamH Ⅰ、SacⅠ、SpeⅠ、Hind Ⅲ均购自宝生物工程(大连)有限公司。人胚肾细胞系HEK293A、脂质体转染试剂Lipofectamine 2000均购自Life Technology公司。除特别说明外,所有细胞培养所需试剂均购自Gibco公司。试验小鼠均为中山大学实验动物中心的SPF级昆明白小鼠(生产合格证号:SYXK(粤)2011-0112)。
1.2载体构建
根据GenBank数据库中的序列信息,由上海生工生物工程技术有限公司合成源于猪肠病毒(Porcine teschovirus,PTV),口蹄疫病毒(Foot and mouth picornavirus,FMDV)以及马鼻炎病毒(Equine rhinitis A virus,ERAV)3种病毒的2A肽DNA序列,并将它们连接到pBluescript Ⅱ SK+载体中,得到携带2A序列以及多种酶切位点的载体pBlu-FMDV-2A、pBlu-ERAV-2A以及pBlu-PTV-2A。在EGXA,BGL4 和XYNB 3种经过“人源化”密码子优化的DNA序列前端连接牛β-酪蛋白信号肽[15],然后通过限制性内切酶位点NheⅠ和BamHⅠ分别将其连接到pBlu-FMDV-2A、pBlu-ERAV-2A、pBlu-PTV-2A载体中,使每种基因序列都和一种2A序列连接。将BGL4-2A、XYNB-2A片段通过SacⅠ、SpeⅠ以及Hind Ⅲ限制性内切酶位点克隆到pBlu-EGXA-2A载体上,形成pBlu-EGXA-BGL4-XYNB。
将合成的增强型绿色荧光蛋白(Enhanced green fluorescence protein,EGFP)编码区序列克隆到pBudCE4.1载体中CMV启动子下游。最后,从pBlu-EGXA-BGL4-XYNB载体上切下EGXA-2A-BGL4-2A-XYNB-2A片段,克隆到pBudCE4.1-EGFP载体中EF1α启动子下游,形成最终的真核多基因共表达载体pBud-EF1α-EGXA-2A-BGL4-2A-XYNB-CMV-GFP(图1),以下简称pBud-EGXA-BGL4-XYNB。
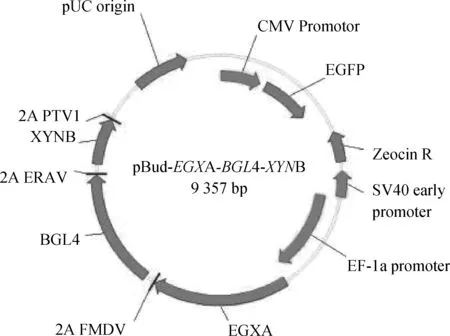
2A FMDV、2A ERAV 和2A PTV1分别代表源于口蹄疫病毒、马鼻炎病毒以及猪肠病毒的2A肽。分别介导EGX A、BGL 4和XYN B 3种基因的共表达,且同时可作为检测3种酶的蛋白标签。EGX A、BGL 4和XYN B 3种基因DNA序列经过“人源化”密码子优化,并添加牛β-酪蛋白信号肽 2A FMDV,2A ERAV and 2A PTV1 represent 2A sequences from FMDV,ERAV and PTV respectively,they mediate the co-expression of EGX A,BGL 4 and XYN B and also can be used as protein tags.The DNA sequences of EGX A,BGL 4 and XYN B were optimized using “humanised” codon usage method and bovine β-Casein signal peptide was added before each gene图1 3基因共表达载体pBud-EGX A-BGL 4-XYN B结构示意图Fig.1 Schematic diagram of pBud-EGX A-BGL 4-XYN B vector
1.3细胞培养与转染
HEK293A细胞复苏后,使用含10%胎牛血清(Fetal bovine serum,FBS)的DMEM培养基在5%CO2,37 ℃培养箱中培养。取传至3~5代的HEK293A细胞,等细胞汇合度约80%时,按照转染试剂说明书进行转染。在相同条件下,每种质粒转染3个孔作为重复。转染4 h后,将无血清培养基换为DMEM培养基(10%FBS)。连续培养24 h后进行细胞荧光观察,观察转染效果。在转染48 h后,提取细胞总蛋白进行后续分析。
1.4转基因小鼠制备
多基因共表达载体pBud-EGXA-BGL4-XYNB经限制性内切酶PvuI酶切后进行凝胶电泳回收,稀释至3~5 ng·μL-1。之后将该质粒按照小鼠原核显微注射标准操作流程注射到昆明白小鼠的受精卵中。试验小鼠的使用符合动物保护、动物福利和伦理原则,符合国家实验动物福利伦理的相关规定,并通过中山大学实验动物伦理委员会审核。
1.5转基因小鼠的PCR鉴定
通过PCR反应鉴定胚胎移植后出生的小鼠及其后代是否为转基因阳性个体。取出生后3周的小鼠尾尖,用组织DNA提取试剂盒(Omega,美国)提取DNA后,用表1中的引物进行PCR反应。PCR检测结果为阳性的小鼠用于进一步的Western blot分析以及酶活性分析。
表1鉴定转基因细胞和小鼠的引物及其序列
Table 1Primer sequences used in the screening of transgenic cells and mice
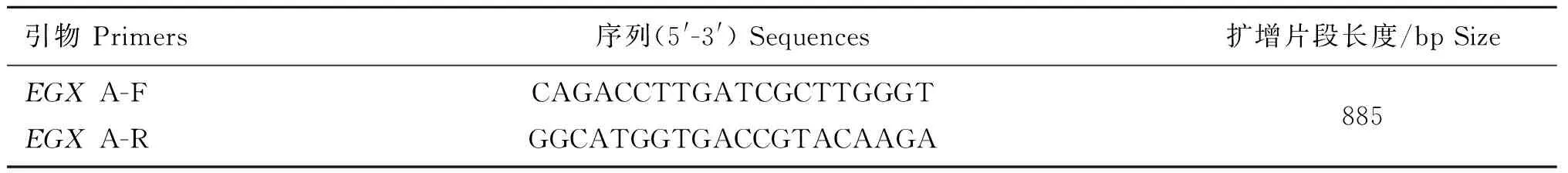
引物Primers序列(5'-3')Sequences扩增片段长度/bpSizeEGXA-FEGXA-RCAGACCTTGATCGCTTGGGTGGCATGGTGACCGTACAAGA885
1.6Western blot分析
根据PCR检测结果,将阳性小鼠处死,以其全同胞阴性小鼠作为阴性对照,分别解剖获取舌、食道、胃、十二指肠、空肠和大肠6种组织。取100 mg组织按照活性蛋白提取试剂盒和全蛋白提取试剂盒(凯基生物,南京)说明书操作提取组织总蛋白,用Bradford法检测蛋白浓度,分装保存于-70 ℃。转染后的HEK293A细胞使用活性蛋白提取试剂盒(凯基生物,南京)提取总蛋白,用Bradford法检测蛋白浓度,分装保存于-70 ℃。取适量的蛋白样品,加入50 μL的SDS-PAGE上样缓冲液,在10%的SDS-PAGE胶上进行电泳后转膜,封闭后分别以anti-2A肽(Millipore,美国)一抗以及羊抗兔二抗孵育,之后通过增强型化学发光法检测携带2A肽的蛋白表达情况。
1.7免疫组织化学分析
将转基因阳性小鼠处死,以其全同胞阴性小鼠作为阴性对照,解剖采集舌、食道、胃、十二指肠、空肠和大肠组织块,并立即放入液氮中。将组织块切成6 μm厚的冷冻切片,用丙酮固定15 min后,于-80 ℃保存备用。在进行免疫组织化学分析时,先用3% H2O2处理组织切片,去除内源性过氧化氢酶活性。再用5%的牛血清白蛋白(Bovine serum albumin,BSA)封闭。之后分别以anti-2A肽(Millipore,美国)一抗以及羊抗兔二抗孵育,漂洗后进行DAB染色3~20 min,苏木精复染1~2 min后,脱水,封片后在显微镜下观察。
1.8酶活性分析
将转染质粒后细胞的活性蛋白样品,以及转基因小鼠、全同胞阴性小鼠的各组织活性蛋白样品进行纤维素和木质素酶的酶活性分析。外源基因EGXA的纤维素酶活性按照纤维素酶酶活测定试剂盒(Fluorescent Celluase Assay Kit,Marker Gene Technologies,美国)的原理和操作步骤进行酶活测定和分析;外源基因BGL4的葡萄糖苷酶活性按照β-葡萄糖苷酶酶活测定试剂盒(β-Glucosaccharase Assay Kit,BioAssay Systems,美国)的说明书进行操作和分析;外源基因XYNB的木聚糖酶活性按照木聚糖酶酶活测定试剂盒(Xylanase assay Kit,Invitrogen,美国)的说明书进行酶活测定和计算[16]。
1.9统计分析
所有酶活数据均以“平均值±标准误”表示。统计分析使用单因素方差分析以及Duncan’s post-hoc test检验。P<0.05表示差异显著。
2 结 果
2.1EGXA、BGL4以及XYNB酶在HEK293A细胞中的共表达
本课题组之前已成功在HEK293A细胞中分别表达EGXA、BGL4 以及XYNB酶[15-16]。表达效果良好,酶活力水平较高。为了进一步验证2A肽能否介导这3种纤维素酶同时在真核细胞中表达,构建了真核表达载体pBud-EGXA-2A-BGL4-2A-XYNB(图1)。该载体含有两个真核启动子,除同时表达3种纤维素酶蛋白外,还可同时表达增强型绿色荧光蛋白(EGFP),以便直观的观察质粒的转染效率。使用脂质体转染试剂Lipofectamine 2000在相同条件下分别向HEK293A细胞中转入pBud-EGXA-BGL4-XYNB质粒以及pEGFP-N1质粒(图2),pBud-EGXA-BGL4-XYNB转染效率较低,但是仍然能观察到EGFP蛋白的表达。
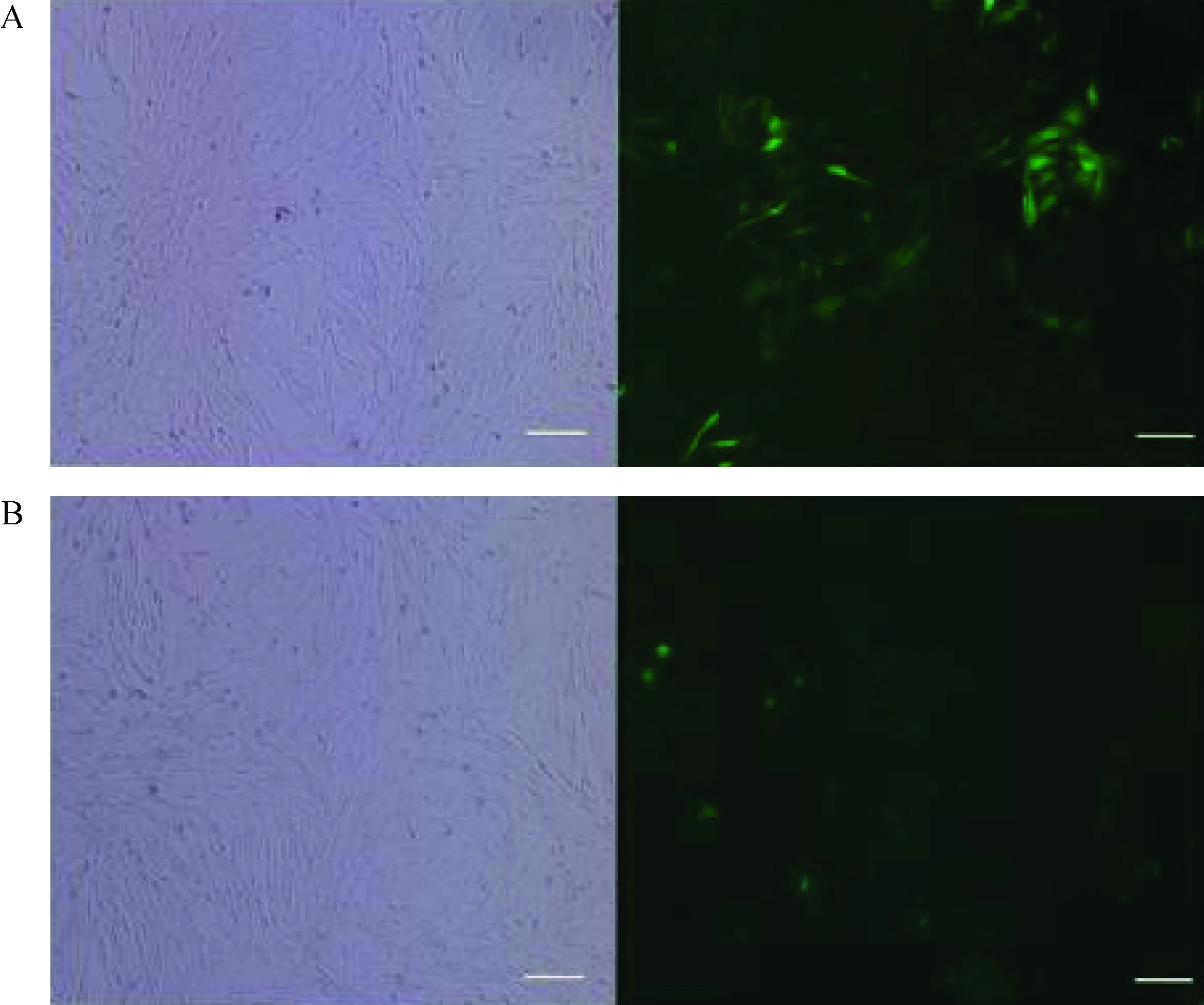
A.HEK293A细胞转染空载体PEGFP-N1质粒;B.HEK293A细胞转染pBud-EGX A-BGL 4-XYN B质粒;左边为明场,右边为绿色荧光,标尺为100 μmA.HEK293A cells transfected with PEGFP-N1;B.HEK293A cells transfected with pBud-EGX A-BGL 4-XYN B;Left panels are bright field photos,right panels are green fluorescent photos.Scale bar=100 μm图2 HEK293A细胞转染pBud-EGX A-BGL 4-XYN B后EGFP蛋白表达情况Fig.2 Expression of pBud-EGX A-BGL 4-XYN B in HEK293A cell
为进一步检测3种纤维素酶的表达情况,收集转染后细胞的总蛋白,使用anti-2A肽抗体作为一抗,进行Western blot检测(图略)。检测发现EGXA、BGL4以及XYNB蛋白均能正常表达,且表达水平基本一致。这进一步说明构建的多基因表达载体已经有效的转入HEK29A细胞中,并正常表达。表明2A肽能够高效介导EGXA、BGL4以及XYNB蛋白的自我切割。
2.2转EGXA、BGL4和XYNB基因小鼠的制备
通过在HEK293A细胞中的试验验证2A肽介导的多基因表达载体的有效性后,进一步制作同时表达3种纤维素酶的转基因小鼠。将pBud-EGXA-BGL4-XYNB载体线性化后,显微注射到昆明小鼠的受精卵中,选择GFP阳性的受精卵(图3A)移植到代孕母鼠中。代孕母鼠共产下52只小鼠,通过PCR鉴定(图3B)发现,其中3只为转基因阳性个体(TGM02、TGM03和TGM07)。但其中两只雌性小鼠(TGF02和TGF03)由于未知原因无法生育后代。另外一只雄性小鼠与野生型昆明鼠交配后,获得10只转基因阳性个体,其中3只为雌性个体,7只为雄性个体(图3C)。

A.显微注射pBud-EGX A-BGL 4-XYN B质粒4~6 h 后小鼠受精卵中EGFP蛋白的表达情况,标尺为250 μm;B.F0代转基因小鼠的PCR鉴定。左边7~1.TGM07、TGM06、TGM05、TGM04、TGM03、TGM02 以及TGM01号小鼠的组织样品;右边1~5.TGF01、TGF02、TGF03、TGF04以及 TGF05号小鼠的组织样品。C.F1代小鼠的PCR鉴定。M.DNA marker,N.野生型小鼠的组织样品,P.质粒pBud-EGX A-BGL 4-XYN B,扩增引物为EGX A-F和EGX A-RA.Photos were taken at 4-6 hours after microinjection.Scale bars=250 μm;B.Identification of F0 generation transgenic mice by PCR.In the left panel,7 to 1 represent the samples from littermates of TGM07,TGM06,TGM05,TGM04,TGM03,TGM02 and TGM01,respectively.In the right panel,1 to 5 represent the samples from littermates of TGF01,TGF02,TGF03,TGF04 and TGF05;C.Identification of F1 generation transgenic mice by PCR.Genomic DNA was isolated from the tails of F0,F1 generation and wild type mice,used as the templates in PCR screening.Primers are EGXA-F and EGXA-R.M,N and P represent DNA marker,negative control and positive control respectively图3 显微注射后的小鼠受精卵(A)以及转基因小鼠的PCR鉴定(B、C)Fig.3 Expression of pBud-EGX A-BGL 4-XYN B in mouse embryos (A) and PCR identification of transgenic mouse (B,C)
2.33种纤维素酶在转基因小鼠中的表达
取TGM05号转基因小鼠与其全同胞CT03非转基因小鼠处死,解剖,取心、肝、脾、肺、肾、大脑、骨骼肌、胃、大肠、小肠和卵巢共11个组织的样品,提取活性蛋白进行纤维素酶活性检测(图4)。并取消化道组织:舌头、食道、胃、十二指肠、空肠和大肠等样品进行免疫组织化学检测(图5)。
在解剖过程中,未发现转纤维素酶转基因小鼠与野生型小鼠的组织器官有显著差异。通过对小鼠不同组织中EGXA、BGL4和XYNB 3种酶活力的检测发现,尽管使用的并不是消化道特异性启动子,但3种外源纤维素酶的活性都是在大肠、小肠等组织中最高。另外,除少数组织中无法检测出相关酶活性外(图4C),转基因小鼠组织中3种酶的活性均显著高于野生型小鼠。特别是在大肠与小肠中,转基因小鼠的EGXA和XYNB酶活性远远高于野生型小鼠(图4A,B)。不同于EGXA和XYNB酶,BGL4酶活性在转基因小鼠的肾、脑以及卵巢组织中远高于野生型小鼠。
取转基因小鼠的胃、大肠和小肠样品进行Western blot检测3种外源纤维素酶在转基因小鼠的胃肠道中的表达。检测发现(图4D),在3个组织中,胃组织中未发现3种外源蛋白,而大肠、小肠组织样中则有明显的3种外源蛋白的条带。另外,在3种外源蛋白中,BGL4蛋白在大肠、小肠组织中的表达量明显低于EGXA和XYNB,与酶活性检测结果一致。酶活性试验和Western blot检测结果表明,尽管没有使用消化道特异性启动子,3种外源纤维素酶仍然在转基因小鼠的大肠、小肠组织中高效表达,尤其是EGXA和XYNB酶,两者在大肠和小肠中的活性显著高于野生型小鼠。

1.心;2.肝;3.脾;4.肺;5.肾;6.脑;7.肌肉;8.胃;9.大肠;10.小肠;11.卵巢。所有酶活数据均表示为“平均值±标准误差”,每个组织的检测结果均为同一组织上3个不同部位样品检测结果的平均值。*.P<0.05。St.胃组织样品;Li.大肠组织样品;Si.小肠组织样品。TG.转基因个体;WT.野生型个体1.Heat;2.Liver;3.Spleen;4.Lung;5.Kidney;6.Brain;7.Muscle;8.Stomach;9.Large intestine;10.Small intestine;11.Ovary.Data are expressed as “means±SE”,each column represents 3 different samples from the same tissue.*.P<0.05.St,Li and Si.Stomach,large intestine and small intestine.TG.Transgenic mice;WT.Wild-type mice图4 转3基因小鼠各组织中EGXA(A),BGL4(B)以及XYNB(C)3种酶的酶活水平以及蛋白表达情况(D)Fig.4 Fibrolytic enzyme activities in transgenic mouse and non-transgenic full sib tissues (A,B,C ) and detection of 2A-taged proteins in transgenic mice tissues (D)

转基因小鼠的舌、十二指肠和大肠组织中,外源蛋白的表达量显著高于野生型小鼠。TG.转基因个体;WT.野生型个体The exogenous proteins were highly expressed in tongue,duodenum and large intestine tissues.Signals were detected using an HRP-DAB system.TG.Transgenic mice;WT.Wild-type mice图5 转3基因小鼠与非转基因小鼠消化道组织的免疫组织化学分析(标尺为250 μm)Fig.5 Immunohistochemical analysis of tissues from digestive tracts of transgenic and wild type mice (Scale bar=250 μm)
取转基因小鼠和野生型小鼠的舌、食管、胃、十二指肠、空肠、大肠6个组织的样品,用anti-2A抗体进行免疫组织化学检测(图5)。检测显示,在整个消化道中,外源纤维素酶主要在舌、十二指肠和大肠这3个部位表达,与酶活性检测以及Western blot检测结果一致。
综上表明,在不使用组织特异性启动子的情况下,小鼠的舌、大肠、小肠等部位对外源蛋白的表达效果较好。提示这些组织可能会提供一个相对温和的环境,有利于外源蛋白的积累以及活性的保持。其次,EGXA、BGL4和XYNB 3种纤维素酶中,BGL4蛋白的表达量和活性均较弱,而这3种酶在HEK293A细胞中的表达却是基本一致的,说明BGL4蛋白在小鼠的肠道中可能更容易被降解。这些发现有助于今后更好的设计和制作消化道特异性表达外源消化酶的转基因动物,提高外源蛋白的表达效率。
3 讨 论
纤维素是自然界中含量最为丰富的干物质,大约占植物干物质总量的45%~50%[17]。如果能使单胃动物自身合成分泌纤维素酶,降解和利用饲料中的纤维素,不仅能消除纤维素导致的抗营养作用,还能充分利用纤维素中的能量,提高动物的饲料转化率。本研究成功利用2A肽介导3种降解纤维素和木质素所必需的酶在哺乳动物细胞以及转基因小鼠的体内协同表达,为培育高饲料转化率的动物新品种奠定了理论基础。
2A肽现已被证明能够高效的介导多个基因的共表达,且能使上下游基因以相同的表达水平进行表达[18]。因此,该技术比内部核糖体进入位点、多启动子、融合蛋白等策略更具优势。在本研究中,使用3种来源于不同物种的2A序列,以避免在质粒载体制备过程中可能发生的同源重组。与此同时,本研究结果表明,2A肽可以直接作为鉴定外源蛋白的标签,从而免去了制备特异性抗体的繁琐过程。Western blot检测表明,3种不同来源的2A肽都能高效的进行自我切割,没有形成多蛋白融合体。而酶活检测则证明共表达的3种外源纤维素酶EGXA、BGL4和XYNB都具有正常功能,2A肽的添加并没有影响这3种蛋白的折叠以及蛋白功能,与前人的研究结果一致[19-20],表明2A肽能够有效地介导多顺反子的共表达。
本研究在建立转基因小鼠模型时,没有使用组织特异性启动子如腮腺分泌蛋白(Parotid secret protein,PSP)启动子[11]或其他消化道特异表达的启动子。而是使用了组成性启动子EF-1α,目的是为了观察小鼠的哪些组织部位能更高效表达外源纤维素酶并保持其活性。通过Western blot、酶活试验以及免疫组织化学检测,发现,3种外源纤维素酶在转基因小鼠的舌、大肠、小肠等部位有较高表达,而在食管和胃等组织中却基本没有表达。这可能说明在哺乳动物的消化道中,口腔、大肠和小肠等组织更容易合成、分泌外源纤维素酶蛋白以及保持其活性,因此更适合作为表达外源蛋白的靶点。另外,在转入的3种纤维素酶中,尽管BGL4酶在小鼠肠道中的活性与野生型小鼠相比有显著差异,但其活性与EGXA、XYNB相比较低。这可能是BGL4蛋白与其他两种蛋白相比,稳定性较差导致的。将其替换为稳定性、耐酸碱能力更强的葡糖苷酶可能会获得更好效果。
本研究表明,2A肽能够有效介导3个外源基因在HEK293A细胞以及小鼠中的共表达。并获得3基因共表达转纤维素酶转基因小鼠,为培育具有高饲料转化率的转基因动物奠定基础。
[1]BEDFORD M R.Exogenous enzymes in monogastric nutrition—their current value and future benefits [J].AnimFeedSciTechnol,2000,86(1-2):1-13.
[2]KIM J C,SIMMINS P H,MULLAN B P,et al.The digestible energy value of wheat for pigs,with special reference to the post-weaned animal [J].AnimFeedSciTechnol,2005,122(3-4):257-287.
[3]RAVINDRAN V,SON J H.Feed enzyme technology:present status and future developments [J].RecentPatFoodNutrAgric, 2011,3(2):102-109.
[4]WALSH G A,POWER R F,HEADON D R.Enzymes in the animal-feed industry [J].TrendsBiotechnol,1993,11(10):424-430.
[5]HALL J,ALI S,SURANI M A,et al.Manipulation of the repertoire of digestive enzymes secreted into the gastrointestinal tract of transgenic mice [J].Biotechnology(NY),1993,11(3):376-379.
[6]FONTES C M,ALI S,GILBERT H J,et al.Bacterial xylanase expression in mammalian cells and transgenic mice [J].JBiotechnol,1999,72(1-2):95-101.
[7]TAKASHIMA S,NAKAMURA A,HIDAKA M,et al.Molecular cloning and expression of the novel fungal beta-glucosidase genes from Humicola grisea and Trichoderma reesei [J].JBiochem,1999,125(4):728-736.
[8]GOLOVAN S P,HAYES M A,PHILLIPS J P,et al.Transgenic mice expressing bacterial phytase as a model for phosphorus pollution control [J].NatBiotechnol,2001,19(5):429-433.
[9]GOLOVAN S P,MEIDINGER R G,AJAKAIYE A,et al.Pigs expressing salivary phytase produce low-phosphorus manure [J].NatBiotechnol,2001,19(8):741-745.
[10]YIN H F,FAN B L,YANG B,et al.Cloning of pig parotid secretory protein gene upstream promoter and the establishment of a transgenic mouse model expressing bacterial phytase for agricultural phosphorus pollution control [J].JAnimSci,2006,84(3):513-519.
[11]HUANG M,LI Z,HUANG X,et al.Co-expression of two fibrolytic enzyme genes in CHO cells and transgenic mice [J].TransgenicRes,2013,22(4):779-790.[12]WANG J,DING M,LI Y H,et al.Isolation of a multi-functional endogenous cellulase gene from mollusc,Ampullariacrossean[J].ActaBiochBiophSin,2003,35(10):941-946.
[13]WANG J,DING M,LI Y H,et al.A monovalent anion affected multi-functional cellulase EGX from the mollusca,Ampullariacrossean[J].ProteinExprPurif,2003,31(1):108-114.
[14]ZHANG H,YAO B,WANG Y,et al.Characterization,gene cloning and expression of new xylanase XYNB with high specific activity [J].ChinSciBull,2003,48(8):761-765.
[15]LIU Z,SUN Y,FENG T,et al.Mammalian expression levels of cellulase and xylanase genes optimised by human codon usage are not necessarily higher than those optimised by the extremely biased approach [J].BiotechnolLett,2014,36(11):2169-2176.
[16]LIU Z,FENG T,JI Q,et al.Introduction of silent mutations in a codon-optimized xylanase (xynB) results in enhanced protein expression in HEK293A cells [J].BiotechnolLett,2013,35(12):2105-2111.
[17]LYND L R,WEIMER P J,VAN ZYL W H,et al.Microbial cellulose utilization:fundamentals and biotechnology [J].MicrobiolMolBiolRev,2002,66(3):506-577.
[18]DENG W,YANG D,ZHAO B,et al.Use of the 2A peptide for generation of multi-transgenic pigs through a single round of nuclear transfer [J].PLoSOne,2011,6(5):e19986.
[19]HASEGAWA K,COWAN A B,NAKATSUJI N,et al.Efficient multicistronic expression of a transgene in human embryonic stem cells [J].StemCells,2007,25(7):1707-1712.
[20]TRICHAS G,BEGBIE J,SRINIVAS S.Use of the viral 2A peptide for bicistronic expression in transgenic mice [J].BMCBiol,2008,6:40.
(编辑程金华)
Generation of a Transgenic Mouse Model Co-expressing Three Fibrolytic Enzyme Genes
HE Zu-yong1#,LIU Zhi-guo1,2#,SUN Yan-xia1,CONG Pei-qing1,CHEN Yao-sheng1*
(1.StateKeyLaboratoryofBiocontrol,SchoolofLifeSciences,SunYatSenUniversity,Guangzhou510006,China;2.InstituteofAnimalScience,ChineseAcademyofAgriculturalSciences,Beijing100193,China)
By expressing fibrolytic enzymes targeting cellulose and xylan through transgenic technology,new breeds of monogastric animals with enhanced feed conversion rates could be developed.Here we described the co-expression of cellulase genesEGXA andBGL4,and the xylanase geneXYNB,under the control of EF1α promoter and linked via 2A peptides,in both HEK293A cells and transgenic mice.Recombinant enzyme expression was detected in gastrointestinal tract as determined by both Western blot and immunohistochemistry,and were functionally active in cellulolytic enzyme assays.Notably,all 3 fibrolytic enzymes were highly expressed in the intestine tissue of transgenic mice.In summary,we have demonstrated that the EF1α promoter in conjunction with 2A peptide sequences could successfully mediate the co-expression ofEGXA,BGL4 andXYNB genes in transgenic mice.The study presents a feasible method for generating genetically modified animals with enhanced feed conversion ability.
β-glucosidase;cellulase;co-expression;transgenic mice;xylanase;2A peptide
10.11843/j.issn.0366-6964.2016.06.011
2015-11-19
广东省自然科学基金项目(U1201213);国家转基因动物新品种培育重大专项(2014ZX08006005-005)
何祖勇(1981-),男,福建莆田人,副教授,博士,主要从事动物生物技术研究,E-mail:zuyonghe@foxmail.com,Tel:020-39943536;刘志国(1986-),男,河北唐山人,助理研究员,博士,主要从事胚胎工程与转基因动物研究,E-mail: zhiguoliu2010@126.com,Tel:010-62813339。何祖勇和刘志国为共同第一作者
陈瑶生,教授,主要从事动物遗传育种研究,E-mail:chyaosh@mail.sysu.edu.cn
Q78
A
0366-6964(2016)06-1162-08

