脱氢表雄酮对卵巢低反应患者体外受精-胚胎移植周期的影响
滑 玮, 武 雁, 张翠翠, 陈 琳, 何娅绒, 黄艳红
(第四军医大学西京医院妇产科,西安 710032;*通讯作者,E-mail:huangyh@fmmu.edu.cn)
脱氢表雄酮对卵巢低反应患者体外受精-胚胎移植周期的影响
滑玮, 武雁, 张翠翠, 陈琳, 何娅绒, 黄艳红*
(第四军医大学西京医院妇产科,西安710032;*通讯作者,E-mail:huangyh@fmmu.edu.cn)
摘要:目的初步探讨脱氢表雄酮(DHEA)对卵巢低反应患者的卵巢储备功能和体外受精-胚胎移植(IVF-ET)周期的影响。方法筛选2012-07~2013-07间IVF-ET治疗失败的卵巢低反应患者76例,给予DHEA口服(75 mg/d),治疗3个月后再次接受IVF-ET治疗。分三个不同年龄段(<35岁,35-40岁,>40岁)比较服用DHEA前后卵巢储备功能的变化以及再次IVF-ET的周期参数和妊娠结局。结果与服药前相比,三个不同年龄段患者的基础窦卵泡数有增加趋势,雄激素水平显著升高(P<0.01),卵泡刺激素(FSH)、雌二醇(E2)的水平明显降低(P<0.05)。IVF-ET治疗过程中,促性腺激素(Gn)显著降低(P<0.05),获得了19.73%(15/76)临床妊娠率。结论DHEA能提高卵巢低反应患者的雄激素水平,有效改善卵巢储备功能和再次IVF-ET的妊娠结局。
关键词:脱氢表雄酮;卵巢低反应;卵巢储备功能;体外受精-胚胎移植;妊娠率
不同人群对超排卵反应不一,其中正常反应者占绝大多数,低反应人群占10%[1],随着IVF技术的进步,卵巢低反应(poor ovarian response,POR)人群因其卵子数量少、质量低下、IVF结局差而受到越来越多的关注。研究表明,脱氢表雄酮(dehydroepiandrosterone,DHEA)能改善卵巢储备功能,提高卵巢对促排卵药物反应,提高妊娠率[2-10],但是目前尚无足够有力的证据支持DHEA对卵巢低反应患者IVF-ET的治疗作用,故DHEA在该领域的应用仍存在争议[11,12]。本研究选择IVF-ET失败的卵巢低反应患者,对其进行DHEA治疗,通过比较用药前后卵巢储备功能和IVF-ET周期参数,初步评估DHEA对卵巢低反应患者治疗效果。
1资料与方法
1.1研究对象
选择2012-07~2013-07间在第四军医大学西京医院生殖医学中心行IVF-ET治疗失败的卵巢低反应患者,参照博洛尼亚标准[13]进行筛选。2010年ESHRE修订了POR的诊断标准[13],以下3条中至少2条符合即可诊断POR:①高龄(≥40岁)或者有其他已知的遗传性或获得性导致卵泡减少的风险因素;②既往有因为少于3个卵泡发育导致周期取消的病史,或每天至少使用FSH 150 IU但获卵数仍少于4个的病史(不包括微刺激);③卵巢储备功能检测异常:包括AFC(窦卵泡)<5-7个或抗苗勒激素(AMH)<0.5-1.1 ng/ml;如果年龄或者卵巢储备功能检测正常,患者连续2个周期应用最大化的卵巢刺激方案仍出现POR也可以诊断。
根据患者意愿,筛选愿意服用DHEA(美国Schiff公司)的患者入组。
排除标准:所有患者均需排除子宫内膜异位症、生殖器官畸形、高泌乳素血症和多囊卵巢综合征(PCOS)及其他内分泌疾病,近3个月内未使用内分泌药物或其他药物治疗。本研究经本院伦理委员会批准,所有入组患者均签订了知情同意书。
1.2研究方法
1.2.1基础指标测定及用药方法于月经第3天检测肝肾功能、FSH、LH、E2、T,经阴道超声检测AFC数。嘱患者口服DHEA,25 mg,3次/d,共服3个月。服药期间观察记录治疗效果(卵巢储备功能评价指标)和不良反应,服药结束后再次接受IVF-ET治疗。
1.2.2IVF-ET的过程IVF促排前一周期黄体期起口服雌激素至早卵泡期,根据患者的年龄、基础内分泌水平、AFC数等特征,选择促排卵方案(拮抗剂方案)。阴道B超定期监测卵泡的生长,并根据卵泡生长情况调整促性腺激素的使用剂量。当双侧卵巢内至少有2个以上直径大于18 mm的卵泡时,使用人绒毛膜促性腺激素(HCG) 8 000-10 000 IU,注射HCG 34-36 h 取卵。采用IVF或卵母细胞质内单精子注射技术(ICSI)授精。取卵3 d,根据子宫内膜厚度(>7 mm)、P值(<1.5 ng/ml)、获得胚胎数是否符合国家规定数目,确定是否进行新鲜胚胎移植。新鲜胚胎移植后给予黄体酮(浙江仙琚制药)支持黄体。如不符合新鲜胚胎移植条件,即进行胚胎冷冻,3月后进行冷冻胚胎移植,方案采用人工周期进行内膜准备,当内膜达到8 mm以上,黄体酮转化内膜,4 d后解冻胚胎进行胚胎移植,移植后14 d检测血β-HCG诊断妊娠,35 d行超声检测,见到孕囊诊断为临床妊娠。卵裂期胚胎评级综合卵裂速度、卵裂球均等程度及碎片比例,授精后66-68 h,胚胎卵裂球在7-10之间,且大小较均匀、碎片<25%的胚胎认为是优质胚胎[14]。
1.2.3监测指标及结果判定检测FSH、E2、T等性激素水平,记录促排卵时间、总促性腺激素使用剂量、获卵数、优质胚胎数、临床妊娠率(CPR)。根据不同年龄段将患者资料分为三组:<35岁组、35-40岁组、≥40岁组,比较三组患者用药前后卵巢储备功能及IVF周期参数。
1.2.4药物不良反应复查肝肾功能,根据患者主诉,判断并记录有无恶心、呕吐、皮疹、痤疮、性欲改变、性格改变以及其他不良反应。
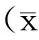
2结果
入组患者共76例,其中包括前次周期未获卵18例,前次取消周期10例。
2.1 一般资料
将患者根据年龄段分为三组,三组患者的一般资料差异无统计学意义,具有可比性。<35岁组患者共15例,平均不孕(4.60±3.40)年;35-40岁组患者共33例,平均不孕(5.70±4.20)年;>40岁组患者共28例,平均不孕(5.20±4.60)年。
2.2服药前后卵巢储备功能比较
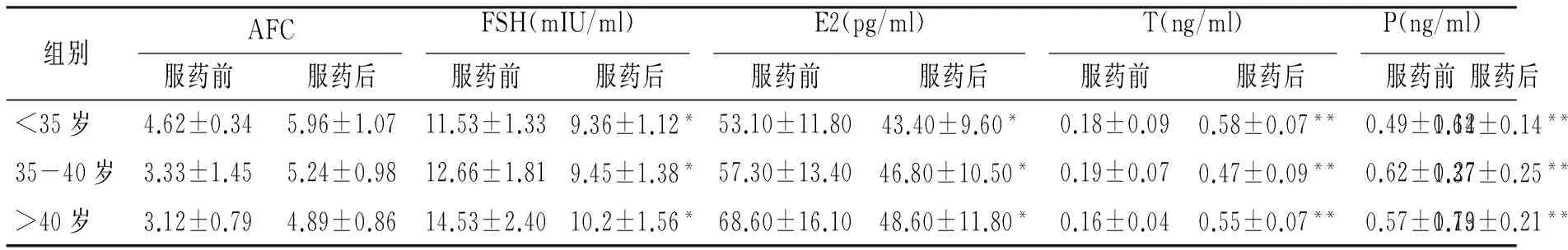
三组患者服药后AFC有增加趋势,FSH及E2显著下降;睾酮、孕酮水平均有显著性增加(见表1)。
2.3服药前后IVF-ET周期参数比较
本研究中>40岁组的28例患者中,有7例患者获卵<3枚,得到可利用胚胎1-2枚。根据我国辅助生殖技术规范,35岁以下患者可移植胚胎2个或小于2个,35岁及35岁以上患者可移植胚胎3个,本研究依照国家规定选择可移植的最多胚胎数。这些患者胚胎数小于规定的数目,其中3例于3月后解冻2次IVF的冻胚,另4例进行的第3次IVF,方案同前次,凑够冷冻胚胎数目后行冻胚移植。基于以上原因,妊娠率指标选择了累计妊娠率,如行新鲜移植者直接录入数据,如行冻胚移植者按累计妊娠率计算。
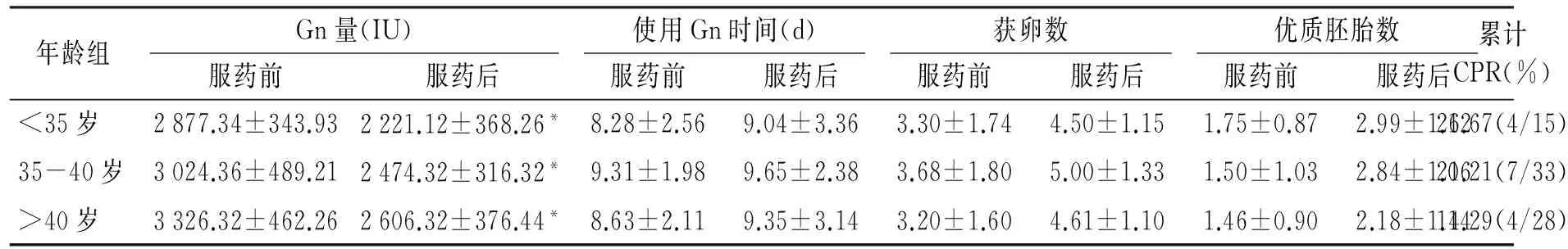
前次周期未获卵18例及取消周期10例均有获卵,累计妊娠5例。三组患者服药后IVF-ET周期Gn量较前减少,差异具有统计学意义(P<0.05);获卵数、优质胚胎数有增加趋势,但差异无统计学意义;三组均获得临床妊娠患者,累计妊娠率分别为26.67%,21.21%,14.29%,40岁以上组显著低于其余两组,总妊娠率19.73%(15/76)(见表2)。
表1治疗前后卵巢储备功能比较
Table 1Comparison of ovarian reserve before and after treatment
组别AFCFSH(mIU/ml)E2(pg/ml)T(ng/ml)P(ng/ml)服药前服药后服药前服药后服药前服药后服药前服药后服药前服药后<35岁4.62±0.345.96±1.0711.53±1.339.36±1.12*53.10±11.8043.40±9.60*0.18±0.090.58±0.07**0.49±0.121.64±0.14**35-40岁3.33±1.455.24±0.9812.66±1.819.45±1.38*57.30±13.4046.80±10.50*0.19±0.070.47±0.09**0.62±0.271.37±0.25**>40岁3.12±0.794.89±0.8614.53±2.4010.2±1.56*68.60±16.1048.60±11.80*0.16±0.040.55±0.07**0.57±0.191.73±0.21**
与服药前相比,*P<0.05,**P<0.01
表2IVF妊娠结局与前一周期比较
Table 2Comparison of pregnancy outcome between the final and previous cycle
年龄组Gn量(IU)使用Gn时间(d)获卵数优质胚胎数服药前服药后服药前服药后服药前服药后服药前服药后累计CPR(%)<35岁2877.34±343.932221.12±368.26*8.28±2.569.04±3.363.30±1.744.50±1.151.75±0.872.99±1.1226.67(4/15)35-40岁3024.36±489.212474.32±316.32*9.31±1.989.65±2.383.68±1.805.00±1.331.50±1.032.84±1.0621.21(7/33)>40岁3326.32±462.262606.32±376.44*8.63±2.119.35±3.143.20±1.604.61±1.101.46±0.902.18±1.1414.29(4/28)
与服药前相比,*P<0.05
3讨论
随着生存压力的增大,当今社会晚婚日益普遍,女性的生育年龄延迟,卵巢储备功能下降的患者日益增多[2],使得行IVF-ET的患者出现卵巢低反应的比例显著增加。而卵巢低反应会致使获得优质卵子的数量减少,周期取消率升高,导致妊娠率下降,据报道,在所有IVF-ET周期中,约有5%-18%的周期因卵巢低反应而取消,妊娠率仅为2%-4%[15],故POR已成为辅助生殖领域的难题之一。造成POR的可能原因有:年龄因素、卵巢或盆腔手术、有超排卵失败的经历、Gn受体缺陷、遗传因素等。治疗策略应该是对POR患者通过标准的和改良的COS方案以及各种调节内分泌的方法以增加卵泡的募集,改善细胞质的完整性,从而改善这些患者的预后。目前,虽然有大量不同的方案正应用于卵巢低反应的患者,以改善治疗结局,遗憾的是所有这些方案的成功率均非常有限,其中包括雄激素及其调节剂的治疗。
DHEA是人体血循环中含量最为丰富的甾体物质, 主要在肾上腺网状带合成,具有弱雄激素作用,在外周组织主要转化成睾酮(T)和雌二醇(E2)。循环中DHEA水平随年龄增长明显下降。1931年,德国生化学家Butenandt 首次分离提纯得到了脱氢表雄酮(dehydroepiandrosterone,DHEA)[16],并因此获得了1939 年的性激素领域的诺贝尔化学奖。之后, 伴随着 DHEA 对男性、女性抗衰老作用的共识[17],激发了更多学者在更深和更广泛领域研究DHEA,特别是其在生殖领域的作用。2000年,DHEA可改善卵巢反应低下患者临床结局的研究首次在辅助生殖领域中报道[18]。随后,越来越多的研究证实了DHEA在改善POR患者妊娠结局方面的作用,但由于此类患者年龄较大,妊娠要求迫切,实施随机对照试验的可行性差,国内外很多计划进行的随机对照试验均因患者不愿入对照组而无法进行。本研究选择前次IVF-ET失败的POR患者作为研究对象,观察DHEA治疗后患者卵巢储备的改善情况,以及行再次IVF-ET周期的妊娠情况,患者自身治疗前后对比,虽然不具有随机对照试验的优越性,但仍具有重要的临床意义,对于此类患者治疗策略的制定有着重要的指导意义。另外,本研究将患者群按年龄分为三组,观察不同年龄对药物的反应,在同类研究中鲜见报道,研究结果有利于临床上对不同患者制定个体化的治疗方案。
本研究发现,服用DHEA后所有患者的卵巢储备指标均较服药前明显改善,与既往研究报道一致[2]。第一,循环中雄激素和孕激素水平在各年龄组显著增加,孕激素水平较用药前升高,根据经典的两细胞-两促性腺激素学说,可能与循环中雄激素水平升高、前体物质堆积有关。第二,窦卵泡数较用药前略有增加,可以看到有增加的趋势,但差异尚未达到统计学意义,现有关报道结果不完全一致,分析本研究结果可能与治疗周期长度、样本量等有关,详细的治疗机制尚需进一步的、深入的研究阐明。第三,虽然窦卵泡数没有显著增加,但其他衡量卵巢储备功能的指标均有改善,如基础FSH、基础E2均有下降,总体来说,DHEA治疗使得已经发生功能减退的卵巢产生了有益的治疗作用。
关于DHEA改善POR患者妊娠结局的作用机制可能与以下原因有关:①DHEA是类固醇激素合成必需的底物[19]。在外源性促性腺激素促排卵周期中,DHEA是卵泡液中高达48%睾酮(T)的前体,而T是E2的前体物质。如果DHEA异常低下,雄烯二酮(A)、T和E2合成底物缺乏,可以导致这些激素含量低下。而这些激素在卵泡生长、成熟、排卵过程中必不可少,有着重要的作用。②雄激素影响卵泡生长,不仅因为其是甾体激素代谢合成的前体物质,还可作为雄激素受体(AR)的配体或通过其他非经典机制发挥作用[20],雄激素和FSH一起刺激卵泡分化生长。雄激素可诱导颗粒细胞FSH受体生成,认为卵巢储备功能低下患者促排卵周期联合使用芳香化酶抑制剂后临床结局改善,可能是雄激素诱导颗粒细胞上FSH受体生成的结果。雄激素促进甾体激素合成,促使卵泡募集,增加募集卵泡数目。卵泡内雄激素含量增加,促进颗粒细胞分泌抗苗勒氏管激素(anti-mullerian hormone,AMH)和抑制素B[21]。③DHEA可降低胚胎非整倍体率。④改善卵巢微环境。有研究推测[4,8],DHEA可改善卵巢功能低下患者的卵巢微环境,使其功能更年轻化,DHEA可能影响卵泡生成过程中的较早阶段。
本研究选取了前次IVF-ET失败患者作为研究对象,其中包括未获卵18例,取消周期10例。卵巢低反应患者由于卵巢功能减退,往往会出现早卵泡期FSH升高及窦卵泡不同步等现象,严重影响IVF结局,故临床上可能出现因此而取消周期的现象。本研究经过DHEA治疗后,卵巢储备功能指标显著改善,同时选用黄体期补充雌激素同步化卵泡的方法,所有患者符合标准进入促排周期,在一定程度上初步体现出了DHEA的显著疗效。在促排方案选择上,卵巢低反应患者多采用拮抗剂方案、微刺激方案、自然周期、黄体期促排等方案,一般需要根据早卵泡期性激素水平、窦卵泡数量和大小和既往促排卵治疗史选择个体化的方案,为了使治疗方法统一化,本研究对所有患者均选择拮抗剂方案。
本研究还发现,在服用DHEA后,再次IVF-ET周期的Gn量较前明显减少,虽然平均获卵数较前无明显增加,但无一例患者未获卵,且优质胚胎数增加,说明卵巢反应性好转,卵母细胞质量可能较前有所改善。本研究最终仅获得了19.73%的累计妊娠率,虽不能与卵巢正常反应患者相比,但对于此类患者来说也是非常大的收获。随着年龄段的增长,妊娠率逐渐下降,这一结果符合辅助生殖技术的整体规律。此外,在整个研究过程中,除部分患者诉精力充沛、性欲增强之外,无其他不良反应,说明75 mg/d的DHEA剂量较为安全。
综上所述,DHEA可能通过增加卵巢储备、改善卵母细胞质量等方面的作用,提高POR患者的妊娠结局,40岁以上患者的治疗效果较年轻患者稍差,虽然获得的妊娠结局仍不甚满意,但对于POR患者来说,口服DHEA仍不失为一个可以尝试的治疗选择。
参考文献:
[1]Zhen XM,Qiao J,Li R,etal.The clinical analysis of poor ovarian response in in-vitro-fertilization embryo-transfer among Chineses couples[J].J Assist Reprod Genet,2008,25(1):17-22.
[2]Gleicher N,Barad DH.Dehydroepiandrosterone(DHEA) supplementation in diminished ovarian reserve(DOR)[J].Reprod Biol Endocrinol,2011,9:67-79.
[3]Weghofer A,Kim A,Barad DH,etal.The impact of androgen metabolism and FMR1 genotypes on pregnancy potential in women with dehydroepiandrosterone (DHEA)supplementation[J].Hum Reprod,2012,27(11):3287-3293.
[4]Barad D,Brill H,Gleicher N.Update on the use of dehydroepiandrosterone supplementation among women with diminished ovarian function[J].J Assist Reprod Genet,2007,24(12):629-634.
[5]Gleicher N,Kim A,Weghofer A,etal.Starting and resulting testosterone levels after androgen supplementation determine at all agesinvitrofertilization(IVF)pregnancy rates in women with diminished ovarian reserve(DOR)[J].J Assist Reprod Genet,2013,30:49-62.
[6]Gleicher N,Weghofer A,Barad DH.Improvement in diminished ovarian reserve after dehydroepiandrosterone supplementation[J].Reprod Biomed Online,2010,21(3):360-365.
[7]Gleicher N,Weghofer A,Barad DH.Dehydroepiandrosterone(DHEA) reduces embryo aneuploidy:direct evidence from preimplantation genetic screening(PGS)[J].Reprod Biol Endocrinol,2010,8:140-145.[8]Gleicher N,Ryan E,Weghofer A,etal.Miscarriage rates after dehydroepiandrosterone(DHEA) supplementation in women with diminished ovarian reserve:a case control study[J].Reprod Biol Endocrinol,2009,7:108-115.
[9]Zhang J,Qiu X,Gui Y,etal.Wang L.Dehydroepiandrosterone improves the ovarian reserve of women with diminished ovarian reserve and is a potential regulator of the immune response in the ovaries[J].Biosci Trends,2016,9(6):350-359.
[10]Li J,Yuan H,Chen Y,etal.A meta-analysis of dehydroepiandrosterone supplementation among women with diminished ovarian reserve undergoing in vitro fertilization or intracytoplasmic sperm injection[J].Int J Gynaecol Obstet,2015,131(3):240-245.[11]Wiser A,Gonen O,Ghetler Y,etal.Addition of dehydroepiandrosterone(DHEA)for poor-responder patients before and during IVF treatment improves the pregnancy rate:a randomized prospective study[J].Hum Reprod,2010,25(10):2496-2500.
[12]Bosdou JK,Venetis CA,Kolibianakis EM,etal.The use of androgens or androgen-modulating agents in poor responders undergoinginvitrofertilization:a systematic review and meta-analysis[J].Hum Reprod Update,2012,18(2):127-145.
[13]Ferraretti AP,La Marca A,Fauser BC,etal.ESHRE consensus on the definition of poor response to ovarian stimulation forinvitrofertilization:the Bologna criteria[J].Hum Reprod,2011,26(7):1616-1624.
[14]杨慧军,李媛,吴克良,等.授精后5h补救性卵胞浆内单精子显微注射的临床应用价值[J].山东大学学报(医学版),2011,49(10):139-142.
[15]Frattarelli JL,Hill MJ,McWilliams GD,etal.A luteal estradiol protocol for expected poor-responders improves embryo number and quality[J].Fertil Steril,2008,89:1118-1122.
[16]Butenandt A.Über die chemische untersuchung der sexual hormone[J].Zeitschrift für Angewandte Chemie,1931,44(46):905-908.
[17]Baulieu E.Dehydroepiandrosterone(DHEA):a fountain of youth[J].J Clin Endocrinol Metab,1996,81(9):3147-3151.
[18]Casson PR,Lindsay MS,Pisarka MD,etal.Dehydroepiandrosterone supplementation augments ovarian stimulation in poor responders:a case series[J].HumReprod,2000,15(10):2129-2132.
[19]McNatty KP,Makris A,Reinhold VN,etal.Metabolism of androstenedione by human ovarian tissues in vitro with particular reference to reductase and aromatase activity[J].Steroids,1979,34(4):429-443.
[20]Moon YS,Armstrong DT.Estradiol 17[beta] biosynthesis in cultured granulosa cells from hypophysectomized immature rats stimulation by follicle stimulating hormone[J].Endocrinology,1975,97(5):1328-1331.
[21]Andersen CY,Lossi K.Increased intrafollicular androgen levels affect human granulose secretion of anti-Müllerian hormone and inhibin-B[J].Fertil Steril,2008,89(6):1760-1765.
Effect of dehydroepiandrosterone supplementation oninvitrofertilization outcome in women with poor ovarian response
HUA Wei, WU Yan,ZHANG Cuicui, CHEN Lin, HE Yarong, HUANG Yanhong*
(DepartmentofObstetricsandGynecology,XijingHospitalofFourthMilitaryMedicalUniversity,Xi’an710032,China;*Correspondingauthor,E-mail:huangyh@fmmu.edu.cn)
Abstract:ObjectiveTo evaluate the effect of dehydroepiandrosterone(DHEA) supplementation on ovarian reserve and in vitro fertilization and embryo transfer(IVF-ET) outcomes in women with poor ovarian response.MethodsSeventy-six women with poor ovarian response(at least one IVF cycle failure) from July 2012 to July 2013 received 75 mg DHEA daily for three months.Patients were divided into three groups according to the age. Antral follicle count(AFC),follicle stimulating hormone(FSH),estradiol(E2),testosterone(T),progesterone(P)and IVF outcome parameters were compared before and after the DHEA treatment.ResultsIn all three groups, AFC mildly increased, the serum levels of T increased significantly(P<0.01),while FSH and E2 levels decreased significantly after DHEA supplementation(P<0.05). IVF cycle outcomes demonstrated significant decrease of Gn amount after the DHEA treatment(P<0.05).Finally,fifteen women conceived with a clinical pregnancy rate of 19.73%.ConclusionDHEA supplementation could significantly increase the androgen level in women with poor ovarian response,which could improve ovarian reserve and the pregnancy rate.
Key words:dehydroepiandrosterone; poor ovarian response;ovarian reserve function;in vitro fertilization and embryo transfer;pregnancy rate
基金项目:陕西省社会发展科技攻关基金资助项目(2015SF122)
作者简介:滑玮,女,1978-11生,博士,主治医师, E-mail:huawei@fmmu.edu.cn
收稿日期:2016-01-18
中图分类号:R711.6
文献标志码:A
文章编号:1007-6611(2016)05-0470-05
DOI:10.13753/j.issn.1007-6611.2016.05.017

