γ干扰素诱导蛋白-10在强直性脊柱炎患者血清中的表达及其临床意义
杨 彪, 王 瑶, 赵晓光, 王 磊
(1西安医学院第一附属医院骨科,西安 710077; 2西安医学院第一附属医院检验科;*通讯作者,E-mail:95244556@qq.com)
γ干扰素诱导蛋白-10在强直性脊柱炎患者血清中的表达及其临床意义
杨彪1, 王瑶2*, 赵晓光1, 王磊1
(1西安医学院第一附属医院骨科,西安710077;2西安医学院第一附属医院检验科;*通讯作者,E-mail:95244556@qq.com)
摘要:目的 检测强直性脊柱炎(AS)患者血清中γ干扰素诱导蛋白-10(IP-10)的表达水平,分析IP-10与疾病的关系,评价其在AS疾病活动中的临床意义。方法选取AS活动期患者34例、AS稳定期患者24例及体检健康者46例作为研究对象,采用ELISA法检测血清中IP-10、IL-17、IL-23和TNF-α水平,分析血清IP-10水平与AS各临床和实验室指标的相关性。结果AS活动期组及稳定期组患者血清IP-10含量水平均显著高于健康对照组(P<0.05);IP-10在AS活动期组含量水平高于稳定期组(P<0.05);两组AS患者血清IL-17、IL-23及TNF-α含量水平均高于健康对照组(P<0.05);IL-17和TNF-α在AS活动期组含量水平高于稳定期组(P<0.05)。相关性分析表明,AS患者中IP-10与IL-17、IL-23、TNF-α、PLT、ESR、CRP和BASDAI评分呈正相关。结论血清中IP-10水平可能是AS发病过程中重要的免疫学标志,检测IP-10有助于对AS的诊断和病情的评估。
关键词:γ干扰素诱导蛋白-10;强直性脊柱炎;细胞因子
强直性脊柱炎(ankylosing spondylitis,AS)是一种与遗传相关的自身免疫性疾病[1],主要侵犯骶髂关节、脊柱骨突、脊柱旁软组织及外周关节,致残率高。AS通常在青壮年发病,目前病因尚未完全阐明,多数研究显示其发病可能与遗传、感染及免疫环境等因素有关[2]。
γ干扰素诱导蛋白-10(interferon-γ-inducible protein 10,IP-10)是近年来发现的一种在诱导白细胞迁移至炎症部位的过程中扮演重要角色的趋化因子。已有研究证实IP-10通过促进CD4+T细胞和F4/80+巨噬细胞的迁移及上调滑膜CD4+T细胞核因子-κB受体活化因子配体表达等多种方式引发骨质破坏,是风湿及类风湿性关节炎、银屑病性关节炎、幼儿特发性关节炎等骨关节炎症性疾病的重要发病因素[3-5]。本文以AS患者为研究对象,以健康人作为对照,检测血清中IP-10含量,结合IL-17、IL-23和TNF-α的分泌水平,探讨IP-10与IL-17、IL-23和TNF-α分泌模式在AS患者致病过程中发生的变化,为进一步了解IP-10的致病机制提供资料。
1材料与方法
1.1研究对象
研究对象为2014-03~2015-12在我院门诊或收治住院中符合2010年中华医学会风湿病分会制定的《强直性脊柱炎诊断及治疗指南》[6]中疾病诊断标准的患者58例,按照强制性脊柱炎疾病活动指数(bath ankylosing spondylitis disease activity index,BASDAI)计分方法进行评分,将其分为两组:活动期组34例(定义为BASDAI≥4分),稳定期组24例(定义为BASDAI<4分)。46例本院体检健康者入选标准:肝肾功能、血脂、血常规、尿常规、影像学检查均正常,与AS组的性别、年龄相匹配。所有参与研究的AS患者及健康对照组均排除:①处于急性或慢性感染期;②患有严重心、肝、肾及血液系统疾病;③合并其他诊断明确的自身免疫性疾病,如系统性红斑狼疮、多发性硬化、严重性肠病、银屑病、葡萄膜炎等;④患有糖尿病、甲状腺等内分泌系统疾病;⑤肿瘤患者。
1.2研究方法
所有研究对象均在临床干预治疗前清晨空腹采集静脉血,送我院检验科,常规检查血分析、血沉、C反应蛋白、类风湿因子、HLA-B27等相关项目,同时另采集静脉血3 ml,3 500 r/min离心10 min,取血清于-80 ℃冷冻保存待测。采用双抗体夹心ELISA法,按照试剂盒说明书的操作要求检测外周血清中IP-10、IL-17、IL-23和TNF-α水平。
对所有研究对象进行详细的审查、登记,填写统一编制的表格,内容包括一般情况(如:姓名、性别、年龄、身高、体重、BMI等)及检测各项指标及结果,数据编入计算机进行统计分析。实验所用人IP-10 ELISA监测试剂盒购自美国Biosource公司,IL-17及IL-23 ELISA监测试剂盒购自美国B&D公司,TNF-α ELISA监测试剂盒购自上海北诺公司。
1.3统计学处理

2结果
2.1一般资料比较
AS活动期组、AS稳定期组及健康对照组在性别、年龄、BMI和类风湿因子上的差异无统计学意义,在白细胞计数(WBC)、血小板计数(PLT)、血沉(ESR)、C反应蛋白(CRP)、HLA-B27阳性率和BASDAI评分上差异有统计学意义,且AS活动期组的PLT、CRP和BASDAI评分均显著高于AS稳定期组(P<0.05,见表1)。
表1AS患者与健康对照一般资料比较
Table 1Comparison of general datum between AS patients and healthy controls
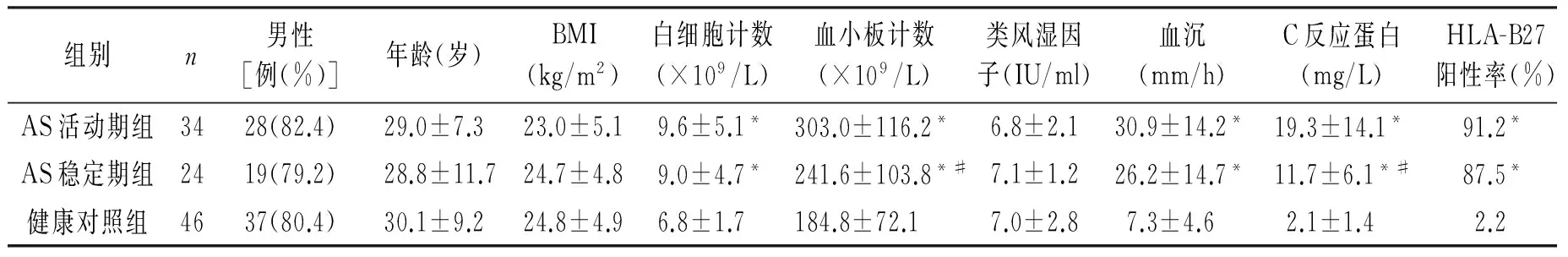
组别n男性[例(%)]年龄(岁)BMI(kg/m2)白细胞计数(×109/L)血小板计数(×109/L)类风湿因子(IU/ml)血沉(mm/h)C反应蛋白(mg/L)HLA-B27阳性率(%)BASDAI评分(分)AS活动期组3428(82.4)29.0±7.323.0±5.19.6±5.1*303.0±116.2*6.8±2.130.9±14.2*19.3±14.1*91.2*6.1±1.1*AS稳定期组2419(79.2)28.8±11.724.7±4.89.0±4.7*241.6±103.8*#7.1±1.226.2±14.7*11.7±6.1*#87.5*2.4±0.7*#健康对照组4637(80.4)30.1±9.224.8±4.96.8±1.7184.8±72.17.0±2.87.3±4.62.1±1.42.20.6±0.8
与健康对照组比较,*P<0.05;与AS活动组比较,#P<0.05
2.2血清IP-10、IL-17、IL-23和TNF-α含量检测结果比较
AS活动期组及稳定期组患者血清IP-10含量水平均显著高于健康对照组(F分别为88.68,12.81,均P<0.05);IP-10在AS活动期组含量水平高于稳定期组(F=26.80,P<0.05)。两组AS患者血清IL-17、IL-23及TNF-α含量水平均高于健康对照组,差异有统计学意义(F分别为99.49,59.19,15.96,均P<0.05);IL-17和TNF-α在AS活动期组含量水平高于稳定期组(F分别为12.14,5.24,均P<0.05,见表2)。
2.3AS患者IP-10与IL-17、IL-23、TNF-α、WBC、PLT、ESR、CRP和BASDAI评分间相关性分析
经Pearson相关性分析,AS患者中IP-10与IL-17、IL-23、TNF-α、PLT、ESR、CRP和BASDAI评分呈正相关,与WBC无相关性(见表3)。
表2三组血清IP-10、IL-17、IL-23和TNF-α水平比较(pg/ml)
Table 2Serum IP-10,IL-17,IL-23 and TNF-α levels in three groups(pg/ml)

组别nIP-10IL-17IL-23TNF-αAS活动期组34256.32±119.53*39.50±12.60*46.44±17.14*17.14±7.58*AS稳定期组24120.71±58.70*#28.92±9.39*#39.16±13.72*13.08±5.06*#健康对照组4669.78±54.589.37±6.9415.85±8.528.93±6.17
与健康对照组比较,*P<0.05;与AS活动组比较,#P<0.05
表3AS患者IP-10与IL-17、IL-23、TNF-α、WBC、PLT、ESR、CRP和BASDAI评分间相关性分析
Table 3Correlation analysis between IP-10 and IL-17,IL-23,TNF-α,WBC,PLT,ESR,CRP,BASDAI score
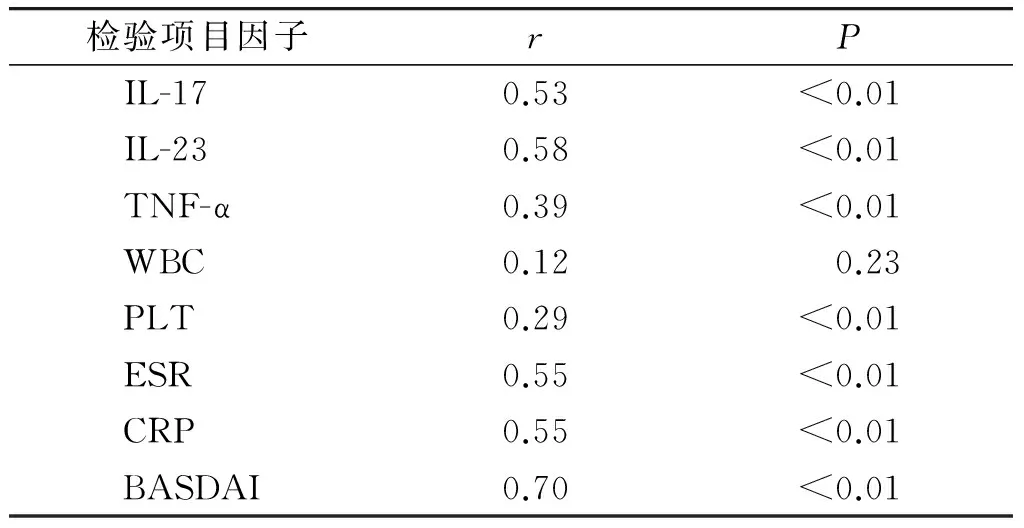
检验项目因子rPIL-170.53<0.01IL-230.58<0.01TNF-α0.39<0.01WBC0.120.23PLT0.29<0.01ESR0.55<0.01CRP0.55<0.01BASDAI0.70<0.01
3讨论
AS是一种多因素共同参与的慢性炎症性疾病,发病年龄轻,致残率高,严重影响病人的生活质量。虽然近年来对AS的诊断与治疗均已取得了长足的进步,但目前仍然无法完全阐明该病发生的确切病因,无法找到根治性的治疗方法。
γ干扰素诱导蛋白-10(IP-10)是近年来发现的半胱氨酸-X-半胱氨酸(CXC)类谷氨酸-亮氨酸-精氨酸(Glu-Leu-Arg,ELR)亚族趋化因子,又名CXC趋化因子配体10(CXCL10)。是由γ干扰素所诱导产生的一类可以趋化淋巴细胞的蛋白质,主要表达在活化的T淋巴细胞上,特别是Th1型T淋巴细胞,IP-10与之结合后能够诱导Th1细胞活化并定向迁移至特定的组织中从而调节免疫反应。此外IP-10还具有介导细胞凋亡、调节靶细胞生长和增殖、调节血管生成等功能。近年来,已有研究证实IP-10参与多种器官特异性自身免疫性疾病(如1型糖尿病、自身免疫性甲状腺炎、Graves病等)和系统性自身免疫性疾病(如类风湿性关节炎、系统性红斑狼疮、多发性硬化等)的发病过程[7],同时也是风湿、类风湿性关节炎、银屑病性关节炎、幼儿特发性关节炎等骨关节炎症性疾病的重要发病因素[3-5]。
通过本研究发现,AS患者血清中的IP-10含量明显高于健康对照组(P<0.05),说明AS患者存在IP-10表达的增加。同时,AS活动期患者血清IP-10水平高于稳定期组,提示IP-10水平与AS病程分期密切相关。进一步分析显示,AS患者外周血中IL-17、IL-23的水平明显高于健康对照组(P<0.05),并且IL-17与IL-23的表达呈正相关,这与近年来内外相关研究的结果相一致[8-13]。而TNF-α通过激活多形核细胞,刺激前列腺素产生,抑制碱性磷酸酶和胶原的合成及促进软骨细胞分泌纤维蛋白溶解酶激活剂,促使纤维蛋白酶的合成等多种机制在AS的致病过程中发挥着重要的作用已经成为学者们公认的事实[14-16]。通过相关性分析,可以看出,AS患者IP-10水平与IL-17、IL-23、TNF-α、PLT、ESR、CRP和BASDAI评分均呈显著正相关,而与WBC无相关性,这些结果再次提示IP-10在AS的发生和进展过程中起到了重要的作用,是AS特异性极强的敏感性指标,检测血清IP-10水平可能有助于对AS疾病活动性的评估。
本研究通过监测AS患者及健康人血清中IP-10含量,结合IL-17、IL-23和TNF-α的分泌水平,探讨IP-10与IL-17、IL-23和TNF-α分泌模式在AS患者致病过程中发生的变化,证实IP-10同IL-17、IL-23及TNF-α均可能为AS发病过程中重要的免疫学标志,并且在AS发病的过程中发挥着重要的作用。
此外,研究IP-10在AS患者体内血清中的表达及临床意义,不仅有助于进一步了解AS的发病机制,还能为AS的临床治疗提供重要实验室依据。已有研究表明,应用CXCR3小分子拮抗剂AMG487能显著降低滑膜细胞的侵袭性,降低滑液中基质金属蛋白酶水平,阻止IP-10-CXCR3介导的滑膜细胞的激活,从而减少肌动蛋白细胞骨架重组及板状伪足的形成[17]。而应用抗IP-10的单克隆抗体治疗对甲氨蝶呤耐药的RA患者有显著的疗效[18]。因此,针对IP-10的靶点治疗有望成为AS治疗的一种新的方向。
由于本研究的样本量相对较少,研究方法仅局限于ELISA法定量检测,干扰因素相对较多,可能存在系统误差等问题,IP-10的临床意义尚需更大的样本、多中心研究进一步验证。但我们有理由相信,IP-10作为一种新型的标志物,在不远的将来一定能够在AS等免疫相关疾病的早期筛查、辅助诊断、监测病情、疗效评价及判断预后上得到广泛的应用。
参考文献:
[1]Ma B,Yang B,Guo H,etal.The association between tumor necrosis factor alpha promoter polymorphisms and ankylosing spondylitis:A meta-analysis[J].Hum Immunol,2013,74:1357-1362.
[2]刘越,赵艳梅,夏群.强直性脊柱炎的诊断与治疗进展[J].中国矫形外科杂志,2015,23(3):235-238.
[3]Devito A.Interferon γ-induced chemokines in psoriatic arthritis[J].Clin Ter,2014,165(6):442-446.
[4]李瑞娟,唐雪梅,刘玮,等.幼年特发性关节炎白介素6、γ干扰素诱导蛋白10和白介素17的表达及意义[J].中华儿科杂志,2013,51(6):472-476.
[5]Nikiphorou E,Davies C,Mugford M,etal.Direct health costs of inflammatory polyarthritis 10 years after disease onset: results from the Norfolk Arthritis Register[J].J Rheumatol,2015,42(5):794-798.
[6]中华医学会风湿病学分会.强直性脊柱炎诊断及治疗指南[J].中华医学会风湿病学杂志,2010,14(8):557-559.
[7]Antonelli A,Ferrari SM,Giuggioli D,etal.Chemokine(C-X-C motif) ligand(CXCL)10 in autoimmune diseases[J].Autoimmun Rev,2014,13(3):272-280.
[8]Gaffen SL,Jain R,Garg AV,etal.The IL-23/IL-17 immune axis:from mechanisms to therapeutic testing[J].Nat Rev Immunol,2014,14(9):585-600.
[9]Kenna TJ,Davidson SI,Duan R,etal.Enrichment of circulating interleukin-17-secreting interleukin-23 receptor-positive gamma/delta T cells in patients with active ankylosing spondylitis[J].Arthritis Rheum,2012,64(5):1420-1429.
[10]徐忠玉,房光萃,陈开杰,等.强直性脊柱炎与IL-23R基因多态性关联的Meta分析[J].现代免疫学,2015,35(6):477-481.
[11]赵瑞梅,孙永平.强直性脊柱炎患者外周血TNR-α、IL-17、IL-23的表达及相关性分析[J].实用临床医药杂志,2015,19(9):38-40.
[12]Ebihara S,Date F,Dong Y,etal.Interleukin-17 is a critical target for the treatment of ankylosing enthesitis and psoriasis-like dermatitis in mice[J].Autoimmunity,2015,48(4):259-266.
[13]Toussirot E.The IL-23/Th17 pathway as a therapeutic target in chronic inflammatory diseases[J].Inflamm Allergy Drug Targets,2012,11(2):159-168.
[14]张璐,邹红云,于武忠,等.强直性脊柱炎患者TNF-α表达水平测定分析[J].中国实验诊断学,2014,18(4):589-592.
[15]Zhang JR,Liu XJ,Xu WD,etal.Effects of tumor necrosis factor-α inhibitors on new bone formation in ankylosing spondylitis[J].Joint Bone Spine,2015,12(8):1297-1319.
[16]Liu KG,He QH,Tan JW,etal.Expression of TNF-α,VEGF,and MMP-3 mRNAs in synovial tissues and their roles in fibroblast-mediated osteogenesis in ankylosing spondylitis[J].Genet Mol Res,2015,14(2):6852-6858.
[17]Laragione T,Brenner M,Sherry B,etal.CXCL10 and its receptor CXCR3 regulate synovial fibroblast invasion in rheumatoid arthritis[J].Arthritis Rheum,2011,63(11):3274-3283.
[18]DiDomenicantonio A.Aheumatoid arthritis and the alphachemokine IP-10[J].Clin Ter,2014,165(6):447-451.
Expression of interferon-γ-inducible protein-10 in serum of patients with ankylosing spondylitis and its clinical significance
YANG Biao1, WANG Yao2*, ZHAO Xiaoguang1, WANG Lei1
(1DepartmentofOrthopedics,FirstAffiliatedHospitalofXi’anMedicalUniversity,Xi’an710077,China;2DepartmentofLaboratoryMedicine,FirstAffiliatedHospitalofXi’anMedicalUniversity;*Correspondingauthor,E-mail: 95244556@qq.com)
Abstract:ObjectiveTo investigate the levels of serum interferon-γ-inducible protein 10(IP-10) in patients with ankylosing spondylitis(AS),and evaluate its clinical significance in the disease activity of AS.MethodsThe levels of IP-10,IL-17,IL-23 and TNF-α in serum from 34 patients with active ankylosing spondylitis,24 patients at stable phase and 46 healthy controls were detected by enzyme linked immunosorbent assay(ELISA). The correlation of serum IP-10 level with AS-associated clinical and laboratorial indexes were analyzed. ResultsThe levels of serum IP-10 in active and stable phase AS patients were significantly higher than that of healthy controls(P<0.05),and the serum IP-10 level in active AS patients was significantly higher than that in inactive AS patients(P<0.05). The levels of serum IL-17,IL-23 and TNF-α in AS patients were higher than that of healthy controls(P<0.05),and the levels of serum IL-17 and TNF-α in active AS patients were significantly higher than those of inactive AS patients(P<0.05). Correlation analysis showed that the level of IP-10 was positively correlated with IL-17,IL-23,TNF-α,PLT,ESR,CRP, BASDAI score in AS patients.ConclusionThe serum IP-10 level may be an important immune marker in the process of AS, and it can be helpful to diagnose and evaluate AS.
Key words:interferon-γ-inducible protein-10;ankylosing spondylitis;cytokines
作者简介:杨彪,男,1977-03生,硕士,主治医师,E-mail:yangbiao1977@126.com
收稿日期:2016-03-06
中图分类号:R593.23
文献标志码:A
文章编号:1007-6611(2016)05-0459-04
DOI:10.13753/j.issn.1007-6611.2016.05.014

