化疗药物对晚期非小细胞肺癌患者血清EGFR基因突变的影响
张旭东, 张世强*, 王保庆, 王海清
(1徐州医学院第二附属医院放疗三科,徐州 221006; 2徐州医学院第二附属医院肿瘤内科; 3徐州医学院第二附属医院呼吸内科; *通讯作者E-mail:zhangshiqiang711@163.com)
化疗药物对晚期非小细胞肺癌患者血清EGFR基因突变的影响
张旭东1, 张世强1*, 王保庆2, 王海清3
(1徐州医学院第二附属医院放疗三科,徐州221006;2徐州医学院第二附属医院肿瘤内科;3徐州医学院第二附属医院呼吸内科;*通讯作者E-mail:zhangshiqiang711@163.com)
摘要:目的检测晚期非小细胞肺癌患者化疗前后血清EGFR基因外显子19和外显子21的突变状态,探讨化疗药物对血清EGFR基因突变状态的影响。方法48例非小细胞肺癌患者均接受了至少4-6周期的全身化疗,应用磁珠法提取患者化疗前后的血清游离DNA,RT-PCR技术扩增患者血清游离DNA中EGFR外显子19和外显子21,所有扩增样本均经基因测序法验证EGFR基因突变状态,分析EGFR基因外显子19和外显子21化疗前后突变状态。结果48例肺癌患者化疗前后血清EGFR的突变以外显子21为主,化疗前后外显子19和外显子21的突变率无显著性差异(P>0.05),血清EGFR的突变状态与患者病理类型具有相关性(P<0.02),但与性别无关(P>0.05),化疗前血清EGFR基因突变率为35.4%(17/48),化疗后血清EGFR基因突变率为43.8%(21/48),化疗前后患者EGFR基因突变的一致率为62.5%(30/48),化疗前后EGFR基因的突变率无统计学差异(P>0.05),在不一致的18例患者中,7例患者由化疗前的EGFR突变阳性变为阴性,11例患者由化疗前的EGFR突变阴性变为阳性。结论化疗药物可能导致肺癌患者血清EGFR基因突变的改变,对于一线化疗后拟应用EGFR-TKI治疗的患者宜动态观察血清EGFR基因的变化,避免患者治疗的盲目性。
关键词:肺肿瘤;游离DNA;EGFR基因;化疗药物
循证医学的证据表明,靶向药物是晚期非小细胞肺癌患者重要的治疗手段,其疗效取决于肺癌患者表皮生长因子受体(epidermal growth factor receptor, EGFR)基因的突变状态,但由于靶向药物费用昂贵,目前大部分晚期肺癌患者的一线治疗仍采取以全身化疗为主。许多研究表明,对于EGFR基因突变阳性的肺癌患者,一线靶向药物治疗疗效优于化疗,有效率可达70%以上[1-3],而对于化疗后肺癌患者二/三线应用靶向药物治疗的客观有效率明显降低,有效率在30%-40%[4-6],因此,有学者推测化疗药物可能会对肺癌患者EGFR基因突变状态产生一定的影响。
临床上检测EGFR基因突变状态主要以肿瘤组织为检测标本,但由于大部分肺癌患者确诊时已处于肿瘤晚期,往往无法获得足够用于检测EGFR基因突变的肺癌组织标本,目前已有大量的研究证实[7-9],血清游离DNA中EGFR基因突变状态与肿瘤组织中的EGFR基因突变状态具有高度的相关性,血清DNA可替代肿瘤组织DNA进行肿瘤EGFR基因突变检测,而且近年来国内已有利用血清DNA检测EGFR突变指导靶向药物治疗取得较好疗效的报道[10,11],本研究收集晚期肺癌患者化疗前后的血清标本,应用RT-PCR法直接测序进行EGFR基因突变检测,观察化疗药物对血清中EGFR基因突变状态是否存在影响。
1资料与方法
1.1研究对象
选择2014-01~2015-09就诊于我院的48例非小细胞肺癌患者作为研究对象。所有入组的肺癌患者均有组织学和/或细胞学诊断依据,分期为Ⅲb期或Ⅳ期,所有患者KPS评分大于60分;其中男性30例,女性18例;年龄45-72岁,平均57.5岁,腺癌26例,鳞癌22例。采集患者全身化疗前和化疗4-6个周期后的血清标本(一线化疗方案:铂类+多西他塞/培美曲塞/吉西他滨),所有入组患者最后的化疗疗效评估:部分缓解(PR)10例,疾病稳定(SD)25例,疾病进展(PD)13例,所有患者均签署知情同意书。
1.2方法
1.2.1外周血游离DNA的提取采集患者治疗前外周静脉血4 ml,室温放置2 h后用低温高速离心机将静脉血离心(20 ℃,3 000 r/min,10 min),弃下液,取上层液血清1 ml放置入2 ml冻存试管,血清DNA以磁珠法全血基因组DNA抽提试剂盒(美国Omega公司生产)抽提,按说明书所述的方法抽提血清DNA。
1.2.2外周血游离DNA中EGFR基因突变状态的检测DNA抽提完成后进行PCR扩增目的片段EGFR,EGFR外显子19上游引物:5′- AACGTCTTCTCCCTTCTCTCTCTGTCA-3′,下游引物:5′- C CACACAGCA AAGCAGAAACT -3′,产物大小为150 bp;EGFR外显子21上游引物:5′-TCTTCTCGTTTT CAGGGC ATG-3′,下游引物:5′-GGCTGACCTAAAGCCACCTC -3′,产物大小为196 bp;PCR扩增体系设计为20 μl,模板1 μl。扩增外显子为19、21外显子。①95 ℃,5 min变性。②95 ℃30 s,57 ℃30 s,72 ℃ 45 s,40个循环。③72 ℃延伸7 min。扩增产物经1.6%琼脂糖凝胶电泳100 V 30 min后EB染色摄片。对观察到阳性扩增条带的样本分离纯化后进行基因测序,测序引物采用各外显子的上游引物。
1.3统计学分析
使用SPSS 16.0软件进行统计分析,使用χ2检验分析不同亚组及化疗前后肺癌患者EGFR基因突变率的差异,P<0.05为差异有统计学意义。
2结果
2.1化疗前血清EGFR基因突变
化疗前血清DNA样本检测结果显示患者EGFR基因突变发生率为35.4%(17/48)。外显子19突变10个,突变率为20.8%(10/48),外显子21突变15个,突变率为31.3%(15/48),EGFR基因以外显子21突变为主(60.0%,15/25),其中8例患者同时伴有外显子19和21突变。女性患者EGFR基因突变率为38.9%(7/18),男性患者突变率为33.3%(10/30),女性高于男性,但差异无统计学意义(χ2=0.151,P=0.698)。腺癌患者突变率为50.0%(13/26),鳞癌患者突变率为22.7%(4/22),腺癌患者血清EGFR基因突变率明显高于鳞癌患者,差异具有统计学意义(χ2=5.274,P=0.021)。
2.2化疗后血清EGFR基因突变
化疗后血清DNA样本检测结果显示患者EGFR基因突变发生率为43.8%(21/48)。外显子19突变12个,突变率为25.0%(12/48),外显子21突变16个,突变率33.3%(16/48),可见化疗后血清EGFR基因突变的检测结果仍以外显子21突变为主(57.1%,16/28),其中7例患者同时有外显子19和21突变。女性患者EGFR基因突变率为33.3%(6/18),男性患者EGFR基因突变率为50.0%(15/30),女性明显低于男性,但差异无统计学意义(χ2=1.269,P=0.259)。腺癌患者突变率为61.5%(16/26),鳞癌患者突变率为18.2%(5/22),腺癌患者血清EGFR基因突变率明显高于鳞癌患者,差异具有统计学意义(χ2= 5.635,P=0.017)。
对于入组患者EGFR基因突变状态进一步亚组分析,外显子19缺失突变,化疗前突变率为20.8%(10/48),化疗后突变率为25.0%(12/48),差异无统计学意义(χ2= 0.235,P=0.627),其中化疗前后均阳性3例,化疗前后均阴性27例患者,化疗前阴性化疗后阳性5例,化疗前阳性化疗后阴性7例。对于EGFR外显子21点突变,化疗前突变率为31.3%(15/48),化疗后突变率33.3%(16/48),无统计学差异(χ2=0.047,P=0.827),其中化疗前后均阳性7例,化疗前后均阴性28例,化疗前阴性化疗后阳性6例,化疗前阳性化疗后阴性3例(见表1)。
2.3化疗前后EGFR基因突变变化
48例肺癌患者中化疗前EGFR基因突变阳性率为35.4%(17/48),化疗后患者EGFR基因突变阳性率为43.8%(21/48),差异无统计学意义(χ2=0.697,P=0.403)。 化疗前后患者EGFR突变状态一致率为62.5%(30/48),在不一致的18例患者中,7例患者由化疗前的EGFR突变阳性变为阴性,11例患者由化疗前的EGFR突变阴性变为阳性(见表2)。
表1晚期肺癌患者临床特征与化疗前后血清EGFR基因突变状态的关系
Table 1Relationship between EGFR gene mutation and clinical pathological features of patients with advanced lung cancer before and after chemotherapy
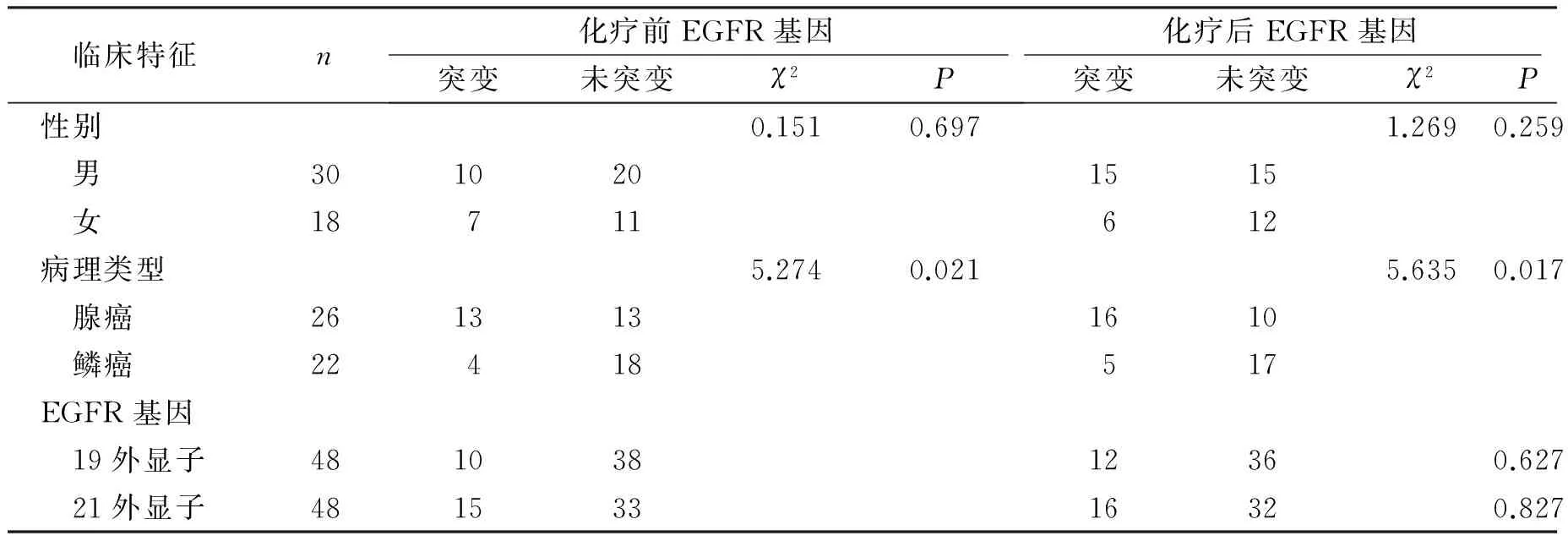
临床特征n化疗前EGFR基因突变未突变χ2P化疗后EGFR基因突变未突变χ2P性别0.1510.6971.2690.259 男3010201515 女18711612病理类型5.2740.0215.6350.017 腺癌2613131610 鳞癌22418517EGFR基因 19外显子48103812360.627 21外显子48153316320.827
表2肺癌患者化疗前后EGFR基因突变状态的变化
Table 2The EGFR gene mutation changes in serum samples before and after chemotherapy in patients with advanced lung cancer
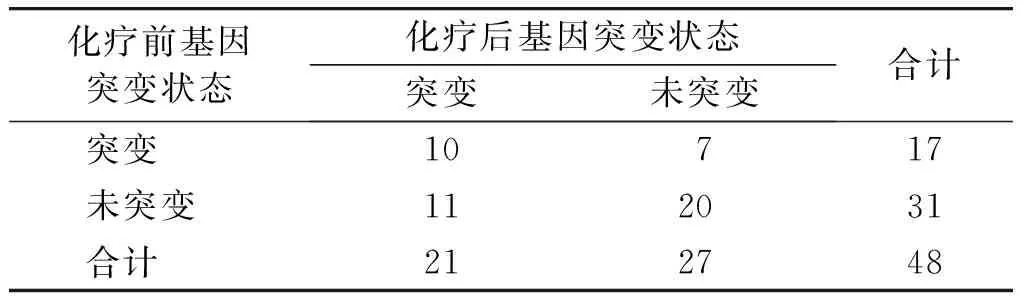
化疗前基因突变状态化疗后基因突变状态突变未突变合计突变10717未突变112031合计212748
3讨论
肺癌已成为严重威胁人类健康与生命的恶性肿瘤之一,大部分患者确诊时已处于晚期,对于中晚期肺癌患者的治疗目前仍以姑息性化疗为主,主要目的是改善症状,但第三代化疗药物的临床应用未能明显改善患者的预后。近年来,随着医学研究的发展,肺癌的靶向治疗取得了突破性的进展,EGFR-TKI已成为目前肺癌靶向治疗最重要的手段,国内外研究表明[12,13],EGFR-TKI作为EGFR突变阳性的肺癌一线治疗的有效率明显高于二/三线治疗的有效率,其差异的原因至今未明,由于大部分晚期肺癌患者的一线治疗仍采取以化疗为主,化疗药物是否会对EGFR基因突变状态产生影响值得进一步研究,本研究收集晚期肺癌患者化疗前后的血清标本,使用RT-PCR进行EGFR基因突变检测,同时进行直接测序验证,探讨化疗药物对EGFR基因突变状态是否存在影响。
在本研究中发现,48例肺癌患者化疗前和化疗后血清DNA样本均可检测出EGFR基因外显子19和外显子21的突变,其中以外显子21的突变率较高,部分患者同时合并有外显子19和外显子21的突变,但统计学分析表明,化疗前后外显子19和外显子21的突变率无显著性差异,进一步分析血清EGFR基因突变与患者临床特征的持续更新发现,血清EGFR基因的突变状态与患者的病理类型具有密切的相关性(P<0.05),与我们既往的研究结果相一致[7],但本研究中未发现血清EGFR基因的突变状态与性别具有相关性(P>0.05),与已有的文献报道结果不一致[14-15],出现差异的原因考虑可能与本研究中入组的肺癌患者样本例数较少有关。另外,在本研究中48例肺癌患者化疗前和化疗后EGFR基因突变阳性率分别为35.4%和43.8%,化疗前后患者EGFR突变状态一致率为62.5%,在不一致的18例患者中,7例由化疗前的EGFR突变阳性变为阴性,11例由化疗前的突变阴性变为阳性,提示化疗前后肺癌患者血清EGFR基因的突变状态会发生变化,但统计学分析显示化疗前后EGFR基因突变状态无显著性差异(P>0.05),国内学者韩如冰等[16]亦有相似的报道。因此,化疗会在一定的程度上影响血清EGFR基因的突变状态,分析其原因可能有:化疗可能使EGFR基因突变阳性的肿瘤细胞更易被杀伤,因而释放更多DNA入血,因此,化疗后EGFR基因突变阳性比例升高;其次,肿瘤在进展过程中EGFR基因突变状态可能发生变化;另外,不排除由于实验条件及方法的不同导致假阳性或假阴性的可能,建议扩大样本量进一步临床研究。
总之,晚期肺癌患者一线应用化疗药物后会影响血清EGFR基因的突变状态,对于二线或三线应用EGFR-TKI治疗的患者建议动态观察血清EGFR基因的变化,可以避免患者靶向药物治疗的盲目性,而且以血清为样本进行多次检测EGFR基因突变,取材方便而且无创,患者痛苦小也易于接受。
参考文献:
[1]Yang JC,Hirsh V,Schuler M,etal.Symptom control and quality of life in LUX-Lung 3:a phase Ⅲ study of afatinib or cisplatin/pemetrexed in patients with advanced lung adenocarcinoma with EGFR mutations[J].J Clin Oncol,2013,31 (27):3342-3350.
[2]Wu YL,Zhou C,Hu CP,etal.Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non small-cell lung cancer harbouring EGFR mutations(LUX-Lung 6):an open-label, randomised phase 3 trial[J].Lancet Oncol,2014,15(2):213-222.
[3]Douillard JY,Shepherd FA,Hirsh V,etal.Molecular predictors of outcome with gefitinib and docetaxel in previously treated non small-cell-lung cancer:data from the randomized phase III INTEREST trial[J].J Clin Oncol,2010,28(5):744-752.
[4]Bezjak A,Tu D,Seymour L,etal.Symptom improvement in lung cancer patients treated weth erlotinib:Quality of life analysis of the National Cancer Institute of Canada Clinical Trials Group Study BR 21[J].J Clin Oncol,2006,24(24):3831-3837.
[5]Sun JM,Lee KW,Kim JH,etal.Efficacy and toxicity of pemetrexed as a third-line treatment for non-small cell lung cancer[J].Jpn J Clin Oncol,2009,39(1):27-32.
[6]Girard N,Jacoulet P,Gainet M,etal.Third-line chemotherapy in advanced non-small cell lung cancer: identifying the candidates for routine practice[J].J Thorac Oncol,2009,4(12):1544-1549.
[7]张世强,王保庆,王海清,等.非小细胞肺癌患者外周血游离DNA中检测EGFR基因突变[J].国际检验医学杂志,2015,36(9):1185-1187.
[8]赵宇,郭惠琴.检测非小细胞肺癌患者的血清循环EGFR基因突变研究进展[J].癌症进展,2012,10(1):6-9.
[9]赵瑾,彭群新,杨炳华,等.应用HRM法检测肺癌患者循环DNA中表皮生长因子受体基因突变[J].中华医学杂志,2011,91(10):674-678.
[10]周小昀,李龙芸,崔巍,等.检测肺癌患者血清游离DNA的EGFR基因点突变与EGFR-TKI疗效的相关性分析[J].癌症进展,2011,9(1):13-18.
[11]张世强,王保庆,王海清,等.晚期NSCLC患者外周血游离DNA中EGFR突变与靶向药物一线治疗疗效的相关性[J].山西医科大学学报,2015,46(7):645-648.
[12]Zhou C,Wu YL,Chen G,etal.Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL,CTONG-0802):a multicentre,open-label,randomised, phase 3 study[J].Lancet Oncol,2011,12(8):735-742.
[13]Shepherd FA,Rodrigues Pereira J,Ciuleanu T,etal.Erlotinib in previously treated non-small-cell lung cancer[J].N Engl J Med,2005,353(2):123-132.
[14]Mitsudomi T,Kosaka TH,Horio Y,etal.Mutations of the epidermal growth factor receptor gene redict prolonged survival after gefitinib treatment in patients with non-small-cell lung cancer with postoperative recurrence[J].J Clin Oncol,2005,23(11):2513-2520.
[15]Takano T,Ohe Y,Tsuta K,etal.Epidermal growth factor receptor mutation detection using high-resolution melting analysis predicts outcomes in patients with advanced non-mall cell lung cancer treated with gefttinib[J]. Clin Cancer Res, 2007,13(18):5385-5390.
[16]韩如冰,钟巍,赵静,等.晚期肺腺癌患者化疗前后血清EGFR基因突变状态的比较[J].中国肺癌杂志,2011,14(2):127-131.
Influence of chemotherapy drugs on serum EGFR mutation status in advanced non-small cell lung cancer
ZHANG Xudong1, ZHANG Shiqiang1*, WANG Baoqing2, WANG Haiqing3
(1ThirdDepartmentofRadiotherapy,SecondAffiliatedHospitalofXuzhouMedicalCollege,Xuzhou221006,China;2DepartmentofOncology,SecondAffiliatedHospitalofXuzhouMedicalCollege;3DepartmentofRepiration,SecondAffiliatedHospitalofXuzhouMedicalCollege;*Correspondingauthor,E-mail:zhangshiqiang711@163.com)
Abstract:ObjectiveTo detect EGFR exon 19 and exon 21 mutation status in serum before and after chemotherapy from advanced non-small cell lung cancer patients,and evaluate the effect of chemotherapy on EGFR mutation status. MethodsMagnetic beads were used for DNA extraction in serum of 48 advanced non-small cell lung cancer patients before and after chemotherapy. The EGFR was amplified by RT-PCR and all samples were analyzed by direct sequencing and the changes of EGFR exon 19 and exon 21 mutations were observed before and after chemotherapy.ResultsThe rate of serum EGFR exon 21 mutations in 48 patients was higher than that of exon 19,but there was no significant difference(P>0.05). The rates of EGFR mutations showed no significant difference between male and female(P>0.05),but there was significant difference between adenocarcinoma and squamous cell carcinoma(P<0.02). EGFR mutations were found in 35.4%(17/48)and 43.8%(21/48)in serum before and after chemotherapy respectively,and there was no significant difference(P>0.05),The consistency rate of EGFR mutation before and after chemotherapy was 62.5%(30/48). Among 18 discordant cases,11 cases changed from wild type to mutant type after chemotherapy, and 7 cases changed from mutant type before chemotherapy to wild type after chemotherapy.ConclusionChemotherapy drugs may have influence on serum EGFR mutation in advanced carcinoma patients. It is important for lung cancer patients with first-line chemotherapy to detect serum EGFR gene mutation before EGFR-TKI treatment.
Key words:lung neoplasms;EGFR;mutation;chemotherapy drug
基金项目:徐州市科技计划基金资助项目(XM13B045)
作者简介:张旭东,男,1967-01生,本科,副主任医师,E-mail:zxdmail8@sohu.com
收稿日期:2016-02-20
中图分类号:R734.2
文献标志码:A
文章编号:1007-6611(2016)05-0455-04
DOI:10.13753/j.issn.1007-6611.2016.05.013

