两种培养基对羊驼毛囊干细胞生长和增殖的影响
弓慧敏, 白 瑞, 贾宗菲, 董常生, 庞全海*
(1山西医科大学晋祠学院基础医学部形态学教研室,太原 030025; 2山西农业大学动物科技学院; *通讯作者,E-mail:pangquanhai@126.com)
两种培养基对羊驼毛囊干细胞生长和增殖的影响
弓慧敏1, 白瑞2, 贾宗菲2, 董常生2, 庞全海2*
(1山西医科大学晋祠学院基础医学部形态学教研室,太原030025;2山西农业大学动物科技学院;*通讯作者,E-mail:pangquanhai@126.com)
摘要:目的比较K-SFM和DMEM/F12两种培养基对羊驼毛囊干细胞生长和增殖的影响。方法取2-3岁羊驼背部皮肤,采用联合酶消化法分离毛囊干细胞,用无血清角质化培养基(K-SFM)和自配无血清培养基(DMEM/F12)培养羊驼毛囊干细胞,比较羊驼毛囊干细胞的生长状况,用CK19、integrin-β1特异性标志物免疫细胞化学鉴定细胞。结果免疫细胞化学证实所培养的细胞为羊驼毛囊干细胞。两种培养基均能培养一定量的羊驼毛囊干细胞,培养基K-SFM有利于羊驼毛囊干细胞的增殖,细胞生长数量多,细胞克隆形成能力强,增殖速度快;DMEM/F12培养基细胞数量少,细胞活力不强,传代次数少,增殖速度慢。结论成功分离并鉴定了羊驼毛囊干细胞,建立了适于羊驼毛囊干细胞体外扩增的培养基,K-SFM培养基较自配培养基DMEM/F12更适合羊驼毛囊干细胞的体外培养。
关键词:羊驼;毛囊干细胞;细胞培养;免疫细胞化学
羊驼(Lama pacos)属于哺乳纲、偶蹄目、骆驼科、美洲驼属,其毛具有重要经济价值。羊驼毛有22种自然色泽,羊驼毛织成的衣服轻盈、柔软,是半细毛类中特别优良的毛纤维,被视为纺织品中的“软黄金”。
目前,有关毛囊干细胞(hair follicle stem cells,FSC)的分离培养,在多数实验室中以鼠的触须毛囊[1-3]、外科获取的人头皮样本[4]为毛囊干细胞的组织来源。样本经中性蛋白酶DispaseⅡ酶处理,分离去除表皮,或者用胰酶/EDTA处理的毛囊组织,获得单细胞悬液培养毛囊干细胞。毛囊干细胞在体外可诱导分化为神经元,神经胶质细胞,角化细胞,平滑肌细胞和黑色素细胞等[5,6],而在体内(移植后)可分化为神经元、黑色素细胞等。另外,毛囊干细胞还能分化成毛囊、皮脂腺、表皮[7]等,毛囊周期生长是由毛囊干细胞和间质细胞的共同作用完成。因此,毛囊干细胞对毛发的再生以及毛色的影响起着重要的作用[8,9]。由于羊驼皮肤组织更新速度快、再生能力强,来源充足、取材方便、创伤小,其对自体细胞构建的组织不存在排斥反应,可在体外大量培养扩增,因此,来自皮肤局部的干细胞受到了重视。
由于羊驼皮肤毛囊相对大鼠毛囊要细小,单根毛发显微切割过程持续时间长,容易污染,而且工作强度大。DispaseⅡ酶属于中性蛋白酶,常用来分离皮肤的表皮和真皮进行细胞培养[10,11],是分离组织和细胞的一种性质稳定的消化酶,它不损伤细胞膜[12-14]。本实验初步探讨了羊驼毛囊干细胞的分离培养,为羊驼毛发及毛色的研究以及干细胞分化成其他功能细胞的研究建立了一个技术平台。
1材料和方法
1.1动物
2-3岁雌性羊驼,山西农业大学羊驼养殖基地(原种引自澳大利亚)。
1.2主要试剂及其配制
牛血清白蛋白(BSA)、胰岛素样生长因子(IGF-1)均购自美国Sigma公司。DispaseⅡ酶购自美国Gibco公司。胰蛋白酶购自美国Sigma公司。EDTA购自美国Invitrogen公司。DMEM培养基购自杭州四季青生物工程有限公司。CK19和β1-整合素购自武汉博士德生物工程有限公司。
K-SFM无血清培养基:1 000 ml K-SFM+5 μl/ml BPE+0.1 μl/ml EGF+0.5 μg/ml氢化可得松+5 μl/ml胰岛素,均购自美国Gibco公司。
DMEM/F12自配培养基:1 000 ml DMEM/F12+2%BSA+100 ng/ml EGF+0.5 μg/ml氢化可得松+5 μl/ml胰岛素+10 ng/ml IGF-1。
1.3毛囊干细胞的分离培养
取羊驼背部直径约0.8 cm的皮肤样本,置DMEM培养基中,4 ℃保存备用。将皮肤样本置于75%乙醇中消毒3 min,无菌操作移入PBS中,用眼科镊和眼科剪及手术刀片刮去皮肤表面脏物,去除真皮脂肪组织;将样本切成约0.2 cm×0.3 cm的条块,用含双抗(青霉素100 U/ml和链霉素100 U/ml)的PBS冲洗4次,将其浸泡在0.2%DispaseⅡ酶中,37 ℃消化2 h。取出组织置于PBS中用眼科镊分离毛囊,PBS中漂洗毛囊后,置于0.25%胰蛋白酶∶0.02% EDTA(1∶1)中37 ℃消化2 min,终止液终止消化,用弯头滴管吹打,200目滤网过滤,将滤过物1 000 r/min离心10 min,移入24孔培养板上,置于37 ℃,饱和温度,5% CO2培养箱中培养。对第1,3,5代细胞进行形态学观察比较。
1.4细胞生长曲线测定
分别取K-SFM和DMEM/F12两种培养基培养的生长良好的第3代羊驼毛囊干细胞以1×104个/孔的细胞密度接种于96孔板,每孔0.2 ml,分为2组,分别采用两种培养基培养。每日观察细胞的生长状况并拍照,同时每天每组取3孔细胞进行计数,计算平均值,连续计数7 d,绘制细胞生长曲线,分析不同培养基对羊驼毛囊干细胞生长和增殖的影响。
1.5细胞克隆形成率测定
参照文献[15-17]的方法,分别取K-SFM和DMEM/F12两种培养基培养的第3代细胞稀释成克隆密度(1细胞/μl溶液),每孔100个细胞接种于6孔培养板上,分别培养7-9 d,固定后用姬姆萨法染色,在解剖镜下计克隆数,按式计算,克隆形成率=克隆细胞数/接种细胞数×100%[15-17]。
1.6免疫细胞化学检测毛囊干细胞表面标志CK和integrin-β1
选用两种培养基培养的生长良好的第3代细胞,用0.25%胰酶∶0.02%EDTA(1∶1)37 ℃消化3 min,制成单细胞悬液,调整细胞密度,接种于12孔板上的其中6孔,每孔预先放入处理好的细胞爬片(盖玻片)。将接种好的12孔板放入37 ℃,5%CO2,饱和湿度下培养3-5 d,细胞达到70%左右时,吸出预检测细胞的培养液,用缓冲液DPBS清洗细胞爬片后,用4%多聚甲醛固定爬片20-30 min,DPBS冲洗除去固定液,按免疫组化试剂盒操作程序进行CK19、integrin-β1免疫细胞化学染色(CK19、integrin-β1为源于人、小鼠、大鼠的多克隆抗体),分两组,每组3孔。
1.7统计学分析
2结果
2.1两种培养基培养的毛囊干细胞的形态学比较
用K-SFM分离培养第1代羊驼毛囊干细胞,第2天可见部分细胞贴壁(细胞周围无光晕),部分未贴壁(细胞周围有光晕),在开始培养的3 d内,细胞呈圆形,未伸展成多角形的形态,从第6天开始可见呈多角形的细胞,形成几个细胞聚集的呈小岛状均匀分布小克隆(见图1A),此后细胞增殖加速,10-15 d细胞可接近融合,镜下观察毛囊干细胞呈扁平多角形或铺路石状(见图1B)。
用DMEM/F12分离培养第1代羊驼毛囊干细胞,前3 d与KSF培养基培养的细胞无明显差别,第6天形成小的、不明显的聚集,细胞开始增殖,呈圆形,未伸展成多角形的形态(见图1E),一直到第11天才会呈均匀分布状态,细胞集落中细胞的大小不等,形态不一,有些细胞呈老化状态,体积变大,出现空泡(见图1F)。
胰酶消化细胞制备细胞悬液,加培养基稀释细胞进行传代,按1∶2传,K-SFM培养基和DMEM/F12培养基的两组细胞均为第2天开始贴壁生长。K-SFM培养基培养的细胞生长状况良好,呈克隆状小岛样生长,形态一致,3-5 d多个小岛样克隆汇合,排列紧密,只有少量悬浮细胞(见图1C,D),前10代细胞形态无明显变化,12代开始细胞生长缓慢,形成的小岛样克隆较小且不规则,小克隆之间汇合时间延长至12 d,细胞普遍较大,排列疏松,出现细胞衰老现象,能传代生长至15代,另外,在消化过程中,12代以后的细胞不易脱落,胰酶消化时间逐渐延长,可延长至10 min。而DMEM/F12培养基培养的细胞生长缓慢,贴壁细胞相对要少,相对不易贴壁,总有部分细胞呈半贴壁状态,悬浮细胞多,不易汇合,需一周左右才能汇合,细胞体积较大,排列疏松,第5代开始逐渐老化,只可传代至8代(见1G,H)。
两种培养基均能培养扩增一定量的羊驼毛囊干细胞,但K-SFM培养基有利于羊驼毛囊干细胞的增殖,细胞生长数量多,细胞克隆形成能力强,增殖速度快,而DMEM/F12培养基细胞数量少,细胞活力不强,传代次数少,增殖速度慢。
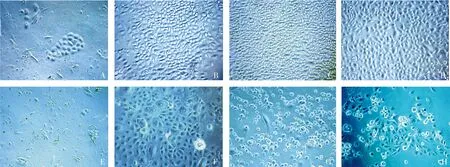
A-D分别为K-SFM培养基第1代第6,10天、3代第7天和5代第6天;E-H分别为DMEM-F12培养基第1代第6和11天d、3代第6天和5代第6天图1 两种培养基羊驼毛囊干细胞分离培养和传代的形态学观察比较 (×200)Figure 1 Comparison of the morphology of hair follicle stem cells between two culture mediums (×200)
2.2两种培养基对毛囊干细胞生长的影响
从第3代细胞生长曲线可以看出,两种培养基中毛囊干细胞在接种前2 d生长缓慢,2-4 d进入倍增期,此后两组之间细胞增长走势不同,K-SFM培养基进入倍增期后仍然保持增殖态势,没有明显平台期,而DMEM-F12培养基毛囊干细胞增殖缓慢,进入倍增期,从第5天开始出现接触抑制,生长速度减慢,进入平台期(见图2)。K-SFM组和DMEM-F12组间细胞增殖数量差异有统计学意义(P<0.01)。
2.3两种培养基对毛囊干细胞增殖的影响
由图3可看出,两种培养体系对羊驼毛囊干细胞克隆形成率有明显的影响,K-SFM培养基培养基细胞克隆形成率明显高于DMEM-F12培养基细胞的克隆形成率,而且两种培养体系都是第5代干细胞克隆形成率高于第3,7,9代。通过t检验,K-SFM组和DMEM-F12组之间细胞克隆形成率差异有统计学意义(P<0.01)。
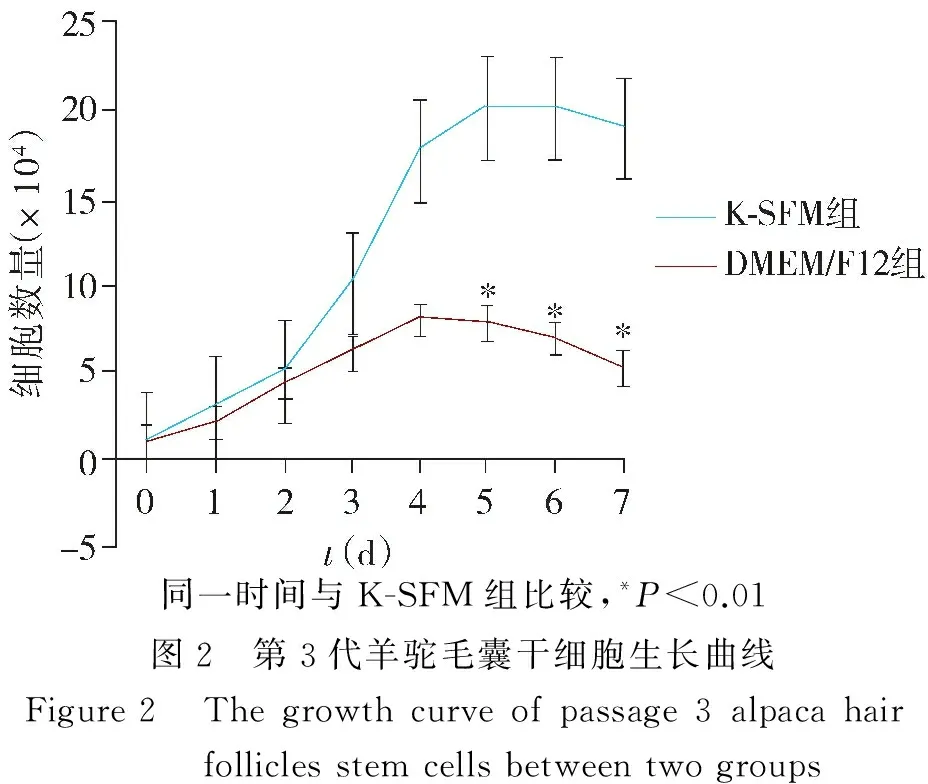
同一时间与K-SFM组比较,*P<0.01图2 第3代羊驼毛囊干细胞生长曲线Figure2 Thegrowthcurveofpassage3alpacahairfolliclesstemcellsbetweentwogroups
2.4毛囊干细胞的免疫细胞化学检测结果
CK19、integrin-β1是毛囊干细胞及祖细胞特异性标志物,对培养细胞进行上述指标检测,羊驼毛囊干细胞免疫组化染色结果可以看出,两种培养基培养的细胞CK19均呈现阳性,在细胞膜内外表达,细胞核呈浅蓝色或蓝紫色,细胞质呈褐色(见图4A、B),而空白对照无表达,作为阴性对照(见图4C)。两种培养基培养的细胞integrin-β1也呈阳性表达,细胞核呈浅蓝色或蓝紫色,细胞质呈褐色(见图4D、E),而空白对照无表达,作为阴性对照(见图4F)。
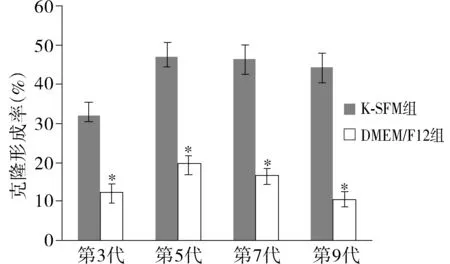
相同代次与K-SFM组比较,*P<0.01图3 不同代次两组羊驼毛囊干细胞克隆形成率比较Figure3 Comparison of clone formation rate in different passage between two groups

A-C分别为K-SFM培养第3代细胞CK19阳性表达、integrin-β1阳性表达、对照组;D-F分别为DMEM/F12培养第3代细胞CK19阳性表达、integrin-β1阳性表达、对照组图4 毛囊干细胞免疫细胞化学鉴定 (×300)Figure 4 Immunocytochemical identification of hair follicle stem cells (×300)
3讨论
本实验选用的两种培养基均为无血清培养基。虽然血清中含有多种黏附因子可促进细胞贴壁,但血清的成分复杂,可促进细胞复层化和分化[12],故实验中采用无血清培养基培养。此外,研究显示血清中的一些成分和Ca2+可以抑制角质形成细胞的分裂促其分化,最终细胞发生老化、凋亡[18],使用无血清培养基可以排除血清中许多未知因素的干扰,并减少动物血清带来的不利影响[10,12]。
许多研究报道,毛囊干细胞培养所用的培养基为无血清角质化培养基[1,11,18,19]和自配无血清培养基DMEM/F12[3,12,20],故本实验采用这两种培养基进行比较培养,旨在选择更适合羊驼毛囊干细胞的生长条件。在角朊细胞生长过程中存在两种主要的生长因子增殖信号途径,即胰岛素激活途径和表皮生长因子(EGF)激活途径[2],故在培养基中添加胰岛素和EGF。鉴于氢化可的松可抑制成纤维细胞和黑色素细胞的增殖[10,21],能够进一步的纯化毛囊干细胞,故此实验中在培养体系中添加了氢化可的松。
K-SFM培养基富含铜、硒、锌等微量元素和丰富的必需氨基酸,可为毛囊干细胞的生长提供良好的营养[10,18],获得较纯的毛囊干细胞,且具有良好的增殖能力,能形成较多的克隆。
形态学观察显示,两种培养基均能培养一定量的羊驼毛囊干细胞,K-SFM培养基细胞生长数量多,细胞克隆形成能力强,增殖速度快,DMEM/F12培养基细胞数量少,细胞活力不强,传代次数少,增殖速度慢。由此可知,K-SFM培养基更利于羊驼毛囊干细胞的生长和增殖,在体外培养条件下,无血清K-SFM培养基更能保持毛囊干细胞高增殖、低分化的生长特性。
外根鞘细胞与表皮细胞均属于上皮细胞,但它们在体内表达的角蛋白具有明显的差异,表皮细胞表达CK1和CK10等分子量较大的分化标记蛋白,而在毛囊外根鞘中表达CK6、CK16和CK19等分子量较小的增殖相关角蛋白[22],CK19可作为皮肤干细胞的标记[23]。β1整合素被认为是表皮干细胞的标志物之一[12],Moll[24]发现β1整合素在毛囊部和基质处的角质细胞强烈表达,β1整合素阳性细胞包含了干细胞和部分祖细胞[12]。故本实验选用CK19和β1整合素做羊驼毛囊干细胞的分子标记物,实验表明,均为阳性表达,与史明艳等[20]对山羊毛囊干细胞的鉴定结果一致。
本实验利用DispaseⅡ酶分离毛囊的真皮鞘以纯化培养毛囊干细胞,再用胰酶消化毛囊得到毛囊干细胞。这样避免了拔毛法造成毛囊的损伤和工作量大等问题,而且减少了操作过程中的污染问题,也减少了成纤维细胞的生长,提高了毛囊干细胞的纯度。
参考文献:
[1]黄恩毅,杨恬,陈伟,等.大鼠毛囊干细胞的纯化培养鉴定及其生物学特性[J].第三军医大学学报,2008,30(1):39-42.
[2]Paus R,Foitzik K.In search of the“hair cycle clock”:a guided tour differentiation[J].Differentiation,2004,72(9-10):489-511.
[3]杨珂,姜自林,杨恬,等.大鼠毛囊干细胞的体外分离培养及增强型绿色荧光蛋白示踪[J].中国组织工程与临床康复,2008,12(8):1481-1484.
[4]Kurata S,Itami S,Terashi H,etal.Successful transplantation of cultured human outer root sheath cells as epithelium[J].Ann Plast Surg,1994,33(3):290-294.
[5]Roh C,Tao Q,Lyle S.Dermal papilla-induced hair differentiation of adult epithelial stem cells from human skin[J].Physiol Genomics,2004,19(2):207-217.
[6]Sieber-Blum M,Grim M,Hu YF,etal.Pluripotent neural crest stem cells in the adult hair follicle[J].Dev Dyn,2004,231(2):258-269.
[7]Taylor G,Lehrer MS,Jensen PJ,etal.Involvement of follicular stem cells in forming not only the follicle but also the epidermis[J].Cell,2000,102(4):451-461.
[8]白瑞,王振华,尹志红,等.真核表达载体pcDNA3.1(+)-GFP-MC1R的构建及在羊驼毛囊干细胞的表达[J].河北农业大学学报,2015,38(3):86-90.
[9]任玉红,杨刚,范瑞文,等.黑素皮质素受体1(MC1R)在不同毛色羊驼皮肤中的表达与定位研究[J].畜牧兽医学报,2012,43(7):1049-1055.
[10]唐建兵,李勤,陈璧,等.两种人毛囊外根鞘细胞培养方法的比较[J].广东医学,2005,26(1):44-46.
[11]张群,杨光辉,丛笑倩,等.人毛囊外根鞘细胞的分离及培养[J].组织工程与重建外科杂志,2006,2(2):79-82.
[12]张群,丛笑倩,张文杰,等.利用中性蛋白酶消化法扩增毛囊干细胞的实验研究[J].上海交通大学学报(医学版),2007,27(4):387-389.
[13]赵奎,贾宗菲,弓慧敏,等.毛囊干细胞的分离方法及其应用[J].中国畜牧兽医,2010,37(12):82-85.
[14]弓慧敏,李方华,万婷,等.毛囊干细胞的研究进展[J].中国畜牧兽医,2010,37(7):61-63.
[15]史明艳,高雪,杨学义,等.不同浓度的IGF-1对山羊毛囊干细胞体外培养的影响[J].中国畜牧兽医,2009,36(5):127-129.
[16]史明艳,林峰,杨学义,等.不同浓度的EGF对山羊毛囊干细胞体外培养的影响[J].西北农业学报,2009,18(3):26-28.
[17]赵奎,庞全海,王振华,等.羊驼毛囊干细胞分离培养与鉴定[J].中国兽医学报,2014,34(1):171-176.
[18]符刚,高强国,杨恬,等.无血清K-SFM培养条件下大鼠毛囊Bulge细胞生物学特性的研究[J].第三军医大学学报,2005,27(15):1538-1540.
[19]华云旗,李秀兰,张杨,等.毛囊干细胞的分离用培养方法[J].国际生物医学工程杂志,2007,30(3):133-137.
[20]史明艳,杨学义,窦忠英.山羊毛囊干细胞分离培养方法研究[J].畜牧兽医学报,2006,37(5):436-440.
[21]刘栋,朱文元,谭城.皮质类因醇对培养Cloudman S91黑素瘤细胞株黑素合成的影响[J].临床皮肤科杂志,2003,32(1):3-6.[22]Schirren CG,Burgdorf WH,Sander CA,etal.Fetal and adult hair follicle:An immunohisto chemical study of anticytokeratin antibodies in fomalin-fixed and paraffin-embedded tissue[J].Am J Dematopathol,1997,19(4):334-336.
[23]仇文颖,许增禄.毛囊干细胞的研究进展[J].基础医学与临床,2002,22(4):304-306.
[24]Moll I.Proliferative potential of different keratinocytes of plucked human hair follicle[J].J Invest Dermatol,1995,105(1):14-21.
Effect of two kinds of culture medium on the alpaca hair follicle stem cell growth and proliferation
GONG Huimin1, BAI Rui2, JIA Zongfei2, DONG Changsheng2, PANG Quanhai2*
(1DepartmentofMorphology,JinciCollegeofShanxiMedicalUniversity,Taiyuan030025,China;2CollegeofAnimalScienceandVeterinaryMedicine,ShanxiAgriculturalUniversity;*Correspondingauthor,E-mail:pangquanhai@126.com)
Abstract:ObjectiveTo compare the effect of K-SFM and DMEM/F12 on alpaca hair follicle stem cell growth and proliferation.MethodsSkins were collected from the back of 2-3-year-old alpaca. The alpaca hair stem cells were disassociated with collagenase and trypsin. The keratinocyte serum free medium(K-SFM) and the self-made serum-free medium (DMEM/F12) were used to culture the alpaca follicle stem cells, and then the growth conditions were compared. The expression of CK19 and integrin-β1 was detected in stem cells.ResultsThe cultured cells expressed CK19 and integrin-β1 and desmin in cytoplasm, demonstrating that they were indeed alpaca hair follicle stem cells. Some alpaca hair follicle stem cells were cultured in both two kinds of medium. K-SFM was beneficial to the growth of the alpaca follicle stem cells, with a large number of the cells, the powerful ability of cellclone formation, and the rapid reproduction. After cultured with DMEM/F12, the number of the alpaca follicle stem cells was less, its vitality was lower, its passage was decreased, and its reproduction was slower.ConclusionThe present study successfully isolate and identify the alpaca hair follicle stem cells, and K-SFM medium is more suitable for the culture of alpaca hair follicle stem cells in vitro.
Key words:alpaca;hair follicle stem cells;cell culture;immunocytochemistry
基金项目:国家自然科学基金资助项目(30972223);山西农业大学博士启动基金资助项目(412528);山西农业大学博士后基金资助项目(614114)
作者简介:弓慧敏,女,1983-05生,硕士,助教,E-mail:397362842@qq.com
收稿日期:2016-01-10
中图分类号:R329.2
文献标志码:A
文章编号:1007-6611(2016)05-0424-05
DOI:10.13753/j.issn.1007-6611.2016.05.006

