miR-373-3p参与去甲肾上腺素对结肠癌细胞RKO体外增殖的调控
马瑞丽, 韩 佳, 侯 妮, 黄 辰,3*
(1西安交通大学医学部细胞生物学与遗传学系,西安 710061; 2西安医学院基础医学部; 3西安交通大学医学部心血管研究中心;*通讯作者,E-mail:hchen@mail.xjtu.edu.cn)
miR-373-3p参与去甲肾上腺素对结肠癌细胞RKO体外增殖的调控
马瑞丽1,2, 韩佳1, 侯妮1, 黄辰1,3*
(1西安交通大学医学部细胞生物学与遗传学系,西安710061;2西安医学院基础医学部;3西安交通大学医学部心血管研究中心;*通讯作者,E-mail:hchen@mail.xjtu.edu.cn)
摘要:目的确定miR-373-3p是否参与去甲肾上腺素对结肠癌细胞RKO细胞增殖的调控。方法将结肠癌细胞RKO分为处理组和对照组,处理组细胞培养于含有终浓度10 μmol/L去甲肾上腺素的培养基中,对照组培养于正常培养基中,使用MTT法检测细胞增殖的差异。使用划痕实验观察细胞迁移,使用流式细胞术检测细胞周期。通过RT-PCR检测处理组细胞的miR-373-3p表达量。合成miR-373-3p的DNA抑制剂si-miR-373-3p,将其转染入细胞,观察其对RKO细胞增殖的影响。采用SPSS22.0对数据进行统计学分析,P<0.05视为有统计学差异。结果10 μmol/L去甲肾上腺素促进RKO细胞的体外增殖(P<0.05)和迁移过程。细胞周期结果显示,处理组细胞S期和G2期比例均上升。处理组细胞miR-373-3p表达量上升(P<0.05),转染si-miR-373-3p的RKO细胞增殖受到抑制(P<0.05)。对转染si-miR-373-3p的细胞,去甲肾上腺素不再促进细胞增殖。结论miR-373-3p参与了去甲肾上腺素促进的结肠癌细胞RKO的增殖过程。
关键词:去甲肾上腺素;结肠癌;细胞增殖;miR-373-3p
结肠癌(colorectal cancer,CRC)是发生在结肠和直肠的消化系统恶性肿瘤,为世界第三大高发癌症,2012年结肠癌患者为354万,因其死亡的人数69万[1]。结肠癌的发生与基因突变、饮食、炎症、生活方式等多种因素相关。近年来的研究发现,肾上腺素、去甲肾上腺素与癌症的发展和转移密切相关。Pu等[2]的研究发现,肾上腺素可以诱导结肠癌细胞HT29的迁移,并增加其抗药性。Yang等[3]的研究表明,去甲肾上腺素可以通过诱导IL-6的表达,参与到胃癌的发生过程中。Stock等[4]的研究发现,去甲肾上腺素会阻滞胰腺癌细胞的迁移。这些研究说明,去甲肾上腺素参与到癌症的发展中,但其在结肠癌中的作用机制还有待于更进一步的研究。
微小RNA(microRNA,miRNA)是一类进化上高度保守的单链非编码小分子RNA,在真核生物中广泛存在,主要由基因的内含子部位剪切产生。已有的研究表明,miRNA的作用方式主要有两种方式:当其与目的蛋白的mRNA完全互补时,诱导目的蛋白降解;当其与目的蛋白的mRNA不完全互补时,通过不完全的碱基配对,与目的蛋白mRNA的3′UTR区结合,抑制其转录[5],调节细胞的各种功能。已有研究表明,miR-373作为促癌基因,作用于YOD1基因,促进了宫颈癌的发展[6]。在非小细胞肺癌中,miR-373被组蛋白去乙酰化沉默,在非小细胞肺癌的发展和转移中发挥了重要作用[7]。本研究旨在观察miR-373-3p是否参与由去甲肾上腺素介导的结肠癌细胞RKO增殖和迁移的过程。
1材料与方法
1.1细胞株和主要试剂
人结肠癌细胞RKO由西安交通大学医学部环境与疾病相关基因教育部重点实验室提供,培养于含10%胎牛血清的1640培养基中。置于37 ℃、5% CO2培养箱中,隔天换液,取对数生长期细胞进行实验。重酒石酸去甲肾上腺素(norepinephrine,NE)购于美国Sigma公司;转染试剂Lipfectamine 2000 Transfection和RNA提取试剂Trizol购于美国Invitrogen公司;逆转录试剂盒PrimeScript RT Regent kit和real time PCR试剂盒SYBR premix EX TaqTM购于日本TaKaRa公司,引物和抑制剂由中国上海生工生物工程股份有限公司合成。
1.2MTT检测细胞增殖
按5 000个细胞/孔进行96孔板铺板,12 h向培养基中加入NE,药物终浓度为10 μmol/L,每组做5个复孔。加NE后24 h,48 h和72 h使用MTT法测定细胞数目。
1.3划痕实验检测细胞迁移
按2×105/孔铺6孔板,12 h用10 μl加液器吸头划线,并换培养基为含10 μmol/L NE和1%胎牛血清的培养基,分别于24 h,48 h和72 h观察其划痕愈合情况。
1.4流式细胞仪检测细胞周期
按2×105/孔铺6孔板,12 h时加入10 μmol/L NE,10%胎牛血清的培养基培养24 h,用胰酶消化细胞,PBS洗涤2次,75%乙醇固定,用碘化丙啶染色,避光静置30 min后使用流式细胞仪检测细胞周期。
1.5引物设计
设计miR-373-3p和U6的逆转录引物和实时定量PCR引物,以及DNA抑制剂si-miR-373-3p,序列见表1。
表1Real Time PCR所用引物序列及miR-373-3p抑制剂序列
Table 1Real time PCR primer sequence and miR-373-3p inhibitor sequence
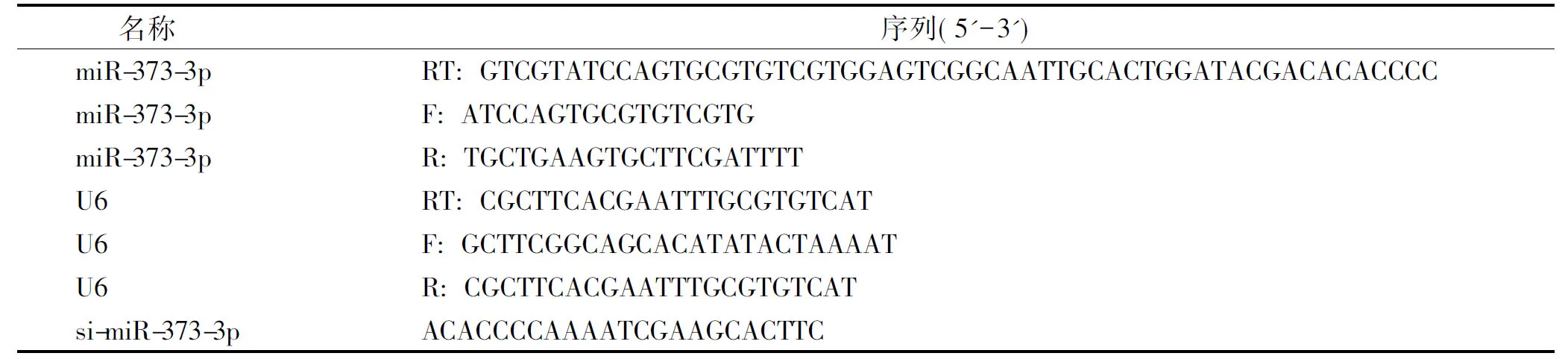
名称 序列(5'-3')miR-373-3pRT:GTCGTATCCAGTGCGTGTCGTGGAGTCG-GCAATTGCACTGGATACGACACACCCCmiR-373-3pF:ATCCAGTGCGTGTCGTGmiR-373-3pR:TGCTGAAGTGCTTCGATTTTU6RT:CGCTTCACGAATTTGCGTGTCATU6F:GCTTCGGCAGCACATATACTAAAATU6R:CGCTTCACGAATTTGCGTGTCATsi-miR-373-3pACACCCCAAAATCGAAGCACTTC
1.6RNA抽提和鉴定以及逆转录PCR获取cDNA
按2×105/孔铺6孔板,12 h时加入10 μmol/L NE,使用含10%胎牛血清的1640培养基培养24 h,使用Trizol试剂盒提取总RNA。分别利用miR-373-3p特异性逆转录引物和内参U6引物进行逆转录,获取cDNA,反应产物4 ℃保存。
1.7实时定量PCR(RT-PCR)检测miR-373-3p表达量变化
采用试剂盒SYBR Premix Ex TaqTMⅡ(Perfect Real Time), 设置U6作为内参,检测处理组和对照组miR-373-3p表达量,每组样本均做3个重复。读取RT-PCR反应结果的Ct值,计算2-ΔΔCt分析比较样品中miR-373-3p表达量的差异。
1.8si-miR-373-3p瞬时转染
按5 000个细胞/孔进行96孔板铺板,铺板12 h时进行转染。分别设置阴性对照组,si-miR-373-3p组,si-miR-373-3p+NE组,每组设5个复孔。其中阴性对照组转染的为乱序对照,si-miR-373-3p组转染si-miR-373-3p,si-miR-373-3p+NE组在转染si-miR-373-3p 4 h后换液为含10 μmol/LNE的培养基。按照Lipfectamine 2000 Transfection 试剂盒要求进行转染,加NE后24 h,48 h和72 h使用MTT法测定细胞数量。
1.9统计学分析
采用SPSS22.0对实验结果进行t检验,P<0.05为差异有统计学意义。
2结果
2.1NE促进RKO细胞增殖
MTT实验结果显示,处理组细胞增殖活性高于对照组,结果有统计学差异(P<0.05,见图1)。
2.2NE促进RKO细胞迁移
划痕实验结果显示,10 μmol/L NE促进细胞迁移(见图2)。
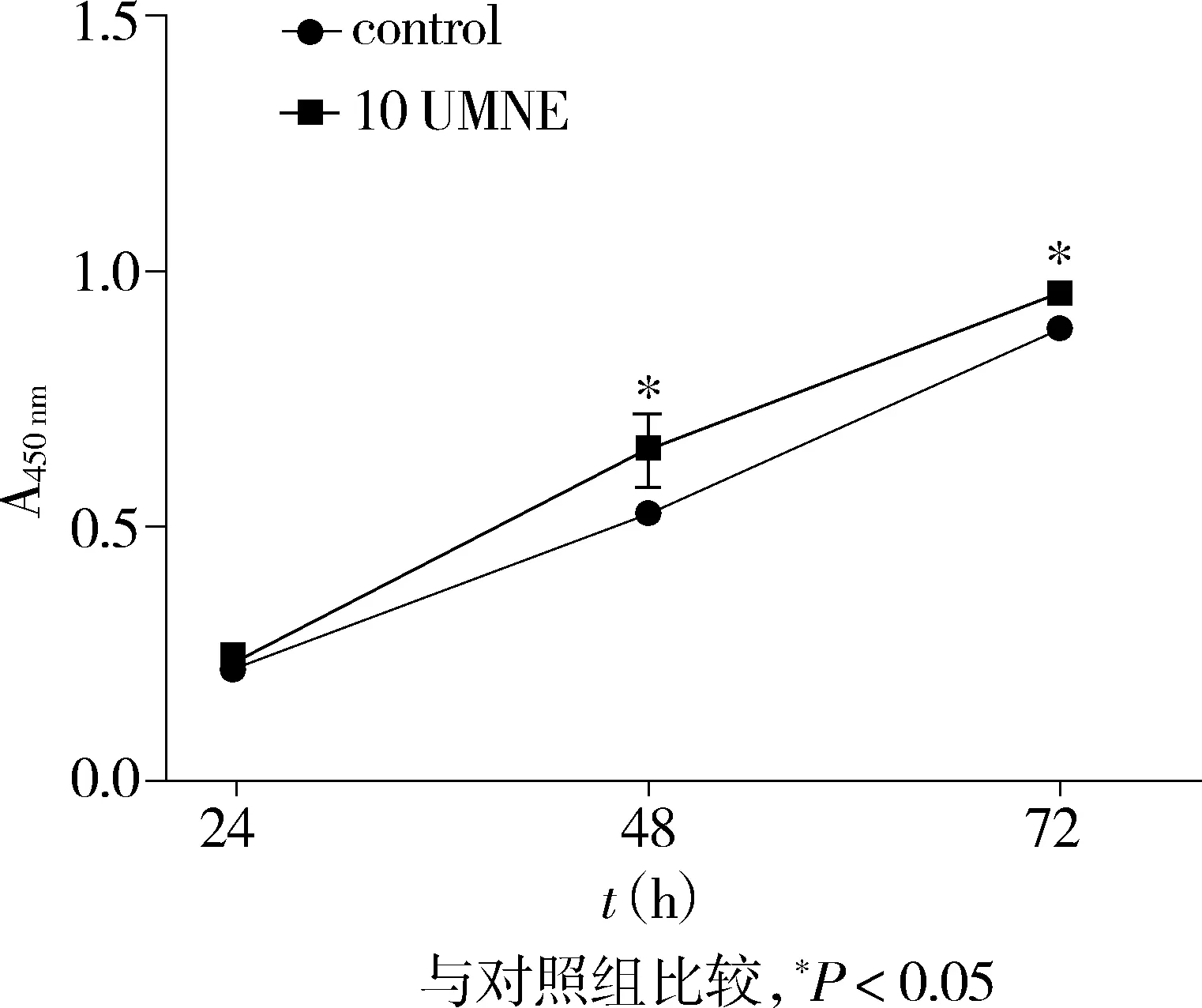
图1 NE对RKO细胞增殖的影响 Figure 1 Effects of NE on RKO proliferation
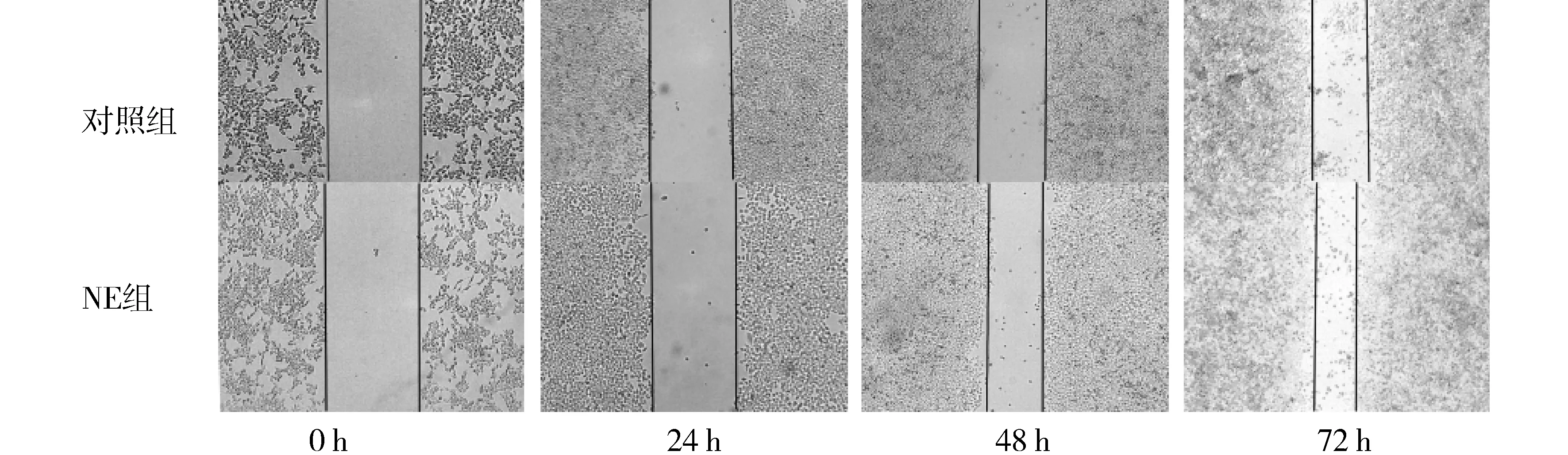
图2 NE对RKO细胞迁移的影响Figure 2 Effects of NE on RKO cells migration
2.3NE对RKO细胞周期的影响
流式细胞仪检测细胞周期发现,处理组细胞的S期比例上升(P<0.05),G2期比例上升(见图3)。
2.4NE使RKO细胞miR-373-3p表达量上调
RT-PCR结果显示,处理组的细胞miR-373-3p的表达量上升,结果有统计学差异(P<0.05,见图4)。
2.5si-miR-373-3p抑制RKO细胞增殖
si-miR-373-3p组细胞与阴性对照组细胞相比较,增殖活力下降(P<0.05),si-miR-373-3p+NE组细胞增殖活力与阳性对照组相比显著下降(P<0.05)。RT-PCR结果显示,转染si-miR-373-3p后细胞中miR-373-3p表达量显著下调(P<0.05,见图5)。
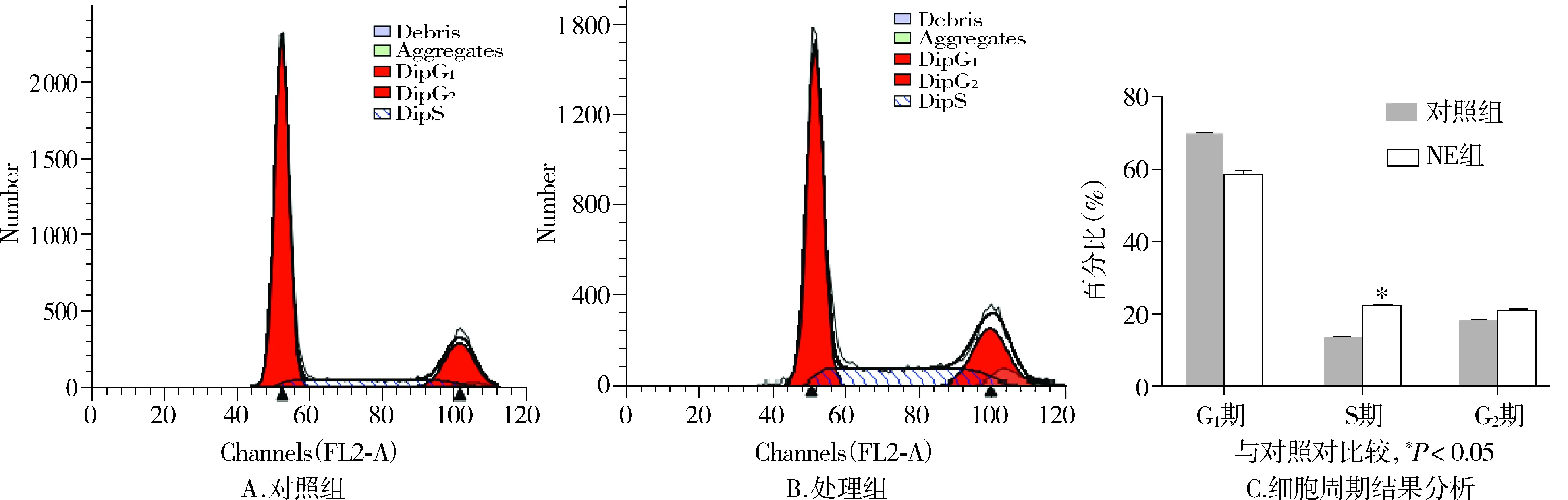
图3 NE对RKO细胞周期的影响Figure 3 Effects of NE on cells cycle distribution
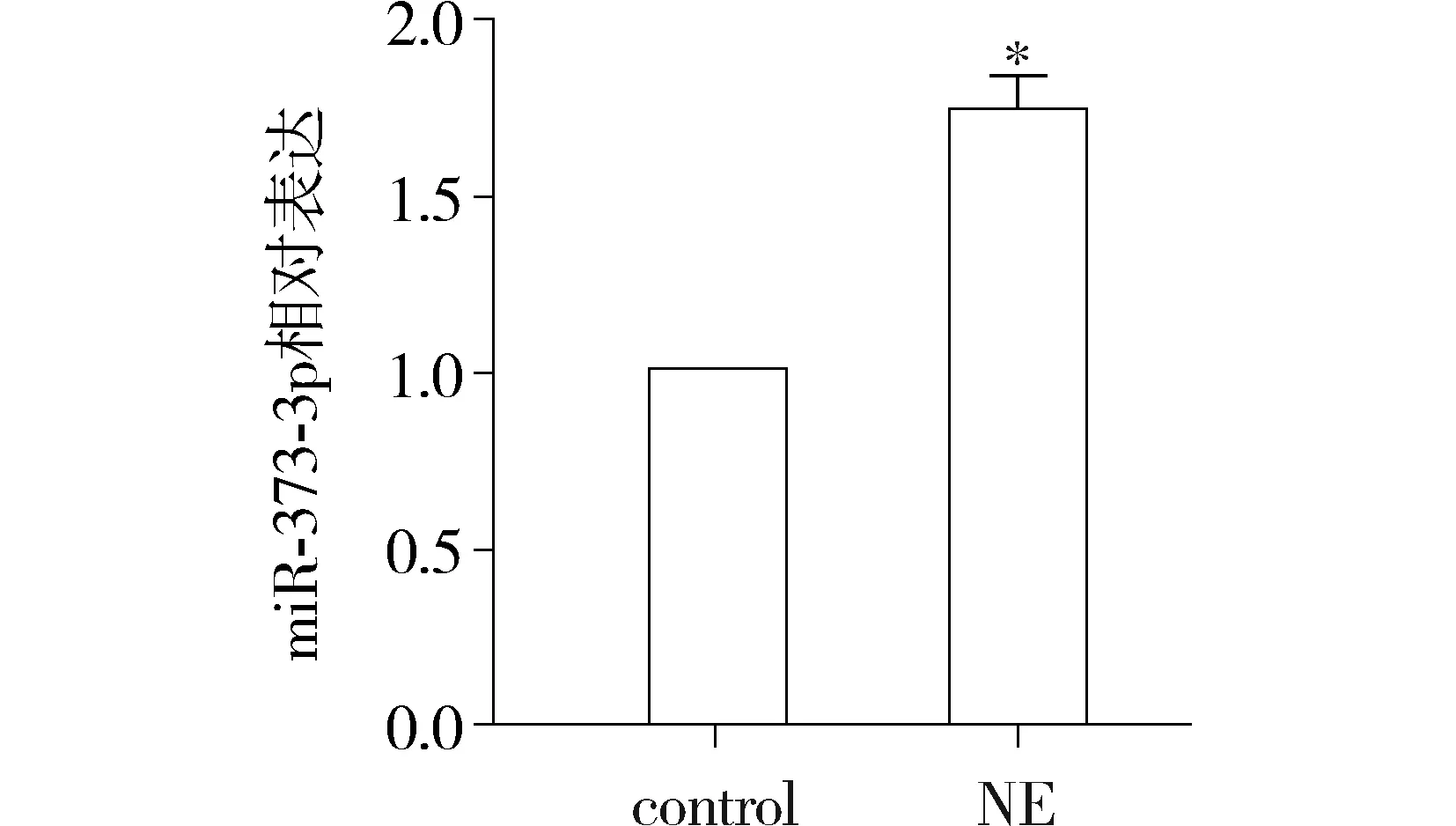
与对照组比较,*P<0.05图4 NE对miR-373-3p表达量的影响Figure 4 Effects of NE on miR-373-3p expression in RKO cells
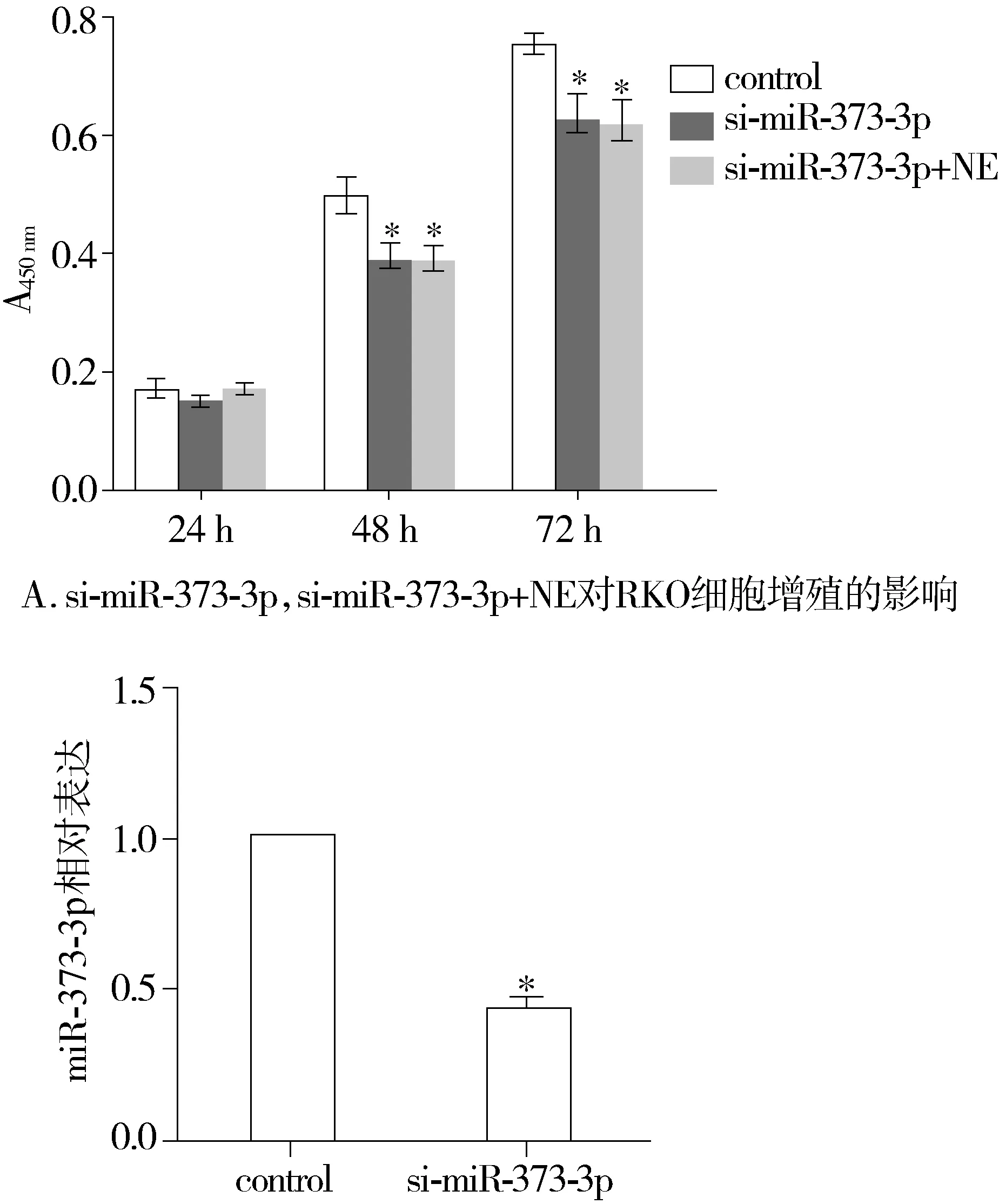
B. 转染si-miR-373-3p后miR-373-3p的表达量与对照组比较,*P<0.05图5 si-miR-373-3p,si-miR-373-3p+NE对RKO细胞增殖的影响Figure 5 Effects of si-miR-373-3p,si-miR-373-3p+NE on RKO cells proliferation
3讨论
随着医学模式的改变,精神应激与疾病的关系越来越引起人们的注意。精神应激是指机体在各种内外界环境及社会、心理因素刺激下所表现出的全身性非特异性反应。面临精神应激时,机体的所有器官最终都会发生改变,但神经内分泌系统的改变是其他器官功能改变的先导和基础。应激状态下的神经内分泌变化错综复杂,但主要包括肾素-血管紧张素和HPA轴的激活,儿茶酚胺类物质(肾上腺素和去甲肾上腺素)的增加是非常典型的表现之一[8]。去甲肾上腺素作为重要的神经递质,其在癌症发展中的作用受到越来越多的研究。Fitzgerald等[9]和Pai等[10]的文章均发现,使用去甲肾上腺素削弱药品的病人,其癌症发生率下降,这提示去甲肾上腺素浓度升高可能是癌症发生发展的原因之一。我们的实验发现,去甲肾上腺素可以促进结肠癌细胞的体外增殖,划痕实验显示去甲肾上腺素促进了RKO细胞的迁移,这与Shan等[11]在胃癌中的研究结果一致。细胞周期分析显示处理组细胞S期和G2期均上升,说明其促进DNA合成,加速了细胞分裂过程。进一步证明去甲肾上腺素具有促进RKO细胞体外增殖的功能。然而,其促进细胞增殖的具体机制并不明确。
去甲肾上腺素与细胞膜上的β2受体结合后,通过G蛋白偶联受体,引起cAMP浓度上升,激活cAMP依赖性蛋白激酶PKA,导致其下游的蛋白磷酸化,调节细胞的各项功能[12]。CREB作为重要的转录因子,被PKA激活后,进入胞核内,引起目的基因转录水平的改变。Zhang等[13]的研究发现,CREB可以调控miR-373的表达,引起其下游基因TP53INP1,CD44等的表达量改变。据此,我们推测miR-373可能是去甲肾上腺素诱导的RKO细胞体外增殖的调控机制之一。
miR-373位于第19号染色体上,是miR-371-373家族中的一员,其与肿瘤发生发展的关系较为复杂,在不同的肿瘤中,其表达情况不尽相同,但在大部分肿瘤中,其与癌症的发生发展是正相关的[14]。通过实时定量PCR,我们发现在处理组细胞中miR-373-3p的表达量显著上调,初步说明miR-373-3p可能参与了去甲肾上腺素促进的RKO细胞增殖的过程。为了进一步确认miR-373-3p的作用,我们设计了miR-373-3p的抑制剂,将其转染到细胞中,结果表明,抑制剂组的细胞,其增殖活性明显下降。对转染过抑制剂的细胞,去甲肾上腺素不再促进其细胞增殖。为了确保抑制效率,我们对转染si-miR-373-3p的细胞进行了总RNA抽提和RT-PCR验证,发现其miR-373-3p表达量显著下调,说明抑制剂设计合理。这些结果表明,miR-373-3p的确参与了由去甲肾上腺素诱导的结肠癌细胞的增殖。
综上所述,去甲肾上腺素能够促进结肠癌细胞RKO的体外增殖,且在其调控过程中有miR-373-3p的参与。我们推测miR-373-3p可能通过去甲肾上腺素-β2受体-cAMP-CREB-miR-373-3p-目的基因的通路,在RKO细胞的增殖过程中起到调控作用。这将在后续的实验中深入研究,同时也将为癌症的靶向治疗提供新思路。
参考文献:
[1]Stintzing S.Management of colorectal cancer[J].F1000Prime Rep,2014,6:108.
[2]Pu J,Bai D,Yang X,etal.Adrenaline promotes cell proliferation and increases chemoresistance in colon cancer HT29 cells through induction of miR-155[J].Biochem Biophys Res Commun,2012,428:210-215.
[3]Yang R,Lin Q,Gao HB,etal.Stress-related hormone norepinephrine induces interleukin-6 expression in GES-1 cells[J].Braz J Med Biol Res,2014,47:101-109.
[4]Stock AM,Powe DG,Hahn SA,etal.Norepinephrine inhibits the migratory activity of pancreatic cancer cells[J].Exp Cell Res,2013,319:1744-1758.
[5]Okamura K,Phillips MD,Tyler DM,etal.The regulatory activity of microRNA* species has substantial influence on microRNA and 3′ UTR evolution[J].Nat Struct Mol Biol,2008,15:354-363.
[6]Wang LQ,Zhang Y,Yan H,etal.MicroRNA-373 functions as an oncogene and targets YOD1 gene in cervical cancer[J].Biochem Biophys Res Commun,2015,459:515-520.
[7]Seol HS,Akiyama Y,Shimada S,etal.Epigenetic silencing of microRNA-373 to epithelial-mesenchymal transition in non-small cell lung cancer through IRAK2 and LAMP1 axes[J].Cancer Lett,2014,353:232-241.
[8]Eng JW,Kokolus KM,Reed CB,etal.A nervous tumor microenvironment: the impact of adrenergic stress on cancer cells,immunosuppression,and immunotherapeutic response[J].Cancer Immunol Immunother,2014,63:1115-1128.
[9]Fitzgerald PJ.Is norepinephrine an etiological factor in some types of cancer[J].Int J Cancer,2009,124:257-263.
[10]Pai PY,Hsieh VC,Wang CB,etal.Long term antihypertensive drug use and prostate cancer risk:A 9-year population-based cohort analysis[J].Int J Cardiol,2015,193:1-7.
[11]Shan T,Cui X,Li W,etal.Novel regulatory program for norepinephrine-induced epithelial-mesenchymal transition in gastric adenocarcinoma cell lines[J].Cancer Sci,2014,105:847-856.
[12]Siddiq MM,Hannila SS.Looking downstream:the role of cyclic AMP-regulated genes in axonal regeneration[J].Front Mol Neurosci,2015,8:26-32.
[13]Zhang Y,Yang J,Cui X,etal.A novel epigenetic CREB-miR-373 axis mediates ZIP4-induced pancreatic cancer growth[J].EMBO Mol Med,2013,5:1322-1334.
[14]Wei F,Cao C,Xu X,etal.Diverse functions of miR-373 in cancer[J].J Transl Med,2015,13:162-170.
The miR-373-3p participated in the regulation of norepinephrine(NE) on RKO proliferationinvitro
MA Ruili1,2, HAN Jia1, HOU Ni1, HUANG Chen1,3*
(1DepartmentofCellBiologyandGenetic,Xi’anJiaotongUniversityschoolofMedicine,Xi’an710061,China;2CollegeofBasicMedicalScience,Xi’anMedicalUniversity;3CardiovascularResearchCenter,Xi’anJiaotonguniversityschoolofMedicine;*Correspondingauthor,E-mail:hchen@mail.xjtu.edu.cn)
Abstract:ObjectiveTo confirm whether miR-373-3p was involved in the regulation of norepinephrine(NE) on RKO proliferation in vitro. MethodsRKO cells were divided into NE group and control group. RKO cells were cultured in medium containing final concentration of 10 μmol/L NE in NE group and normal medium in control group. Cell proliferation was measured by MTT. Wound healing was used to observe the migration ability. Flow cytometry was adopted to analyze the change of cell cycle distribution. The level of miR-373-3p was detected by real-time PCR. The si-miR-373-3p was synthesized and then transfected into cells to observe its effect on cell proliferation. SPSS22.0 was chosen to analyze the data,and P<0.05 was considered as statistically significant difference.ResultsThe 10 μmol/L NE promoted proliferation(P<0.05) and migration ability of RKO cells in vitro. In NE group, the percentage of S phase and G2 phase cells were higher than in control group, and the relative expression of miR-373-3p was up-regulated(P<0.05). The si-miR-373-3p caused a decline of cell proliferation(P<0.05). NE didn’t promote the proliferation of RKO cells after transfected with si-miR-373-3p.ConclusionThe miR-373-3p may participate in the regulation of NE on RKO cells proliferation in vitro.
Key words:norepinephrine(NE);colorectal cancer;cell proliferation;miR-373-3p
基金项目:国家自然科学基金青年基金资助项目(31100969)
作者简介:马瑞丽,女,1985-05生,本科,助理实验师,E-mail:mary3578@163.com
收稿日期:2016-03-03
中图分类号:R735.35
文献标志码:A
文章编号:1007-6611(2016)05-0429-05
DOI:10.13753/j.issn.1007-6611.2016.05.007

