茶氨酸对全脑缺血再灌注大鼠JNK信号通路与DNA修复的影响
王 宁, 吕建瑞, 张珍妮, 薛荣亮
(西安交通大学医学院第二附属医院麻醉科,西安 710004;*通讯作者,E-mail:xuerl@china.com)
茶氨酸对全脑缺血再灌注大鼠JNK信号通路与DNA修复的影响
王宁, 吕建瑞, 张珍妮, 薛荣亮*
(西安交通大学医学院第二附属医院麻醉科,西安710004;*通讯作者,E-mail:xuerl@china.com)
摘要:目的探讨茶氨酸在大鼠全脑缺血再灌注过程中对c-Jun氨基末端激酶(c-Jun N-terminal kinases,JNK)信号通路与DNA修复的作用。方法15周龄雄性SD大鼠108只,随机均分为假手术组(SH组)、缺血再灌注组(IR组)和茶氨酸组(TH组)。每组根据再灌注时间分为2,6,12,24,48,72 h 6个亚组,每亚组6只。采用4-VO法建立SD大鼠全脑缺血模型,在预定时间点行灌注固定取脑、石蜡包埋切片,光镜下计数CA1区存活细胞,TUNEL法检测CA1区凋亡细胞,免疫组化检测p-JNK和DNA修复蛋白X线修复交叉互补蛋白1(X-ray repair cross complementing protein l,XRCC1)的表达变化。结果脑缺血再灌注后海马CA1区神经元存活数目TH组明显高于IR组(P<0.01),凋亡细胞数目显著低于IR组(P<0.01)。海马CA1区p-JNK在IR组有明显表达,24 h达到高峰;TH组p-JNK的表达明显低于IR组(P<0.05)。SH组XRCC1表达量较强,IR组XRCC1的表达量下降(P<0.01)。TH组XRCC1表达量高于IR组(P<0.05)。 结论在大鼠全脑缺血再灌注损伤过程中,JNK信号通路与DNA修复蛋白XRCC1有一定关联。JNK通路的激活在直接导致细胞损伤凋亡的同时,很可能也是DNA修复功能受伤的原因之一。茶氨酸则通过抑制JNK信号通路上调DNA修复蛋白XRCC1的表达发挥其神经保护作用。
关键词:脑缺血再灌注损伤;茶氨酸;细胞凋亡;c-Jun氨基末端激酶;DNA修复蛋白
脑缺血卒中、心脏骤停等疾病严重危害着人类健康,脑缺血再灌注损伤是此类疾病的主要病理生理过程,探寻对脑缺血再灌注损伤有效的预防和治疗的方法及药物一直是临床研究方向。近年来茶氨酸对神经损伤的保护作用受到了越来越多的关注[1],但其对脑缺血再灌注损伤过程中的神经细胞凋亡和DNA修复功能的保护作用及机制目前尚不清楚。DNA修复蛋白X线修复交叉互补蛋白1(X-ray repair cross complementing protein l,XRCC1)是参与哺乳动物DNA的修复,在碱基切除修复中起整体作用,与DNA连接酶Ⅲ、DNA多聚酶β及PARA形成复合物修复一系列内外氧化剂导致的DNA单链断裂和碱基损伤。脑缺血再灌注时,脑细胞氧供和能量代谢受到干扰,DNA的修复功能亦受到损伤,导致细胞凋亡[2]。在生物体内,丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)超家族广泛分布于细胞浆内,是细胞外与细胞内的信号转导的交汇点。c-Jun氨基末端激酶(c-Jun N-terminal kinases,JNKs)是MAPK家族成员之一,被激活后迅速转位入核,激活活化转录因子c-Jun、 AP-1、JunB、JunD、ATF-2、ELK-1等的转录活性,活化的转录因子与顺式作用元件相结合,引起大量与凋亡有关的基因表达,与细胞延迟性死亡关系密切[3]。本实验采用大鼠全脑缺血再灌注模型,应用组织病理学、TUNEL法凋亡细胞检测、免疫组织化学等方法探讨茶氨酸对JNK信号通路与DNA修复蛋白XRCC1表达的影响及相互关系。
1材料与方法
1.1主要实验试剂
p-JNK抗体(购自美国Cell Signal公司),XRCC1抗体(购自美国Santa Cruz公司),原位末端细胞凋亡POD检测试剂盒(购自中国华美公司),DAB(购自北京中山试剂公司),戊巴比妥钠(购自西安)。DMSO(购自美国Santa Cruz公司)。
1.2动物分组
15周龄雄性SD大鼠,体重290-310 g,由西安交通大学医学院实验动物中心提供。术前在20-25 ℃环境中饲养1周,术前夜禁食,随意进水。随机分为:假手术组(SH组)、缺血再灌注组(IR组)和茶氨酸组(TH组)。每组根据再灌注时间不同再分为2,6,12,24,48,72 h 6个亚组,每亚组6只动物。
1.3模型制作
采用4-VO法[4]建立SD大鼠全脑缺血再灌注损伤模型。1%戊巴比妥钠40 mg/kg对大鼠腹腔注射施行麻醉(所有动物麻醉均与此相同),仰卧位固定,颈前正中切口,分离双侧颈总动脉,穿线留置备用,缝合颈部切口。改俯卧位固定,颈后正中切口,逐层分离肌肉,暴露第一颈椎翼小孔,用烧红的探针插入翼小孔,烧灼双侧椎动脉,使之永久闭塞。放回鼠笼。术后第2日,麻醉后仰卧位固定,剪开切口缝线,沿昨日留置线再次游离暴露双侧颈总动脉,予以微动脉夹夹闭6 min,松开微动脉夹恢复脑血流。颈总动脉夹闭2 min内瞳孔不散大者弃之。SH组仅游离暴露双侧颈总动脉,不予微动脉夹夹闭。三组动物在夹闭双侧颈总动脉前4 h分别尾静脉注射0.9%NaCl,0.9%NaCl和25%茶氨酸(茶氨酸溶于0.9%NaCl),4 ml/kg,药物在5 min内注完。
1.4组织学观察神经元形态及数目
在预定时间点,1%戊巴比妥钠40 mg/kg对大鼠腹腔注射施行麻醉,开胸,经升主动脉依次灌注0.1 mol/L磷酸盐缓冲液(PBS)100 ml和4%多聚甲醛300 ml固定,取脑。取视交叉后1-4 mm脑块进行石蜡包埋,冠状面切片,切片厚5 μm。切片行HE染色,在400倍光镜下计数CA1区中段100单位长度内存活神经元数目。
1.5TUNEL染色检测凋亡细胞
取海马冠状石蜡切片,常规二甲苯、乙醇脱蜡至水。蛋白酶K(20 mg/L)室温消化,用甲醇配制的3%过氧化氢消除内源性辣根过氧化酶活性,加末端脱氧核糖核酸转移酶(TdT)与地高辛标记的dUTP混合反应进行孵育,再加辣根过氧化物酶标记的抗地高辛抗体进行孵育,用DAB显色,核呈深棕黄色者为凋亡细胞,最后复染、脱水、透明、封片。在400倍光镜下计数海马CA1区中段100单位长度内TUNEL染色阳性细胞数目。
1.6免疫组织化学检测p-JNK和XRCC1表达水平
取海马冠状石蜡切片,采用SABC法行免疫组化法。p-JNK多抗及XRCC1多抗稀释度分别为1∶100,1∶100。切片依次脱蜡至水,3%过氧化氢孵育10 min,三蒸水冲洗5 min。PBS(pH 7.4)浸泡5 min,电炉水浴抗原修复,加热至95 ℃ 15-20 min后,自然冷却至室温。滴加正常山羊封闭血清,室温孵育1 h,侵去勿洗。滴加1∶100的p-JNK多抗及1∶100的XRCC1多抗,放入4 ℃冰箱过夜。PBS冲洗5 min 3次,擦干切片周围水分后,滴加生物素标记的二抗,37 ℃温箱孵育1 h,PBS冲洗5 min 3次,擦干切片周围水分后,滴加辣根酶标记链霉卵白素工作液,放入37 ℃温箱孵育20 min。三蒸水洗5 min 3次,DAB显色,脱水、透明、封片。采用Leica Qwin图像处理与分析系统进行图像分析。每张切片取CA1区中1/3段测量平均灰度值代表p-JNK、XRCC1的表达水平,p-JNK、XRCC1的表达强弱与灰度值成反比。
1.7统计学分析
2结果
2.1海马CA1区神经元形态及数目变化
SH组HE染色,海马CA1区神经元细胞3-4层,排列紧密、整齐,细胞质呈淡红色,细胞核呈蓝黑色,高倍镜下细胞核大而圆,有1-2个核仁;IR组HE染色,海马CA1区神经元细胞失去正常结构,排列紊乱,细胞核皱缩或染色质边聚,可见凋亡小体,细胞数量较SH组减少(P<0.01);TH组海马CA1区存活神经元细胞数目较IR组明显增加(P<0.01,见表1)。再灌注2,6,12,24,48,72 h细胞计数IR组分别为SH组的97%,92%,89%,70%,52%,42%,而TH组再灌注24,48,72 h细胞计数分别为IR组的130%,167%和199%。
2.2海马CA1区凋亡细胞变化
TUNEL法检测,SH组凋亡细胞极少;IR组凋亡细胞于再灌注6 h开始增多, 24 h凋亡细胞数目明显增加,48 h达到高峰;TH组凋亡细胞各时点较IR组明显减少(P<0.01, 见表2)。
2.3海马CA1区p-JNK和XRCC1免疫组化表达情况
SH组p-JNK表达量很低,IR组p-JNK的表达2 h时即明显升高,6 h时略有降低,后逐渐上升,24 h到高峰,之后表达量减降,与SH组比较有显著性差异(P<0.01)。TH组p-JNK的表达受到抑制,各时点与IR组比较均有显著性差异(P<0.05, 见表3)。

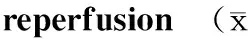

组别n2h6h12h24h48h72hSH组634.18±8.2737.00±9.9633.07±7.9234.42±6.9535.70±6.7832.33±4.12IR组632.05±5.9734.18±6.76★29.06±3.54★24.10±7.65★18.22±4.78★13.28±8.28★TH组633.78±8.1635.67±4.9731.59±5.41▲31.22±7.46▲30.54±8.31▲26.53±6.48▲
与SH组相比,★P<0.01;与IR组相比,▲P<0.01
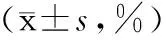
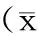

组别n2h6h12h24h48h72hSH组61.22±0.531.61±0.631.63±0.541.58±0.722.01±0.511.74±0.47IR组62.65±0.4916.41±3.18★25.77±5.91★56.54±4.84★48.42±7.16★31.59±4.92★TH组61.89±0.549.18±2.35▲14.00±1.89▲20.36±4.63▲16.69±2.76▲11.44±3.40▲
与SH组相比,★P<0.01;与IR组相比,▲P<0.01

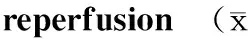

组别n2h6h12h24h48h72hSH组6192.47±3.26193.39±3.62196.76±3.85194.59±5.03196.33±3.79189.71±6.35IR组6163.54±3.76★187.58±4.80★150.49±4.67★132.28±4.83★145.61±4.48★159.79±5.59★TH组6183.46±2.57▲182.59±5.39▲178.82±5.39▲170.18±3.26▲166.81±4.37▲165.89±4.95▲
与SH组相比,★P<0.01;与IR组相比,▲P<0.05
SH组XRCC1表达量较强,IR组XRCC1的表达与SH组比较有统计学差异(P<0.01),2 h即已开始下降。TH组XRCC1表达量的降低则不明显,各时点与IR组比较均有显著性差异(P<0.05,见表4)。
3讨论
XRCC1是编码碱基损伤修复联合序列的一种重要蛋白[5],在碱基切除修复中起整体作用,脑缺血再灌注中大量DNA单链断裂和细胞调亡相关,一过性局灶脑缺血10 min,XRCC1开始衰减,持续至再灌注后24 h[6],免疫组化和TUNEL双标显示XRCC1免疫活性丧失的神经元变为TUNEL染色阳性,表明XRCC1早期降低先于DNA断裂的发生[7],XRCC1早期降低是DNA单链断裂无法修复的机制之一[8]。本实验采用大鼠全脑缺血再灌注模型,IR组XRCC1的表达随再灌注时间亦呈衰减趋势。JNK信号通路在细胞受到胁迫性刺激而发生凋亡的过程中发挥重要的作用。对其促调亡可能与上调促调亡蛋白的表达(p53、c-Myc、bax等)、作用于Bcl-2家族进而调控线粒体促进细胞色素酶的释放[9,10]等有关。本实验中IR组JNK的表达增加,凋亡细胞数目增多,再次证实了JNK的促凋亡作用。本课题组先前实验中通过JNK信号通路抑制剂SP600125明显抑制大鼠6 min全脑缺血后再灌注各时点JNK的表达,进而减轻了海马CA1区神经元损伤,抑制了凋亡细胞的产生,与此同时,也明显抑制了XRCC1在再灌注各时点的衰减,提示JNK可使全脑缺血再灌注大鼠海马神经元DNA修复功能受损,导致细胞凋亡,其机制可能与下调DNA修复蛋白XRCCl的表达有关[11]。

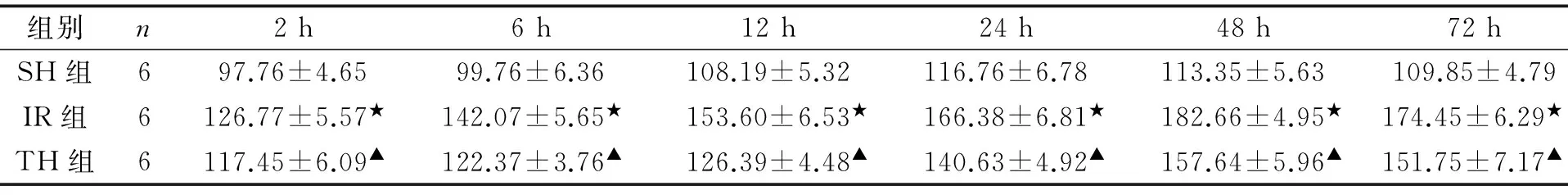
组别n2h6h12h24h48h72hSH组697.76±4.6599.76±6.36108.19±5.32116.76±6.78113.35±5.63109.85±4.79IR组6126.77±5.57★142.07±5.65★153.60±6.53★166.38±6.81★182.66±4.95★174.45±6.29★TH组6117.45±6.09▲122.37±3.76▲126.39±4.48▲140.63±4.92▲157.64±5.96▲151.75±7.17▲
与SH组相比,★P<0.01;与IR组相比,▲P<0.01
茶氨酸是茶叶中的一种独特成分,其作为食品添加剂已广泛使用,具有良好的安全性、稳定性,且摄入量不受限制。目前越来越多的研究表明茶氨酸对神经系统有保护作用[12],其可减小缺血再灌注之后的脑梗死面积[13],其可同时作用于阳离子门控通道的离子型谷氨酸受体和G-蛋白偶联的谷氨酸代谢型受体,直接拮抗谷氨酸对培养的神经细胞的兴奋性毒性[14],可抑制谷氨酰胺在神经元和星形胶质细胞之间的传递[15],维持谷氨酸、谷氨酸盐焦谷氨酸及γ-氨基丁酸的代谢平衡[16],还有实验证明其可提高幼鼠在神经发育成熟过程中神经营养因子和神经递质的合成[17],但具体机制尚未完全明确。在本实验中,茶氨酸减轻了全脑缺血再灌注引起的海马CA1区神经元损伤,抑制了凋亡细胞的产生。与此同时,茶氨酸明显抑制了p-JNK在再灌注各时点的表达,并上调了XRCC1的表达,JNK与XRCC1的表达趋势与我们前期实验结果相一致。由此推论,在大鼠全脑缺血再灌注损伤过程中,茶氨酸可能作用于JNK信号通路抑制JNK信号通路的激活,减少XRCC1的下调,维持并促进DNA修复功能,进而抑制神经元凋亡和损伤来发挥其神经保护作用的。
综上所述,茶氨酸对全脑缺血再灌注海马CA1区神经元损伤及凋亡具有保护作用,抑制JNK凋亡通路并维持DNA修复功能可能是其机制之一,为茶氨酸作为神经保护剂的潜在研发工作提供了一定的理论依据。
参考文献:
[1]Egashira N,Ishigami N,Pu F,etal.Theanine prevents memory impairment induced by repeated cerebral ischemia in rats[J].Phytother Res,2008,22(1):65-68.
[2]Ghosh S,Canugovi C,Yoon JS,etal.Partial loss of the DNA repair scaffolding protein,XRCC1,results in increased brain damage and reduced recovery from ischemic stroke in mice[J].Neurobiol Aging,2015,36(7):2319-2330.
[3]Reddy CE,Albanito L,De Marco P,etal.Multisite phosphorylation of c-Jun at threonine 91/93/95 triggers the onset of c-Jun pro-apoptotic activity in cerebellar granule neurons[J].Cell Death Dis,2013,4:e852.
[4]Pulsinelli WA,Brierley JB.A new model of bilateral hemispheric ischemia in the unanesthetized rat[J].Stroke,1979,10(3):267-272.
[5]Thacker J,Zdzienicka MZ.The mammalian XRCC genes:their roles in DNA repair and genetic stability[J].DNA Repair(Amst),2003,2(6):655-672.
[6]Caldecott KW.XRCC1 and DNA strand break repair[J].DNA Repair(Amst),2003,2(9):955-969.
[7]Fujimura M,Morita-Fujimura Y,Kawase M,etal.Early decrease of apurinic/apyrimtidinic endonuclease expression after transient focal cerebral ischemia in mice[J].J Cereb Blood Flow Metab,1999,19(5):459-501.
[8]方传勤,周华东,高长越,等.XRCC1与脑缺血再灌注DNA单链断裂[J].武警医学,2004,15(8):595-598.
[9]Tournier C,Hess P,Yang DD,etal.Requirement of JNK for stress-induced activation of the cytochrome c-mediated death pathway[J].Science,2000,288(5467):870-874.
[10]Okuno S,Saito A,Hayashi T,etal.The c-Jun N-terminal protein kinase signaling pathway mediates Bax activation and subsequent neuronal apoptosis through interaction with Bim after transient focal cerebral ischemia[J].J Neurosci,2004,24(36):7879-7887.
[11]王宁,薛荣亮,姚凤珍,等.c-Jun氨基末端激酶在全脑缺血再灌注大鼠海马神经元DNA修复中的作用[J].中华麻醉学杂志,2009,12(27):1110-1113.
[12]Sumathi T,Shobana C,Thangarajeswari M,etal.Protective effect of L-Theanine against aluminium induced neurotoxicity in cerebral cortex,hippocampus and cerebellum of rat brain-histopathological,and biochemical approach[J].Drug Chem Toxicol,2015,38(1):22-31.
[13]Kakuda T.Neuroprotective effects of theanine and its preventive effects on cognitive dysfunction[J].Pharmacol Res,2011,64(2):162-168.
[14]Lee J,Jo DG,Park D,etal.Adaptive cellular stress pathways as therapeutic targets of dietary phytochemicals:focus on the nervous system[J].Pharmacol Rev,2014,66(3):815-868.
[15]Ogura M,Kakuda T,Takarada T,etal.Promotion of both proliferation and neuronal differentiation in pluripotent P19 cells with stable overexpression of the glutamine transporter slc38a1[J].PLoS One,2012,7(10):e48270.
[16]Inoue K,Miyazaki Y,Unno K,etal.Stable isotope dilution HILIC-MS/MS method for accurate quantification of glutamic acid,glutamine,pyroglutamic acid,GABA and theanine in mouse brain tissues[J].Biomed Chromatogr,2016,30(1):55-61.
[17]Yamada T,Terashima T,Wada K,etal.r-glutamylethylamide,increases neurotransmission concentrations and neu-rotrophin mRNA levels in the brain during lactation[J].Life Sci,2007,81(16):1247-1255.
Effect of theanine on JNK signaling pathway and DNA repair in global brain ischemia/reperfusion rats
WANG Ning, LÜ Jianrui, ZHANG Zhenni, XUE Rongliang*
(DepartmentofAnesthesiology,SecondAffiliatedHospitalofMedicalCollege,Xi’anJiaotongUniversity,Xi’an710004,China;*Correspondingauthor,E-mail:xuerl@china.com)
Abstract:ObjectiveTo explore the effect of theanine on c-Jun N-terminal kinase(JNK) signaling pathway and DNA repair in global brain ischemia/reperfusion rats.MethodsOne hundred and eight 15-week-old SD rats were randomly divided into sham operation group, ischemia-reperfusion(IR) group and theanine group. Each group was divided into 6 subgroups according to reperfusion time: 2, 6, 12, 24, 48, 72 h groups.Transient global brain ischemia was induced by four-vessel occlusion, and the rats were perfusion-fixed at specified time points after reperfusion. The brains were removed, embedded and sliced up. The numbers of survival cells and apoptotic cells in hippocampal CA1 region were counted respectively by histochemistry and TUNEL,and the activities of p-JNK and X-ray repair cross complementing protein l(XRCC1) were detected by immunohistochemistry.ResultsIn theanine group, the number of survival cells in hippocampal CA1 region was significantly higher than that in IR group(P<0.01), and the number of apoptotic cells was lower than that in IR group(P<0.01). The p-JNK in IR group was markedly expressed in CA1 region, and the expression reached the peak at 24 h after reperfusion. The level of p-JNK in theanine group was significantly lower than that in IR group(P<0.05). The XRCC1 was markedly expressed in sham group, whereas the expression decreased in IR group(P<0.01), and the level of XRCC1 in theanine group was higher than that in IR group(P<0.05).ConclusionThere is a certain relationship between JNK signaling pathway and DNA repair protein XRCC1 during global brain ischemia-reperfusion injury. The activation of the JNK signaling pathway may be one of the reasons of the damages of DNA repair protein function during the induction of cell apoptosis. Theanine may play its neuroprotection by inhibiting JNK signaling pathway and up-regulating the expression of DNA repair protein XRCC1.
Key words:brain ischemia/reperfusion injury;theanine;apoptosis;JNK;DNA repair protein
基金项目:国家自然科学基金资助项目(81071070)
作者简介:王宁,女,1983-04生,硕士,主治医师,E-mail:wangningcare@163.com
收稿日期:2016-02-25
中图分类号:R363
文献标志码:A
文章编号:1007-6611(2016)05-0415-04
DOI:10.13753/j.issn.1007-6611.2016.05.004

