比索洛尔对心衰大鼠心室肌细胞内向整流钾电流的影响
王建丽, 马爱群, 王 贺, 王亭忠, 韩 克
(1成都市第六人民医院心血管内科,成都 610051; 2西安交通大学医学院第一附属医院心血管内科,教育部环境与疾病相关基因重点实验室,西安 710061; *通讯作者,E-mail:maaiqun@medmail.com.cn)
比索洛尔对心衰大鼠心室肌细胞内向整流钾电流的影响
王建丽1,2, 马爱群2*, 王贺2, 王亭忠2, 韩克2
(1成都市第六人民医院心血管内科,成都610051;2西安交通大学医学院第一附属医院心血管内科,教育部环境与疾病相关基因重点实验室,西安710061;*通讯作者,E-mail:maaiqun@medmail.com.cn)
摘要:目的观察比索洛尔对容量超负荷心衰大鼠左室心肌细胞内向整流钾电流(IK1)的影响。方法成年雄性SD大鼠(180-200 g)随机分为假手术组、心衰组和比索洛尔干预组,采用腹主动脉-下腔静脉穿刺造瘘法制作容量超负荷心衰模型。术后8周,比索洛尔干预组给予比索洛尔(1 mg/kg,1次/d)灌胃,干预4周后,检测血清脑钠肽(BNP)及超声心动图以评价心功能。急性酶解法分离大鼠左室心肌细胞,采用全细胞膜片钳技术记录动作电位及IK1电流,并绘制I-V曲线。结果心衰组与假手术组大鼠比较,心功能明显下降,血清BNP水平(pmol/L)明显升高(1 562.89±153.26 vs 225.57±63.62,P<0.01),动作电位时程(APD,ms)延长(APD90:324.85±21.66 vs 137.80±15.24,P<0.01),IK1电流密度减小(-140 mV:-23.20±2.10 vs-35.55±2.78,P<0.01)。比索洛尔干预可明显改善心功能,缩短APD,增加IK1电流密度(-140 mV:-27.16±2.62 vs-23.20±2.10,P<0.01)。结论比索洛尔干预可改善慢性心衰大鼠的心功能,增加IK1电流密度。
关键词:比索洛尔;心力衰竭;内向整流钾电流;大鼠
慢性心力衰竭是大多数心血管疾病的终末阶段,其中35%-50%发生恶性心律失常乃至猝死[1]。慢性心力衰竭发生过程中存在心肌结构重构与心电重构,相关离子通道的异常是心电重构的分子基础,与恶性心律失常的发生密切相关[2],其中最主要的电生理变化是心肌细胞动作电位时程(action potential duration,APD)延长,外向钾电流减少或内向钠电流增加[3]均可导致APD延长,主要外向钾电流包括内向整流钾电流(inward rectifier potassium current,IK1)、瞬时外向钾电流(transient outward potassium current,Ito)和延迟整流钾电流(delayed rectifier potassium curret,IK,包括快速激活成分IKr和缓慢激活成分IKs)[4]。
IK1是心肌最主要的背景外向钾电流,主要参与静息电位的维持和心肌动作电位3期终末的复极[5]。近年来有关慢性心衰时电压依赖性钾电流变化的多项研究中,较为一致的观点是慢性心衰时心室肌细胞的Ito和IKs减小,大多数研究认为IKr无显著变化,IK1在不同研究中结果差异较大[6,7],这些研究结果的差异可能与动物种属、心衰模型、心衰阶段的不同有关。
β-受体阻滞剂是一种非传统离子通道阻断剂,欧洲心脏病学会(ESC)慢性心衰诊疗指南中推荐美托洛尔、比索洛尔、卡维地洛用于慢性心力衰竭的治疗,其中比索洛尔是高选择性β1-受体阻滞剂[8]。CIBIS Ⅰ-Ⅲ(心功能不全比索洛尔研究)是使用比索洛尔治疗慢性心衰的大型多中心随机试验,CIBISⅡ表明比索洛尔能显著降低心衰患者的再住院率、病死率及心源性猝死率[9],这可能与比索洛尔减少恶性心律失常的发生有关,但具体电生理机制不完全清楚。本研究通过建立容量超负荷大鼠心衰模型,观察其左室心肌细胞内向整流钾电流的变化,以及比索洛尔的干预作用,为比索洛尔在慢性心衰治疗方面提供电生理依据。
1材料与方法
1.1实验动物与主要仪器
清洁级健康雄性Sprague-Dawely大鼠(封闭群),体重180-200 g,约8周大(西安交通大学医学院实验动物中心提供,生产许可证:SCXK陕2012-003)。THONOS 2500心脏彩色超声诊断仪(美国惠普公司),BL-420E生物机能实验系统(成都泰盟生物技术有限公司),Axon 700B膜片钳放大器、Digidata 1322A数/模转换系统、pClamp10.0数据采集分析软件(美国Axon公司)。
1.2主要试剂与溶液
脑钠肽(brain natriuretic peptide,BNP)ELISA试剂盒(美国Assay Pro公司),富马酸比索洛尔片(德国默克公司),Ⅱ型胶原酶(美国Worthington公司),牛血清白蛋白(BSA)(美国Sigma公司),其余试剂为国产分析纯级。
含钙台氏液:NaCl 140 mmol/L、KCl 5.4 mmol/L、MgCl21.8 mmol/L、CaCl21.8 mmol/L、葡萄糖10 mmol/L、HEPES 10 mmol/L,NaOH调节pH为7.35-7.40;心肌消化酶液:30 ml无钙台氏液(不包含CaCl2,其余成分与含钙台式液相同)中加入10 mgⅡ型胶原酶、20 mg BSA;心肌细胞储存液(KB液):KCl 25 mmol/L、KH2PO410 mmol/L、MgCl23 mmol/L、Taurine 20 mmol/L、L-谷氨酸 70 mmol/L、EGTA 0.5 mmol/L、HEPES 10 mmol/L、葡萄糖 10 mmol/L,KOH调节pH为7.35-7.40;记录动作电位电极内液:NaCl 10 mmol/L、KCl 143 mmol/L、MgATP 2 mmol/L、EGTA 10 mmol/L、HEPES 10 mmol/L,KOH调节pH为7.30;记录动作电位电极外液为含钙台氏液;记录IK1电极内液:KCl 140 mmol/L、MgCl20.5 mmol/L、EGTA 10 mmol/L、HEPES 5 mmol/L、K2ATP 4 mmol/L,KOH调节pH为7.20;记录IK1电极外液:无钙台式液中加入CaCl21.0 mmol/L、CdCl20.1 mmol/L、4-AP 5.0 mmol/L。
1.3心衰模型建立及心功能评价
大鼠随机分为假手术组(sham operation,SO,n=16)、心衰组(heart failure,HF,n=20)和比索洛尔干预组(bisoprolol,BISO,n=20)。采用腹主动脉-下腔静脉穿刺造瘘法[10]制作容量超负荷心衰模型,假手术组不进行造瘘,其余手术步骤与心衰组相同。术后8周经心脏彩超证实心衰模型建立成功后,比索洛尔干预组给予富马酸比索洛尔灌胃(1 mg/kg,2 ml/只,1次/d),假手术组和心衰组均以等容量去离子水灌胃,干预4周(28 d)后,心脏彩超[11]及BNP检测以评价心功能。
1.4全细胞膜片钳记录动作电位及IK1
戊巴比妥钠(40-50 mg/kg)腹腔注射麻醉大鼠,开胸取出心脏,迅速将升主动脉安装在心脏灌流装置上,以Langendorff法主动脉逆行灌流,先灌流无钙台式液,待心脏内残留血液冲洗干净,心脏颜色变淡后,用心肌消化酶液循环灌流心脏(流速5 ml/min)约15-20 min。待左右心室充分消化,心肌蓬松变软后,用无钙台氏液继续冲灌(流速5 ml/min)12 min洗去酶液,终止反应。剪下心脏,置于氧饱和的KB液中,用眼科剪分出左右心室,剪碎左心室肌并稍加振荡,使心肌细胞进一步分散成单个细胞,用220 μm尼龙网过滤,室温(22-24 ℃)保存备用。
在电流钳“I=Normal或Fast”的模式下给予脉宽5 ms、电流900 pA刺激,在1 Hz的频率下记录动作电位。使用方波阶跃电压刺激方法,Vh=-40 mV,给予-140~40 mV,阶跃10 mV,TC为400 ms的去极化脉冲,记录IK1,以各脉冲下电流密度幅值对相应膜电位作图,得I-V曲线。
1.5统计学分析
2结果
2.1比索洛尔对心功能的影响
术后12周,与假手术组大鼠比较,心衰组反映左心室腔大小的LVEDs、LVEDd及反映左心室壁厚度的IVST、PWT均明显增加(P<0.01),EF值则明显降低,BNP明显升高(P<0.01,见表1)。表明左心室腔明显扩张,心功能显著下降,大鼠容量超负荷心衰模型建立成功。比索洛尔干预后反映左室腔大小及室壁厚度的指标均明显下降,EF值升高,BNP水平显著下降,表明比索洛尔干预能显著改善慢性心衰时发生的心功能下降及心肌重构。
表1比索洛尔干预对心衰大鼠心功能指标的影响
Table 1The effect of bisoprolol on heart function in heart failure rats
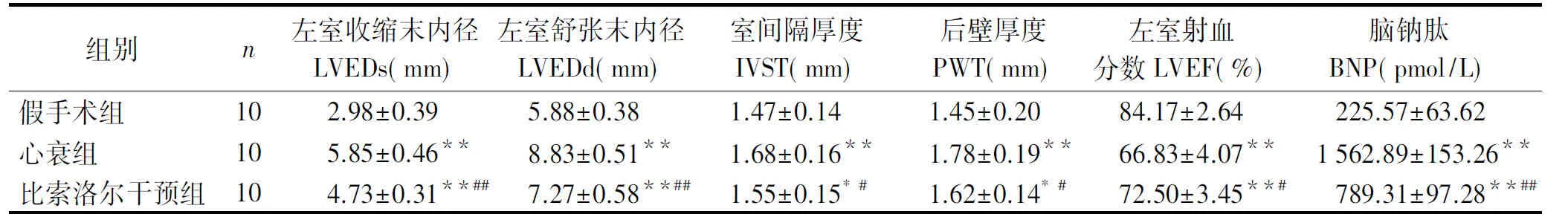
组别n左室收缩末内径LVEDs(mm)左室舒张末内径LVEDd(mm)室间隔厚度IVST(mm)后壁厚度PWT(mm)左室射血分数LVEF(%)脑钠肽BNP(pmol/L)假手术组102.98±0.395.88±0.381.47±0.141.45±0.2084.17±2.64225.57±63.62心衰组105.85±0.46**8.83±0.51**1.68±0.16**1.78±0.19**66.83±4.07**1562.89±153.26**比索洛尔干预组104.73±0.31**##7.27±0.58**##1.55±0.15*#1.62±0.14*#72.50±3.45**#789.31±97.28**##
与假手术组比较,*P<0.05,**P<0.01;与心衰组比较,#P<0.05,##P<0.01
2.2比索洛尔对动作电位的影响
与假手术组比较,心衰组大鼠的心率增快,QT及QTc间期均显著延长(P<0.01),提示慢性心衰时心率加快,动作电位时程延长。比索洛尔干预可减慢心率,缩短QT及QTc间期(P<0.05,见表2),表明比索洛尔干预可部分逆转慢性心衰时发生的心电重构。
大鼠左室心肌细胞动作电位呈三角形,无明显平台期(见图1)。心衰组的静息电位绝对值较假手术组明显减低(P<0.01),而比索洛尔干预可部分逆转这一改变。反映除极过程的APA在心衰组及假手术组间无明显差异,心衰组中反映复极过程的APD10、APD50及APD90均较假手术组明显延长,而比索洛尔干预可明显缩短心衰大鼠心室肌细胞的动作电位时程(见表3)。
2.3比索洛尔对IK1的影响
记录各组大鼠左室心肌细胞IK1电流大小,计算其电流密度并绘制I-V曲线。按设定的刺激程序,记录到一电压依赖的内向电流(见图2),在400 ms内无明显失活,IK1内向成分随去极化而减小,反转电位为-50 mV,在其以上转为外向电流,具有明显内向整流特性,其I-V曲线呈“N”形(见图3)。
表2比索洛尔干预对心衰大鼠心电图的影响
Table 2The effect of bisoprolol on ECG in heart failure rats
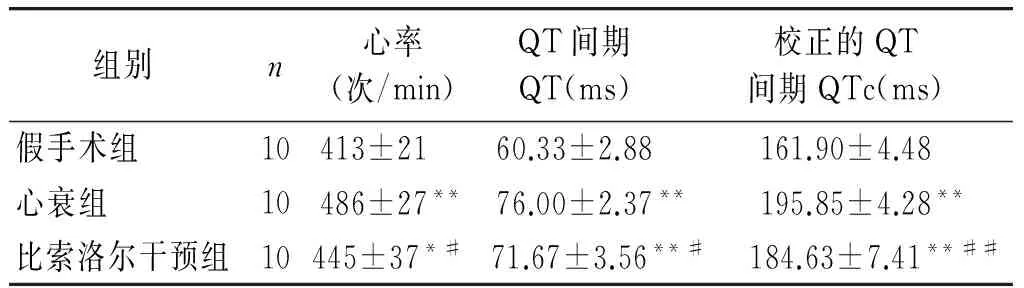
组别n心率(次/min)QT间期QT(ms)校正的QT间期QTc(ms)假手术组10413±21 60.33±2.88161.90±4.48心衰组10486±27**76.00±2.37**195.85±4.28**比索洛尔干预组10445±37*# 71.67±3.56**#184.63±7.41**##
与假手术组比较,*P<0.05,**P<0.01;与心衰组比较,#P<0.05,##P<0.01
刺激电位为-140~-90 mV时,心衰组较假手术组IK1电流密度绝对值显著减小(P<0.05),在-90 mV以上无明显差异。而比索洛尔干预组在刺激电位为-140 mV~-130 mV时,IK1电流密度较心衰组显著增加(P<0.05)。表明心衰时IK1电流密度显著减小,而比索洛尔干预可部分逆转这一改变。
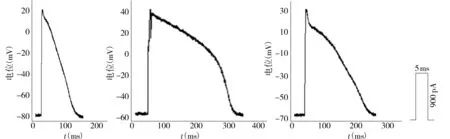
A.假手术组 B.心衰组 C.比索洛尔干预组图1 三组大鼠左室心肌细胞动作电位记录图Figure 1 Action potential recordings of left ventricular cardiomyocyes in three groups
表3比索洛尔干预对心衰大鼠动作电位的影响
Table 3The effect of bisoprolol on action potential in heart failure rats
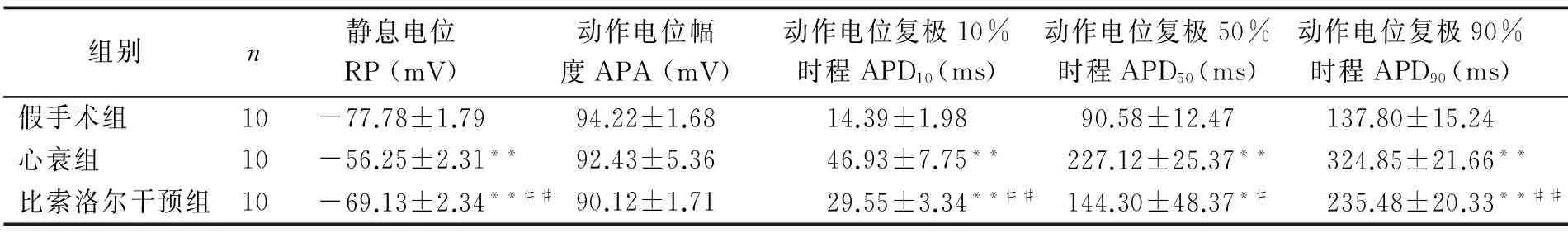
组别n静息电位RP(mV)动作电位幅度APA(mV)动作电位复极10%时程APD10(ms)动作电位复极50%时程APD50(ms)动作电位复极90%时程APD90(ms)假手术组10-77.78±1.7994.22±1.6814.39±1.9890.58±12.47137.80±15.24心衰组10-56.25±2.31**92.43±5.3646.93±7.75**227.12±25.37**324.85±21.66**比索洛尔干预组10-69.13±2.34**##90.12±1.7129.55±3.34**##144.30±48.37*#235.48±20.33**##
与假手术组比较,*P<0.05,**P<0.01;与心衰组比较,#P<0.05,##P<0.01
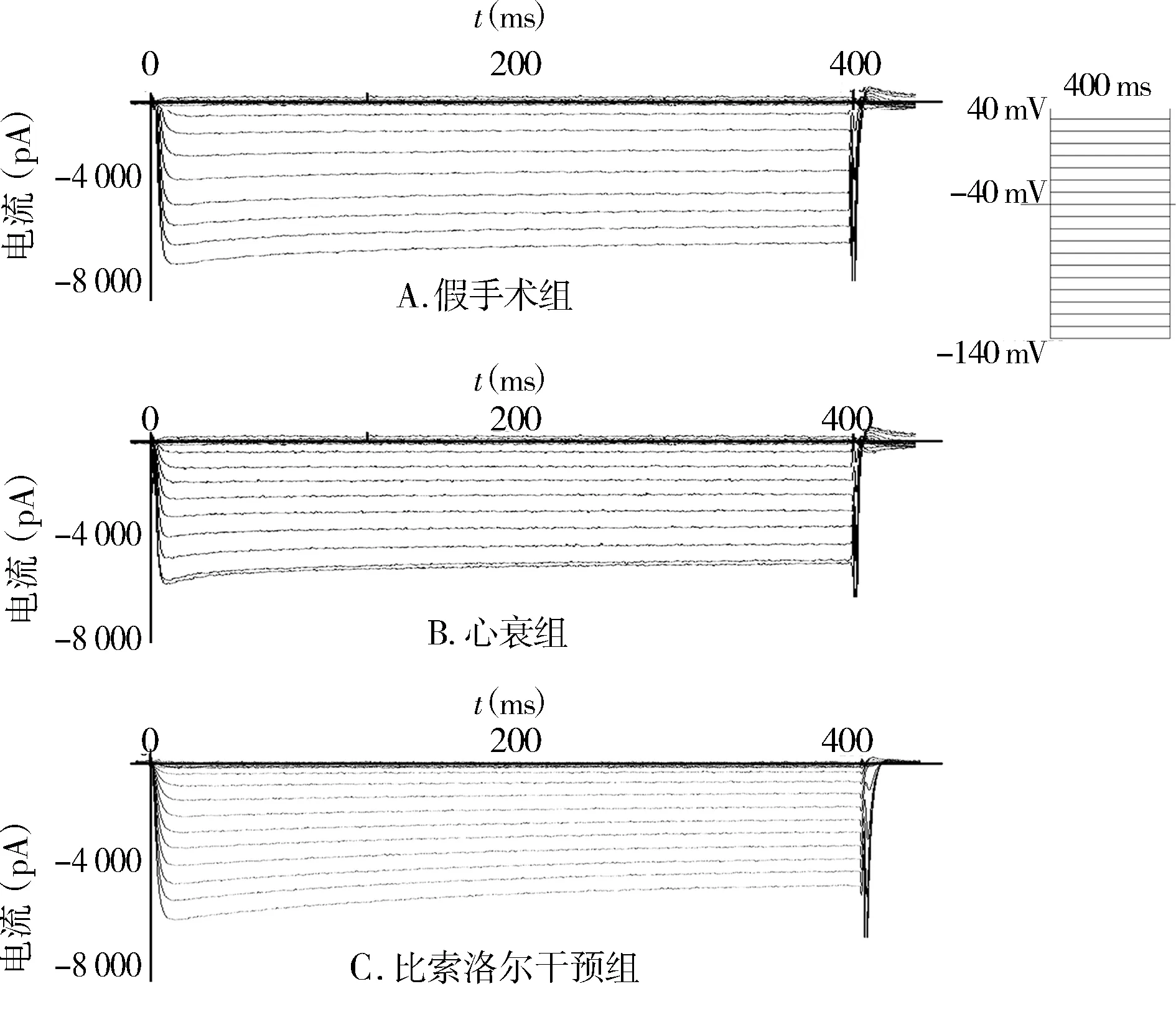
图2 三组大鼠左室心肌细胞IK1记录图Figure 2 IK1 current traces of left ventricular cardiomyocyes in three groups

与假手术组比较,*P<0.05,**P<0.01;与心衰组比较,#P<0.05,##P<0.01图3 三组大鼠左室心肌细胞IK1的I-V曲线Figure 3 I-V curves of left ventricular cardiomyocyes in three groups
3讨论
本研究通过建立容量超负荷大鼠心衰模型,观察其左室心肌细胞内向整流钾电流(IK1)的变化,以及比索洛尔的干预作用。结果表明,心衰大鼠IK1电流明显减小,动作电位时程延长,比索洛尔干预可部分逆转这些改变。
内向整流钾电流主要参与维持心肌细胞的静息膜电位和复极过程,影响动作电位的时段和形态,对维持心肌正常的兴奋节律、防止心律失常的发生具有重要的意义[12]。慢性心力衰竭时,IK1电流减小,APD延长,心室复极延迟,促进早期后除极(EADs)的发生,导致触发活动和快速型室性心律失常,包括尖端扭转型室速[13]。IK1减小还会引起膜电位波动,造成膜电位的不稳定,并促进延迟后除极(DADs)的发生,从而增加发生室性心律失常的机率[14]。因此,调控IK1电流有助于减少室性心律失常的发生,减低心源性猝死率。
CIBISⅡ试验表明比索洛尔可显著降低心衰患者的病死率和心源性猝死率[9],可能与其减少室性心律失常的发生有关,但具体机制不完全清楚。有多项研究表明β受体阻滞剂有逆转心衰时离子通道重构的作用[15,16],本课题组前期研究发现比索洛尔可逆转容量超负荷心衰兔IKs、IK1、Ito的蛋白表达水平[17,18]及小电导钙激活钾通道的心电重构[19]。本研究表明,比索洛尔长期干预可增加心衰大鼠心室肌细胞的IK1电流密度,缩短动作电位时程,比索洛尔可改善慢性心衰时发生的心电重构,这说明比索洛尔改善心电重构的作用可能是其抗心律失常的重要因素。
那么,比索洛尔对IK1电流的作用是通过直接离子通道调控作用还是间接调控作用呢?慢性心衰时β肾上腺素受体过度激活,同样参与心电重构过程,而假手术组无β肾上腺素受体过度激活,比索洛尔干预对其IK1电流无明显影响。另外,最后一次比索洛尔灌胃在细胞分离前24 h,心肌细胞分离后灌流液里不含比索洛尔,因此无法观察比索洛尔对离子通道的直接调控作用。这表明比索洛尔长期干预可逆转慢性心衰心肌细胞IK1电流的变化,可能通过抑制β肾上腺素受体活性,影响离子通道的表达及功能,而非直接通道调控作用。结合本研究结果及课题组既往研究结果,认为比索洛尔可从整体上逆转心电重构,进而减少心律失常等发生。这一作用可能是比索洛尔减少室性心律失常及心源性猝死率的机制之一,为其在心衰患者中的广泛应用提供理论电生理依据。
参考文献:
[1]Klein L,Hsia H.Sudden cardiac death in heart failure[J].Cardiol Clin,2014,32(1):135-144.
[2]Cutler MJ,Jeyaraj D,Rosenbaum DS.Cardiac electrical remodeling in health and disease[J].Trends Pharmacol Sci,2011,32(3):174-180.
[3]Xi Y,Wu G,Yang L,etal.Increased late sodium currents are related to transcription of neuronal isoforms in a pressure-overload model[J].Eur J Heart Fail,2009,11(8):749-757.
[4]Ravens U,Cerbai E.Role of potassium currents in cardiac arrhythmias[J].Europace,2008,10(10):1133-1137.
[5]Anumonwo JM,Lopatin AN.Cardiac strong inward rectifier potassium channels[J].J Mol Cell Cardiol,2010,48(1):45-54.
[6]Cutler MJ,Rosenbaum DS,Dunlap ME.Structural and electrical remodeling as therapeutic targets in heart failure[J].J Electrocardiol,2007,40(6 Suppl):S1-S7.
[7]王建丽,王贺,马爱群,等.容量超负荷大鼠左室内向整流钾通道蛋白表达的研究[J].西安交通大学学报(医学版),2013,34(2):173-176.
[8]Ong HT,Ong LM,Kow FP.Beta-blockers for heart failure:an evidence based review answering practical therapeutic questions[J].Med J Malaysia,2012,67(1):7-11.
[9]Castagno D,Jhund PS,McMurray JJ,etal.Improved survival with bisoprolol in patients with heart failure and renal impairment:an analysis of the cardiacinsufficiency bisoprolol study II(CIBIS-II) trial[J].Eur J Heart Fail,2010,12(6):607-616.
[10]Abassi Z,Goltsman I,Karram T,etal.Aortocaval fistula in rat:a unique model of volume-overload congestive heart failure and cardiac hypertrophy[J].J Biomed Biotechnol,2011,2011:729497.
[11]朱文晖,张晓红,肖渊茗.超声心动图评价心力衰竭大鼠模型心功能改变[J].中南大学学报(医学版),2009,34(5):453-456.
[12]陆彤,蒋彬.内向整流性钾离子通道家族[J].中国心脏起搏与心电生理杂志,2009,23(3):187-195.
[13]Qu Z,Xie LH,Olcese R,etal. Early afterdepolarizations in cardiac myocytes:beyond reduced repolarization reserve[J].Cardiovasc Res,2013,99(1):6-15.
[14]Nattel S.Remodeling of cardiac inward-rectifier currents:an often-overlooked contributor to arrhythmogenic states[J].J Mol Cell Cardiol,2003,35(12):1395-1398.
[15]Rehsia NS,Dhalla NS.Mechanisms of the beneficial effects of beta-adrenoceptor antagonists in congestive heart failure[J].Exp Clin Cardiol,2010,15(4):86-95.
[16]Tang HF,Wu SL,Deng CY,etal.Bisoprolol inhibits sodium current in ventricular myocytes of rats with diastolic heart failure[J].Clin Exp Pharmacol Physiol,2007,34(8):714-719.
[17]李溪,马爱群,任京婷,等.比索洛尔对心力衰竭兔心房肌细胞钾通道表达的影响[J].山西医科大学学报,2011,42(10):787-792.
[18]陈文婷,李溪,倪雅娟,等.心力衰竭兔左室Ito、Ik1通道蛋白表达变化及比索洛尔干预作用[J].中国分子心脏病学杂志,2013,13(1):419-423.
[19]Ni Y,Wang T,Zhuo X,etal.Bisoprolol reversed small conductance calcium-activated potassium channel(SK) remodeling in a volume-overload rat model[J].Mol Cell Biochem,2013,384(1/2):95-103.
Effect of bisoprolol on inward rectifier potassium current in ventricular cardiomyocytes of heart failure rats
WANG Jianli1,2, MA Aiqun2*, WANG He2, WANG Tingzhong2, HAN Ke2
(1DepartmentofCardiovascularMedicine,SixthPeople’sHospitalofChengdu,Chengdu610051,China;2DepartmentofCardiovascularMedicine,FirstAffiliatedHospitalofXi’anJiaotongUniversity,KeyLaboratoryofEnvironmentandGenesRelatedtoDiseases;*Correspondingauthor,E-mail:maaiqun@medmail.com.cn)
Abstract:ObjectiveTo explore the effect of bisoprolol on inward rectifier potassium current(IK1) in left ventricular cardiomyocytes of volume-overload heart failure(HF) rats.MethodsAdult male SD rats(180-200 g) were randomly divided into sham operation group(SO), heart failure group(HF) and bisoprolol group(BISO). Volume-overload heart failure rats were established by abdominal arteriovenous fistula for 8 weeks, and then bisoprolol(1 mg/kg, quadrantly) was administrated for 4 weeks. Brain natriuretic peptide(BNP) and echocardiographic variables were determined to evaluate the heart function. Action potential(AP) and IK1were recorded by whole cell patch clamp technique.ResultsCompared with SO group, heart function and BNP level decreased in HF group[(1 562.89±153.26)pmol/L vs (225.57±63.62)pmol/L,P<0.01)]. The action potential duration(APD) was prolonged[(APD90:(324.85±21.66)ms vs (137.80±15.24)ms, P<0.01)], while the current density of IK1was decreased in HF group (-140 mV:-23.20±2.10 vs -35.55±2.78,P<0.01).Long term treatment with bisoprolol improved heart function, shortened the APD and increased the density of IK1(-140 mV: -27.16±2.62 vs -23.20±2.10, P<0.01).ConclusionBisoprolol could ameliorate the cardiac function and down-regulate IK1in HF rats.
Key words:bisoprolol;heart failure;inward rectifier potassium current;rats
基金项目:国家自然科学基金重点资助项目(30830051)
作者简介:王建丽,女,1984-08生,硕士,住院医师
收稿日期:2016-02-23
中图分类号:R541.6
文献标志码:A
文章编号:1007-6611(2016)05-0401-05
DOI:10.13753/j.issn.1007-6611.2016.05.001

