miR-365通过靶向E2F2抑制胃癌细胞增生和肿瘤形成
郭水龙 朱圣韬 程 芮 邵琳琳 孙秀梅 张澍田
(首都医科大学附属北京友谊医院消化内科 国家消化系统疾病临床医学研究中心 首都医科大学消化病学系 消化疾病癌前病变北京市重点实验室,北京 100050)
miR-365通过靶向E2F2抑制胃癌细胞增生和肿瘤形成
郭水龙朱圣韬程芮邵琳琳孙秀梅张澍田*
(首都医科大学附属北京友谊医院消化内科 国家消化系统疾病临床医学研究中心 首都医科大学消化病学系 消化疾病癌前病变北京市重点实验室,北京 100050)
【摘要】目的研究胃癌相关miR-365调控胃癌细胞增生和肿瘤发生的功能,并通过验证下游靶分子E2F2研究miR-365的作用机制。方法采用Northern blotting法检测miR-365在小鼠各组织器官中的表达谱;real-time PCR检测miR-365在人胃癌组织中的表达变化;细胞实验和裸鼠成瘤实验研究miR-365过表达对胃癌细胞增生的抑制作用;生物信息学分析miR-365下游靶分子E2F2;构建E2F2 3’UTR 野生型和突变型荧光素酶报告载体,并利用双荧光素酶活性分析检测miR-365对E2F2基因表达的调控和结合位点;Western blotting法检测miR-365对E2F2蛋白表达的调控作用。 结果miR-365在包括胃在内的多种消化道组织中表达; miR-365在人胃癌组织中表达显著下调;miR-365过表达显著抑制多种胃癌细胞的增生和裸鼠皮下的成瘤能力;E2F2是miR-365的靶分子,miR-365通过E2F2 3’UTR上的结合位点抑制E2F2的蛋白表达。结论miR-365 在人胃癌组织和小鼠胃癌模型中表达下调,并通过下游靶分子E2F2抑制胃癌细胞增生和肿瘤形成。
【关键词】E2F2;miR-365;胃癌;microRNA
胃癌是严重危害人类健康的常见恶性肿瘤,名列全球第二大癌症死亡原因[1]。我国是胃癌高发国,每年新发胃癌患者40万人,发病率在所有恶性肿瘤中居首位,死亡人数达30万,约占所有恶性肿瘤死亡人数的25%~30%[2]。miR-365作为一种抑癌miRNA,广泛参与多种消化道肿瘤的发生、发展[3-5]。E2F家族是调控细胞周期与凋亡的一类重要的转录因子,广泛参与各种组织和器官的肿瘤发生过程[6]。在消化系统肿瘤中,目前对E2F1研究较多,其作为抑癌基因在食管癌、胃癌和结直肠癌中具有重要的诊断价值[7]。目前对E2F2在消化道肿瘤中的功能研究主要集中在结直肠癌,其在胃癌发生中的功能机制仍不清楚。本研究从多个方面证实miR-365可靶向抑制E2F2表达,并抑制胃癌细胞增生和肿瘤形成,揭示了胃癌发生、发展的新的调控机制。
1材料与方法
1.1材料
miR-365 Luciferase报告载体pGL3-CM 由pGL3-control改构而成。AGS、BGC-823、SGC-7901和Ges-1细胞由本实验室保存。E2F2抗体购自英国Abcam公司。GAPDH抗体和二抗购自中杉金桥公司。各种限制性内切酶和T4多聚核苷酸激酶购自美国NEB公司。Taqman miRNA real-time试剂盒购自美国ABI公司。 miRNA mimic和ASO及相应对照合成自上海吉玛制药技术有限公司;引物和探针合成自美国Invitrogen公司。质粒抽提及凝胶回收试剂盒购自德国Qiagen公司,转染试剂购自美国Invitrogen公司,双荧光素酶检测试剂盒购自美国Promega公司,其他试剂均为国产分析纯。人胃癌标本购自郑州大学附属河南肿瘤医院肿瘤组织标本库。所有肿瘤标本已经组织学鉴定,标本取得后迅速置于液氮中至RNA和蛋白提取。普通小鼠和裸鼠来自解放军军事医学科学院动物中心,实验动物许可证号:SYXK(京)2012-0023。
1.2方法
1.2.1Northern blotting法检测小鼠各器官组织中miR-365的表达
小鼠处死后,提取各器官组织总RNA,根据文献[8]描述方法进行Northern blotting检测。具体步骤为:25 μg RNA经电泳、转膜、固定和预杂交后,与p32标记的 miR-365或U6特异探针室温杂交过夜,经洗膜后压片显影。
1.2.2人胃腺癌组织中检测miR-365的表达
使用ABI公司的Taqman试剂盒进行miRNA的定量检测,具体方法是Trizol法提取人胃癌组织中总RNA,经cDNA反转后,依据说明书进行Real-time PCR。
1.2.3细胞增生检测
2×104细胞/孔接种到24孔板中,培养24 h后,转染细胞,使用Lipofectamine 2000进行转染,miRNA mimic或ASO浓度为50 nmol/L。每组设置4个复孔。转染72 h后,去除上清,胰蛋白酶消化细胞,完全培养基终止消化。加入台盼蓝染液标记死亡细胞,光镜下对活细胞计数。
1.2.4裸鼠成瘤实验
将处于对数增长期的1×106个对照细胞或miR-365稳定转染的BGC-823细胞分别注射到8只雌性裸鼠(4~5周)的左右背部皮下。饲养4周后处死裸鼠,分离背部皮下肿瘤组织,分别测量左右两侧肿瘤组织的质量。
1.2.5miR-365靶向E2F2的生物信息学预测
使用microRNA在线靶点分析工具TargetScan(www.targetscan.org)分析人E2F2基因3’UTR。1.2.6荧光素酶活性分析检测miR-365对E2F2的靶向作用
使用上下游引物5′-CCGCTCGAGTTTTCTTTAGGGACCAGG-3′和5′-CCGACGCGTGCAGTTTAATGTTTAATGCC-3′ 扩增人E2F2基因的3’UTR序列,并克隆到 pGL3-CM质粒构建荧光素酶报告载体(野生型)。采用引物5′-CCGGAATTCAATTTTTCAGTGTAGTTTGTTGTT-3′ 和5′-CCGACGCGTCCTCCTTGTATTGAGATAATTG-3′将E2F2 3’UTR的 miR-365潜在结合位点进行突变,构建荧光素酶报告载体(突变型)。将报告载体与miR-365过表达载体共转染细胞,48 h后裂解细胞,根据试剂说明书进行检测。检测仪器为LB 960 Centro XS3 Luminometer。
1.2.7Western blotting蛋白检测
使用RIPA裂解细胞提取蛋白并检测蛋白浓度。SDS-PAGE凝胶电泳,上样量为25 μg到50 μg。半干法转膜,5%(质量分数)脱脂牛奶封闭,一抗(1∶1 000)4 ℃孵育过夜,HRP偶联二抗室温孵育1 h,ECL发光显影。
1.3 统计学方法
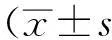
2结果
2.1 miR-365在小鼠胃及其他组织中特异表达
Northern blotting检测结果显示,miR-365在包括胃在内的多种组织中表达,尤其在胃肠道系统中的胃、食管、小肠和结肠中都有表达,提示miR-365可能在这些组织中具有重要的生理功能(图1)。
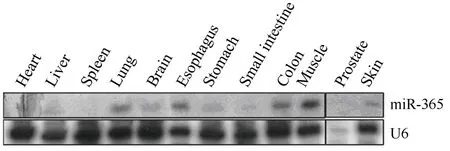
图1 Northern blotting 检测miR-365在小鼠组织中的表达谱
2.2人胃腺癌组织中miR-365表达显著下调
Real-time PCR结果显示,与对应的癌旁正常组织相比,28例人胃癌组织中,20例明显下调,下调的比例达到71%。统计结果显示,人胃癌组织中miR-365的平均表达水平只相当于正常胃组织中的38% (P<0.001,图2)。这一结果表明,miR-365的下调在人胃癌中较为常见,提示其下调可能与胃癌发生发展相关。
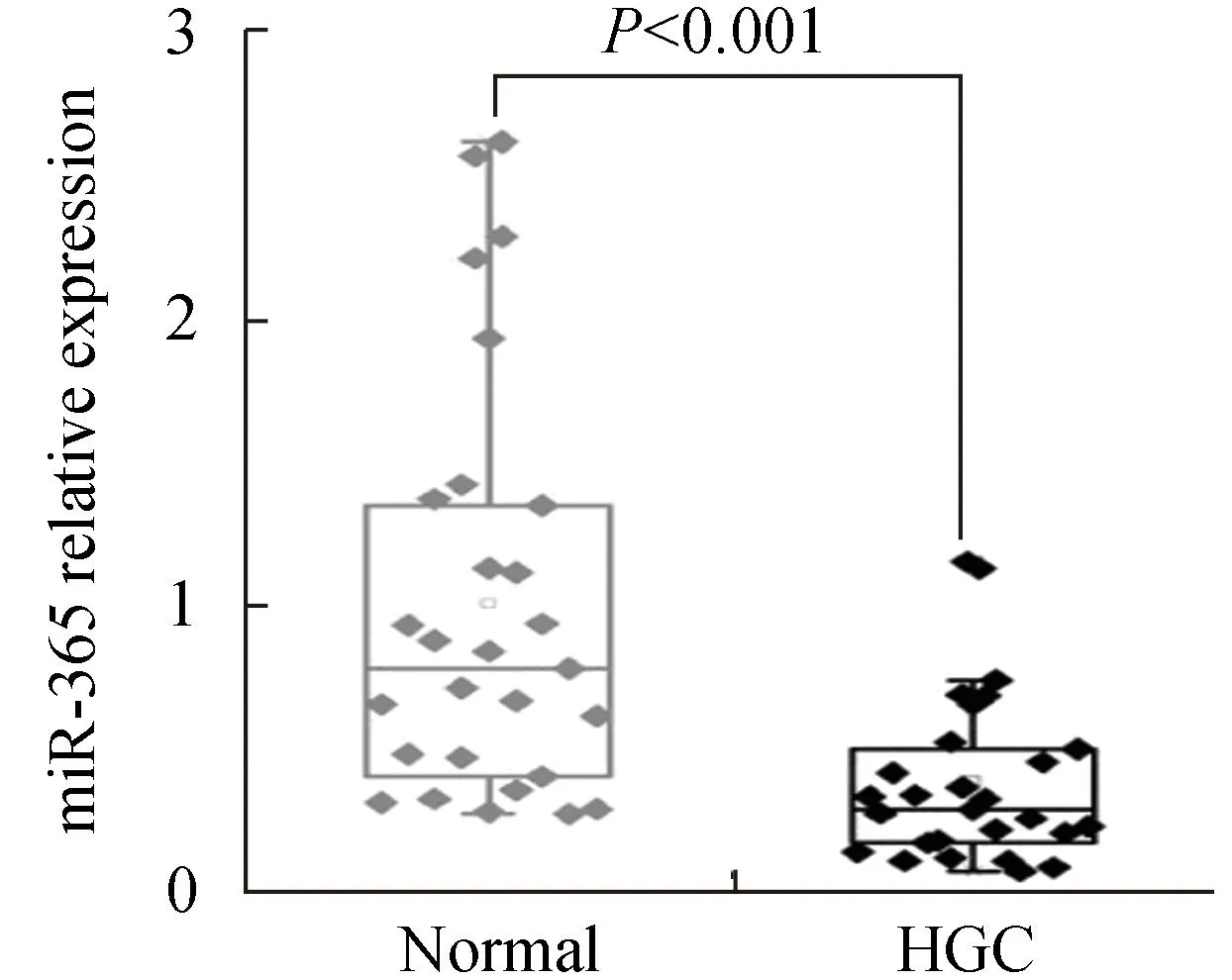
图2 miR-365在人胃癌组织中表达检测
2.3过表达miR-365抑制胃癌细胞增生
在3种胃癌细胞系AGS、BGC-823、SGC-7901和1种胃上皮正常细胞系GES-1中瞬时转染miR-365 mimics,72 h后,与对照组(NC)相比,miR-365过表达明显抑制4种细胞系的细胞增生,抑制率达35%~50%(P<0.01,图3)。
2.4过表达miR-365抑制胃癌细胞裸鼠皮下成瘤
裸鼠成瘤实验结果显示,右侧miR-365过表达组的肿瘤明显小于左侧对照细胞组,证明miR-365可显著抑制胃癌细胞的成瘤能力(P<0.01,图4)。
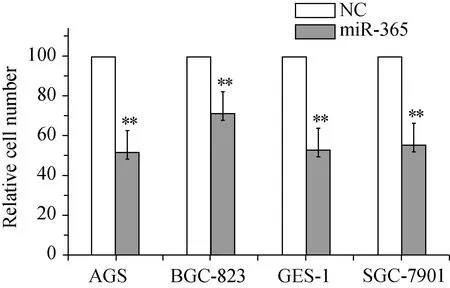
图3 miR-365过表达抑制胃癌细胞增生
**P<0.01vsNC group; NC:normal control.
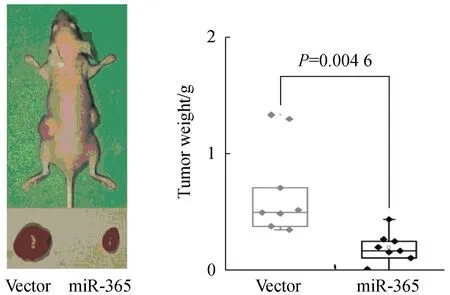
图4 miR-365过表达抑制胃癌细胞的成瘤性
2.5miR-365直接靶向人E2F2基因3’UTR,抑制人E2F2基因的表达
如图5所示,生物信息学分析发现在人E2F2基因mRNA 3’UTR上存在1处miR-365潜在结合位点,提示miR-365与E2F2之间存在可能的靶向关系。进一步的荧光素酶活性检测结果显示, miR-365过表达可以明显抑制E2F2 3’UTR报告载体的荧光素酶活性,约为对照组的60%(P<0.01),表明miR-365通过结合3’UTR区可抑制E2F2基因的表达。将预测的miR-365结合位点突变,可显著消除miR-365过表达导致的荧光素酶活性降低 (P>0.05,图6)。

图5 人E2F2 3’UTR 上miR-365结合位点分析
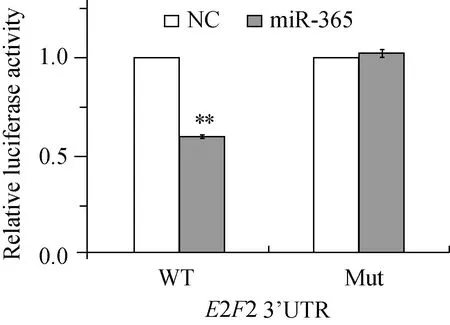
图6 荧光素酶活性分析检测各组报告载体表达
*P<0.01vsNC group; NC:normal control.
2.6miR-365抑制E2F2蛋白表达
Western blotting检测结果显示,在胃癌细胞AGS中过表达miR-365, E2F2的蛋白表达水平明显下降,而用ASO敲低BGC-823细胞内源性的miR-365水平后,E2F2表达明显上调(图7)。此外,与野生型小鼠相比,在pten基因特异敲除的小鼠胃癌组织中,miR-365表达下调,同时E2F2蛋白表达水平显著上升(图8)。这些结果表明,miR-365负向调节E2F2的蛋白表达,E2F2可能是miR-365的直接靶基因。
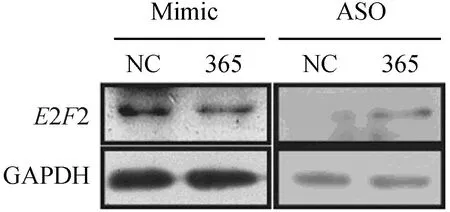
图7 Western blotting检测各组细胞E2F2蛋白表达
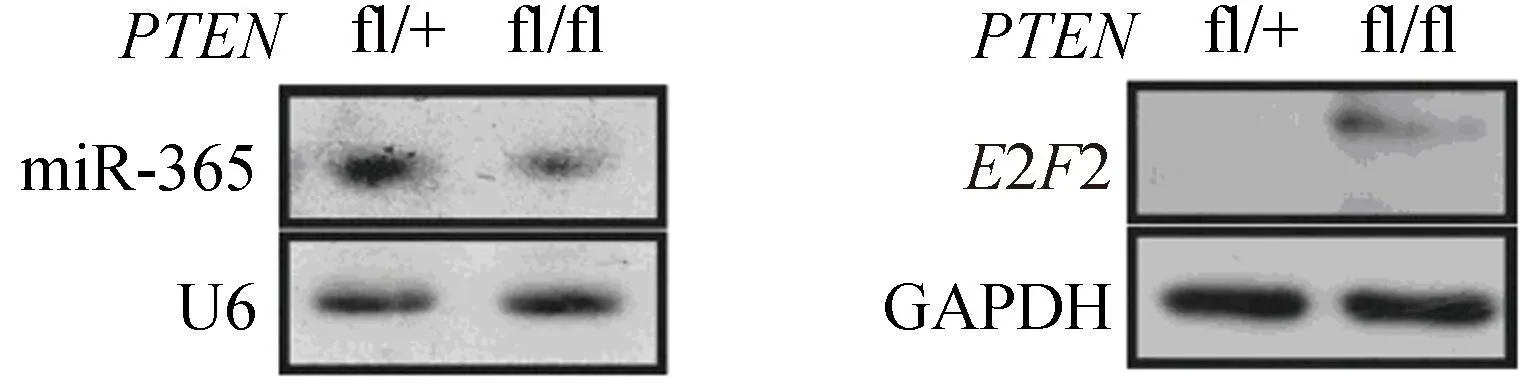
图8 PTEN基因敲除小鼠(PTENfl/fl)胃癌组织中
3讨论
MicroRNA (miRNA)是一类22bp左右的非编码小RNA,通过序列互补与特异mRNA结合,在转录后水平调控靶基因的表达,广泛参与各种肿瘤的发生发展,并在肿瘤诊断和治疗方面具有很大的应用前景[9-10]。大量研究[11-14]结果显示,miR-365在多种肿瘤组织中表达下调,并通过不同靶分子促进肿瘤的增生和迁移。笔者的表达谱实验结果显示,miR-365在多种小鼠消化道组织中高表达,提示其可能在消化道肿瘤中发挥了重要作用。而研究结果表明,miR-365的确在人胃癌组织中表达下调,并通过其新的靶分子E2F2促进胃癌细胞增生和肿瘤形成。E2F2是E2F转录因子家族的成员,其主要以细胞周期依赖性的模式与视网膜母细胞瘤蛋白pRB结合,调控下游细胞周期与增生相关蛋白的表达[15]。最新的研究[16]结果显示,E2F1和E2F2共同与P53蛋白维持细胞的稳态,其失衡将导致肿瘤的发生。笔者与国外课题组的前期研究[5, 17-19]结果显示,miR-365主要通过调控细胞周期抑制肿瘤细胞增生,其主要靶分子为cyclin D1和CDK4/6,而E2F家族则是cyclin D1和CDK4/6下游重要的转录因子。新靶分子E2F2的发现,不仅使得miR-365调节肿瘤细胞周期的调控网络更加完善和精确,也提示该调控网络在肿瘤发生发展中的重要作用。
随着个体化精准医疗的兴起,国内外研究者都在开发新的胃癌早期诊断标志物和药物作用靶点,而miRNA和周期调控蛋白是其中的两大热点[15, 20-23]。本研究的结果为胃癌早期筛查和治疗提供了新的潜在靶分子,并为下一步的临床研究奠定了基础。
4参考文献
[1]Kamangar F, Dores G M, Anderson W F. Patterns of cancer incidence, mortality, and prevalence across five continents: defining priorities to reduce cancer disparities in different geographic regions of the world[J]. J Clin Oncol, 2006, 24(14): 2137-2150.
[2]Yang L. Incidence and mortality of gastric cancer in China[J]. World J Gastroenterol, 2006, 12(1): 17-20.
[3]Guo S L, Ye H, Teng Y, et al. Akt-p53-miR-365-cyclin D1/cdc25A axis contributes to gastric tumorigenesis induced by PTEN deficiency[J]. Nat Commun, 2013, 4: 2544.
[4]Zhou X, Xu X, Wang J, et al. Identifying miRNA/mRNA negative regulation pairs in colorectal cancer[J]. Sci Rep, 2015, 5: 12995.
[5]Nie J, Liu L, Zheng W, et al. microRNA-365, down-regulated in colon cancer, inhibits cell cycle progression and promotes apoptosis of colon cancer cells by probably targeting Cyclin D1 and Bcl-2[J]. Carcinogenesis, 2012, 33(1): 220-225.
[6]Indovina P, Pentimalli F, Casini N, et al. RB1 dual role in proliferation and apoptosis: cell fate control and implications for cancer therapy[J]. Oncotarget, 2015, 6(20): 17873-17890.
[7]Xanthoulis A, Tiniakos D G. E2F transcription factors and digestive system malignancies: how much do we know?[J]. World J Gastroenterol, 2013, 19(21): 3189-3198.
[8]Sun Q, Zhang Y, Yang G, et al. Transforming growth factor-beta-regulated miR-24 promotes skeletal muscle differentiation[J]. Nucleic Acids Res, 2008, 36(8): 2690-2699.
[9]Liu J, Zhang L, Lei J, et al. MicroRNA-responsive cancer cell imaging and therapy with functionalized gold nanoprobe[J]. ACS Appl Mater Interfaces, 2015, 7(34): 19016-19023.
[10]Zhang Z, Li Z, Li Y, et al. MicroRNA and signaling pathways in gastric cancer[J]. Cancer Gene Ther, 2014, 21(8): 305-316.
[11]Bai J, Zhang Z, Li X, et al. MicroRNA-365 inhibits growth, invasion and metastasis of malignant melanoma by targeting NRP1 expression[J]. Cancer Biomark, 2015, 15(5): 599-608.
[12]Bai J, Zhang Z, Li X, et al. MicroRNA-365 inhibits growth, invasion and metastasis of malignant melanoma by targeting NRP1 expression[J]. Int J Clin Exp Pathol, 2015, 8(5): 4913-4922.
[13]Chen Z, Huang Z, Ye Q, et al. Prognostic significance and anti-proliferation effect of microRNA-365 in hepatocellular carcinoma[J]. Int J Clin Exp Pathol, 2015, 8(2): 1705-1711.
[14]Kang S M, Lee H J, Cho J Y. MicroRNA-365 regulates NKX2-1, a key mediator of lung cancer[J]. Cancer Lett, 2013, 335(2): 487-494.
[15]Evangelou K, Havaki S, Kotsinas A. E2F transcription factors and digestive system malignancies: how much do we know?[J]. World J Gastroenterol, 2014, 20(29): 10212-10216.
[16]Iglesias-Ara A,Zenarruzabeitia O, Buelta L, et al. E2F1 and E2F2 prevent replicative stress and subsequent p53-dependent organ involution[J]. Cell Death Differ, 2015, 22(10): 1577-1589.
[17]Zhang P, Zheng C, Ye H, et al. MicroRNA-365 inhibits vascular smooth muscle cell proliferation through targeting cyclin D1[J]. Int J Med Sci, 2014, 11(8): 765-770.
[18]Zhou L, Wang Y, Ou C, et al. microRNA-365-targeted nuclear factor I/B transcriptionally represses cyclin-dependent kinase 6 and 4 to inhibit the progression of cutaneous squamous cell carcinoma[J]. Int J Biochem Cell Biol, 2015, 65: 182-191.
[19]Guo S L, Ye H, Teng Y, et al. Akt-p53-miR-365-cyclin D1/cdc25A axis contributes to gastric tumorigenesis induced by PTEN deficiency[J]. Nat Commun, 2013, 4: 2544.
[20]Tong F, Cao P, Yin Y, et al. MicroRNAs in gastric cancer: from benchtop to bedside[J]. Dig Dis Sci, 2014, 59(1): 24-30.
[21]Kanat O, O’Neil B, Shahda S. Targeted therapy for advanced gastric cancer: A review of current status and future prospects[J]. World J Gastrointest Oncol, 2015, 7(12): 401-410.
[22]李龙,李静,黄东兰,等. 胃癌患病风险关键基因筛选[J]. 中华肿瘤防治杂志,2014,21(2):95-99.
[23]李立平,吴炜景,赵亚刚. microRNA与胃癌的研究进展[J]. 中华肿瘤防治杂志. 2013,20(4):312-316.
编辑陈瑞芳
miR-365 inhibited the proliferation and tumorigenicity of gastric cancer cells by targeting E2F2
Guo Shuilong, Zhu Shengtao, Cheng Rui, Shao Linlin, Sun Xiumei, Zhang Shutian*
(DepartmentofGastroenterology,BeijingFriendshipHospital,CapitalMedicalUniversity;NationalClinicalResearchCenterforDigestiveDiseases;FacultyofGastroenterologyofCapitalMedicalUniversity;BeijingKeyLaboratoryforPrecancerousLesionofDigestiveDiseases,Beijing100050,China)
【Abstract】ObjectiveTo investigate the regulatory role of miR-365 on proliferation and tumorigenicity of gastric cancer cells, and explore the functional mechanism of miR-365 by verifying its target molecule E2F2 protein. MethodsThe expression profile of miR-365 in mouse tissues was checked by Northern blotting. The expression of miR-365 in human gastric cancer tissues was detected by Real-Time PCR. The regulatory role of miR-365 on gastric cancer cell proliferation and tumorigenicity were explored with cells experiment and nude mouse tumorigenicity assay; The potential binding site of miR-365 in the E2F2 3′ untranslated region (3′UTR) was predicted with the bioinformatic tools; The luciferase report plasmids containing the wild type and mutated binding site of E2F2 3′UTR were constructed, and were used to study the regulation mechanism and identify the binding sites of miR-365 by luciferase activity analysis; The regulation effect of miR-365 on E2F2 protein expression was checked by Western blotting. Results The specific expression of miR-365 was detected in various digestive tissues including stomach; miR-365 was down-regulated in human gastric cancer tissues; miR-365 inhibited the expression of E2F2 protein by recognizing the specific binding site on the 3′UTR of E2F2 mRNA. ConclusionmiR-365 was down-regulated in gastric cancer tissues of human and mouse model, and suppressed the proliferation and tumorigenicity of gastric cancer cells by inhibiting the expression of E2F2.
【Key words】E2F2; miR-365; gastric cancer; microRNA
(收稿日期:2015-12-25)
【中图分类号】R 735.2
[doi:10.3969/j.issn.1006-7795.2016.01.001]
*Corresponding author, E-mail:zhangshutian@ccmu.edu.cn
基金项目:国家自然科学基金(81302160, 81272447),国家消化系统疾病临床医学研究中心基金(2015BAI13B09),北京市自然科学基金(7152043)。 This study was supported by National Natural Science Foundation of China (81302160, 81272447), National Clinical Research Center for Digestive Diseases (2015BAI13B09), Natural Science Foundation of Beijing (7152043).
网络出版时间:2016-01-2714∶37网络出版地址:http://www.cnki.net/kcms/detail/11.3662.R.20160127.1437.002.html
· 消化系统重大疾病的全链条研究 ·

