博尔宁抑制S-180肉瘤细胞增殖抗癌作用机制研究
王秀萍,张莹雯
(1. 武汉大学第二临床学院,湖北 武汉 430000;2. 武汉大学中南医院,湖北 武汉 430000)
博尔宁抑制S-180肉瘤细胞增殖抗癌作用机制研究
王秀萍1,张莹雯2
(1. 武汉大学第二临床学院,湖北 武汉 430000;2. 武汉大学中南医院,湖北 武汉 430000)

[摘要]目的观察博尔宁对S-180肉瘤细胞及其实体瘤的增殖抑制作用,探讨其抗肿瘤效应及与NF-κB的相关性。方法①体外实验:体外培养S-180肉瘤细胞,分为空白组,博尔宁A组、B组、C组,5-Fu组,联合给药组,分别培养24,48,72 h,MTT法检测细胞体外增殖程度,计算增殖抑制率。②体内实验:将含S-180肉瘤细胞的小鼠乳白色腹水接种于50只雄性裸小鼠右侧腋窝皮下,然后随机将裸小鼠分为5组,空白组给予生理盐水灌胃,5-Fu组给予5-Fu 10 μg/mL灌胃,博尔宁A组、B组、C组给予10 μg/mL、20 μg/mL、40 μg/mL博尔宁灌胃。灌胃15 d后取材,计算抑瘤率,RT-PCR法检测瘤组织NF-κp65 RNA的表达情况,考马斯亮兰法检测NF-κB蛋白浓度,凝胶电泳迁移率试验(EMSA)检测NF-κB活性。结果在体外,博尔宁呈浓度依赖性抑制S-180肉瘤细胞增殖,且在处理48 h时作用最佳。在体内,博尔宁各组荷瘤裸鼠的瘤质量呈浓度依赖性下降,差异均有统计学意义(P均<0.05),博尔宁C组与5-Fu组抑瘤率比较差异无统计学意义(P>0.05);各给药组瘤组织NF-κB p65 RNA及蛋白表达水平均明显低于空白组(P均<0.05),并随着博尔宁浓度的增加逐渐降低,各组间比较差异均有统计学意义(P均<0.05)。结论博尔宁可显著抑制S-180肉瘤细胞和实体瘤的增殖,其作用与降低NF-κB的表达、抑制其活性有关。
[关键词]博尔宁;S-180肉瘤细胞;增殖;NF-κB
癌症是全球范围内导致死亡的主要原因之一,且其发病率和死亡率均呈上升趋势,据世界卫生组织2014年癌症报告显示,2012年全球约有1 400万新发癌症患者,其中20%发生在我国,在未来20年每年癌症新发病例将达到2 200万[1],故积极探索有效的抗肿瘤药物具有重要的现实意义。近年来,中医药以其不良反应小、治疗全面等独特优势成为临床肿瘤治疗的新选择。博尔宁由黄芪、女贞子、山慈菇、重楼、龙葵、紫苏子、僵蚕、大黄等制成,已被证实可用于胃癌[2]、肝癌[3]、非小细胞肺癌[4]等多种恶性肿瘤的治疗,并取得较好的疗效,但其具体作用机制尚未明确。核因子κB(nuclear factor-κB,NF-κB)是一种重要的核转录因子,广泛存在于各种细胞中,它参与细胞内的信号传递,调控多种基因的表达,与多种肿瘤的发生密切相关[5-6]。本研究拟从体内和体外研究博尔宁对S-180肉瘤细胞及其实体瘤增殖的影响,明确其作用时间、剂量与抑瘤效果关系,探讨博尔宁抗肿瘤作用机制及其与NF-κB的相关性。
1实验资料
1.1试剂 NF-κB核蛋白提取试剂盒购自凯基生物,RPMI1640培养基、定量PCR试剂盒购自TOYOBO,EMSA试剂盒购自Thermo Scientific公司,MTT检测试剂盒、PBS缓冲液购自Aspen公司。博尔宁、5-Fu由武汉大学中南医院药房提供。
1.2细胞培养S-180肉瘤细胞由武汉大学病毒研究中心提供,培养于含10%胎牛血清、100 μg/mL青霉素及100 μg/mL链霉素的RPMI1640培养基中,37 ℃ 25%CO2、饱和湿度条件下扩增培养,镜下S-180肉瘤细胞呈圆形或椭圆形,均匀悬浮在培养瓶中,每1~2 d传代1次。体外实验在第5天开始,传代细胞给予冷冻保存。体外实验结束后继以上法培养细胞,第4天开始接种小鼠。
1.3体外实验
1.3.1实验分组分为空白组(加入100 μL RPMI 1640培养液),5-Fu组(加入100 μL 5-Fu 10 μg/mL),博尔宁A组、B组、C组(分别加入3种不同浓度博尔宁100 μL,使药物终浓度为10,20,40 μg/mL),联合用药组(5-Fu 10 μg/mL+博尔宁40 μg/mL各半)。
1.3.2MTT法检测细胞增殖活性细胞株常规培养后取指数生长期细胞用完全RPMI1640培养基调整至2×108L-1,接种于96孔板中,每孔接种细胞悬液100 μL,5% CO2,37 ℃孵育至细胞单层铺满孔底,分别加入上述分组药物,每组设5个复孔,分别培养24,48,72 h后终止反应,每孔加入20 μL MTT溶液(5 mg/mL)继续培养4 h,离心后小心弃去培养液,每孔加入150 μL二甲基亚砜(DMSO),在振荡器上振荡10 min后,于酶标仪中检测各孔570 nm波长的光密度值(OD),实验重复3次,抑制率按下列公式计算:抑制率(%)=(1-加药孔平均OD值)/对照孔平均OD值×100%。
1.4体内实验
1.4.1实验动物与分组雄性裸小鼠50只,体质量(20±2)g,购自武汉大学ABSL-3动物实验中心。取体外培养的S-180肉瘤细胞接种于小鼠腹腔,腹水形成后转种3次,抽取生长最佳状态的乳白色腹水,用生理盐水稀释成1×109L-1,以每只0.2 mL的量接种于裸小鼠右侧腋窝皮下,然后随机分为空白组,5-Fu组,博尔宁A组、B组和C组,每组10只。接种S-180肉瘤细胞5 d后可见实体瘤突起,开始灌胃,各组灌胃剂量均为0.2 mL/10g,空白组给予生理盐水,5-Fu组给予5-Fu 10 μg/mL,博尔宁A组、B组、C组给予浓度分别为10 μg/mL、20 μg/mL、40 μg/mL的博尔宁,均1次/d,连续给药15 d后处死。实验结束时无死亡。
1.4.2抑瘤率计算给药完毕后,断颈处死裸鼠,并剥离皮下瘤块,称瘤质量,计算抑瘤率,抑瘤率计算公式:抑瘤率(%)=(模型组瘤质量-实验组瘤质量)/模型组瘤质量。
1.4.3瘤体组织中NF-κBp65 RNA表达检测采用实时荧光定量PCR(RT-PCR)法检测。从肿瘤组织提取总RNA,按试剂盒操作说明书进行,并用生物分析仪对总RNA进行完整性检测及浓度测定。逆转录反应条件:42 ℃ 30 min,80 ℃ 5 min,完成后-20 ℃保存。PCR扩增引物由Invitrogen Biotechnology Co, LTD中国公司合成,信息见表1;反应条件:94 ℃ 1 min(变性),58 ℃ 1 min(退火),72 ℃ 1 min(延伸)的顺序进行32个循环,72 ℃延伸10 min。分别取PCR产物和β-actin扩增产物各10 μL混匀后行2%琼脂糖凝胶电泳,溴化乙锭(EB)做荧光指示剂,然后应用自动凝胶成像分析系统进行吸光度扫描,测得数据用2△△Ct 法分析基因表达,以Ct-NF-κB/与Ct-β-actin的比值进行统计学分析。

表1 PCR引物信息
1.4.4肿瘤组织中NF-κB活性检测采用电泳迁移率实验(EMSA)检测。肿瘤组织蛋白提取严格按照说明书操作。取少量用考马斯亮兰(Bradford法)测定提取物中蛋白浓度,剩余部分冻存备用。蛋白与探针反应体系(各组总体积均为20 μL):阴性对照反应(标记探针);阳性对照(含激活的目的转录因子的核蛋白+标记探针);探针冷竞争反应(含激活的目的转录因子的核蛋白+标记探针+标记探针200倍量的未标记探针);常规反应(待测样品核蛋白+标记探针,同上述实验分组)。上述反应体系配置好后,室温放置20 min,随后加5 μL的5×上样缓冲液到样品混合液中,于150 V反应30~45 min。待电泳完成并转膜后于紫外灯下交联10 min,采用凝胶成像系统及分析系统进行条带分析。

2结果
2.1各组体外培养S-180肉瘤细胞增殖抑制率比较 MTT检测结果显示博尔宁可显著抑制S-180肉瘤细胞的增殖,在同时间段内,博尔宁呈浓度依赖性抑制S-180肉瘤细胞增殖,各组间比较差异均有统计学意义(P均<0.05);5-Fu组各时间段抑制率均明显高于博尔宁C组(P均<0.05),联合用药组与5-Fu组比较差异无统计学意义(P均>0.05)。各给药组均在处理48 h时抑制率明显高于24,72 h(P均<0.05)。见表2。

表2 各组体外培养S-180肉瘤细胞增殖
注:①与博尔宁A组比较,P<0.05;②与博尔宁B组比较,P<0.05;③与博尔宁C组比较,P<0.05;④与培养48h比较,P<0.05。
2.2各组荷瘤裸小鼠瘤质量及抑瘤率比较各给药组荷瘤裸小鼠瘤质量均明显低于空白组(P均<0.05);博尔宁各组瘤质量呈浓度依赖性下降,抑瘤率呈浓度依赖性升高,差异均有统计学意义(P均<0.05);博尔宁C组与5-Fu组瘤质量及抑瘤率比较差异均无统计学意义(P均>0.05)。见表3。

表3 各组荷瘤裸小鼠瘤质量及抑瘤率比较
注:①与空白组比较,P<0.05;②5-Fu组比较,P<0.05;③与博尔宁A组比较,P<0.05;④与博尔宁B组比较,P<0.05。
2.3各组实体瘤内NF-κB p65 mRNA表达量比较 荧光定量PCR结果显示,各给药组肿瘤组织中NF-κB p65 mRNA表达水平明显低于空白组(P均<0.05),博尔宁各组肿瘤组织中NF-κB表达水平呈浓度依赖性下降,组间比较差异均有统计学意义(P均<0.05);5-Fu组与博尔宁C组比较差异无统计学意义(P>0.05)。见图1。

图1 各组NF-κB p65 mRNA 表达量比较
2.4各组实体瘤组织中NF-κB蛋白表达水平及活性比较各给药组肿瘤组织中NF-κB表达水平均明显低于空白组(P均<0.05);博尔宁各组肿瘤组织中NF-κB表达水平呈浓度依赖性下降,组间比较差异均有统计学意义(P均<0.05);5-Fu组与博尔宁C组比较差异无统计学意义(P>0.05)。见表4。EMSA实验显示,各给药组肿瘤组织中NF-κB结合条带灰度值均明显低于空白组,且随着博尔宁浓度增加,NF-κB活性呈浓度依赖性下降,博尔宁C组与5-Fu组比较差异无统计学意义(P>0.05),见图2。

表4 各组实体瘤组织内NF-κB蛋白表达水平比较±s)
注:①与空白组比较,P<0.05;②5-Fu组比较,P<0.05;③与博尔宁A组比较,P<0.05;④与博尔宁B组比较,P<0.05。
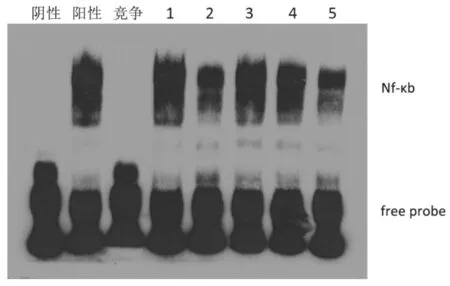
1为空白组,2为5-Fu组,3为博尔宁A组,
3讨论
恶性肿瘤的发生与体内正常细胞基因突变及其过度增殖密切相关,突变的肿瘤细胞持续增殖,不仅破坏原有的器官、组织结构的功能和形态,还可浸润、侵犯周边及远处组织,最终导致广泛转移,严重威胁患者生命。控制肿瘤增生及转移是防治恶性肿瘤的主要目标之一。中医药对“癌”的认识由来已久,古书中记载的“肾岩”“乳岩”“噎膈”等均属于癌症范畴。近年来中医癌毒学说被普遍接受,癌毒与气滞、血瘀、痰凝等致癌因素相兼是肿瘤发生的关键,癌毒的产生与正气不足、邪气内生或外邪内侵相关,而正气亏虚是其根本。在治疗上周仲瑛教授认为可采用抗癌解毒、活血化瘀、软坚散结与整体辨证相结合[7]。博尔宁组方以黄芪、女贞子等扶正固本为主,与山慈菇、重楼、龙葵等解毒中药相结合,并含有大黄、僵蚕等软坚散结成分,符合现代肿瘤治疗的组方思想,具有益气活血、散结消肿、扶正祛邪等功效,现在临床上常将其作为肿瘤治疗的辅助用药,认为其可增强患者的免疫力,提高机体抗病能力[3],并可协助化疗,具有较好的抗肿瘤作用[8-9]。
NF-κB是一种重要的核转录因子,调控多种基因的转录,其在诸多恶性肿瘤组织中高表达。静息状态下,NF-κB以二聚体的形式(主要是p50/p65)与其抑制性蛋白(IkB)结合存在于细胞质中,其含量很少,当细胞受到各种刺激时,IkB被磷酸化而降解,使NF-κB二聚体得以释放激活,并转移到细胞核,与目的基因结合促进其转录,在正常组织中激活的NF-κB很快被反馈性抑制而失活。当细胞恶变时,体内多种微环境变化均可激活NF-κB[10],并呈持续性,直接导致受NF-κB调控的下游基因表达失控,其中就包括与肿瘤细胞增殖相关的雌激素受体(EHR2)[11]、血管内皮生长因子(VEGF)[12]、神经生长因子(NGF)[13]等,直接诱导肿瘤细胞增殖。NF-κB还可促进恶性肿瘤的侵袭和迁移[14-15],诱导其抗凋亡作用[16],使恶性细胞永生化,也是其促进肿瘤增殖的一个重要证据。p65是NF-κB家族的重要成员,研究发现在p65中存在着转录激活区域,是NF-κB促进转录的主要环节之一,通过封闭p65启动子区域可以对抗NF-κB引起的恶性细胞增殖,促进其凋亡[17]。
本研究结果显示,在体外,博尔宁可明显抑制S-180肉瘤细胞的增殖,并呈一定的浓度依赖性,但其抑制作用低于临床常用化疗药物5-Fu,且博尔宁与5-Fu联合用药组抑制率与5-Fu组比较差异无统计学意义,提示两药之间并无协同作用;各给药组均在处理48 h时抑制率明显高于24,72 h,提示博尔宁抑制S-180肉瘤细胞增殖的最佳时间可能是给药后48 h。体内试验发现,博尔宁各组荷瘤裸鼠的瘤质量呈浓度依赖性下降,博尔宁C组与5-Fu组抑瘤率比较差异无统计学意义。证实博尔宁可有效抑制体内S-180实体瘤的增殖,且其体内抗肿瘤作用强于体外抑制恶性肿瘤细胞增殖作用,说明除直接抑制肿瘤细胞的增殖外,还可能存在其他抗肿瘤机制,如改善机体内环境、提高免疫力等,具体机制尚有待进一步研究。为进一步明确其抗肿瘤机制与NF-κB之间的相关性,本研究检测肿瘤组织中NF-κB mRNA、蛋白的活性及含量,发现各给药组瘤组织NF-κb p65 mRNA及蛋白表达水平均明显低于空白组,并随着博尔宁浓度的增加逐渐降低,这与体内及体外肿瘤增殖抑制率保持一致,提示博尔宁的抗肿瘤效应与其对NF-κB的抑制有一定的相关性。
综上所述,博尔宁可有效抑制S-180肉瘤细胞及其实体瘤的增殖,除直接抑制肿瘤细胞增殖外,尚存在其他抗肿瘤效应,而其机制与抑制NF-κB的活性及表达相关。
[参考文献]
[1]世界癌症报告中国新增病例全球第一[J]. 临床合理用药杂志,2014,7(3):170
[2]何洁, 张大鹏, 何静. 博尔宁胶囊配合化疗治疗胃癌的临床疗效观察[J]. 中国医院用药评价与分析,2012,12(11):1016-1017
[3]殷飞,曹凤,姚树坤. 博尔宁对原发性肝癌患者肝动脉插管化疗栓塞术后Th1/Th2型细胞因子的影响[J]. 中国中医基础医学杂志,2008,14(3):218-219
[4]杨静,杨乐,张王刚. 博尔宁胶囊治疗32例非小细胞肺癌疗效观察[J]. 现代肿瘤医学,2013,21(5):1053-1055
[5]Maniati E,Bossard M,Cook N,et al. Crosstalk between the canonical NF-kappaB and Notch signaling pathways inhibits Ppary expression and promotes pancreatic cancer progression in mice[J]. J Clin Invest,2011,121(12):4685-4699
[6]吕坤聚,赵统,蒋悍东. NF-κB、VEGF在非小细胞肺癌中的表达及其与肿瘤血管形成的研究[J]. 中国组织化学与细胞化学杂志,2013,22(1):59-62
[7]吕玉萍,安丰辉,吕玉红,等. 肿瘤中医病机各家杂谈[J]. 环球中医药,2010,5(3):225-226
[8]秦冬莉,宋轶凡. 博尔宁胶囊联合FOLFOX4方案治疗结肠癌的临床分析[J]. 中国医药指南, 2013,11(27):214-215
[9]李士坤,陈克河,任庆梅. 博尔宁胶囊联合FOLFOX方案治疗晚期胃癌68例疗效观察[J]. 中国医药指南,2012,10(12):264-265
[10] Prasad S,Ravindran J,Aggarwal BB. NF-kappaB and cancer: how intimate is this relationship[J]. Mol Cell Biochem,2010,336(1/2):25-37
[11] Meiyanto E,Putri DD,Susidarti RA,et al. Curcumin and its analogues (PGV-0 and PGV-1) enhance sensitivity of resistant MCF-7 cells to doxorubicin through inhibition of HER2 and NF-kB activation[J]. Asian Pac J Cancer Prev,2014,15(1):179-184
[12] Orr WS,Denbo JW,Saab KR,et al. Liposome-encapsulated curcumin suppresses neuroblastoma growth through nuclear factor-kappa B inhibition[J]. Surgery,2012,151(5):736-744
[13] Marampon F,Casimiro MC,Fu M,et al. Nerve Growth factor regulation of cyclin D1 in PC12 cells through a p21RAS extracellular signal-regulated kinase pathway requires cooperative interactions between Sp1 and nuclear factor-kappaB[J]. Mol Biol Cell,2008,19(6):2566-2578
[14] 包巍,杨建华. 抗氧化剂与大肠癌细胞MMP-3表达关系研究[J]. 医学信息,2010,23(5):1270-1271
[15] Shin EM,Hay HS,Lee MH,et al. DEAD-box helicase DP103 defines metastatic potential of human breast cancers[J]. J Clin Invest,2014,124(9):3807-3824
[16] Davoudi Z,Akbarzadeh A,Rahmatiyamchi M,et al. Molecular target therapy of AKT and NF-kB signaling pathways and multidrug resistance by specific cell penetrating inhibitor peptides in HL-60 cells[J]. Asian Pac J Cancer Prev,2014,15(10):4353-4358
[17] 李琦,于颖彦,朱正纲,等. 核因子-κB/p65反义寡核苷酸对胃癌细胞增殖和凋亡的影响及其机制[J]. 中华实验外科杂志,2008,25(8):1009-1011
Study on the anti-cancer mechanism of inhibition of Boerning in proliferation of S-180 cell
WANG Xiuping1,ZHANG Yingwen2
(1. The Second Clinical College of Wuhan University, Wuhan 430000,Hubei,China; 2. Zhongnan Hospital of Wuhan University, Wuhan 430000, Hubei, China)
Abstract:Objective It is to explore the anti-tumor effect of Boerning and its' relationship with NF-κB by inhibiting the proliferation of S-180 tumor cells. Methods In vitro, S-180 cell was divided into six groups: the control group, 5-Fu group, Boerning A-C groups and combination regimen group, and they were cultivated for 24,48,72 hours respectively. MTT method was used to detect the degree of cell proliferation and get the inhibitory rate. In vivo, fifty nude mice were randomly divided into 5 groups: control group, Boerning A-C groups and 5-Fu group, which were treated with normal saline, 10 μg/mL,20 μg/mL,40 μg/mL Boerning and 10 μg/mL 5-Fu by gavage respectively. Then the tumor tissue was obtained fifteen days later and calculated the inhibitory rate. The expression of NF-κBp65 RNA,NF-κB protein concentration and the activity of NF-κB were detected by RT-PCR, Coomassie blue staining and electrophoretic mobility shift assay respectively. Results In vitro, Boerning could inhibit the proliferation of S-180 cell with a concentration-dependent manner, and had the best effect when dealing with 48 hours. In vivo, the tumor weight of nude mice was decline as the increase of concentration of Boerning, all had significant difference(P<0.01 or 0.05). There was no statistically difference in inhibitory rate between Boerning C group and 5-Fu group (P>0.05). The RNA and protein expression of NF-κB decreased gradually with the increased concentration of Boerning, there was a markedly difference (P<0.05 or 0.01) between each groups. Conclusion Boerning can significantly inhibit the proliferation of S-180 cells by in vitro and vivo and its effect is closely related with the inhibition of the expression and activity of NF-κB.
Key words:Boerning;S-180 cells;proliferation;NF-κB
[收稿日期]2015-04-18
[中图分类号]R-332
[文献标识码]A
[文章编号]1008-8849(2016)01-0011-04
doi:10.3969/j.issn.1008-8849.2016.01.004
[基金项目]湖北省自然科学基金资助项目(2009CHB001)
[作者简介]王秀萍,女,硕士研究生在读,研究方向为中西医结合内分泌疾病的诊治。

