三黄鸡STING胞外区基因克隆及原核表达
曹艳杰 何怡宁 唐宁 王海勇 张志鹏 谢智文 韦平 韦天超 磨美兰

摘要:【目的】克隆鸡干扰素基因刺激蛋白(STING)胞外区基因并进行原核表达,为了解STING蛋白的生物学功能及探讨禽类的固有免疫机制打下基础。【方法】采用RT-PCR扩增鸡STING胞外区基因,与原核表达载体pGEX-4T-1连接构建重组表达质粒,再转化BL21(DE3)感受态细胞,经IPTG诱导表达后进行12% SDS-PAGE和Western blotting鉴定分析。【结果】三黄鸡STING胞外区基因全长951 bp,与原核表达载体pGEX-4T-1可成功构建重组表达质粒pGEX-4T-1-STING,转化BL21(DE3)感受态细胞后经1.0 mmol/L IPTG诱导表达4 h,12% SDS-PAGE电泳检测得到一个带GST标签约62 ku的融合蛋白,采用抗GST多克隆抗体进行Western blotting鉴定,约在62 ku处可见一条明显的蛋白印迹条带,表明目的蛋白原核表达正确,且特异性较高。【结论】从三黄鸡外周血淋巴细胞中克隆获得的STING胞外区基因片段可在原核细胞中高效表达,且纯化后的融合蛋白可用于制备鸡STING多克隆抗体。
关键词: 三黄鸡;干扰素基因刺激蛋白(STING);克隆;原核表达
中图分类号: S831.2 文献标志码:A 文章编号:2095-1191(2016)08-1401-05
Abstract:【Objective】The extracellular domain gene of chicken stimulator of interferon genes(STING) was expressed in prokaryotic cell, in order to lay the foundation for understanding biological function of STING protein and studying innate immune mechanisms of poultry. 【Method】The Sanhuang chicken STING extracellular domain gene was amplified by RT-PCR, and ligated into PGEX-4T-1 vector to construct recombinant expression plasmid PGEX-4T-1-STING. The recombinant expression plasmid was transformed into E. coli BL21(DE3) competent cell, and the recombinant strain was induced by IPTG, and the expression products were identified and analyzed by 12% SDS-PAGE and Western blotting. 【Result】The results showed that, the Sanhuang chicken STING extracellular domain gene was 951 bp in length. And the recombinant expression plasmid PGEX-4T-1-STING was constructed successfully. After the recombinant expression plasmid was transformed into E. coli BL21, the recombinant strain was induced by 1.0 mmol/L IPTG for 4 h. A 62 ku fusion protein with a GST-tag was expressed successfully, and could be detected by 12% SDS-PAGE. And the Western blotting results showed that, using anti-GST-tag polyclonal antibody, a special antibody binding band was found, with molecular mass of 62 ku, it indicated that the target protein was expressed accurately, and had high specificity. 【Conclusion】The STING extracellular domain gene is cloned from peripheral blood lymphocytes of chicken, and can be expressed at high level in prokaryotic cell. The high-purity fusion protein can be used to prepare polyclonal antibody of chicken STING.
Key words: Sanhuang chicken; stimulator of interferon genes(STING); cloning; prokaryotic expression
0 引言
【研究意义】干扰素基因刺激蛋白(Stimulator of interferon genes,STING)是位于内质网(或线粒体膜和其他膜结构)上的跨膜蛋白,也是参与诱导固有免疫反应的一个重要接头蛋白(Ishikawa and Barber,2008;Jin et al.,2008),在天然免疫反应系统的抗病毒过程中发挥关键作用。受病毒感染后,STING首先形成二聚体活性形式,再招募TBK1及IRF3形成功能复合体,进而激活IRF3并促使其进入细胞核,诱导I型干扰素产生(Zhong et al.,2008;Sun et al.,2009)。因此,加强鸡STING鉴定及诱导表达研究,对制备单因子血清及探讨STING在固有免疫信号通路中的作用机制具有重要意义。【前人研究进展】Jin等(2011)研究发现,STING的泛素化可诱导其发生二聚化,也是STING招募TBK-1并磷酸化IRF3的前提条件,若经处理使其无法发生泛素化修饰,则会抑制干扰素通路。谢立兰(2011)研究表明,超表达猪STING能激活转录因子IRF3和NF-kB,并诱导干扰素β(IFN-β)產生,而干扰STING表达能降低IFN-β的产生。张静(2013)研究发现,人源STING全长有379个氨基酸,N端有4个跨膜结构域,负责将STING定位在线粒体或内质网上,C端是效应结构域,含有一系列磷酸化位点,其磷酸化活性对介导I型干扰素的激活非常重要。可见,STING缺失细胞能有效阻断无序列特征DNA转染或DNA病毒引起的I型干扰素产生,且部分抑制RNA病毒介导的I型干扰素产生。此外,STING依赖的信号通路对DNA疫苗引起的适应性免疫也非常必需(Ishikawa et al.,2009)。Ishikawa等(2008,2009)研究表明,缺失STING的小鼠对RNA病毒如口炎性水泡病毒、仙台病毒及DNA病毒如单纯疱疹病毒1等均有高度的敏感性,说明STING在抗病毒固有免疫中发挥重要作用。吴俊娇(2014)研究发现,STING的cGAS/STING信号通路关键因子会在系统性红斑狼疮患者的外周淋巴细胞中表达。【本研究切入点】近年来,关于人类与哺乳动物STING基因的表达已有报道,对其蛋白晶体结构与功能也进行了深入研究,并取得了长足进展(谢立兰,2011;张俊兵,2013),但有关禽类STING基因原核表达的研究鲜见报道。【拟解决的关键问题】以鸡的外周血淋巴细胞总RNA为模板,RT-PCR扩增STING胞外区基因片段,并将该基因片段克隆至原核表达载体pGEX-4T-1,再转化BL21(DE3)感受态细胞,IPTG诱导STING胞外区基因表达,旨在为进一步了解鸡STING蛋白的生物学功能及探讨禽类相关疾病固有免疫机制打下基础。
1 材料与方法
1. 1 试验材料
三黄鸡购自广西富凤农牧有限公司。Phanta HS Super-Fidelity DNA聚合酶购自南京诺唯赞生物科技有限公司;抗GST标签兔多克隆抗体(HRP标记)、BL21(DE3)感受态细胞购自北京康为世纪生物科技有限公司;GST融合蛋白纯化试剂盒购自南京金斯瑞生物科技有限公司;Blue Plus III Protein Marker购自北京全式金生物科技有限公司;PageRulerTM Prestained Protein Ladder购自赛默飞世尔科技公司;RNA抽提试剂盒、质粒小量提取试剂盒购自天根生化科技(北京)有限公司;限制性内切酶EcoR I与Xho I、T4 DNA连接酶购自宝生物工程(大连)有限公司;淋巴细胞分离液购自北京索莱宝科技有限公司;其他试剂均为国产分析纯。
1. 2 引物设计与合成
参照NCBI上的原雞STING mRNA基因序列(NM_001305152.1),利用Primer 6.0和Oligo 7设计1对扩鸡STING胞外区基因全长序列的引物。上游引物(F):5'-TAGGAATTCATGCAGCTCGGGGTGCTGCT
CAA-3'(下划线部分为EcoR I酶切位点);下游引物(R):5'-TACTCGAGTCAGTCACTGCGCAGCGGCTG
GG-3'(下划线部分为Xho I酶切位点)。引物由广州华大基因有限公司合成。
1. 3 三黄鸡STING胞外区基因扩增
采集三黄鸡新鲜抗凝血样5.0 mL,分离外周血淋巴细胞,并按参照说明进行总RNA抽提,反转录后进行PCR扩增。扩增程序:95 ℃预变性3 min;95 ℃ 10 s,69 ℃ 15 s,72 ℃ 1 min,进行35个循环;72 ℃延伸5 min。反应结束后,回收纯化目的条带。
1. 4 重组表达质粒构建与鉴定
在37 ℃下用EcoR I和Xho I双酶切STING胞外区基因和pGEX-4T-1表达载体30 min,将酶切产物分别进行纯化回收,用T4连接酶连接(16 ℃,12 h)纯化回收产物,转化DH5α感受态细胞,37 ℃下摇菌1.5 h后接种于含氨苄青霉素的LA固体培养基上进行培养。提取重组质粒后,经双酶切鉴定与PCR鉴定,筛选出阳性重组质粒并送至广州华大基因有限公司测序。
1. 5 融合蛋白原核表达及可溶性分析
以阳性重组质粒转化BL21(DE3)感受态细胞,37 ℃下摇菌1.5 h后接种于含氨苄青霉素的LA固体培养基上,37 ℃培养12 h,挑取单菌落接种至含氨苄青霉素的LB液体培养基(5.0 mL),37 ℃摇床培养,当菌液麦氏浊度单位(MCF)达0.5时,加入终浓度为1 mmol/L的IPTG,继续培养4 h。离心收集菌体,进行12% SDS-PAGE电泳检测。同时取阳性菌液20.0 mL,5000 r/min离心10 min,弃上清液,用PBS重悬沉淀部分,加入溶菌酶,菌液经-80 ℃冻融3次,然后置于细胞超声波破碎仪上破碎30 min,5000 r/min离心10 min,分离上清液和沉淀,对其进行12% SDS-PAGE电泳检测,鉴定融合蛋白是否为可溶性蛋白。
1. 6 融合蛋白纯化
应用GST融合蛋白纯化试剂盒对融合蛋白进行纯化,具体操作步骤:对目的蛋白进行变性复性,将复性液加入到洗涤后的高亲和力GST纯化介质层析柱中,流速控制在10~15 cm/h,重复过柱3次,以增加纯化介质与GST融合蛋白结合率。对纯化后的产物进行12% SDS-PAGE电泳检测,观察纯化结果。
1. 7 融合蛋白Western blotting鉴定
纯化目的蛋白经12% SDS-PAGE电泳检测后转移至PVDF膜,用5%脱脂牛奶进行封闭,4 ℃过夜,加入HRP标记的抗GST标签兔多克隆抗体,稀释倍数1∶4000,37 ℃孵育2 h,加入DAB底物溶液进行显色,至出现蛋白条带后,用三蒸水洗膜,终止显色。
2 结果与分析
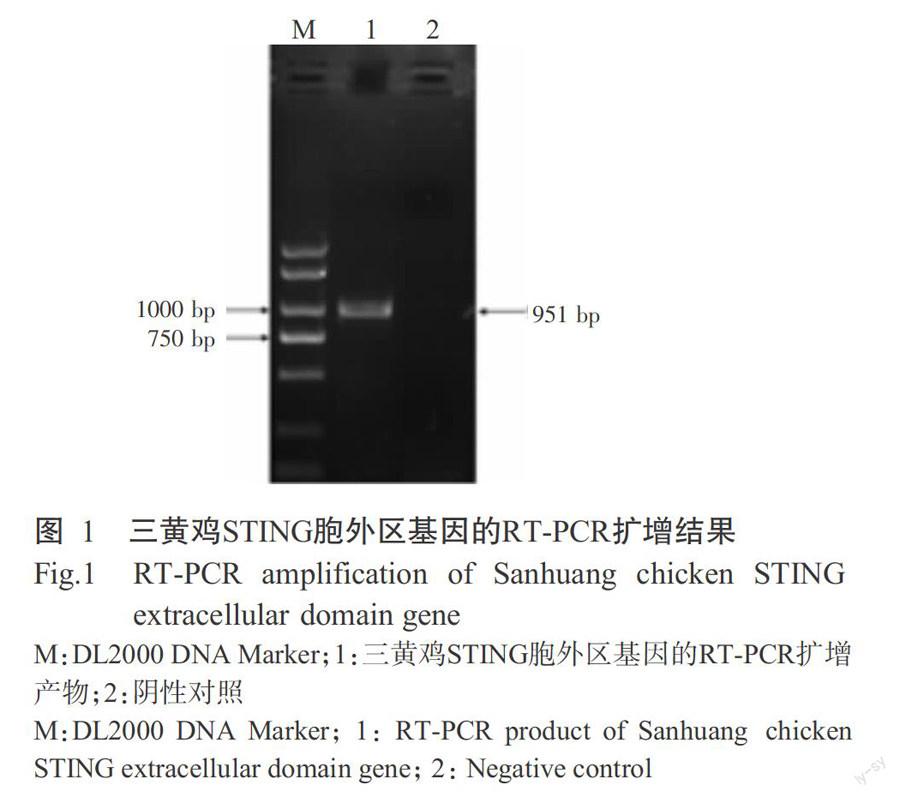
2. 1 三黄鸡STING胞外区基因的扩增结果
以三黄鸡外周血淋巴细胞总RNA反转录获得的产物为模板进行PCR扩增,结果扩增获得约950 bp的片段(图1),与预期结果一致。
2. 2 重组表达质粒的鉴定结果
PCR鉴定重组表达质粒pGEX-4T-1-STING,可扩增获得约950 bp的目的片段,与预期结果相符;对重组质粒进行单、双酶切鉴定(分别为EcoR I和EcoR I/Xho I),酶切产物电泳后得到的目的条带与STING胞外区基因和pGEX-4T-1载体的大小相符(图2)。测序结果进一步证实,鸡STING胞外区基因序列、插入位置及阅读框均准确无误,表明鸡STING胞外区基因已成功克隆至原核表达载体pGEX-4T-1,重组表达质粒构建成功。
2. 3 融合蛋白的原核表达及溶解性检测结果
重组表达质粒pGEX-4T-1-STING转化BL21(DE3)感受态细胞后经1.0 mmol/L IPTG诱导表达4 h,进行12% SDS-PAGE电泳检测。结果显示,在分子量62 ku附近出现一条明显表达的蛋白条带(图3),与预期结果相符。未经诱导的重组表达质粒pGEX-4T-1-STING菌液与空载体诱导菌液在分子量62 ku处均未见明显的蛋白条带,表明三黄鸡STING蛋白原核表达成功。
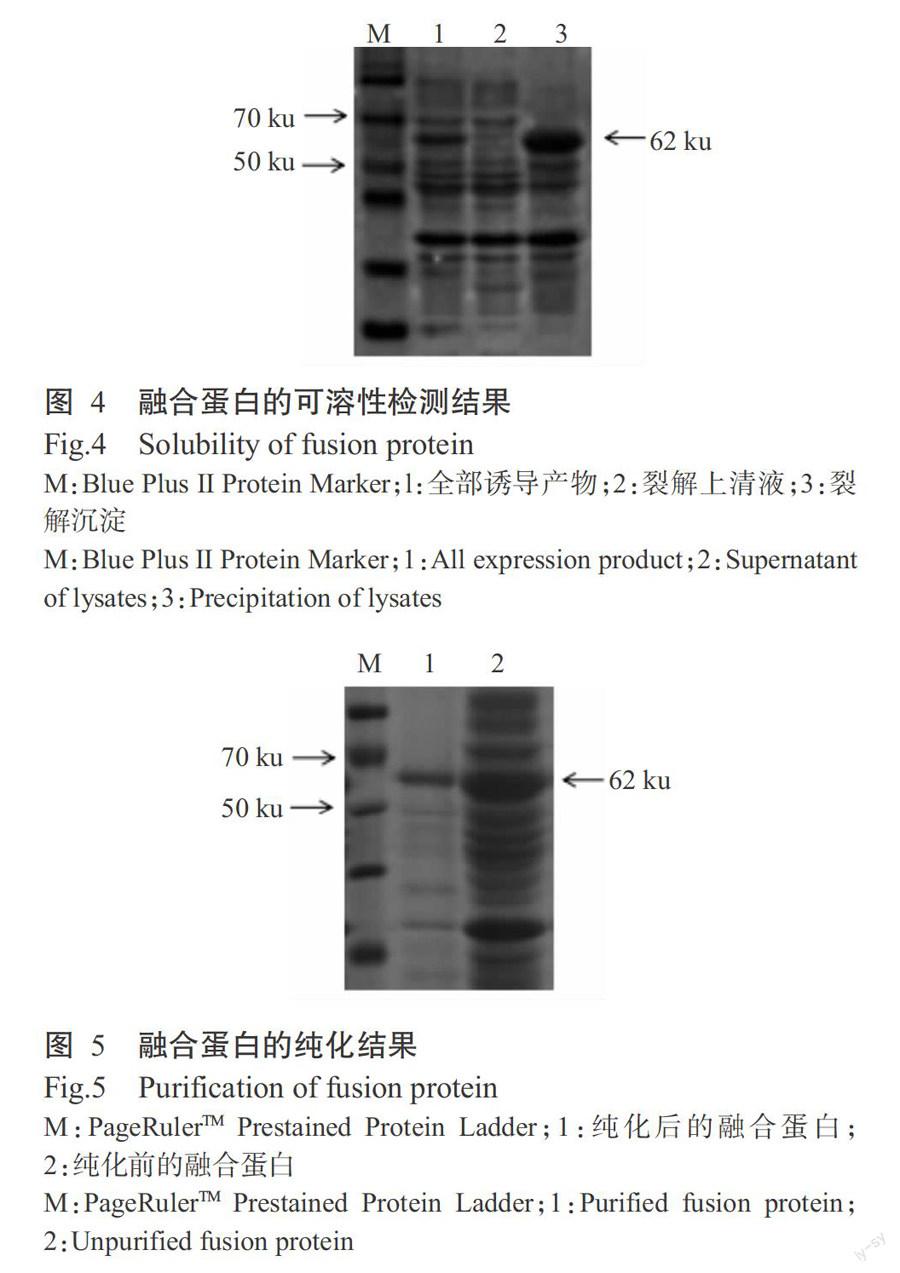
为了鉴定融合蛋白的可溶性,将IPTG诱导菌液破碎后的上清液、沉淀与全菌分别进行12% SDS-PAGE电泳,结果显示,原核表达的三黄鸡STING蛋白在上清液中几乎不表达,而在沉淀中大量表达(图4),表明目的蛋白主要是以包涵体的形式进行表达。
2. 4 融合蛋白的纯化结果
原核表达目的蛋白进行变性复性后以高亲和力GST纯化介质层析柱进行蛋白纯化,将纯化后的融合蛋白样品与纯化前的融合蛋白样品进行12% SDS- PAGE电泳检测,结果显示,纯化前的融合蛋白纯度较差,杂蛋白较多;纯化后的融合蛋白比较单一,杂蛋白条带消失(图5)。
2. 5 纯化融合蛋白的Western blotting鉴定结果
将纯化的融合蛋白进行Western blotting鉴定,结果显示,纯化融合蛋白能被HRP标记的抗GST标签兔多克隆抗体识别,并发生特异性结合,约在62 ku处可见一条明显的蛋白印迹条带(图6),表明目的蛋白原核表达正确,且特异性较好。
3 讨论
近年来,有关机体固有免疫的研究已取得了长足进展,特别是固有免疫识别受体和病原相关分子模式的发现、鉴定及其概念的提出意义重大。STING是固有免疫系統I型干扰素信号通路中的一个重要接头蛋白,定位在内质网(或称在线粒体膜和其他膜结构)上,能强烈刺激I型干扰素和白介素等免疫炎症因子的产生(Ishikawa and Barber,2008;Zhong et al.,2008;Sun et al.,2009)。STING以STING/TBK1/IRF3为轴心模式,介导DNA、RNA、病原性小分子诱导的固有免疫反应,从而发挥抗病毒作用(谢欣等,2014)。STING在人体的多种组织细胞中广泛表达,尤其在与免疫相关的组织细胞中高度表达,如胸腺、心、脾脏、胎盘、肺脏及外周血白细胞,提示其在免疫调节方面可能具有十分重要的功能作用(Jin et al.,2008;Ishikawa and Barber,2008;Zhong et al.,2008)。Cheng等(2015)研究发现,鸡STING能高效诱导干扰素刺激基因(ISGs)的表达,促进I型干扰素产生,从而发挥抗病毒作用,进一步佐证MDA5可通过STING诱导干扰素的观点。可见,STING在病毒诱导固有免疫应答的信号通路中扮演着重要角色。
在进行鸡STING基因原核表达研究中,本课题组曾尝试采用pET-32a表达载体,再转化至BL21(DE3) pLysS和Rosetta(DE3)细胞中进行表达,但均未获得满意效果。原核表达载体pET-32a含有高效的T7 lac启动子、组氨酸标签和T7终止子,被认为是目前大肠杆菌系统表达重组蛋白的最有效工具之一(Kang et al.,2007),但由于鸡STING是由胞内区(1~27 aa)、跨膜区(28~50 aa)和胞外区(51~379 aa)3部分组成,跨膜区对目的蛋白在大肠杆菌的体内表达具有很大干扰作用,在表达前必须去除跨膜区。因此,本研究重新设计扩增鸡STING胞外区基因引物,去除N端的胞内区与跨膜区片段,以排除N端跨膜区在蛋白表达过程中的干扰作用,结果发现STING蛋白得到高水平表达,与李中华等(2015)应用原核表达系统表达传染性支气管炎病毒S1蛋白的结论一致,故推测跨膜区的存在是前期表达失败的主要原因。
4 结论
从三黄鸡外周血淋巴细胞中克隆获得的STING胞外区基因片段可在原核细胞中高效表达,且纯化后的高纯度融合蛋白可用于制备鸡STING多克隆抗体,对进一步探讨该蛋白的生物学功能及禽类的固有免疫机制具有重要意义。
参考文献:
李中华,肖运才,胡思顺,吴仁蔚,毕丁仁. 2015. 传染性支气管炎病毒S1蛋白基因的克隆与原核表达[J]. 中国兽医杂志,51(4):35-38.
Li Z H,Xiao Y C,Hu S S,Wu R W,Bi D R. 2015. Cloning and expression of S1 protein of infection bronchitis virus in prokaryocyte[J]. Chinese Journal of Veterinary Medicine,51(4):35-38.
吴俊娇. 2014. cGAS/STING信号通路关键因子在SLE中的表达及Ⅰ型IFNs与疾病活动指标的相关性分析[D]. 长沙:中南大学.
Wu J J. 2014. Expression of the key factors of cGSA/STING signaling pathway in SLE and correlation analysis between type Ⅰ interferons and indicators of disease activity[D]. Changsha:Central South University.
谢立兰. 2011. 伪狂犬病毒和猪传染性胃肠炎病毒诱导β干扰素产生的分子机制研究[D]. 武汉:华中农业大学.
Xie L L. 2011. Studies on the molecular mechanisms that PRV induced and TGEV induced IFN-β production[D]. Wuhan:Huazhong Agricultural University.
谢欣,王孝伟,刘俊义. 2014. 免疫途径抗HIV信号通路:cGAS-STING研究进展[J]. 国际药学研究杂志,41(5):528-532.
Xie X,Wang X W,Liu J Y. 2014. Research advance in cGAS-STING pathway:a pathway unlock the anti-HIV function of immune system[J]. Journal of International Pharmaceutical Research,41(5):528-532.
張静. 2013. TRIM32调控病毒诱导的I型干扰素表达的分子机制[D]. 武汉:武汉大学.
Zhang J. 2013. The mechanisms of virus-induced expression of type I interferon by TRIM32[D]. Wuhan:Wuhan University.
张俊兵. 2013. STING蛋白的初步晶体学研究[D]. 济南:山东大学.
Zhang J B. 2013. The preliminary crystallization study of the protein STING[D]. Jinan:Shandong University.
Cheng Y,Sun Y,Wang H,Yan Y,Ding C,Sun J. 2015. Chicken STING mediates activation of the IFN gene independently of the RIG-I gene[J]. The Journal of Immunology,195(8):3922-3936.
Ishikawa H,Barber G N. 2008. STING is an endoplasmic reticulum adaptor that facilitates innate immune signaling[J]. Nature,455(7213):674-678.
Ishikawa H,Ma Z,Barber G N. 2009. STING regulates intracellular DNA-mediated,type I interferon-dependent innate immunity[J]. Nature,461(7265):788-792.
Jin L,Waterman P M,Jonscher K R,Short C M,Reisdorph N A,Cambier J C. 2008. MPYS,a novel membrane tetraspanner,is associated with major histocompatibility complex class II and mediates transduction of apoptotic signals[J]. Molecular and Cellular Biology,28(16):5014-5026.
Jin L,Xu L G,Yang I V,Davidson E J,Schwartz D A,Wurfel M M,Cambier J C. 2011. Identification and characterization of a loss-of-function human MPYS variant[J]. Genes and Immunity,12(4):6361-6365.
Kang Y,Son M S,Hoang T T. 2007. One step engineering of T7-expression strains for protein production:increasing the host-range of the T7-expression system[J]. Protein Expression and Purification,55(2):325-333.
Sun W,Li Y,Chen L,Chen H,You F,Zhou X,Zhou Y,Zhai Z,Chen D,Jiang Z. 2009. ERIS,an endoplasmic reticulum IFN stimulator,activates innate immune signaling through dimerization[J]. Proceedings of the National Academy of Sciences of the United States of America,106(21):8653-8658.
Zhong B,Yang Y,Li S,Wang Y Y,Li Y,Diao F,Lei C,He X,Zhang L,Tien P,Shu H B. 2008. The adaptor protein MITA links virus-sensing receptors to IRF3 transcription factor activation[J]. Immunity,29(4):538-550.
(责任编辑 兰宗宝)

