海水养殖斜带石斑鱼致病性鳗弧菌的分离鉴定及药敏试验
饶颖竹 梁静真 陈蓉 杨廷宝


摘要:【目的】了解海水养殖斜带石斑鱼弧菌病的病原,为生产中有效防治石斑鱼弧菌病提供科学依据。【方法】采用常规方法进行患病斜带石斑鱼病原菌分离,人工感染试验确定其致病性,以形态学观察、生理生化测试结合16S rRNA和gyrB基因序列分析等方法进行菌株鉴定,并以K-B纸片扩散法进行药敏试验。【结果】从广东省湛江市某养殖场患病斜带石斑鱼中分离获得1株优势菌株(M1),经人工感染试验证实其对斜带石斑鱼具有较强的致病性。M1菌株的16S rRNA序列和gyrB基因序列与GenBank数据库中的鳗弧菌具有较高相似性,其同源性均在95.7%以上。根据M1菌株的形态特征、生理生化特性及分子特征,可鉴定其属于弧菌属的鳗弧菌(Vibrio anguillarum)。药敏试验结果显示,M1菌株对庆大霉素、新生霉素、阿奇霉素、氟苯尼考、利福平、诺氟沙星和左氟沙星等7种药物高度敏感,对阿洛西林、强力霉素、链霉素、复方新诺明和甲氧苄啶等14种药物敏感。【结论】引起广东省湛江市某养殖场海水养殖患病斜带石斑鱼弧菌病的病原菌为弧菌属鳗弧菌,生产中可适度选用氟苯尼考、强力霉素、复方新诺明和甲氧苄啶等抗菌药物进行防治。
关键词: 斜带石斑鱼;鳗弧菌;16S rRNA序列;gyrB基因;药敏试验
中图分类号: S965.334.42 文献标志码:A 文章编号:2095-1191(2016)08-1416-07
Abstract:【Objective】In order to provide scientific basis for effective prevention and control of grouper vibriosis, the pathogen was isolated and identified from diseased Epinephelus coioides, and its drug sensitivity was tested. 【Method】The pathogen was isolated by conventional method, and its pathogenicity was determined by artificial infection. Based on morphological observation, physiological-biochemical test, and sequences analysis of 16S rRNA and gyrB gene, the pathogen was identified. And its drug sensitivity was tested by Kirby-Bauer disc diffusion method. 【Result】One dominant bacterium strain was isolated from diseased E. coioides from fish farm in Zhanjiang, Guangdong, and named M1. It was pathogenic to E. coioides in artificial challenge test. The sequence analysis showed that, 16S rRNA and gyrB gene sequences of M1 shared high homology(more than 95.7%) with Vibrio anguillarum from GenBank database. Moreover, the strain M1 was identified as V. anguillarum based on its morphology, physiological-biochemical characteristics and molecular features, and it was highly sensitive to gentamicin, novobiocin, azithromycin, florfenicol, rifampicine, norfloxacin and levofloxacin, and moderately sensitive to 14 kinds of drugs, viz., azlocillin, doxycycline, streptomycin, trimethoprim(TMP), SMZ+TMP and so on. 【Conclusion】V. anguillarum is pathogen causing vibriosis of E. coioides cultured in a fish farm of Zhanjiang, Guangdong, and can be controlled by florfenicol, doxycycline, SMZ+TMP, TMP, etc.
Key words: Epinephelus coioides; Vibrio anguillarum; 16S rRNA sequence; gyrB gene; drug sensitivity test
0 引言
【研究意义】斜带石斑鱼(Epinephelus coioides)俗称青斑,隶属于鲈形目(Perciformes)鮨科(Serranidae)石斑鱼亚科(Epinephelinae)石斑鱼属(Epinephelus),因具有生长快、适应能力强、饲养成活率高、经济价值高等特点,现已成为重要的海水鱼类养殖对象。近年来,随着石斑鱼养殖规模的不断扩大和养殖密度的增加,加上有毒有害物质的侵袭及水体环境污染等因素的影响,各种石斑鱼病害频发(张永嘉,1990;贝维全等,2010;王大鹏等,2012),给其养殖业带来严重的经济损失。在石斑鱼养殖过程中,极易出现神经坏死病毒病、白點病、鱼虱病、烂鳃病和细菌性疾病,而弧菌是引起海水养殖石斑鱼细菌性疾病的最主要病原菌之一(罗鸣等,2013),因此,加强弧菌病原研究对有效防治石斑鱼弧菌病及提高其养殖效益具有重要意义。【前人研究进展】弧菌是水产养殖环境中最常见的优势细菌类群,其中鳗弧菌(Vibrio anguillarum)又是水产养殖中最常见的条件性致病菌。鳗弧菌是一类革兰氏阴性杆菌,广泛存在于海水、沉积物和水生动物体内,当养殖环境条件不利或水产动物受伤时会诱发一系列病症,造成大规模暴发(张新中等,2007)。肖慧等(1999)从山东发生烂鳃、烂尾病的鲈鱼体内分离鉴定出1株鳗弧菌,人工感染有较强的致病性;李清禄和陈强(2001)从福建海水养殖的患病大黄鱼体内分离获得2株致病性鳗弧菌,并进行药敏试验和临床治疗试验;莫照兰等(2002)从山东患溃烂症的养殖牙鲆体内分离获得1株致病性鳗弧菌,与弧菌属的同源性高达94%~98%;陈吉祥等(2005)、张晓君等(2009)分别从山东沿海患病大菱鲆体内分离鉴定出多株鳗弧菌,并检测了部分毒力基因和主要外膜蛋白基因;Mikkelsen等(2007)从挪威的大西洋鳕鱼体上分离鉴定出不同血清型的致病性鳗弧菌;赵鲁宁等(2015)收集了自1999年以来的山东、河北和江苏等地海水养殖鱼类的31株鳗弧菌,通过生理生化、16S rRNA基因序列、血清分型和抗生素敏感性研究,发现我国海水养殖鱼类携带的鳗弧菌普遍存在多重耐药性。【本研究切入点】近年来,石斑鱼弧菌病暴发频繁,严重制约了其养殖业的健康发展,但至今有关广东省海水养殖石斑鱼弧菌病的报道较少(刘荭和江育林,2002),尚未见针对石斑鱼鳗弧菌分子鉴定、致病性和药物敏感性的研究报道。【拟解决的关键问题】对海水养殖患病斜带石斑鱼的病原菌进行分离和致病性研究,在常规微生物分类的基础上采用16S rRNA和gyrB基因序列分析进行分子生物学鉴定及药敏试验,旨在了解斜带石斑鱼弧菌病的病原,为生产中有效防治石斑鱼弧菌病提供科学依据。
1 材料与方法
1. 1 试验材料
患病斜带石斑鱼采自广东省湛江市某养殖场;供人工感染试验的斜带石斑鱼购自广东省湛江市东海岛某养殖场(80尾,体重25~35 g,体长10~15 cm),活动正常,体表无损和体色正常。硫代硫酸盐柠檬酸盐胆盐蔗糖(TCBS)琼脂培养基和弧菌科细菌生理生化鉴定试剂盒购自广东环凯微生物科技有限公司,药物敏感纸片购自杭州微生物试剂有限公司,PCR试剂盒和DNA纯化回收试剂盒均购自宝生物工程(大连)有限公司,16S rRNA基因和gyrB基因的扩增引物由生工生物工程(上海)股份有限公司合成。
1. 2 病原菌分离
无菌条件下从患病斜带石斑鱼肝脏、溃烂皮肤等部位取样,接种在TCBS培养基上,30 ℃培养20~24 h后挑取优势单菌落再次划线接种在TCBS培养基上,以获得纯培养菌株(M1)。挑取单菌落移入LB液体培养基中,150 r/min振荡培养12 h后进行生理生化鉴定,同时挑取相同单菌落进行革兰氏染色鉴定。最后将扩大培养的菌液加入灭菌甘油至终浓度为20%,-70 ℃保存备用。
1. 3 人工感染试验
将M1菌株接种于普通营养肉汤培养基上,30 ℃培养12 h后用无菌0.1 mol/L PBS(pH 7.0)振荡清洗、离心,弃上清液,再用0.1 mol/L PBS重悬菌体,采用平板计数法测定菌浓度。菌液用0.1 mol/L PBS稀释成107 CFU/mL。挑取80尾健康斜带石斑鱼,随机均分为4组,其中2组为试验组,每尾腹腔注射0.1 mL菌液,剩下2组为对照组,每尾注射相同剂量的0.1 mol/L PBS(pH 7.0)。注射后每天观察记录斜带石斑鱼的发病和死亡情况,连续观察10 d,对死亡鱼及时解剖,并以相同方法对致病菌再次进行分离鉴定。以引起试验鱼发病死亡并能重新分离到感染菌株作为分离菌株致病与否的判定标准。
1. 4 细菌鉴定
1. 4. 1 形态观察及常规生理生化测试 挑取M1单菌落接种于TCBS培养基上,30 ℃培养18~24 h,观察TCBS培养基上菌落的生长特征,经革兰氏染色后光学显微镜观察其形态、大小,表型特征鉴定参照Schiewe等(1981)的方法。采用弧菌科细菌生理生化鉴定试剂盒对纯化的M1菌株进行生理生化特性鉴定,并根据鉴定结果判定弧菌种类。
1. 4. 2 16S rRNA和gyrB基因序列测定与分析 将M1菌株接种于普通营养肉汤培养基上,30 ℃振荡培养12 h后取10 μL菌液95 ℃灭活5 min,菌液上清液可直接作为PCR模板。16S rRNA序列的PCR扩增引物为27F(正向引物):5'-AGAGTTTGATC(A/C)TGGCTCA
G-3'和1492R(反向引物):5'-TACGG(C/T)TACCTTG
TTACGACTT-3'。PCR反应体系50.0 μL,即5.0 μL 10×PCR缓冲液,5.0 μL的2.5 mmol/L dNTPs,4.0 μL的5 μmol/L引物,1.25 U Taq DNA聚合酶,5.0 μL PCR模板,去离子水补足至50.0 μL。扩增程序:94 ℃预变性5 min;94 ℃ 40 s,55 ℃ 40 s,72 ℃ 90 s,进行30个循环;72 ℃延伸7 min。
gyrB基因序列的PCR扩增引物为UP-1(正向引物):5'-GAAGTCATCATGACCGTTCTGCA(C/T)GC(A/T/G/C)GG(A/T/G/C)GG(A/T/G/C)AA(A/G)TT(C/
T)GA-3'和UP-2r(反向引物):5'-AGCAGGGTACGGA
TGTGCGAGCC(A/G)TC(A/T/G/C)AC(A/G)TC(A/
T/G/C)GC(A/G)TC(A/T/G/C)GTCAT-3'。除引物不同外,PCR反应体系及其扩增程序与16S rRNA序列的扩增一致。PCR产物经琼脂糖电泳确定特异条带后,进行胶回收纯化,送至生工生物工程(上海)股份有限公司进行测序。测序结果在GenBank数据库中进行BLAST比较,再采用ClustalX进行多序列比对,序列一致性由DNASTAR的MegAlign进行计算,采用MEGA 3.0邻接法构建系统发育进化树。
1. 5 药敏试验
按常规的K-B纸片扩散法进行病原菌的药敏试验,再根据美国临床实验室标准化协会(CLSI)药敏试验判断标准判断药敏结果。
2 結果与分析
1. 1 M1菌株的形态特征及生理生化特性
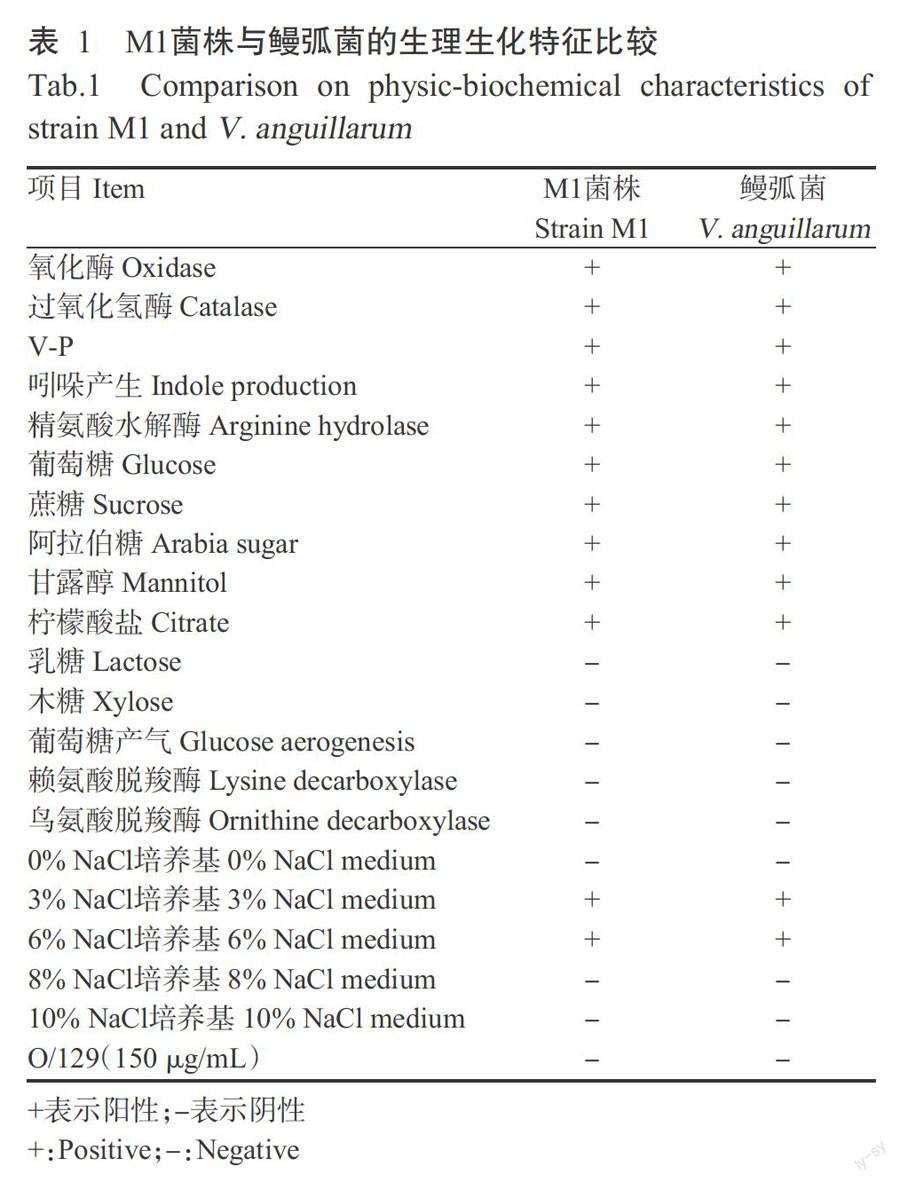
M1菌株在TCBS培养基上30 ℃培养18~24 h,其菌落呈黄色,直径约2.0 mm。显微镜下观察发现,M1菌体半透明、杆状、略显弧形、可运动,菌体革兰氏染色呈阴性。常规生理生化特性测试结果表明,M1菌株的氧化酶反应、葡萄糖磷酸盐胨水反应(V-P)、蛋白胨水(吲哚)试验和精氨酸双水解酶试验呈阳性,能发酵葡萄糖、蔗糖、阿拉伯糖和甘露醇,对弧菌抑制剂O/129(150 μg/mL)敏感。在无盐培养基(无盐胨水)上不生长,在3%~6% NaCl胨水培养基上生长,葡萄糖产气、赖氨酸脱羧酶和鸟氨酸脱羧酶等反应呈阴性(表1)。上述生理生化特性与鳗弧菌的特征特性基本一致,参考《常见细菌系统鉴定手册》、《伯杰鉴定细菌学手册》和弧菌生理生化鉴定试剂盒说明,初步判定M1菌株为鳗弧菌(V. anguillarum)。
2. 2 人工感染试验结果
腹腔注射M1菌株的活菌液3~5 d后,试验组斜带石斑鱼病情加重,陆续死亡,8 d后试验组的斜带石斑鱼累计死亡率达100%,而对照组斜带石斑鱼未表现出任何病症。人工感染发病的斜带石斑鱼主要表现为无力、身体不平衡、体表溃烂、腹水、肝脏肿大糜烂,与自然发病斜带石斑鱼的临床症状相似。从人工感染死亡斜带石斑鱼可再次分离获得与M1菌株形态、生理生化特性、16S rRNA和gyrB基因序列均一致的菌株,表明所分离获得的M1菌株即为斜带石斑鱼的致病菌。
2. 3 基因序列分析结果及其系统发育进化树
以引物27F和1492R扩增的16S rRNA序列长度为1509 bp(图1),GenBank登录号JX966409。从NCBI核苷酸数据库中选取21株弧菌菌株的16S rRNA序列进行比对分析,结果表明,M1菌株的16S rRNA序列与鳗弧菌(AB680389)16S rRNA序列的一致性最高,为99.8%(表2)。由16S rRNA序列构建的弧菌系统发育进化树(图2)可知,M1菌株与鳗弧菌AB680389和NR042509、标准菌株(ATCC19264)、奥德弧菌(V. ordalii,AY530930)聚为一支,对应的16S rRNA序列一致性依次为99.8%、99.7%、97.8%和99.1%;M1菌株與其他弧菌的16S rRNA序列一致性在94.2%~99.1%(表2)。
由引物UP-1和UP-2r扩增的gyrB基因序列长度为1259 bp(图1),GenBank登录号JX966408。BLAST分析结果显示,与该基因序列同源性较高的100个序列均为弧菌属细菌的gyrB基因序列。选取19个弧菌菌株的gyrB基因序列构建系统发育进化树,结果表明,M1菌株与鳗弧菌AB373054和JQ698507聚为一支(图3),对应的gyrB基因序列一致性分别为99.2%和98.7%(表2)。此外,M1菌株与鳗弧菌AB373055、AB373056和AB373057的gyrB基因序列一致性均为98.3%,与鳗弧菌标准菌株(ATCC19264)的序列一致性为95.7%,与奥德弧菌(AB298237)的序列一致性为98.5%,与其他弧菌的gyrB基因序列一致性在79.9%~83.6%(表2)。
综合M1菌株的形态特征、生理生化特性、16S rRNA和gyrB基因序列分析结果,将其鉴定为弧菌属的鳗弧菌(V. anguillarum)。
2. 4 药敏试验结果
由表3可以看出,M1菌株对庆大霉素、新生霉素、阿奇霉素、氟苯尼考、利福平、诺氟沙星和左氟沙星等7种抗菌药物高度敏感,对阿洛西林、哌拉西林、壮观霉素、头孢克洛、头孢曲松、头孢哌酮、头孢咪唑、头孢拉定、多黏霉素B、强力霉素、甲氧苄啶、链霉素、四环素和复方新诺明等14种药物敏感,对青霉素、苯唑霉素、氨苄青霉素、罗红霉素、克林霉素、阿莫西林、甲硝唑、头孢呋辛和杆菌肽等9种药物不敏感(耐药)。
3 讨论
弧菌是海水养殖环境中最常见的优势细菌类群,其中鳗弧菌是危害鱼类的主要条件性致病菌(罗鸣等,2013),在某种应激因素刺激使鱼体抵抗力下降的情况下极易造成感染发病,可引起世界范围内的多种海水和淡水养殖鱼类发生弧菌病(Mikkelsen et al.,2007),也是我国鲈鱼、牙鲆、大菱鲆和大黄鱼等海水养殖鱼类的主要病原菌(李清禄和陈强,2001;莫照兰等,2002;陈吉祥等,2005),给水产养殖业造成较大危害。石斑鱼是广东沿海地区最重要的养殖鱼类之一,由于养殖方式多样、养殖密度高,鳗弧菌病也是石斑鱼养殖过程中需重点防治的疾病(罗鸣等,2013)。本研究从广东省湛江市患病斜带石斑鱼中分离获得1株优势菌株(M1),经人工感染试验,证实M1菌株对斜带石斑鱼表现出较强的致病性,人工感染后3~5 d发生死亡,临床症状以肝脏肿胀糜烂、发黑为特征,与鲈鱼(肖慧等,1999)和大菱鲆(陈吉祥等,2005)等感染鳗弧菌的症状类似。
有关弧菌的鉴定,过去多采用以形态学和生理生化特征为主的表型鉴定方法。随着分子生物学的发展,现代细菌分类鉴定已从传统的表型分类转向基因型分类(Clarridge,2004)。小亚单位核糖体RNA的16S rRNA约1500 bp,由可变区和保守区交替组成,是细菌分类鉴定中最常用的指标工具(Janda and Abbott,2007),但16S rRNA适用于描述较远的系统发育关系,对于一些亲缘关系密切的细菌,还需用其他基因序列进行辅助分析(侯晓丽和陈智,2005)。gyrB基因是编码细菌DNA促旋酶(Gyrase)的亚单位,属于单拷贝的看家基因,平均碱基替换率比16S rRNA的速率快,且不发生水平转移,普遍存在于各种细菌中,满足作为系统发育分析靶基因的要求,能克服16S rRNA难以准确区分细菌近缘种的困难(La Duc et al.,2004)。本研究在进行细菌形态特征和生理生化特性等常规细菌检测的基础上,进行16S rRNA和gyrB基因分子水平鉴定,结果表明,M1菌株的16S rRNA序列与鳗弧菌AB680389和NR042509、鳗弧菌标准菌株(ATCC19264)、奥德弧菌(AY530930)聚为一个类群,但与双氮养弧菌(V. diazotrophicus)、河口弧菌(V. aestuarianus)和创伤弧菌(V. vulnificus)的序列一致性也较高,均在97.0%以上,即采用16S rRNA序列难以将M1菌株鉴定到种;M1菌株的gyrB基因序列除了与鳗弧菌和奥德弧菌的序列一致性达95.7%~99.2%外,与其他弧菌的序列一致性均在90.0%以下,说明在鳗弧菌鉴别方面gyrB基因比16S rRNA序列更具优越性。
由于操作方便、见效快和疗效好,使用抗菌药物仍是控制水生养殖动物疾病的主要手段(张新中等,2007;王玉堂和吕永辉,2011)。肖慧等(1999)研究认为,痢特灵、呋喃妥因、氯霉素、复方新诺明、美洛西林、新生霉素、利福平和新霉素等10种药物对鲈鱼的鳗弧菌有显著抑制作用,可有效降低鳗弧菌引发的鲈鱼苗烂鳃、烂尾病。张昕和蔡俊鹏(2003)研究表明,鳗弧菌对氯霉素、庆大霉素敏感,对卡那霉素、头孢娄新、青霉素、四环素、红霉素和链霉素已表现出耐药性。公衍军等(2006)研究发现,从发病鲈鱼中分离获得的鳗弧菌对青霉素、氨苄青霉素、强力霉素、磺胺嘧啶等常用抗菌药已产生耐药性,但对新生霉素、呋喃妥因、利福平、新霉素敏感。赵鲁宁等(2015)用ATB药敏检测系统检测了31株海水养殖鱼类鳗弧菌的耐药性,结果显示,鳗弧菌对β-内酰胺类(阿莫西林、阿莫西林/克拉维酸、苯唑西林、青霉素)、林可酰胺类(克林霉素)、硝咪唑类(甲硝唑)和夫西地酸的耐药率为100%。本研究中的药敏试验结果表明,鳗弧菌M1菌株对氨基糖苷类的庆大霉素和新生霉素、大环内酯类的阿奇霉素、酰胺类的氟苯尼考、利福霉素类的利福平及氟喹诺酮类的诺氟沙星和左氟沙星等7种抗菌药物高度敏感,对β-内酰胺类的青霉素、苯唑霉素、氨苄青霉素、阿莫西林,林可酰胺类的克林霉素,硝咪唑类的甲硝唑,糖肽类的杆菌肽等7种药物具有耐药性,与公衍军等(2006)、赵鲁宁等(2015)报道的试验研究结果基本一致。目前,我国农业部批准使用的水产养殖动物国标兽药抗菌药物有14个品种(郭秀平等,2014;中华人民共和国农业部,2015),包括本研究中斜带石斑鱼鳗弧菌菌株对之高度敏感的氟苯尼考粉(水产用)及敏感的盐酸多西环素粉(强力霉素,水产用)、复方磺胺甲噁唑粉(复方新诺明,水产用)和复方磺胺嘧啶粉(甲氧苄啶,水产用)。因此,在生产中可适度选用氟苯尼考、强力霉素、复方新诺明和甲氧苄啶等抗菌药物控制广东省湛江地区海水养殖斜带石斑鱼的鳗弧菌病。
4 结论
引起广东省湛江市某养殖场海水养殖斜带石斑鱼弧菌病的病原菌为弧菌属鳗弧菌,生产中可适度选用氟苯尼考、强力霉素、复方新诺明和甲氧苄啶等抗菌药物进行防治。
参考文献:
贝维全,古荣锋,贾志军. 2010. 石斑鱼新型网箱健康养殖技术[J]. 河北渔业,(9):10-11.
Bei W Q,Gu R F,Jia Z J. 2010. A healthy cultivation technique for Epinephelus awoara in novel net cage[J]. Hebei Fishe-
ries,(9):10-11.
陳吉祥,李彩凤,颜显辉,李筠,池政豪,薛学温,王印庚. 2005. 大菱鲆病原鳗弧菌生物学及分子特征研究[J]. 高技术通讯,15(6):92-96.
Chen J X,Li C F,Yan X H,Li Y,Chi Z H,Xue X W,Wang Y G. 2005. Biological and molecular characteristics of five pathogenic Vibrio anguillarum strains isolated from diseased turbot(Scophthalmus maximus)[J]. High Technology Letters,15(6):92-96.
公衍军,陈吉祥,杜萌,李爱娟,李筠,张晓华. 2006. 不同类型抗菌素对致病性鳗弧菌外膜蛋白表达的影响[J]. 中国水产科学,13(5):794-799.
Gong Y J,Chen J X,Du M,Li A J,Li Y,Zhang X H. 2006. Effects of several antibiotics on expression of outer membrane proteins of Vibrio anguillarum W1[J]. Journal of Fishery Sciences of China,13(5):794-799.
郭秀平,邓国成,杨小静. 2014. 我国现行水产养殖动物使用国标兽药的种类[J]. 海洋与渔业,(3):57-59.
Guo X P,Deng G C,Yang X J. 2014. Kinds of current national standard of veterinary drugs for aquaculture animal[J]. Ocean and Fishery,(3):57-59.
侯晓丽,陈智. 2005. 分类及鉴别细菌的新靶标——gyrB基因[J]. 国外医院·流行病学传染病学分册,32(1):38-41.
Hou X L,Chen Z. 2005. New target for classification and identification of bacteria——gyrB gene[J]. Foreign Medical Scie-
nces Epidemiology Lemology,32(1):38-41.
李清禄,陈强. 2001. 海水网箱养殖大黄鱼细菌性病原鉴定与感染治疗研究[J]. 应用与环境生物学报,7(5):489-493.
Li Q L,Chen Q. 2001. Identification of bacterial pathogen and treatment after infection of Pseudosciaena crocae in marine cage culture[J]. Chinese Journal of Applied and Environmental Biology,7(5):489-493.
刘荭,江育林. 2002. 中国南部养殖石斑鱼“肿胀病”的研究(英文)[J]. 华中农业大学学报,21(3):273-277.
Liu H,Jiang Y L. 2002. Studies on the“Swelling Disease” in cultured groupers(Epinephelus spp.) in South of China[J]. Journal of Huazhong Agricultural University,21(3):273-277.
罗鸣,陈傅晓,刘龙龙,李卫东,曾关琼,谭围,李向民. 2013. 我国石斑鱼养殖疾病的研究进展[J]. 水产科学,32(9):549-554.
Luo M,Chen F X,Liu L L,Li W D,Zeng G Q,Tan W,Li X M. 2013. Progress in disease research of grouper aquaculture in China[J]. Fisheries Science,32(9):549-554.
莫照兰,茅云翔,陈师勇,张培军. 2002. 一株牙鲆皮肤溃烂症病原菌的鉴定[J]. 微生物学报,42(3):263-269.
Mo Z L,Mao Y X,Chen S Y,Zhang P J. 2002. Classification for one pathogenic Vibrio anguillarum strain isolated from skin- ulcer flounder[J]. Acta Microbiologica Sinica,42(3):263-269.
王大鹏,曹占旺,谢达祥,甘西. 2012. 石斑鱼的研究进展[J]. 南方农业学报,43(7):1058-1065.
Wang D P,Cao Z W,Xie D X,Gan X. 2012. Research progress in Epinephelus industry[J]. Journal of Southern Agriculture,43(7):1058-1065.
王玉堂,吕永辉. 2011. 第一批正式转为国家标准的渔药 第一部分:抗微生物药(连载一)[J]. 中国水产,(9):44-47.
Wang Y T,Lü Y H. 2011. The first official to national standards of fishery drugs Part 1:Antimicrobial drugs(Serial 1)[J]. China Fisheries,(9):44-47.
肖慧,李军,王祥红,纪伟尚,徐怀恕. 1999. 鲈鱼苗烂鳃、烂尾病病原菌的研究[J]. 青岛海洋大学学报(自然科学版),29(1):87-93.
Xiao H,Li J,Wang X H,Ji W S,Xu H S. 1999. Studies on pathogens of rotted gill and rotted caudal fins of seaperch (Lateolabrax japonicus) fry[J]. Journal of Ocean University of Qingdao(Natural Science Edition),29(1):87-93.
张晓君,阎斌伦,秦国民,秦蕾,徐静. 2009. 鱼类4种病原弧菌耐药性及主要外膜蛋白OmpK基因检测[J]. 海洋湖沼通报,(3):98-104.
Zang X J,Yan B L,Qin G M,Qin L,Xu J. 2009. Detection of drug resistance and outer embrance protein OmpK gene of 4 pathogenic Vibrio sp. from fish[J]. Transactions of Oceanology and Limnology,(3):98-104.
张昕,蔡俊鹏. 2003. 四种海洋致病弧菌对抗生素敏感性的测定[J]. 华南理工大学学报(自然科学版),31(9):66-69.
Zhang X,Cai J P. 2003. Determination of the antibiotic susceptibilities of four marine pathogenic Vibrios[J]. Journal of South China University of Technology(Natural Science Edition),31(9):66-69.
张新中,张世秀,李海平,谢珍玉,周永灿. 2007. 海水养殖动物致病性(Pathogenicity)鳗弧菌(Vibroan guillarum)的研究综述[J]. 现代渔业信息,22(1):16-19.
Zhang X Z,Zhang S X,Li H P,Xie Z Y,Zhou Y C. 2007. Review on research of Vibrio anguillarum-pathogenicity to aquatic animals in mariculture[J]. Modern Fisheries Information,22(1):16-19.
张永嘉. 1990. 湛江茂名海区饲养石斑鱼的鱼病调查[J]. 海洋科学,(4):53-57.
Zhang Y J. 1990. Fish diseases of farmed grouper(Epinephelus spp.) in the Zhanjiang and Maoming areas[J]. Marine Scie-
nces,(4):53-57.
趙鲁宁,李贵阳,李杰,李晨,张乐萃,莫照兰. 2015. 海水养殖鱼类鳗弧菌(Vibrio anguillarum)临床分离株的血清型和抗生素耐药谱[J]. 海洋与湖沼,46(5):1109-1118.
Zhao L N,Li G Y,Li J,Li C,Zhang L C,Mo Z L. 2015. Serotyping and antibiotics sensitivity of Vibrio anguillarum strains isolated from marine farmed fish[J]. Oceanologia et Limnologia Sinica,46(5):1109-1118.
中华人民共和国农业部. 2015. 中华人民共和国农业部公告 第2292号[EB/OL]. http://www.moa.gov.cn/govpublic/SYJ/201509/ t20150907_4819267.htm.
Ministry of Agriculture of the Peoples Republic of China. 2015. Ministry of Agriculture of the Peoples Republic of China Announcement No. 2292[EB/OL]. http://www.moa.gov.cn/govpublic/ SYJ/201509/t20150907_4819267.htm.
Clarridge J E. 2004. Impact of 16S rRNA gene sequence analysis for identification of bacteria on clinical microbiology and infectious diseases[J]. Clinical Microbiology Reviews,17(4):840-862.
La Duc M T,Satomi M,Agata N,Venkateswaran K. 2004. gyrB as a phylogenetic discriminator for members of the Bacillus anthracis-cereus-thuringiensis group[J]. Journal of Microbiologycal Methods,56(3):383-394.
Janda M J,Abbott S L. 2007. 16S rRNA gene sequencing for bacterial identification in the diagnostic laboratory:pluses,perils,and pitfalls[J]. Journal of Clinical Microbiology,45(9):2761-2764.
Mikkelsen H,Lund V,Martinsen L C,Gravningen K,Schr■der M B. 2007. Variability among Vibrio anguillarum O2 isolates from atlantic cod(Gadusmorhua L.):Characterisation and vaccination studies[J]. Aquaculture,266(1-4):16-25.
Schiewe H M,Trust J T,Crosaw H J. 1981. Vibrio ordalii sp. nov.:A causative agent of Vibriosis in fish[J]. Current Microbiology,6(6):343-348.
(责任编辑 兰宗宝)

