处理认知冲突,让化学史“说话”
叶兰峰 孔琴飞 潘小欧


摘要:高中化学教学中由于受到缺乏先进仪器等客观条件的制约,无法对物质开展微观结构的实验研究,难以解决教学中的认识冲突[1]。作者通过构建化学史解决认知冲突,渗透化学学科思想,让学生感悟化学史实,尊重化学史。
关键词:认知冲突;化学史;原子核外电子的排布
文章编号:1008-0546(2016)08-0024-03 中图分类号:G633.8 文献标识码:B
doi:10.3969/j.issn.1008-0546.2016.08.009
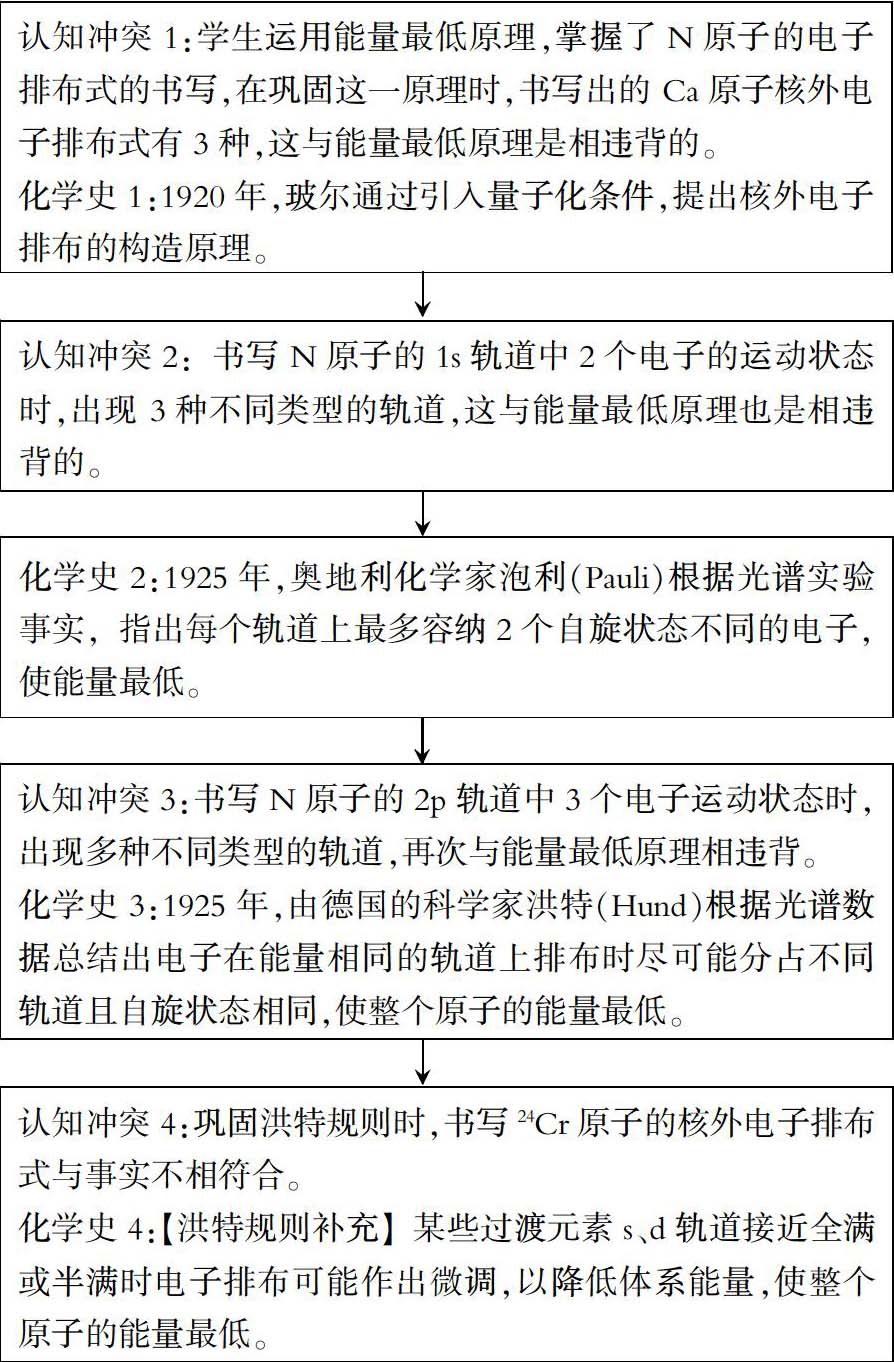
认知冲突是指人在认知发展过程中的原有概念或认知结构与现实情境不相符时心理上所产生的对立性矛盾或冲突。一旦引发这种认知冲突,就会引起学生认知心理的不平衡,就能激起学生的求知欲和好奇心,使学生产生解决这种认知冲突获得心理平衡的动机。运用直观实验、运用客观事实、运用生活发现等引发认知冲突,相信大部分老师都能运用自如,而采取哪些方式去解决这种认知冲突,达成新概念的建立是化学教学中的难点。
一、问题提出
苏教版《物质结构与性质》作为继高一年级必修课程《化学1》、《化学2》之后的选修课程,它将从原子、分子水平上帮助学生认识物质结构的规律;以微粒之间不同的作用力为线索,侧重研究不同类型物质的有关性质,使学生初步认识物质的结构与性质之间的关系,能从物质结构决定性质的视角去解释一些简单的化学现象,预测物质的有关性质;帮助学生形成有关物质构成的科学观念,学习科学思维和科学研究的方法,提高学生分析问题和解决问题的能力。高中化学教学中由于受到缺乏先进仪器等客观条件的制约,无法对物质开展微观结构的实验研究,难以解决教学中的认识冲突。笔者查阅大量文献,关于苏教版“物质结构与性质”的教学论文较少,下面就以“原子核外电子的排布”为例,让化学史“说话”解决认识冲突从而推进课堂教学的有序前行,希望能够引起同行们对该教材的重视达到抛砖引玉的作用。
二、设计思想
本课时的教学从宏观世界与微观世界共同点:能量越低越稳定这一自然规律入手,以研究氮原子核外电子排布为主线,在思考中遇到认知冲突,借用化学史解决冲突,在巩固概念中又遇认知冲突,再用化学史解决冲突,依次循环促使概念得以深化、内化。
三、教学实录
1. 初遇冲突,“玻尔”说话
[生活导课]水往低处流,说明能量越低越稳定是自然界万物遵循的规律之一。宏观物质如此,微观世界也不例外,处于能量最低状态的原子叫基态原子,这样的原子也最稳定。
[问题思考1]多电子原子核外电子排布有哪些规律才能使能量最低?请同学们以氮原子为例,写出该原子的原子结构示意图。
[学生阐述]分层排布;每层最多不超过2n2个;最外层最多不超过8个,次外层最多不超过32个等。
[学生板演]
[问题思考2]为什么K层最多排2个?L层最多排8个?
[学生释疑]K层只有1s轨道,一个原子轨道最多排2个电子;L层有2s,2p两种类型轨道,四个原子轨道一共最多排8个电子。
[机理支撑]原子核外电子先占据能量低的轨道,然后依次进入能量高的轨道,这样使整个原子处于最低的能量状态。因此,氮原子的电子排布式为1s22s22p3。
[跟进强化1]请同学们书写O和Cl原子的核外电子排布式,并分享书写电子排布式的经验。
设计意图:通过生活中的宏观现象水往低处流的本质是万物循环的规律 (低能量的状态是稳定的)引出微观世界中的原子核外电子排布可以消除学生对于新知识内容的陌生感。然后通过先行组织者理论提出[问题思考1]、[问题思考2],完全符合最近发展区理论,学生运用已有知识与经验加深了对能量最低原理的理解,再通过[跟进强化1]达成知识的巩固与落实。
[跟进强化2]请同学们书写Ca原子的核外电子排布式。
[问题思考3]Ca原子的核外电子排布式是1s22s22p63s23p64s2、1s22s22p63s23p63d14s1还是1s22s22p63s2 3p63d2呢?说说你的理由。
[“玻尔”说话]1920年,玻尔通过引入量子化条件,提出核外电子排布的构造原理,如图1所示。
[学生阐述]Ca原子的核外电子排布式是1s22s22p63s23p64s2。依据构造原理从电子层角度来看,第1层到第7层,能量依次升高;从能级角度来看,s,p,d,f能量依次升高,总体符合大多数原子核外电子排布,但局部存在能级交错的现象,如4s比3d低。
[跟进强化3] 请同学们书写Fe原子的核外电子排布式。
[学生阐述]Fe原子的原子序数是26,在核外电子排布过程中出现4s比3d低的能级交错现象,所以Fe原子的核外电子排布式是1s22s22p63s23p63d64s2。
[排布结论] 原子核外电子排布需要遵循能量最低原理。
设计意图:学生通过[跟进强化2]写出了Ca原子的核外电子排布式有3种与已学知识能量最低原理矛盾而陷入思考僵局。此时,化学史玻尔构造原理的出现让学生有了雪中送炭的感觉,紧接着又以Fe原子的核外电子排布式加以明确4s轨道的能量比3d轨道的能量低,从而将能量最低原理落实到了实处。
2. 再遇冲突,“泡利”说话
3. 后遇冲突,“洪特”说话
[问题思考5]N原子的2p三个轨道上的三个电子运动状态又如何?请同学们画出。
[学生板演]
[跟进强化4]请同学们书写O和Cl原子的核外电子轨道表示式。
[排布结论] 原子核外电子的排布在遵循能量最低原理和泡利不相容原理,还需符合洪特规则。
设计意图:[问题思考5]是[问题思考4]的一个延续, N原子的2p轨道中的三个电子运动状态种类繁多,如何抉择。化学史洪特规则的出现,不仅让学生作出了快而准的选择结论,更让学生掌握核外电子轨道表示式的书写法则。
[跟进强化5]请同学们书写24Cr原子的核外电子排布式和轨道表示式。
[学生板演]24Cr原子的核外电子排布式:1s22s2 2p63s23p63d44s2
24Cr原子的核外电子轨道表示式:略
[资料呈现] 根据实验测定,24Cr原子的电子排布式:1s22s22p63s23p63d54s1。
[问题思考7]难道这样排布会使原子能量达到最低?
[洪特规则补充] 某些过渡元素s、d轨道接近全满或半满时电子排布可能作出微调,以降低体系能量,使整个原子的能量最低。
[课堂追问]若原子轨道3d全满,则原子序数最小多少?
[尊重事实]科学研究必须建立在实验的基础上,因此原子核外电子排布要以实验测定的结果为准。
[教学过渡] 原子序数较大原子的核外电子排布式书写比较复杂,为了避免电子排布式书写过繁,可以把内层电子已达到稀有气体结构的部分写成“原子实”,以稀有气体的元素符号外加方括号表示。例如,钠原子的电子排布式可表示为1s2 2s2 2p6 3s1 或 [Ne]3s1。3s1就是钠原子的外围电子,观察下图2,请说说各原子外围电子的特点。
[学生阐述]对于主族元素而言,外围电子就是最外层电子,对于副族元素而言,外围电子除了最外层电子,还包括次外层d轨道上的电子。
[跟进强化6] 请同学们书写Ca和Fe原子的简化电子排布式。
设计意图:学生依据已学知识信心满满书写出的24Cr原子的核外电子排布式竟然与实验测定结果24Cr原子的核外电子排布式存在较大差异从而再次引发认知冲突。实验是化学的灵魂,尊重实验是每位化学工作者与学习者共同的前提与默契,洪特规则的补充为大家解释了这一特殊排布。然后通过逆向提问“若原子轨道3d全满,则原子序数最小多少?”促使学生充分理解洪特规则与洪特规则补充。学生通过观察表1,对比分析主族与副族明确外围电子排布式,掌握简化核外电子排布式的表示方法。
[问题思考8]为什么多电子原子核外电子排布的规律是分层排布;每层最多不超过2n2个;最外层最多不超过8个,次外层最多不超过32个?
设计意图:[问题思考8] 代替以往习题式的课后练习,不仅达到习题式课后练习的功效,更是对课堂概念的引入作了呼应,对本课时的概念进行了内化。学生通过思考,体会到化学是讲道理的,知其然更要知其所以然,也能明白教材知识内容安排的合理顺序。
四、教学启示
在无法借用化学实验探究的前提下,一节枯燥的概念课只要化学教育工作者用心去设计也可呈现出不一样的滋味。本课时就是通过学生构建认知冲突,运用化学史解决认知冲突,渗透化学学科思想,感悟化学史实,使学习者隐约感觉到化学学科的发展是站在巨人的肩膀上不断成长的。
参考文献
[1] 徐立海, 黄君明. 物理教学中的“引发认知冲突”策略[J]. 物理教师, 2011, 32(3): 15-17
[2] 王祖浩.高中化学教学参考书[M].南京:江苏教育出版社,2005

