中脑导水管周围灰质D-丝氨酸促进大鼠电针耐受
孙梦婕,李尤艳,2,肖智
( 1.遵义医学院研究生学院; 2.遵义市第一人民医院眼科; 3.遵义医学院医学与生物学研究中心,贵州遵义 563000)
中脑导水管周围灰质D-丝氨酸促进大鼠电针耐受
孙梦婕1,李尤艳1,2,肖智3
( 1.遵义医学院研究生学院; 2.遵义市第一人民医院眼科; 3.遵义医学院医学与生物学研究中心,贵州遵义563000)
【摘要】目的:观察大鼠中脑导水管周围灰质( PAG)中D-丝氨酸( D-ser)在大鼠电针耐受形成和维持中的作用并探讨其初步的中枢神经机制。方法: SD大鼠给予多次电针刺激后建立大鼠电针耐受模型;观察电针耐受大鼠机械痛阈( MWT)变化百分数的改变; ELISA法检测大鼠在电针耐受前后PAG中D-ser水平变化;电针耐受大鼠PAG微量注射星形胶质细胞抑制剂-氟代柠檬酸( Fc)后给予电针刺激观察大鼠MWT变化百分数改变。结果:大鼠经多次电针刺激后,其MWT变化百分数逐渐降低伴PAG中D-ser水平逐渐升高;电针耐受大鼠给予Fc后再电针刺激,PAG中D-ser水平下降,大鼠MWT变化百分数升高。结论:多次外周穴位电针刺激导致大鼠电针耐受形成,其机制与PAG中星形胶质细胞活化引起D-ser释放增加有关。
【关键词】电针;耐受; D-丝氨酸;中脑导水管周围灰质
网络出版时间: 2016-3-4 10∶16网络出版地址: http: / /www.cnki.net/kcms/detail/51.1254.R.20160304.1016.018.html
临床上对多种疼痛采用外周穴位针刺方法进行镇痛治疗,取得很好的镇痛效果。电针( electroacupuncture,EA)是对传统手针进行改进后的一种针刺方法,它通过在外周穴位给予电刺激进而产生镇痛作用。临床已将电针用于手术后疼痛、头痛、痛经、肌筋膜痛、腰背疼痛等多种疾病的镇痛治疗,但长时间或反复多次给予人或动物电针刺激,电针的镇痛效应会逐渐减低以致消失,表现为电针耐受( electroacupuncture tolerance)。由于电针耐受的出现极大的限制了电针在临床镇痛治疗中的运用,因此,对电针耐受形成和维持机制的研究非常重要。
多年研究结果证实,机体存在一个内源性的疼痛调节系统,包括:下行性疼痛抑制系统和下行性疼痛易化系统。中脑导水管周围灰质( periaqueductal gray,PAG)是位于中脑顶盖和被盖之间,围绕中脑导水管的环形区域。PAG是机体内源性镇痛系统的关键部位,在疼痛调制和吗啡耐受的形成、维持机制中均有重要作用[1]。
既往认为细菌和无脊椎动物体内存在D型氨基酸而哺乳动物体内仅存在L型氨基酸,随着研究方法和仪器的进步发现在哺乳动物大脑中也存在D型氨基酸,例如: D-天冬氨酸,D-丝氨酸( D-serine,DSer)等[2]。D-Ser由丝氨酸消旋酶( serine racemase,SR)将L-serine转化而来;同时大量研究提示,DSer可以作为神经递质或胶质递质由神经元和胶质细胞所分泌。N-甲基-D-天门冬氨酸( N-methyl-D-aspartate,NMDA)受体NR1亚基存在“甘氨酸位点”,该位点被甘氨酸结合后,NMDA受体才能被激活。D-Ser可以与该“甘氨酸位点”结合且结合效能远大于甘氨酸;同时,D-Ser不能被甘氨酸转运体所转运,因而不受重吸收机制的调节。由于NMDA受体参与机体多种生理、病理机制的调节过程,因此,D-Ser可以通过调节NMDA受体的功能介入多种生理、病理过程的调节机制。
对吗啡耐受机制的研究中发现,慢性吗啡治疗可引起NMDA受体活化,细胞内Ca2 +水平增加,激活胞内PKC信号途径,最后引起μ阿片受体磷酸化,吗啡耐受形成。由于吗啡耐受和电针耐受存在交叉耐受,因此,D-Ser可能也通过调节NMDA受体功能参与电针耐受的形成和维持机制。明确PAG 中D-Ser是否介入大鼠电针耐受的机制是本研究的主要目的。
本研究将通过建立电针耐受大鼠模型,观察电针耐受大鼠中脑PAG中D-Ser水平变化;此外在电针耐受大鼠PAG中给予星形胶质细胞活化抑制剂氟代柠檬酸( fluorocitrate,Fc)后观察Fc对大鼠电针耐受的影响。通过本研究可以加深对电针耐受机制的认识,为开发“只镇痛少耐受”的新型镇痛药物提供理论依据。
1 材料与方法
1.1动物及分组
清洁级成年雄性Sprague-Dawley( SD)大鼠共84只购于重庆第三军医大学,体重210~220 g,实验期间分笼饲养,3~4只大鼠1笼;大鼠置于安静,温度( 24±1)℃,湿度( 60±5) %,人工光照,明暗各12 h/d( 8AM-8PM)周期的环境中饲养,自由进食及饮水。本实验严格按照国际疼痛研究协会( International Association for the Study of Pain,IASP)关于应用动物进行疼痛研究的伦理纲要进行操作,实验过程中尽量减少动物的不适和动物的使用量。
按照随机数字表法将84只大鼠随机分为7组( n =12) :正常组( normal)、假电针组( sham-EA)、电针组( EA)、电针+人工脑脊液组( artificial cerebrospinal fluid,aCSF) ( EA + aCSF)和电针+ Fc组( EA + Fc) ; EA + Fc组按照Fc剂量再分为EA +0. 3 μg Fc、EA +0. 6 μg Fc和EA + 1. 2 μg Fc低、中、高剂量3个亚组;正常组不作任何处理,单纯饲养; EA组、EA + aCSF组、EA + Fc组大鼠给予外周穴位电针刺激,1次/d,共6次; EA + aCSF组和EA + Fc组大鼠给予PAG外侧区( lateral subregion of the PAG,lPAG)植管并通过植管微量注射aCSF或不同剂量Fc。假电针组大鼠仅在外周穴位给予针刺,不通电流。
1.2主要实验仪器及试剂
电子Von Frey测痛仪( IITC Life science公司,2390系列,美国)、冰冻切片机( Leica CM1950,德国)、脑立体定位仪( Narishige公司,SR-6R,日本)、全波长酶标仪( Multiskan,美国)。氟代柠檬酸( Sigma Aldrich公司,美国),溶于无菌生理盐水中,浓度为10 μg /μL,微量注射时按需要稀释成适合的终浓度。lPAG中微量注射量为( 0. 3 μg /0. 3 μL、0. 6 μg/0. 3 μL或1. 2 μg /0. 3 μL)。D-serine酶联免疫分析试剂盒购于上海酶研生物科技有限公司。人工脑脊液中各种离子成份及其浓度( mmol/L) 为: NaCl 126,KCl 5,CaCl22,MgCl22,NaH2PO41. 25,NaHCO326,葡萄糖10。
1.3动物模型建立
将大鼠置于固定笼内,双后肢及尾暴露于固定笼外,采用经穴电针治疗仪(华信经穴电针治疗仪HXZ-I-6型,成都)给予大鼠双后肢“足三里”和“三阴交”穴位进针,足三里:大鼠后膝关节下方,腓骨小头下约5 mm;三阴交:在小腿内侧,内踝尖上3 mm,胫骨内侧缘后方;进针部位和针用75%酒精消毒。参照Huang的方法[3]建立大鼠电针耐受模型:大鼠在清醒状态下给予方波刺激,波宽0. 2 ms,频率100 Hz,按照1-2-3 mA强度递增,每个强度维持10 min;每次电针30 min后检测机械痛阈值( mechanical withdrawal threshold,MWT),共电针6 d( 1 次/d),随刺激时间延长,电针的镇痛效果逐渐降低导致电针耐受形成[4]。
1.4机械痛阈值的检测
测定机械痛阈值( mechanical withdrawal threshold,MWT)时,室温维持在20~24℃,保持周围环境安静。先将大鼠置于底带孔的透明有机玻璃笼中30 min以上,使大鼠适应环境,待大鼠停止行走、抓挠、直立、排便等活动处于安静状态后开始检测。通过网孔用电子von Frey纤维刺激大鼠后肢足底中部2 s,出现缩足反应时读数为MWT。建模前( 0 d)和建模后每天检测大鼠MWT变化百分数直到电针后6 d。检测时间点为电针前( 0 d,此时为大鼠基础痛阈)以及电针后每天的MWT并与基础痛阈相比求得机械痛阈变化百分数( %) = (电针后MWT值-基础MWT值) /基础MWT值×100%。MWT检测在每次电针刺激后4 h进行。
1.5中脑导水管周围灰质植管及微量注射
EA + aCSF组和EA + Fc组大鼠在建模前5 d给予4%水合氯醛麻醉( 10 mL/kg),麻醉成功后,大鼠俯卧位置于脑立体定位仪上,切开头皮,暴露颅骨,钻孔,在PAG外侧区( lateral PAG,lPAG)植管。lPAG的坐标为:前囟后7. 80 mm,中线旁开0. 60 mm,颅骨表面下4. 5 mm。插入外直径0. 8 mm的不锈钢插管,用牙科磷酸锌水门钉固定,单侧插管,在插管内放入一内芯,防止插管堵塞。植管后给予青霉素钠盐(溶于2 mL无菌盐水)腹腔注射预防感染和脱水。手术结束后放入笼中,保温直到麻醉苏醒。插管完成后,每日观察大鼠的一般情况,生命体征以及运动功能变化,如果出现神经系统功能障碍(瘫痪、呼吸异常、插管脑脊液漏)等,排除在实验组外。大鼠电针刺激后6 d给予lPAG微量注射aCSF或不同剂量Fc,1次/d,连续3 d。注射药物前轻度固定大鼠,用微量进样器连接注射针头后给予注射,注射针头长于导管1 mm。每次注射0.3 μL,3 min内注射完毕,留针2 min,确保药物的完全扩散。整个实验结束时,通过微量进样器注入2%伊文思蓝0.1 μL,确定注射部位并与大鼠脑图谱[5]比对,只有注射部位位于lPAG的大鼠数据才纳入统计处理。
1.6 ELISA
大鼠麻醉后断头取脑,在冰盘上迅速摘取中脑,取PAG组织约100 mg,按照100 mg/mL加入PBS,pH7. 4,用液氮迅速冷冻保存备用。标本解冻后保持在2~8℃。匀浆后4℃3 000 r/min离心20 min,收集上清液约500 μL。BCA试剂盒(碧云天)进行总蛋白定量后,严格按照酶联免疫分析试剂盒使用说明书操作检测PAG中D-Ser的含量(设置空白孔、标准品孔、待测样品孔,分别进行加样。37℃温育30 min后弃去液体,洗板30 s×5次。加入酶标试剂50 μL,温育30 min后弃去液体,洗板30 s× 5次。加入显色剂A和B各50 μL,轻轻振荡混匀,37℃避光显色10 min,加入终止液50 μL终止反应)。反应终产物在酶标仪以450 nm波长下测量各孔的吸光度( OD值),应用计算机软件根据标准曲线的直线回归方程计算对应的样品D-ser蛋白浓度。
1.7统计学分析
应用SPSS 17.0软件进行统计学分析,计量资料以均数±标准差(±s)表示,不同时间点组内比较采用重复测量方差分析;多组间数据比较采用两因素方差( Two-Way ANOVA)和Post hoc Turky分析,P<0.05表示差异有统计学意义。
2 结果
2.1大鼠持续电针刺激后耐受形成
EA组大鼠EA刺激1 d后,MWT变化百分数为( 86. 7±12. 7) %,与正常组MWT变化百分数比较,差异有统计学意义( P<0.001) ;连续6 d给予电针刺激,MWT变化百分数逐渐变小,第6次电针刺激后MWT值变化百分数为( 3. 5±2. 4) %,与正常组大鼠MWT变化百分数比较,差异无统计学意义,说明随着电针刺激次数的增多,电针的镇痛效应逐渐降低,电针耐受形成。假电针组大鼠在各观察时间点与正常组大鼠MWT变化百分数比较,差异无统计学意义(图1)。
2.2电针耐受大鼠PAG中D-serine水平变化
取电针6次后时间点的正常组、假电针组和电针组大鼠,ELISA法检测PAG中D-ser水平情况。结果提示:电针组大鼠PAG中D-ser水平增加,与正常组比较,差异有统计学意义( P<0. 001) ;假电针组大鼠PAG中D-ser水平与正常组大鼠比较,差异无统计学意义(图2)。
2.3 lPAG中微量注射氟代柠檬酸对电针耐受大鼠机械痛阈变化百分数的影响
取电针耐受大鼠,给予lPAG中微量注射人工脑脊液或不同剂量Fc ( 0.3 μg、0.6 μg或1.2 μg),1次/d,连续给予3 d,同时给予外周穴位电针刺激1次/d,共3次。观察注射人工脑脊液或Fc后大鼠MWT变化百分数。EA +0.3 μg Fc组与EA + aCSF组大鼠比较,MWT变化百分数差异无统计学意义。EA + 0.6 μg Fc组和EA + 1.2 μg Fc组与EA + aCSF组比较,差异有统计学意义( P<0. 001) ; EA + 0.6 μg Fc组与EA +1.2 μg Fc组比较,差异有统计学意义( P<0. 001) (图3)。

图1 多次电针刺激对大鼠MWT变化百分数的影响*P<0.001,#P<0.01,与同时间点正常组大鼠比较。

图2 大鼠PAG中D-ser水平*P<0.001,与正常组大鼠比较。
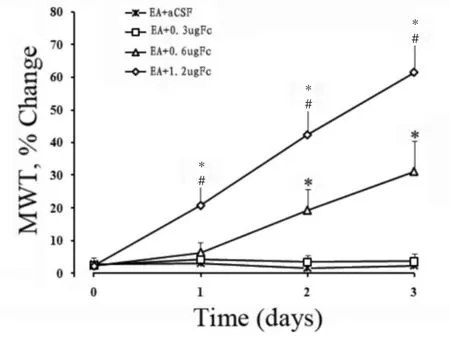
图3 lPAG微量注射Fc对电针耐受大鼠机械痛阈变化百分数的影响*P<0001,与EA+aCSF组大鼠比较;#P<0001,与EA+0.6 μg Fc组大鼠比较。
2.4 lPAG中微量注射氟代柠檬酸对PAG中D-ser水平的影响
取电针耐受大鼠,给予lPAG中微量注射人工脑脊液或不同剂量Fc ( 0.3 μg、0.6 μg或1.2 μg),1次/d,连续给予3 d,同时给予外周穴位电针刺激1 次/d,共3次。观察注射人工脑脊液或Fc对大鼠PAG中D-ser水平的影响。EA +0.3 μg Fc组与EA + aCSF组大鼠比较,PAG中D-ser水平差异无统计学意义。EA +0.6 μg Fc组和EA +1.2 μg Fc组与EA + aCSF组比较,PAG中D-ser水平差异有统计学意义( P<0. 001) ; EA + 0.6 μg Fc组与EA + 1. 2 μg Fc组比较,PAG中D-ser水平差异有统计学意义( P<0. 001) (图4)。

图4 lPAG微量注射Fc对电针耐受大鼠PAG中D-ser水平的影响*P<0.001,与EA+aCSF组大鼠比较;#P<0001,与EA+0.6 μg Fc组大鼠比较。
3 讨论
本研究通过对大鼠进行多次外周穴位电针,观察在电针耐受的形成和维持中,大鼠PAG中D-ser水平的变化。主要研究结果包括以下几个方面:( 1)多次电针刺激引起大鼠机械痛阈变化百分数逐渐减小,电针耐受形成; ( 2)电针耐受大鼠与正常大鼠比较,PAG中D-ser水平升高; ( 3)电针耐受大鼠PAG中微量注射Fc后,大鼠机械痛阈变化百分数增加,电针耐受症状缓解。
普遍认为,电针耐受和吗啡耐受的机制有许多共同点,且存在交叉耐受[6],导致吗啡耐受的机制同样可能引起电针耐受。当前研究已经明确的引起吗啡耐受的主要机制包括: ( 1)阿片受体改变,表现为受体表达量变化或受体内化、G蛋白信号通路脱偶联以及阿片受体的各受体亚型之间的相互作用等; ( 2)内源性阿片拮抗系统的活化,包括:孤啡肽及其受体、去甲肾上腺素、八肽胆囊收缩素( CCK-8)和神经肽FF等; ( 3) NMDA受体活化,一氧化氮( NO)生成增多等促进吗啡耐受形成。此外,近年发现,中枢神经系统胶质细胞活化也与吗啡耐受的形成和维持有关[7-8]。
PAG是阿片镇痛和阿片耐受的关键部位,特别是其腹外侧区[9-10]。近年研究提示PAG中小胶质细胞活化后脑源性神经营养因子( BDNF)释放增多和NMDA受体表达上调促进吗啡耐受形成[11]。本研究中发现,随着电针次数的增多,大鼠机械痛阈变化百分数逐渐减少,提示大鼠电针耐受的出现;同时也观察到,伴随电针耐受的出现,大鼠PAG中D-ser水平的增高。说明PAG中D-ser水平的改变介入了大鼠电针耐受机制。
给予外源性甘氨酸可以增强NMDA受体对NMDA的反应,进一步研究发现,甘氨酸结合于NMDA受体的甘氨酸位点是谷氨酸激活NMDA受体的基础[12]。然而,通过近年来的研究发现,在多个脑区,D-ser才是NMDA受体甘氨酸结合位点的内源性配体[13-14]。D-ser的分布与NMDA受体表达分布平行。D-ser通过可以调节NMDA受体功能,参与对突触可塑性、感觉信息传递、神经发育、神经毒理以及神经系统疾病(帕金森病、阿尔兹海默病、精神分裂症等)机制的调节过程,同样D-ser也可以通过调节NMDA受体的功能参与电针耐受的形成。
Chen等[15]发现:慢性吗啡治疗引起脊髓背角星形胶质细胞活化和D-ser释放增多,大鼠出现吗啡耐受表现;鞘内给予D-氨基酸氧化酶( D-amino acid oxidase,DAAO)降低D-ser水平后可缓解大鼠吗啡耐受表现,说明星形胶质细胞活化和D-ser介入吗啡耐受的脊髓机制。在中枢神经系统,星形胶质细胞通过囊泡释放或出胞作用释放D-ser,值得一提的是近期研究发现,神经元也能释放D-ser和甘氨酸[16]。那么本研究中发现电针耐受大鼠PAG中D-ser水平增高,D-ser来源于何种细胞,我们采用星形胶质细胞活化抑制剂Fc进行验证。Fc通过抑制顺乌头酸酶,干扰细胞内三羧酸循环,对星形胶质细胞活化有特异性的抑制作用。通过给予Fc抑制星形胶质细胞的活化达到镇痛的文献报道较多,但采用Fc观察胶质细胞在吗啡或电针耐受中的作用的研究相对较少。本研究通过在PAG中微量注射Fc抑制星形胶质细胞活化后,PAG中D-ser水平下降并与Fc剂量相关,大鼠电针耐受症状缓解,其机制可能与Fc抑制PAG中星形胶质细胞活化减少D-ser的释放有关。本课题组前期对神经病理性疼痛大鼠的研究中发现,大鼠PAG中D-ser水平的升高,达到( 1 800±327) ng/L,对大鼠的疼痛起缓解作用,其机制可能与PAG中NMDA受体的激活有关[17]。本研究发现,电针耐受大鼠其PAG中D-ser水平进一步增加,达到( 5 200±626) ng/L左右,由于D-ser水平的大幅增加,可能引起NMDA受体的过度激活,最终导致大鼠电针耐受的形成和维持。
以前认为中枢神经系统的胶质细胞仅仅起营养和支持作用,近年研究提示胶质细胞通过释放胶质递质、促炎症细胞因子等广泛参与中枢神经系统功能调节。本研究结果证实PAG中星形胶质细胞活化后通过促进D-ser释放介入电针耐受的形成和维持机制。本研究一方面加深了对电针耐受机制的认识,另一方面为开发“只镇痛少耐受”的新型镇痛药物或镇痛方法提供新的理论依据。
参考文献
[1]Millan MJ.Descending control of pain[J].Prog Neurobiol,2002,66( 6) : 355-474.
[2]Hamase K,Morikawa A,Etoh S,et al.Analysis of small amounts of D-amino acids and the study of their physiological functions in mammals[J].Anal Sci,2009,25( 8) : 961-968.
[3]Huang C,Long H,Shi YS,et al.Ketamine enhances the efficacy to and delays the development of tolerance to electroacupuncture-induced antinociception in rats[J].Neurosci Lett,2005,375( 2) : 138-142.
[4]Tian JH,Zhang W,Fang Y,et al.Endogenous orphanin FQ: evi-dence for a role in the modulation of electroacupuncture analgesia and the development of tolerance to analgesia produced by morphine and electroacupuncture[J].Br J Pharmacol,1998,124( 1) : 21-26.
[5]Paxinos G,Watson C.The Rat Brain in Stereotaxic Coordinates [M].Sixth Edition ed.Amsterdam: Academic Press,2007: 74-76.
[6]韩济生.电针镇痛的耐受及其与吗啡的交叉耐受[J].针刺研究,1982,( 3) : 162-173.
[7]Hameed H,Hameed M,Christo PJ.The effect of morphine on glial cells as a potential therapeutic target for pharmacological development of analgesic drugs[J].Curr Pain Headache Rep,2010,14 ( 2) : 96-104.
[8]Eidson LN,Murphy AZ.Blockade of Toll-like receptor 4 attenuates morphine tolerance and facilitates the pain relieving properties of morphine[J].J Neurosci,2013,33( 40) : 15952-15963.
[9]Mehalick ML,Ingram SL,Aicher SA,et al.Chronic inflammatory pain prevents tolerance to the antinociceptive effect of morphine microinjected into the ventrolateral periaqueductal gray of the rat [J].J Pain,2013,14( 12) : 1601-1610.
[10]Macey TA,Bobeck EN,Suchland KL,et al.Change in functional selectivity of morphine with the development of antinociceptive tolerance[J].Br J Pharmacol,2015,172( 2) : 549-561.
[11]Matsushita Y,Omotuyi IO,Mukae T,et al.Microglia activation precedes the anti-opioid BDNF and NMDA receptor mechanisms underlying morphine analgesic tolerance[J].Curr Pharm Des,2013,19( 42) : 7355-7361.
[12]Oliet SH,Mothet JP.Regulation of N-methyl-D-aspartate receptors by astrocytic D-serine[J].Neuroscience,2009,158 ( 1) : 275-283.
[13]Martineau M,Baux G,Mothet JP.D-serine signalling in the brain: friend and foe[J].Trends Neurosci,2006,29( 8) : 481-491.
[14]Balan L,Foltyn VN,Zehl M,et al.Feedback inactivation of D-serine synthesis by NMDA receptor-elicited translocation of serine racemase to the membrane[J].Proc Natl Acad Sci USA,2009,106 ( 18) : 7589-7594.
[15]Chen ML,Cao H,Chu YX,et al.Role of P2X7 receptor-mediated IL-18/IL-18R signaling in morphine tolerance: multiple glial-neuronal dialogues in the rat spinal cord[J].J Pain,2012,13( 10) : 945-958.
[16]Balu DT,Takagi S,Puhl MD,et al.D-serine and serine racemase are localized to neurons in the adult mouse and human forebrain [J].Cell Mol Neurobiol,2014,34( 3) : 419-435.
[17]李海英,肖智,李树法,等.星形胶质细胞在降钙素中枢镇痛机制中的作用[J].中国疼痛医学杂志,2015,21( 1) : 33-37.
(学术编辑:张晓东)
论著
Midbrain periaqueductal gray D-serine facilitates electroacupuncture tolerance in rats
SUN Meng-jie1,LI You-yan1,2,XIAO Zhi3
( 1.Graduate School,Zunyi Medical College; 2.Department of Ophthalmology,the First People’s Hospital of Zunyi City; 3.Research Center for Medicine&Biology,Zunyi Medical College,Zunyi 563000,Guizhou,China)
【Abstract】Objective: To investigate the role of midbrain periaqueductal gray ( PAG) D-serine( D-ser) in the mechanism of the electroacupuncture ( EA) induced tolerance in rats.Methods: Male Sprague-Dawley( SD) rats were randomly divided into 7 groups,namely,normal group,sham-EA group,EA group,EA plus artificial cerebrospinal fluid ( aCSF) group and EA plus Fc group.The EA plus Fc group was divided into low,middle and high Fc subgroups,and had 0. 3μg,0. 6μg and 1. 2μg Fc intra-PAG injection,respectively.The mechanical withdrawal threshold ( MWT) values were detected via an electronic von Frey apparatus.The ELISA technique was used for determination the alterations of D-ser level in the rats PAG on each observation time point.The effects of intra-lateral PAG ( lPAG) injection of Fc,a glial metabolic inhibitor,on MWT values and D-ser concentrations were further studied on EA tolerant rats.Results: In EA tolerant rats,the MWT percentage changes gradually decreased with an increase of D-ser levels in the PAG.The intralPAG injection of Fc increased the MWT percentage changes.Conclusion: Multiple EA treatments can induce tolerance via an astrocyte activation and an increased D-ser release in the PAG on rats.
【Key words】Electroacupuncture; Tolerance; D-serine; Midbrain periaqueductal gray
作者简介:孙梦婕( 1984-),女,硕士研究生。通讯作者:肖智,E-mail: xiaozhi1971@163.com
基金项目:国家自然科学基金课题( 31160207)
收稿日期:2015-06-14
doi:10. 3969/j. issn. 1005-3697. 2016. 01.09
【文章编号】1005-3697( 2016) 01-0029-06
【中图分类号】R745.42; R245.97
【文献标志码】A

