T细胞疫苗抑制了Flt3-L介导的小鼠肝移植急性排斥反应①
赵振林 赵晨野 谢燕兵 杨 波 苏继荣
(山西医科大学第二医院普外科,太原030001)
T细胞疫苗抑制了Flt3-L介导的小鼠肝移植急性排斥反应①
赵振林赵晨野②谢燕兵杨波苏继荣
(山西医科大学第二医院普外科,太原030001)
[摘要]目的:探讨供体抗原特异性T细胞疫苗诱导肝移植免疫耐受的作用及其机理,同时对肝移植“自动耐受”机制进行探讨。方法:以CBA小鼠作为受体,以B6小鼠作为供体,建立小鼠原位肝移植模型;制备T细胞疫苗:用B6小鼠的脾细胞免疫CBA小鼠,取CBA小鼠的脾淋巴细胞加以灭活,制备成T细胞疫苗(TCV)备用;实验分为3组:组1:单纯移植组,以CBA小鼠作为受体,以B6小鼠作为供体,做原位肝移植。组2:用Flt3-L治疗的B6小鼠作为供体,以CBA小鼠作为受体,做原位肝移植。组3:用Flt3-L治疗的B6小鼠作为供体,以TCV免疫过的CBA小鼠作为受体,进行原位肝移植。组间比较移植物存活时间(MST);测定肝移植小鼠血清中的IL-10、IL-4和IFN-γ水平;组内比较移植前后单向混合淋巴细胞反应(MLR);分离移植物浸润细胞(GICs)组间比较GICs凋亡率。结果:Flt3-L诱导了同种移植急性排斥反应,应用TCV于移植前和移植后可以显著抑制Flt3-L诱导的同种肝移植排斥反应。在没有Flt3-L刺激作用的情况下移植排斥反应非常轻微。肝移植小鼠血清中的IL-10、IL-4和IFN-γ水平检测发现,Flt3-L治疗组IFN-γ水平显著升高,IL-10、IL-4水平降低;TCV免疫组IL-10、IL-4水平显著升高,IFN-γ水平显著下降;单纯移植自动耐受组与TCV免疫组变化趋势一致。单向混合淋巴细胞反应(MLR)显示:在单纯移植组,淋巴细胞增殖效应不明显,CPM为3 318±1 190;在Flt3-L治疗组,效应细胞增殖显著增强,CPM 为9 790±1 369,在TCV免疫组,TCV免疫加Flt3-L治疗,淋巴细胞增殖效应被显著抑制,CPM为4 017±880。分离肝脏移植物内浸润细胞凋亡,TCV免疫组引起TIL凋亡率为(54.20±3.12)%,有效抑制了TIL引起的免疫排斥反应,诱导了免疫耐受。而在Flt3-L治疗组,TIL凋亡率为(3.34±2.49)%。结论:小鼠同种肝移植存在“自动耐受”现象;这种“自动耐受”现象的免疫平衡可以被Flt3-L打破,从而诱发急性排斥反应。针对排斥效应T细胞的特异性T细胞疫苗可以显著抑制Flt3-L诱导的同种肝移植排斥反应。
[关键词]T细胞疫苗; 同种移植;免疫耐受;肝移植
针对移植供体的特异性T淋巴细胞是同种移植免疫排斥的效应细胞,如果能将这些效应细胞清除或有效抑制,则可以防止免疫排斥的发生。本文作者长期致力于T细胞疫苗诱导移植免疫耐受的研究[1],其基本策略是用供体器官抗原刺激受体诱导体产生排斥性T细胞,再将这些T细胞分离灭活,制备成T细胞疫苗,在移植前和移植后用TCV 免疫受体动物,诱导产生针对排斥效应T细胞的免疫反应,从而达到抑制或清除反应性T淋巴细胞,诱导特异性移植耐受的作用[2,3]。因为小鼠肝移植具有自动接受现象,本研究选择小鼠原位肝移植模型,对研究移植免疫耐受具有重要价值。本研究设计旨在比较同种肝移植在发生急性排斥反应、发生自动耐受、应用T细胞疫苗诱导免疫耐受三种状态下的免疫机制,进一步探讨T细胞疫苗诱导同种移植免疫耐受的方法和机制。
1材料与方法
1.1材料
1.1.1实验动物以CBA小鼠作为受体,以B6小鼠作为供体,建立小鼠原位肝移植模型清洁级,以上动物由山西医科大学实验动物中心提供。
1.1.2试剂及药品Flt3-L(PeproTech EC Ltd.);Annexin V-FITC(BD Biosciences); Con A、淋巴细胞分离液、RPMI1640细胞培养液胎牛血清(华美公司);丝裂霉素(Kyowa hakko co Ltd.);3H-TDR(北京原子能研究所)。
1.2方法
1.2.1T细胞疫苗制备(TCV)制备B6小鼠的肝细胞悬液,按照1×106/次腹腔注射,连续3次,每周1次,于第3次免疫后第5天,分别取出被免疫的CBA小鼠的脾脏,用密度梯度离心法分离脾淋巴细胞,用RPMI1640完全培养液调整细胞浓度至2×105ml-1,加Con A 2.5 μg/ml,混合后移至100 ml的培养瓶内(10 ml/瓶),置5%CO237℃孵箱中培养48 h后收集细胞,然后加入丝裂霉素C(25 μg/ml)处理灭活细胞(37℃水浴45 min),用RPMI1640培养液调整细胞浓度到1×108ml-1,制成供体特异性T淋巴细胞疫苗(TCV)冻存备用 。
1.2.2Flt3-L治疗B6小鼠于移植前3周给B6小鼠皮下注射Flt3-L,1 mg/kg,每周1次,连续3周。
1.2.3实验分组及原位肝移植,统计移植物平均存活时间 (Mean survival time,MST)组1:单纯移植组,以CBA小鼠作为受体,以B6小鼠作为供体,做原位肝移植。组2:用Flt3-L治疗的B6小鼠作为供体,以CBA小鼠作为受体,做原位肝移植。组3:用Flt3-L治疗的B6小鼠作为供体,以TCV免疫过的CBA小鼠作为受体,进行原位肝移植。
肝移植手术属于清洁型手术,乙醚麻醉,应用三袖套法进行小鼠原位肝移植,参见文献[4]。术后肌注青霉素40万U,3 d内单笼喂养。实验小鼠肝移植无肝期要求无肝期小于20 min,手术顺利,术后正常苏醒,能活动,非排斥性原因致死者除外。
1.2.4单向混合淋巴细胞反应(MCR)(3H-TDR掺入法)移植后第5天进行单向混合淋巴细胞反应(MLR),反应细胞为经TCV 免疫后的CBA小鼠的脾T淋巴细胞,刺激细胞为灭活的B6小鼠脾T淋巴细胞,两者浓度均为1×106ml-1,取96孔细胞培养板,每孔加入反应细胞100 μl,刺激细胞100 μl,每份标本设三复孔,在含体积分数为5%CO237℃ 饱和湿度下培养96 h,终止培养前18 h每孔加入1 μg3H-TDR。培养结束后,收集细胞于玻璃纤维滤纸上,用蒸馏水反复冲洗,将样品滤纸置于60℃~80℃的烤箱内烘干,将纸片分别置于闪烁瓶中,每瓶加闪烁液5 ml,用液体闪烁计数器测定每分钟脉冲数值(cpm值) 。
1.2.5肝脏移植物内浸润细胞分离和GICs凋亡测定于移植后3 d取肝脏移植物应用原位灌注及胶原酶消化法[3]分离肝脏NPC(Nonparenchymal cells),用0.09%EGTA液经门-腔静脉原位灌注后再用0.05%、含Ca+的Ⅵ型胶原酶灌注,无菌取下肝脏,剪碎后,用Ⅵ型胶原酶消化,用200目钢丝网过滤,制备成细胞悬液,用RPMI1640培养液洗涤两次,用Percoll液(比1.079,Sigma公司)分离,收集中层细胞,台盼蓝拒染法鉴定活细胞>95%。取肝脏NPC用PBS液洗涤两次,用阳性磁珠分离法分离CD3阳性T细胞,调整细胞浓度为1×106ml-1,进行流式细胞检测,取每一管标本100 μl细胞,加AnnexinV-FITC 5 μl和 PI 5 μl,常温避光孵育15 min后,加400 μl结合液,用FACSCalibur流式细胞仪(美国Becion Dickinson)分析。

2结果
2.1各组肝移植后大鼠存活时间(MST)在移植对照组,MST为(41.9±3.0)d;在Flt3-L治疗组,MST为(6.7±2.4)d;而在Flt3-L加TCV组MST为(80.7±10.2)d,移植物存活时间显著延长,与Flt3-L治疗组比较P<0.01,见图1。
2.2移植小鼠血清中的IL-10、IL-4和IFN-γ水平测定测定肝移植小鼠血清中的IL-10、IL-4和IFN-γ水平,并设正常对照。Flt3-L治疗组IFN-γ水平显著升高,IL-10、IL-4水平降低;TCV免疫组IL-10、IL-4水平显著升高,IFN-γ水平显著下降;单纯移植自动耐受组与TCV免疫组趋势一致。见图2。
2.3单向混合淋巴细胞反应(MLR)结果于移植后第3天进行单向混合淋巴细胞反应,应用3H-TDR掺入法,最后用液体闪烁计数器测得每分钟脉冲数值(cpm值)。在单纯移植组,淋巴细胞增殖效应不明显,为3 318±1 190;在Flt3-L治疗组,效应细胞增殖显著增强到9 790±1 369;Flt3-L +TCV组,淋巴细胞增殖效应被显著抑制, cpm为4 017±880,与单纯移植物比较无显著差异,和Flt3-L治疗组比较显著降低(P<0.01),见图3。

图1 各组肝移植后大鼠存活时间(MST)Fig.1 Mean survival time (MST) after liver transplanta-tion in three groupNote: TCV vaccination significantly prolonged the grafts mean survival time (MST) in TCV group , but Flt3-L mediated acute immune rejection against the liver grafts which result in shortened MST compared with the TCV group and transplant control.
2.4肝脏移植物内浸润细胞凋亡流式细胞检测结果流式细胞仪检测肝脏移植物内浸润T细胞凋亡情况:TCV免疫组引起GICs凋亡率为(54.20±3.12)%,显著有效抑制了GICs引起的免疫排斥反应,诱导了免疫耐受。而在Flt3-L治疗组,GICs凋亡率为(3.34±2.49)%。见图4,表1。
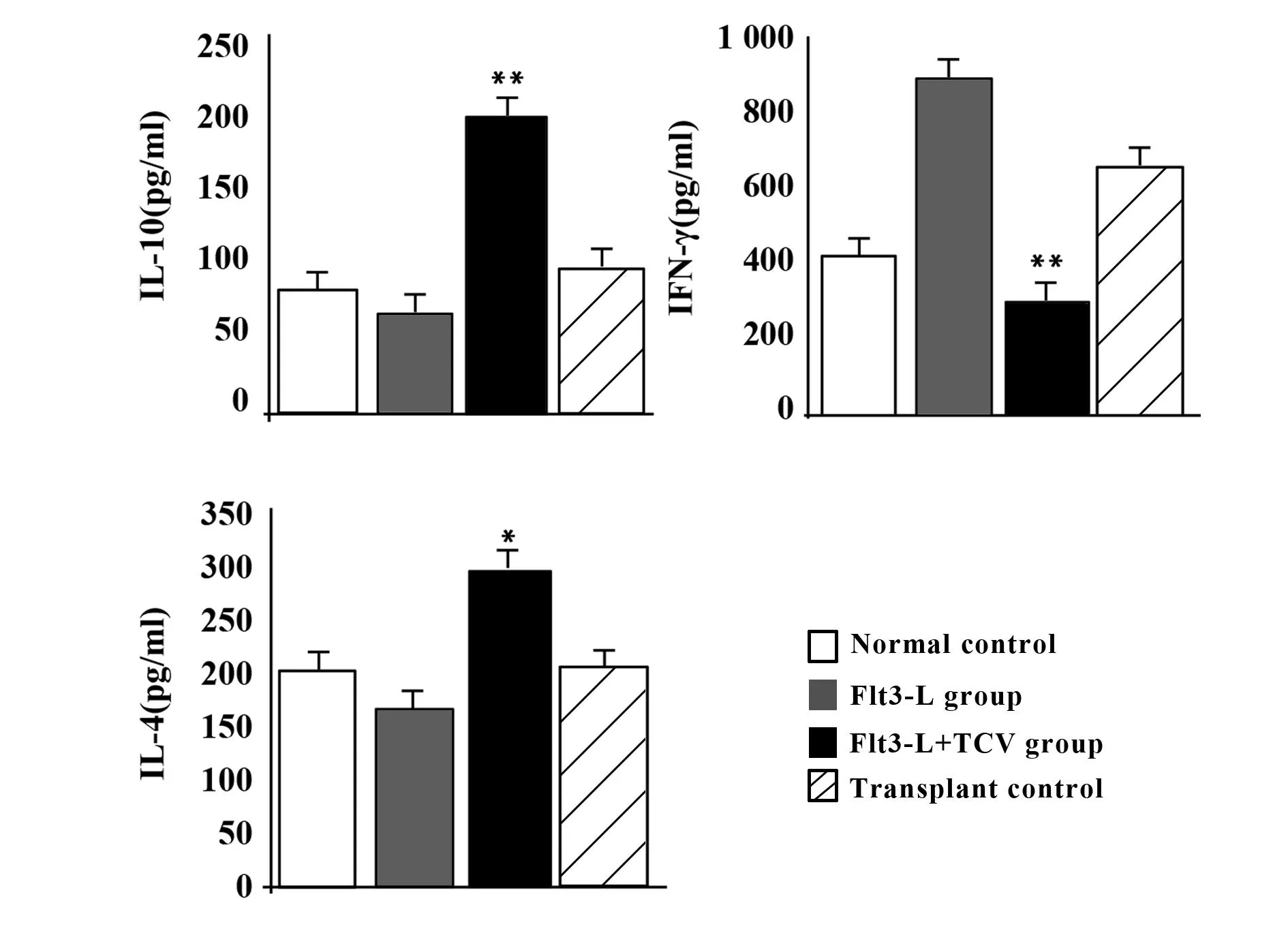
图2 肝移植小鼠血清中的IL-10、IL-4和IFN-γ水平测定Fig.2 Serum value of IL-10,IL-4 and IFN-γ after liver transplantationNote: TCV induced incresed production of IL-4 and IL-10 but depressed the production of IFN-γ in TCV group; Flt3-L mediated acute rejection with incresed IFN-γ and reduced IL-4 and IL-10.
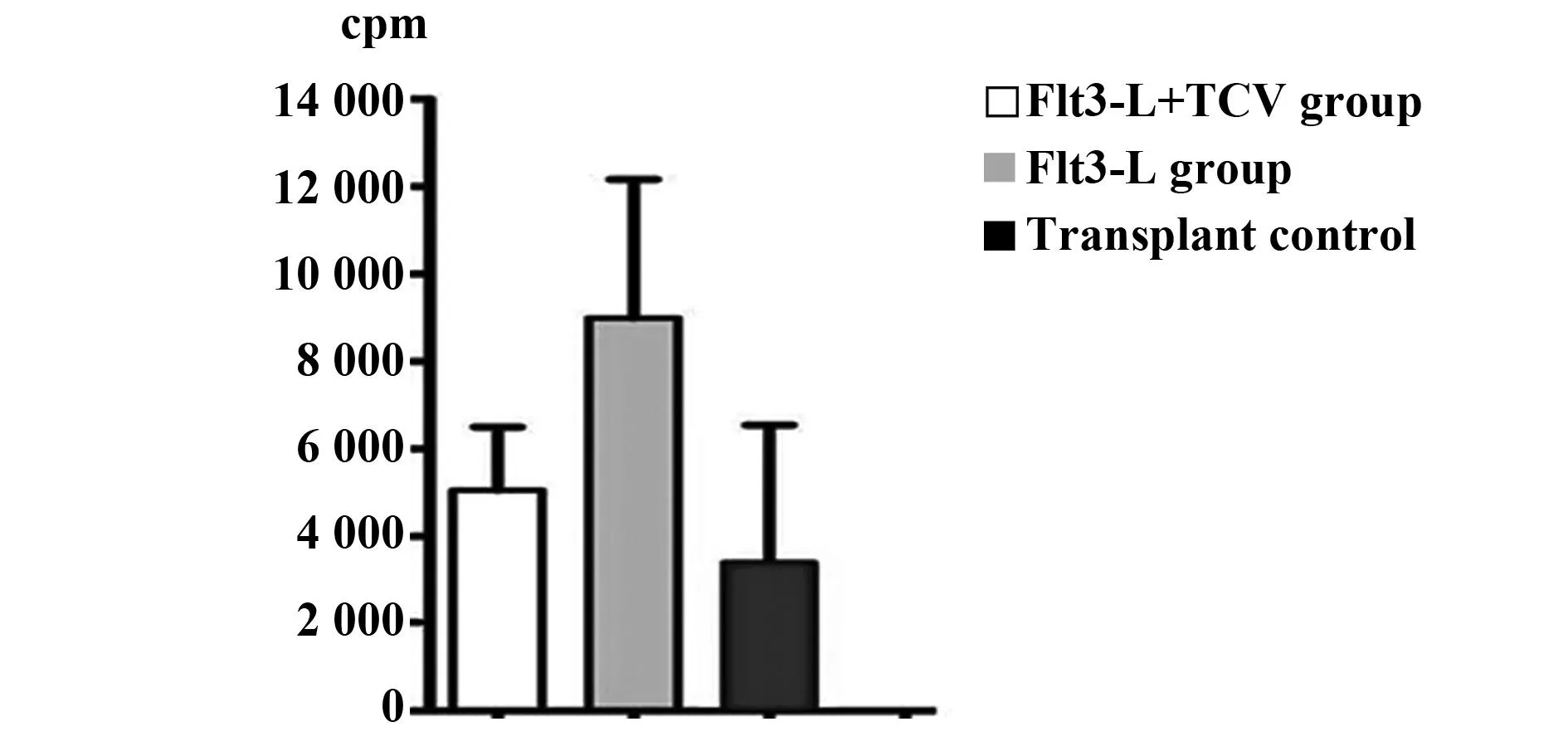
图3 单向混合淋巴细胞反应(MLR)Fig.3 Cpm value of one-way mixed lymphocyte reaction in three groups after transplantation(MLR)Note: The TCV depressed the responding T cells proliferation which may contribute to the inducing immune tolerance .Flt3-L stimulated the proliferation of responding T cells.
表1肝脏移植物浸润细胞凋亡
Tab.1Apoptosis rate of liver graft infiltrating cells

GroupsGroups1Groups2Groups3Apoptosis(%)7.92±2.253.34±2.491)54.20±3.121)
Note:1)P<0.01 versus group 1.
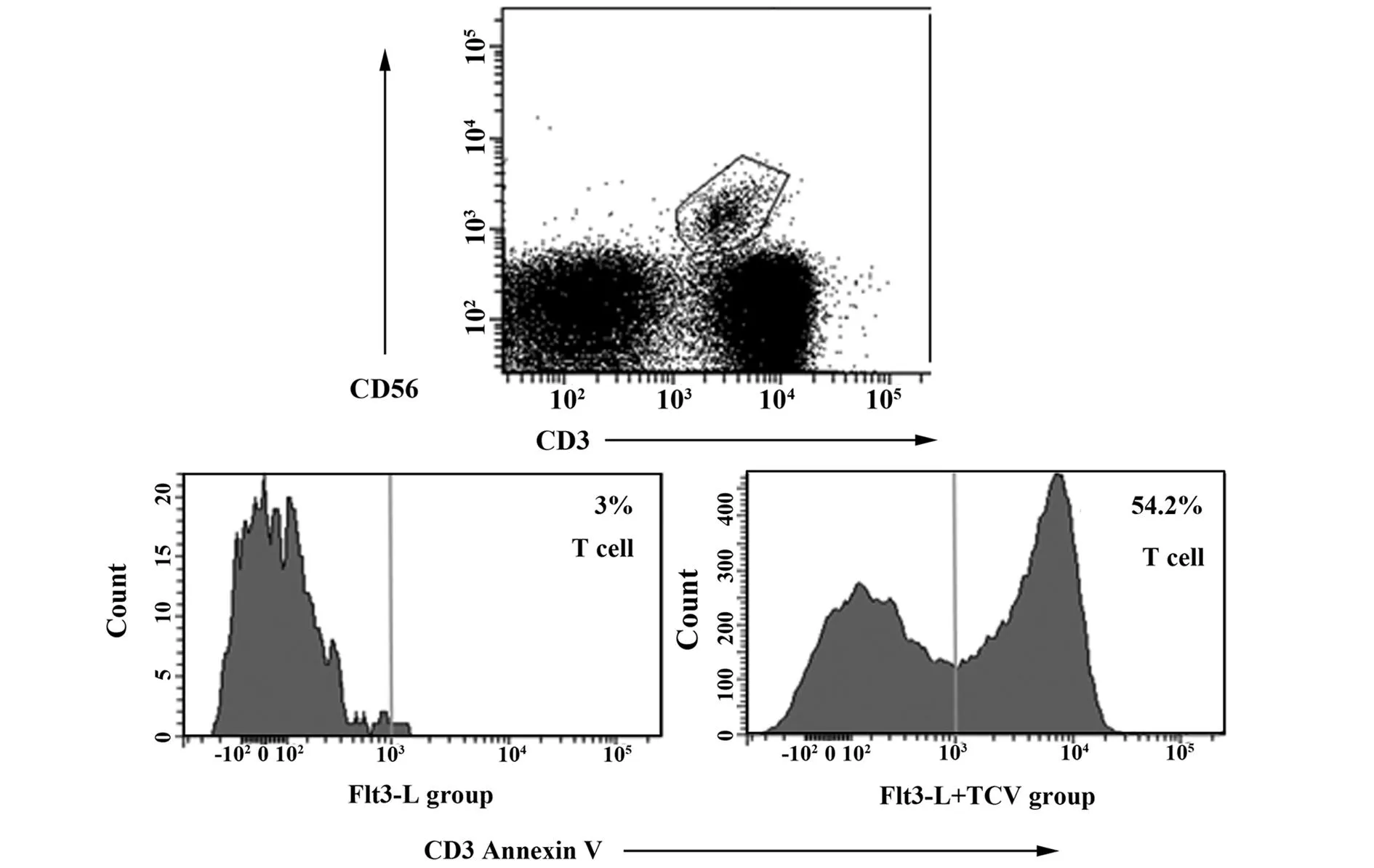
图4 肝脏移植物内浸润细胞凋亡Fig.4 Apoptosis of liver graft infiltrating cells:TCV induced incresed apoptosis of GICs in TCV group,The percentage of apoptosis of GICs was markedly increased in Flt3-L+TCV group in comparison with Flt3-L group.
3讨论
器官移植后发生急慢性免疫排斥仍然是器官移植面临的主要难题,尽管目前应用免疫抑制剂可以有效抑制急性免疫排斥反应,但免疫抑制剂带来的毒副作用严重影响了患者的重要脏器功能和患者的生存质量[5],因此探讨诱导特异性移植免疫耐受是目前移植免疫研究的核心问题。研究小鼠肝移植自动耐受现象的机理对探讨诱导同种免疫耐受方法具有重要价值,本研究以小鼠原位肝移植作为研究模型,发现小鼠同种肝移植存在自动耐受现象,在没有任何免疫干预的情况下可以不发生排斥反应,同时移植物内无明显炎性浸润细胞。本实验用Flt3-L刺激B6小鼠介导了同种肝移植急性排斥反应,在实验组用T细胞疫苗于移植前后免疫CBA大鼠,再用Flt3-L刺激B6小鼠的肝脏进行移植,则不能诱导发生急性免疫排斥反应。
研究表明肝移植“自动耐受”与外周T细胞凋亡有关,肝脏含有大量的过客细胞,其中不成熟树突状细胞(Dendritic cells,DCs)比例很高,这些不成熟的DCs细胞低表达MHC,不表达B7分子,这些DC细胞(immature DCs)虽然有摄取处理抗原和一定的抗原呈递能力,但不能活化T细胞,反而导致T细胞无能。因此导致肝脏不发生免疫排斥,出现所谓的“自动耐受”现象。因此肝脏被称为“耐受器官”、“优惠器官(Privileged organ)”。Thomson 等[6]从小鼠肝脏中分离出DCs前体细胞(DCs progenitors),在体外加入GM-CSF及IL-4扩增后,于小鼠心脏移植前输入受体小鼠,发现移植的异体心脏存活期明显延长,证明了不成熟的DCs具有诱导耐受的功能。
Flt3-L是如何诱发同种肝移植急性排斥反应的?其机理与DC分化有关[7],研究发现Flt3-L能够诱导供体间质树突状细胞(Interstitial DCs)的增加,这些间质DCs分化为成熟的DCs迁移到肝脏,从而诱发了肝移植急性排斥反应的发生。
在研究中,于移植前后用T细胞疫苗免疫CBA受体小鼠,发现Flt3-L介导的急性排斥反应被TCV抑制,TCV免疫使移植物存活期显著延长,T细胞凋亡显著增加;以接受TCV的CBA的T细胞作为反应细胞,以接受Flt3-L治疗的B6小鼠脾细胞作为刺激细胞作单向混合淋巴细胞反应,T细胞增殖被显著抑制,而以未治疗的CBA的T细胞作为反应细胞,以接受Flt3-L治疗的B6小鼠脾细胞作为刺激细胞作单向混合淋巴细胞反应,T细胞增殖显著增强。而在单纯移植出现自动耐受的情况下,虽然没有发生急性排斥反应,但是其T细胞凋亡无显著增加。由此可以推断,肝移植自动耐受是由于肝脏组织内不成熟的DC细胞诱导了T细胞的活化障碍和向调节性T细胞转化,因此导致了移植物无反应状态。用Flt3-L治疗供体小鼠,可以显著增加间质DC向成熟DC转化,促使成熟DC向肝脏募集,当肝移植后存在于肝脏中的大量成熟DC细胞就会活化大量的反应性T淋巴细胞,从而诱发急性免疫排斥反应[8,9]。TCV疫苗细胞是用供体肝脏抗原刺激受体产生的移植排斥效应T细胞经灭活而得,用TCV免疫受体就会诱导产生针对移植排斥效应T细胞的独特型T细胞克隆,独特型T细胞克隆针对移植排斥效应T细胞的免疫反应清除了移植排斥效应细胞,抑制了肝移植免疫排斥反应的发生[10]。
TCV诱导免疫耐受与T细胞克隆转换有关[11,12],CD4+和CD8+T细胞通过识别自身TCR的抗原决定簇而发挥作用,本研究发现TCV 诱导了CD4/CD8降低,CD8T细胞比例上升,说明CD8+T细胞在TCV诱导移植耐受中起着重要作用。T细胞疫苗诱导并激活了CD8+抗独特型T细胞,通过CD8+抗独特型T细胞的作用诱导针对供肝抗原的反应性T细胞凋亡。
本研究发现TCV疫苗导致移植肝内IL-4 mRNA的表达显著上调,INF-γ mRNA的表达受到明显抑制。说明T细胞疫苗可以诱导Th前体向Th2分化。 致敏的CD4+T细胞与抗原接触后,分化成Th1和Th2,Th1主要分泌IL-2和IFN-γ,Th2主要分泌IL-4、IL-5和IL-10等,肝移植自动耐受时,供肝内含有大量的缺乏共刺激分子活性的DCs前体,阻碍了CD4+反应性T细胞进一步活化,使Th前体分化为Th2,形成了有利于肝移植“自动耐受”的环境[13]。而Flt3-L诱导的成熟DCs增加,这些DC细胞具有充足的共刺激分子活性,使肝移植后CD4+反应性T细胞进一步活化,Th前体分化为Th1,介导了强烈的免疫排斥反应。根据本研究,T细胞疫苗可以诱导针对反应性T细胞的CD8+抗克隆型T细胞产生,这些CD8+调节性T细胞可以从另一个水平对Th1和Th2进行调控,从Th2中识别出成熟的Th1并加以抑制或清除[14]。所以TCV诱导移植耐受存在多环节多水平。
T细胞疫苗是作者的系列研究,本实验研究通过B6小鼠作为供体,CBA小鼠作为受体的原位肝移植模型证明:肝移植存在“自动耐受”现象,其机理与肝脏内的幼稚DC无法递呈抗原有关,而Flt3-L可以增加肝移植物内的成熟DC细胞,通过mDC活化反应性CTL细胞,促进Th0向Th1转化,诱导急性排斥反应的发生;TCV 可以诱导针对供肝抗原免疫排斥效应细胞的抗独特性克隆的CD8独特型克隆T细胞,这一群独特克隆T细胞清除了移植排斥效应细胞,抑制了免疫排斥反应,同时TCV还可以促进Th0向Th2转化,为移植免疫耐受创造有利条件。证明了T细胞疫苗能够有效地抑制肝移植急性排斥反应,具有诱导特异性移植耐受的作用。
参考文献:
[1]赵振林,郭永章,李立.T 细胞疫苗诱导异种特异性免疫耐受的作用探讨[J].中国免疫学杂志,2003,19(6):388-391.
[2]Antonella Sistigu,Sophie Viaud,Nathalie Chaput,etal.Immunomodulatory effects of cyclophosphamide and implementations for vaccine design[J].Seminars Immunopathol,2011,33(4):369-383.
[3]Cohen IR,Weiner HL.T-cell vaccination[J].Immunol Today,1988,9(11):332-335.
[4]吴剑英,王孟龙,吕随峰,等.三袖套法大鼠原位肝移植模型的建立[J].第二军医大学学报,1996,17(2):186-187.
[5]杨扬,邓宜南.抗体免疫诱导治疗在肝移植中的应用[J].临床肝胆病杂志,2015,31(12):2031-2034.
[6]Thomson AW,Lu L,Murase N.Microchimerism,dendritic cell progenitors and transplantation tolerance[J].Stem Cells,1995,13(6):622-639.
[7]Morelli AE,Antonysamy MA,Takayama T,etal.Microchimerism,donor dendritic cells,and alloimmune reactivity in recipients of Flt3 ligand-mobilized hemopoietic cells:modulation by tacrolimus[J].J Immunol,2000,165:(1):226-237.
[8]Wei Li,Lina Lu,Zhiliang Wang,etal.Constimulation blocade promotes the apoptotic death of graft-infiltrating T cells and prolongs survival of hepatic allografts from Flt3L-treated donors[J].Transplantation,2001,72(8):1423-1432.
[9]Maraskovsky E,Brasel K,Teepe M,etal.In vivo ad ministration of Ftl3-Ligand results in generation of large numbers of dentritic cells in the lymphoid tissue of mice[J].J Exp Med,1996,184(5):1953-1962.
[10]Steptoe RJ,Fu F,Li W,etal.Augmentayion of dentritic cells in murine organ donor by Flt3-Ligand alters the balance between transplant tolerance and immunity [J].J Imuunol,1997,159(11):5483-5491.
[11]Shapira OM,Mor E,Reshef T,etal.Prolongation of survival of rat cardiac allografts by T cell vaccination [J].J Clin Invest,1993,91(2):388-390.
[12]Kalscheuer H,Onoe T,Dahmani A,etal.Xenograft tolerance and immune function of human T cells developing in pig thymus xenografts [J].J Immunol,2014,192(7):3442-3450.
[13]Hermans G,Denzer U,Lohse A,etal.Cellular and humoral immune response against autoreactive T cells in multiple sclerosis patients after T cell vaccination[J].J Autoimmu,1999,13(2):233-246.
[14]Jiang H,Braunstein NS,Yu B,etal.CD8+T cells control the Thphenotype of MBP-reactive CD4+T cells in EAE mice[J].Proc Natl Acad Sci USA,2001,98(11):6301-6306.
[收稿2015-08-03修回2015-09-15]
(编辑倪鹏)
Effects of donor-Ag specific T cell vaccination on inhibiting Flt3-L-induced acute liver allograft rejection
ZHAOZhen-Lin,ZHAOChen-Ye,XIEYan-Bing,YANGBo,SUJi-Rong.
DepartmentofHepatobiliarySurgery,theSecondHospital,ShanxiMedicalUniversity,Taiyuan030001,China
[Abstract]Objective:To investigate the effect and mechanism of donor-Ag specific T cell vaccination on inducing specific immune tolerance of allogenic liver transplantation and the mechanism of immune privilege of liver transplantation.Methods: CBA mice were recipients,B6 mice were donors,T cell vaccination (TCV) were made from the attenuated spleen cells of CBA mice,which were stimulated by Con A and were challenged with the spleen cells of B6 mice.There are 3 groups in this experiment:Transplant control group:Orthotopic liver transplantation (OLT) were performed with the recipients of CBA mice and donors of B6 mice;Flt3-L treating group:OLT were performed with the recipients of CBA mice and donors of B6 mice treated with Flt3-L;TCV group:OLT were performed with the recipients of CBA mice inoculated with TCV and donors of B6 mice treated with Flt3-L.Median survival time (MST) of liver grafts was recorded,IL-4,IL-10 and IFN-γ in peripheral blood were tested after transplantation in each group.One-way mixed lymphocyte reaction(MLR) were carried out with effectors of spleen cells from CBA mice and stimulator of spleen cells from B6 mice at the 5th day after transplantation.The apoptosis of liver graft infiltrating cells (GICs) were analyzed by flow cytometric analysis at the 5th day after transplantation.Results: Flt3-L treating donor activated allogenic acute rejecting reaction,TCV vaccinating recipient before and after transplantation significantly depressed the acute immune rejecting reaction mediated by Flt3-L.The liver grafts were accepted by recipient without the presence of Flt3-L.The cytokines test show that the serum value of IL-4 and IL-10 were increased in Transplant control group and TCV group,but decreased in Flt3-L treating group.The value of IFN-γ was increased in Flt3-L treating group,but decreased in Transplant control group and TCV group .The result of one-way MLR show that the cpm values in Flt3-L treating group was 9 790±1 369 which was higher than Transplant control group which was 3 318±1 190;the cpm values in TCV group was 3 318±1 190 which show that TCV inhibited Flt3-L mediated liver transplant acute immune rejection.The flow cytometric analysis showed that the percentage of apoptosis of TILs was markedly increased in TCV group (54.20±3.12) in comparison with Flt3-L treating group(3.34±2.49%).The apoptosis analysis certified that TCV inhibited the TIL-mediated immune rejecting reaction.Conclusion: Automatic tolerance can be observed at the situation of allogenic liver transplantation in mice,Flt3-L can break the balance of automatic tolerance and mediate acute rejection reaction .Donor-Ag specific T cell vaccination can successfully inhibit acute immune rejection mediated by Flt3-L.
[Key words]T cell vaccine;Allogenic;Immune tolerance;Liver transplantation
中图分类号R392.4
文献标志码A
文章编号1000-484X(2016)03-0327-05
作者简介:赵振林(1967年-),男,博士,教授,主任医师,主要从事移植免疫方面的研究,E-mail:2412205354@qq.com。
doi:10.3969/j.issn.1000-484X.2016.03.007
①本文受山西省归国留学人员科研基金资助(No.2010-57)。
②深圳大学第一附属医院干细胞再生医学科,深圳518035。

