金属硫蛋白对皮肤癌发生抵抗作用及机制的研究
武月婷 时佳宏 潘奇正 王 元 侯宝莲 任淑萍
(吉林大学公共卫生学院劳动卫生与环境卫生教研室,长春130021)
金属硫蛋白对皮肤癌发生抵抗作用及机制的研究
武月婷时佳宏潘奇正①王元侯宝莲任淑萍
(吉林大学公共卫生学院劳动卫生与环境卫生教研室,长春130021)
[摘要]目的:建立HaCaT细胞UVB损伤模型,给予硫酸锌刺激,探讨其对细胞损伤的拮抗作用及机制。方法:细胞分为正常组、加锌组、紫外线组、加锌紫外线组,照射前24 h给予硫酸锌处理,UVB照射后继续培养,确定硫酸锌给药浓度和UVB辐射时间,Western blot法检测细胞凋亡情况,免疫细胞化学方法检测金属硫蛋白和NF-κB/p65的表达情况。结果:紫外线组细胞内Bax/Bcl-2比值高于正常组和加锌紫外线组;紫外线组、加锌组细胞内MT表达水平均高于正常组,加锌紫外线组细胞MT表达水平高于紫外线组;紫外线组细胞内NF-κB/p65表达水平高于正常组和加锌紫外线组细胞。结论:硫酸锌能够通过细胞内金属硫蛋白的表达,缓解UVB诱发HaCaT细胞凋亡的发生。
[关键词]皮肤癌;紫外线;金属硫蛋白;细胞凋亡
紫外线是环境中的一种重要致癌剂。随着工业发展,大气层的破坏,环境污染日益严重,大气对紫外线的屏障作用日益减弱,紫外线辐射可诱发皮肤光损伤、光老化,甚至皮肤癌的发生,严重威胁着人类的身体健康[1,2]。据统计,每年被诊断为皮肤癌的病例在美国超过1 000例,接近全部新发癌症的40%[3,4]。已有大量研究证实,造成皮肤光老化和皮肤癌的最主要因素就是UVB[5]。UVB引起的皮肤光损伤,机制较为复杂,主要是通过氧化应激产生过多的活性氧,导致细胞发生凋亡造成细胞损伤、引起皮肤光老化,诱发皮肤癌发生[6]。目前,关于硫酸锌通过金属硫蛋白(MT)的表达,对UVB损伤人永生化角质形成细胞(HaCaT)的拮抗作用尚未见报道。本研究通过UVB诱导HaCaT细胞损伤,建立UVB 损伤皮肤细胞模型,通过检测细胞凋亡情况和细胞氧化应激的发生,探讨硫酸锌对UVB导致HaCaT细胞损伤的拮抗作用,旨在为UVB造成的皮肤损伤提供预防与治疗的理论基础,为开发新型抗皮肤损伤产品提供参考依据。
1材料与方法
1.1实验材料、试剂RPMI1640培养基、胰蛋白酶购自美国Gibco公司,胎牛血清购自天津TBD公司,兔抗人Bcl-2抗体、兔抗人Bax抗体、兔抗人MT抗体、兔抗人NF-κB/P65抗体由北京博奥森生物技术有限公司提供,辣根过氧化物酶标记山羊抗兔抗体由北京鼎国生物技术有限公司提供,免疫细胞化学试剂盒购自北京中杉金桥生物技术有限公司,DAB显色试剂盒购自迈新生物技术有限公司。
1.2实验方法
1.2.1HaCaT细胞培养本实验使用HaCaT细胞,采用单层贴壁培养法,培养于含10%胎牛血清的RPMI1640培养液中,于37°C、5% CO2恒温培养箱中培养。镜下观察细胞生长融合达90%时传代。
1.2.2硫酸锌给药浓度及UVB辐射剂量的确定细胞融合90%时,分为对照组,紫外线组,10 μm/L硫酸锌组,50 μm/L硫酸锌组,100 μm/L硫酸锌组,按不同浓度给予硫酸锌处理,镜下观察细胞,确定硫酸锌给药浓度。
UVB辐射细胞5 min、6 min、7 min、8 min、9 min,辐射剂量分别为:7.075 mJ/cm2、8.490 mJ/cm2、9.905 mJ/cm2、11.320 mJ/cm2、12.735 mJ/cm2,台盼蓝法计算细胞存活情况,确定UVB辐射剂量。
1.2.3建立UVB损伤细胞模型细胞传至一次性培养皿中,融合达90%时,随机分为正常组、紫外线组、加锌组、加锌紫外线组。弃掉原有培养液,PBS冲洗3次,加入10 ml含0.5%FBS的1640培养液,加锌组和加锌紫外线组分别加入5 μl ZnSO4,继续培养24 h后,弃掉原有培养液,PBS冲洗3次,加入4 ml PBS浸没平皿底,UVB灯正下方20 cm处照射6 min(其中正常组加盖平皿盖,其余组开盖照射)。照射后,将平皿内的PBS弃掉,加入预冷的PBS 4 ml,冲洗3次。加入1640培养液(10%FBS),培养箱内继续培养24 h。
1.2.4Western blot法检测硫酸锌对HaCaT细胞凋亡的影响细胞照射24 h后,收集至离心管中,离心,1 000 r/min,10 min。弃上清,1 ml PBS 重悬,移入EP管中,4℃离心,4 000 r/min, 5 min。弃上清,加入100 μl RIPA裂解液( 含1 mmol/L PMSF)。4℃裂解30~45 min,每5 min振荡一次。4℃离心,12 000 r/min,5 min,取上清,蛋白定量。
配制分离胶、浓缩胶,加样孔中加入20 μl样品,接通电源,恒压80伏进行电泳。PVDF膜转膜100 mA恒流,2 h。取出膜放入10 ml 封闭缓冲液中,室温轻摇2 h。一抗孵育,4℃过夜。TBST室温洗膜10 min×3次。二抗孵育,室温轻摇45 min。TBST洗膜10 min×3次。 DAB显色试剂盒显色。扫描PVDF膜,Quantity one软件对条带进行统计分析。
1.2.5细胞中金属硫蛋白的检测采用免疫细胞化学法:细胞培养于铺好盖玻片的6孔板中,各组处理因素如1.2.2所述,UVB辐射24 h后,95%乙醇4℃固定10 min后晾干,0.3%Triton-100打孔10 min。3%H2O2去离子水室温孵育10 min。PBS冲洗5 min×3次。正常山羊血清封闭,室温孵育10 min,倾去血清,加入1∶200稀释的兔抗金属硫蛋白多克隆抗体,4℃过夜。PBS冲洗5 min×3次。滴加生物素化二抗工作液(IgG),室温孵育10 min。PBS冲洗5 min×3次。滴加辣根酶标记链霉卵白素工作液,室温孵育10 min。PBS冲洗5 min×3次。用DAB显色试剂盒显色。自来水终止显色后,中性树胶封片。×400显微镜下观察。将结果图片用软件Image Pro Plus 6.0进行统计分析。
1.2.6 细胞中NF-κB/p65的检测操作步骤同1.2.5,UVB辐射2 h后固定细胞。
1.3统计学处理使用SPSS17.0 统计软件进行单因素方差分析。
2结果
2.1改变硫酸锌剂量对细胞状态的影响如图1所示,倒置显微镜下进行观察,正常组、10 μm/L硫酸锌组和50 μm/L硫酸锌组细胞大多数贴壁生长,状态良好。100 μm/L硫酸锌组细胞几乎全部死亡漂起。
2.2改变UVB辐射时间对细胞存活率的影响如图2所示,细胞存活率随着辐射时间的增加而逐渐降低。照射6、7、8、9 min后细胞存活率低于正常组,差异显著(P<0.05)。
2.3硫酸锌对细胞中Bax和Bcl-2 蛋白表达的影响如图3、4所示,以GAPDH为内参,紫外线组细胞内Bax/Bcl-2比值高于正常组,差异有统计学意义(P<0.05)。与紫外线组相比,加锌紫外线组细胞内Bax/Bcl-2比值显著降低,差异有统计学意义(P<0.05)。

图1 倒置显微镜下的细胞状态(×400)Fig.1 State of cells under invert microscope(×400)Note: A.Normal group B.100 μm/L ZnSO4 group C.50 μm/L ZnSO4 group D.10 μm/L ZnSO4 group.
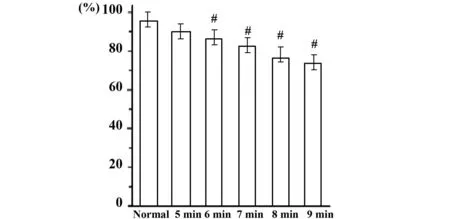
图2 UVB辐射时间对细胞存活率的影响±s)Fig.2 Effects of different duration of UVB radiation on HaCaT cell ±s)Note: #.P<0.05 vs normal group.
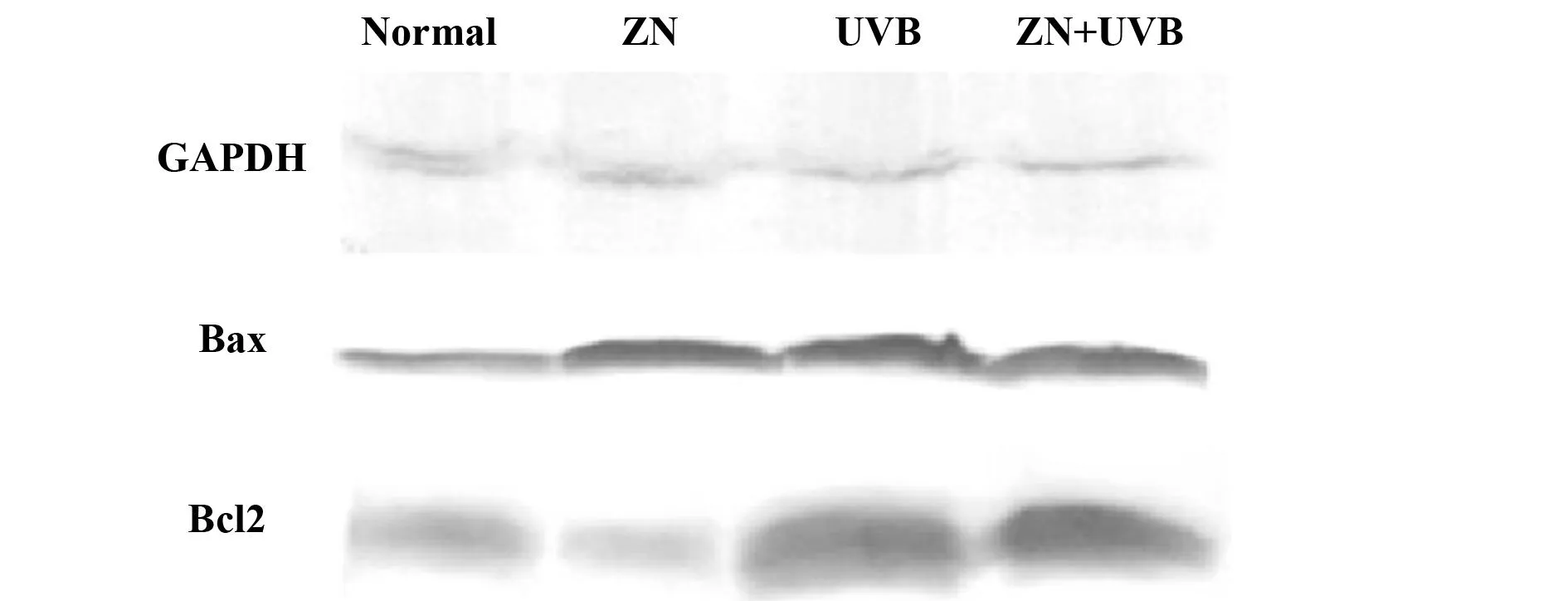
图3 Western 印迹检测细胞中Bax和Bcl-2 蛋白表达Fig.3 Effects of Zinc sulfate on HaCaT cell Bax and Bcl-2 expression detected by Western blot
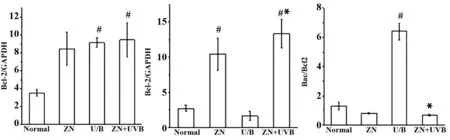
图4 细胞中Bax和Bcl-2表达情况Fig.4 Expression of Bax and Bcl-2 in HaCaT ±s)Note: #.P<0.05 vs normal group;*.P<0.05 vs UVB group.

图5 免疫细胞化学方法检测细胞中金属硫蛋白表达(×400)Fig.5 Expression of metallothionein in HaCaT cells by Immunocytochemistry detection (×400)Note: A.Normal group;B.UVB group;C.ZnSO4 group;D.UVB+ZnSO4 group.

图6 细胞中金属硫蛋白表达情况±s)Fig.6 Expression of metallothionein in HaCaT ±s)Note: #.P<0.05 vs Zn group;*.P<0.05 vs UVB group,Δ.P<0.05 vs normal group.

图7 免疫细胞化学方法检测细胞中NF-κB/p65表达(×400)Fig.7 Expression of NF-κB/p65 in HaCaT cells by Immunocytochemistry detection (×400)Note: A.Normal group;B.UVB group;C.ZnSO4 group;D.UVB+ZnSO4 group.
2.4硫酸锌处理对细胞中金属硫蛋白表达情况的影响与正常组相比,加锌组、紫外线组、加锌紫外线组细胞内MT表达量升高,差异有统计学意义(P<0.05)。与紫外线组相比,加锌紫外线组细胞内MT表达量升高,差异有统计学意义(P<0.05)。与加锌组相比,加锌紫外线组细胞内MT表达量升高,差异有统计学意义(P<0.05),见图5、6。
2.5硫酸锌处理对细胞中NF-κB/p65表达情况的影响与正常组相比,紫外线组、加锌紫外线组细胞内NF-κB/p65表达量升高,差异有统计学意义(P<0.05)。与紫外线组相比,加锌紫外线组细胞内NF-κB/p65表达量显著,差异有统计学意义(P<0.05),见图7、8。

图8 细胞中NF-κB/p65表达情况Fig.8 Expression of NF-κB/p65 of in HaCaT ±s)Note: #.P<0.05 vs normal group;*.P<0.05 vs UVB group;Δ.P>0.05 vs normal group.
3讨论
紫外线对皮肤损伤、炎症、光老化和皮肤癌的发生、发展有着极为重要影响[7,8]。紫外线可通过损伤角质形成细胞DNA,最终导致凋亡[9]。表皮中的角质形成细胞是UVB损伤的主要对象, HaCaT细胞为人永生化角质形成细胞,培养条件相对比较简单,潜在增殖能力高,保留了表皮细胞的分化能力和增殖特性[10],因此,实验选用HaCaT细胞株作为研究对象。
有研究证实,在UVB导致的角质形成细胞损伤中,Bcl-2发挥了抗凋亡的作用[11]。Bcl-2家族由凋亡蛋白和抗凋亡蛋白组成,如Bcl-2属于抗凋亡基因而Bax属于促凋亡基因,这中间的平衡关系决定了细胞的存亡。本研究结果显示,UVB组Bax/Bcl-2比值显著高于正常组,表明该比值的改变导致从线粒体中Cyto-C的释放,致使天冬氨酸特异性半胱氨酸蛋白酶的活化,最终导致了细胞凋亡的发生[12]。在HaCaT细胞中, Bcl-2的过量表达阻断UVB导致的凋亡,其中包括了阻止Cyto-C的释放,Caspase-3的表达等,对半胱氨酸天门冬酶前体-8表达的阻滞,削弱了直接死亡受体对其表达的影响。Bcl-2在UVB辐射刺激的角质形成细胞中也发挥了抗氧化剂的作用。
MT是一种富含半胱氨酸蛋白家族,在体内低水平持续表达,可以通过半胱氨酸残基与重金属离子结合,在存在这些金属离子情况下可以被强烈诱导表达。皮肤中的MT表达可在对烧伤、UV辐射等刺激的应答中上调[13]。MT可降低氧化应激水平,促进组织的愈合,调节免疫功能等,表明这些蛋白可以帮助细胞拮抗UV辐射的损伤效应,阻断细胞内凋亡途径的活化,成为拮抗UV导致皮肤癌症发生发展的内源性潜在保护机制[14,15]。本实验中,与正常组相比,加锌组和紫外线组细胞均有较高的MT表达。这说明50μM的硫酸锌能够诱导细胞中的MT表达,且作为诱导MT表达的物理因素,UVB也能使MT表达水平上调;加锌紫外线组细胞中MT表达水平显著高于紫外线,这说明当细胞受到UVB辐射时,造成生物性损伤,细胞本身产生的MT不足以拮抗损伤,而对细胞进行硫酸锌处理后,锌离子可以诱导细胞内MT的表达,从而拮抗UVB的损伤。
研究表明,活化的NF-κB能够抑制Bcl-2等抗凋亡蛋白的表达与存活[16],使NF-κB成为促进凋亡的因素。本研究中UVB组细胞内NF-κB/p65表达量显著升高,同正常组相比差异有统计学意义(P<0.05),与文献报道一致。在众多的MT光保护机制中, NF-κB活性改变是其中很重要的一种。MT能够通过发挥抗氧化作用,降低NF-κB活性,降低UVB所导致的生物学损伤,而MT能够清除自由基,改善氧化应激状态的特点,也成为间接降低NF-κB表达水平的途径。在本研究中,加锌紫外线组细胞NF-κB/p65表达量比较低,说明硫酸锌诱导金属硫蛋白的表达,可能具有抑制NF-κB的作用,阻止NF-κB/p65导致凋亡的发生。
参考文献:
[1]Haarmann-Stemmann T,Boege F,Krutmann J.Adaptive and maladaptive responses in skin:Mild heat exposure protects against UVB-induced photoaging in mice[J].J Invest Dermatol,2013,133(4):868-871.
[2]张芳芳,车雅敏.环境污染与紫外辐射量相关性及对光老化影响[J].中国美容医学,2011,20(12):1993-1995.
[3]Afaq F,Adhami VM,Mukhtar H.Photochemoprevention of ultraviolet B signaling and photocarcinogenesis[J].Mutat Res,2005,571(1-2):153-173.
[4]Bowden GT.Prevention of non-melanoma skin cancer by targeting ultraviolet-B-light signaling[J].Nat Rev Cancer,2004,4(1):23-35.
[5]Butler PE, Gonzalez S, Randolph MA,etal.Quantitative and qualitative effects of chemical peelingon photo-aged skin:An experimental study[J].Plast Reconstr Surg,2001,107(1):222-228.
[6]Chen L,Hu JY,Wang SQ. The role of antioxidants in photoprotection: a critical review[J]. J Am Acad Dermatol,2012,67(5) : 1013-1024.
[7]Chen HX,Weng Q,Fisher DE. UV signaling pathways within the skin [J]. J Invest Dermatol,2014,134(8) : 2080-2085.
[8]D'Orazio J,Jarrett S,Amaro-Ortiz A,etal. UV radiation and the skin [J]. Int J Mol Sci,2013,14(6) : 12222-12248.
[9]Housman TS,Feldman SR,Williford PM,etal.Skin cancer is among the most costly of all cancers to treat for the Medicare population[J].J Am Acad Dermatol,2003,48(3):425-429.
[10]郭志丽,顾军,米庆胜,等.来氟米特对角质形成细胞增殖及凋亡的影响 [J] . 中华皮肤科杂志,2003,36(10):580-582.
[11]Assefa Z,Garmyn M,Vantieghem A,etal.Ultraviolet B radiation-induced apoptosis in human keratinocytes: cytosolic activation of procaspase-8 and the role of Bcl-2[J].FEBS Lett,2003,540(1-3):125-132.
[12]Ricci JE,Gottlieb RA,Green DR.Caspasemediated loss of mitochondrial function and generation of reactive oxygen species during apoptosis[J].J Cell Biol,2003,160(1):65-75.
[13]Morellini NM,Giles NL,Rea S,etal.Exogenous metallothionein-IIA promotes accelerated healing after a burn wound[J].Wound Repair Regener,2008,16(5):682-690.
[14]Lynes MA,Zaffuto K,Unfricht DW,etal.The physiological roles of extracellular metallothionein[J].ExpBiolMed(Maywood),2006,231(9):1548-1554.
[15]Kim HG,Hwang YP,Han EH,etal.Metallothionein-III provides neuronal protection through activation of Nuclear Factor-kB via the TrkA/Phosphatidylinositol-3 kinase/Akt signaling pathway[J].Toxicol Sci,2009,112(2):435-449.
[16]Campbell KJ,Rocha S,Perkins N.Active repression of antiapoptotic gene expression by relA(p65) NF-κB[J].Mol Cell,2004,13(6):853-865.
[收稿2015-11-26]
(编辑张晓舟)
Antagonizing effects of Metallothionein against development of skin cancer and relevant mechanisms
WUYue-Ting,SHIJia-Hong,PANQi-Zheng,WANGYuan,HOUBao-Lian,RENShu-Ping.
DepartmentofOccupationalandEnvironmentalHealth,SchoolofPublicHealth,JilinUniversity,Changchun130021,China
[Abstract]Objective:To establish a UVB damage cell model with HaCaT cells to investigate the protective effects of Zinc sulfate on the cell damage caused by UVB and its relevant mechanisms.Methods: The cells were divided into normal group,Zinc group,UVB group,Znic and UVB group.The addition of Zinc sulfate to the HaCaT cells was conducted 24h prior to the irradiation to the cells by UVB.Cell apoptosis was detected by Western blot and the expression of metallothionein and NF-κB/p65 were measured by immunohistochemistry.Results: Compared with normal and Zn+UVB group,Bax/Bcl-2 rate in UVB group increased.Compared with normal group,MT expression levels in UVB group,Zn group increased,and compared with UVB group,MT expression level in Zn+UVB group increased .Compared with normal group and Zn+UVB group,NF-κB/p65 expression level in UVB group increased.Conclusion: Zinc sulfate alleviates the apoptosis of HaCaT cell induced by UVB because of the expression of MT.
[Key words]Skin cancer;UV;Metallothionein;Apoptosis
中图分类号R392
文献标志码A
文章编号1000-484X(2016)03-0340-05
作者简介:武月婷(1990年-),女,在读硕士,主要从事环境有害因素对健康影响方面的研究,E-mail:wuyueting72@sohu.com。通讯作者及指导教师:任淑萍(1966年-),女,教授,硕士生导师,主要从事环境有害因素对健康的影响及机制研究,E-mail:rensp@jlu.edu.cn。
doi:10.3969/j.issn.1000-484X.2016.03.010
①吉林大学中日联谊医院,长春130000。

