3~5期慢性肾脏病患者VitD3水平与胰岛素释放的关系研究
韩 艳 李运博 吴春雷 邓华英
(浙江省温州医科大学附属第一医院伤骨科,温州325000)
3~5期慢性肾脏病患者VitD3水平与胰岛素释放的关系研究
韩艳李运博①吴春雷邓华英
(浙江省温州医科大学附属第一医院伤骨科,温州325000)
[摘要]目的:了解CKD 3~5期患者VitD3浓度与OGTT的葡萄糖及胰岛素水平之间的关系。方法:纳入符合纳入标准的确诊为慢性肾脏病3、4、5期的患者,监测每期患者的[1,25(OH):D3]浓度、OGTT时空腹、餐后1 h、2 h的血糖和胰岛素浓度、糖化血红蛋白水平、C肽浓度,并进行相关性分析。结果:91例3~5期CKD患者,3期1,25(OH):D3浓度范围为160.9~261.3 mmol/L,平均(218.38±8.67)mmol/L;4期为75.2~166.3 mmol/L,平均(117.01±4.72)mmol/L;5期为11.8~96.5 mmol/L,平均为(41.91±12.83)mmol/L(P<0.05);3期血清葡萄糖平均浓度空腹为(4.74±0.21)mmol/L、餐后1 h为(8.31±0.43)mmol/L和餐后2 h为(7.36±0.32)mmol/L;4期为(4.92±0.25)、(9.14±0.15)和(8.27±0.39)mmol/L;5期为(4.81±0.13)、(10.72±0.41)和(10.74±0.49)mmol/L(P<0.05);3期胰岛素平均浓度空腹为(6.58±0.32)μU/L、餐后1 h为(57.78±5.63)μU/L和餐后2 h为(42.77±8.45)μU/L;4期为(6.03±0.53)、(55.69±7.35)和(62.52±5.39)μU/L;5期为(6.12±0.65)、(62.82±9.73)和(77.34±8.62)μU/L(P<0.05)。相关性分析结果,不同分期的CKD患者1,25(OH):D3浓度与糖耐量试验胰岛素水平呈负相关(P<0.05)。结论:3~5期CKD患者不同分期维生素D3浓度有明显差异;3~5期CKD患者不同分期的OGTT的葡萄糖及胰岛素水平之间,且维生素D3浓度与OGTT的葡萄糖及胰岛素水平之间的呈负相关关系。
[关键词]慢性肾脏病;维生素D3;血清葡萄糖;胰岛素
胰岛素抵抗(IR)与高胰岛素血症在慢性肾脏病(Chronic kidney disease,CKD)的早期即可出现,增加CKD患者心血管疾病的发病率和死亡率,促进肾脏病的进展。1,25-二羟维生素D3[1,25(OH):D3]是维生素D3的活性形式,除维持钙磷代谢及骨骼结构外,还可作为分化及抗增殖因子在肾脏、心血管及免疫系统中发挥作用[1-4]。已有研究显示CKD患者特别是3~5期,均存在不同程度的VitD3缺乏,影响胰岛素释放导致糖耐量下降,在CKD合并糖尿病中发挥作用。本研究目的在于了解CKD 3~5期患者VitD3浓度与OGTT的葡萄糖及胰岛素水平之间的关系。
1材料与方法
1.1材料
1.1.1研究对象选取2010年1月至 2011年12月在我院诊断明确为慢性肾脏病(Chronic kidney disease,CKD),未使用活性维生素D治疗的患者。
1.1.2纳入标准(1)符合K/DOQI关于CKD及血液净化的临床实践指南,CKD定义为肾损伤或GFR<60 ml/(min·1.73 m2)持续3个月以上。肾损伤定义为病理异常或其他损伤标志(包括血或尿或影像学检查异常);(2)应用CG或MDRD公式判定GFR<60 ml/min;(3)病程大于3个月。
1.1.3排除标准(1)妊娠或哺乳期妇女;(2)有慢性肝炎,结核及胰腺疾病史者;(3)原发病为糖尿病;(4)急性肾功能衰竭;(5)近3个月有维生素D类药物服用史者;(6)有日光曝晒史者(7)维生素D类药物过敏者;(8)钙磷乘积>4.5;(9)不愿意参加本研究者;(10)不符合纳入标准。
1.1.4CKD诊断和分期标准[5](1)美国肾脏病基金会(National Kidney Foundation,NKF) CKD定义:①肾脏损害(肾脏的结构与功能异常)伴或不伴有肾小球滤过率(GFR)下降≥3个月;②GFR<60 ml/(min· 1.73 m2)≥3个月,伴或不伴肾脏损害。(2)参照GFR将CKD分为5期(见表1,应用简化的MDRD公式计算估计GFR)。
1.1.5糖尿病诊断标准参照2013年中国2型糖尿病防治指南[6]推荐采用1999年WHO糖尿病诊断标准,空腹血糖≥7.0 mmol/L和餐后2 h≥11.1 mmol/L诊断为糖尿病;空腹血糖<7.0 mmol/L,餐后2 h 7.8~11.1 mmol/L为糖耐量异常。
表1CKD分期标准
Tab.1Criteria for CKD

StageItemsGFR[ml/(min1.73m2)]1KidneyinjurywithnormalorincreasedGFR≥902KidneyinjurywithmilddecreasedGFR60-893ModerateddecreasedGFR30-594SeveredecreasedGFR15-295Kidneyfunctionalfailure<15ordialysis
1.2方法
1.2.1一般项目记录患者的年龄、性别、原发病。
1.2.2实验室检查指标(1)所有纳入研究的患者纳入时均行以下实验室检查:①纳入研究时所有患者空腹抽取静脉血,使用HITACHI7600-110自动生化分析仪检测以下项目:ALT、AST、血清总蛋白、白蛋白(Alb)、总胆固醇、甘油三脂、钾、钠、磷、钙、尿素氮、肌酐、尿酸、血糖。②化学发光法测定血全段甲状旁腺激素(iPTH)(试剂盒购自美国Beckman Coulter公司)。③酶联免疫吸附试验(ELISA)测定1,25(OH):D3(试剂盒购自英国IDS公司)。维生素D不足定义为<75mmol/L,维生素D缺乏定义为<37.5 mmol/L。④测定果糖胺、C-肽、糖化血红蛋白、胰岛素浓度。⑤测定空腹及口服葡萄糖后1 h及2 h胰岛素及血糖水平。(2)VitD3治疗前后观察指标:血肌酐、尿素氮、血糖、iPTH、钙、磷、VitD3浓度,OGTT后葡萄糖及胰岛素水平。
2结果
2.1一般资料本研究共纳入3~5期CKD患者91例,其中男性63例,女性28例,男女性别比为2.25∶1。年龄范围27~83岁,平均年龄(61.32±4.53)岁。原发病包括慢性肾小球肾炎47例(51.65%),糖尿病肾病15例(16.48%),高血压肾损害13例(14.29%),继发性肾小球疾病7例(7.69%),慢性小管间质性肾病5例(5.49%),其他4例(4.40%)。CKD 3~5期患者分别为17、25和48例。
2.2不同CKD分期的1,25(OH):D3浓度CKD3期患者的1,25(OH):D3浓度范围为160.9~261.3 mmol/L,平均(218.38±8.67)mmol/L;4期为75.2~166.3 mmol/L,平均(117.01±4.72)mmol/L;5期为11.8~96.5 mmol/L,平均为(41.91±12.83)mmol/L;三期比较有统计学差异(P<0.05,表2)。3、4期CKD中无维生素D不足或缺乏,4期仅1例患者为75.2 mmol/L,接近维生素D不足的标准,5期CKD中25例患者为维生素D缺乏,最低1例为11.8 mmol/L;20例<75 mmol/L者定义为维生素D不足,4例>75 mmol/L。
表2不同CKD分期的1,25(OH):D3浓度
Tab.2Concentration of 1,25(OH):D3in CKD patients

CKDstageConcentrationrange(mmol/L)Averageconcentration(mmol/L)31)160.9-261.3218.38±8.6742)75.2-166.3117.01±4.7253)11.8-96.541.91±12.83
Note:1) vs 2),1) vs 3),2) vs 3),about concentration range and average concentrationP<0.05.
表4不同分期CKD患者空腹C肽、空腹果糖胺和糖化血红蛋白水平
Tab.4Serum concentration of C peptide,fructosamine and hemoglobin of CKD patients
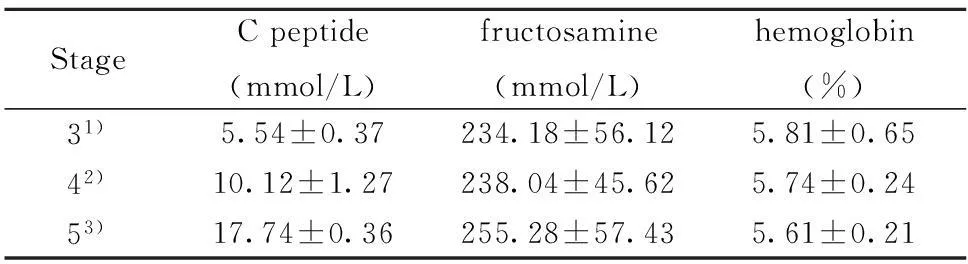
StageCpeptide(mmol/L)fructosamine(mmol/L)hemoglobin(%)31)5.54±0.37234.18±56.125.81±0.6542)10.12±1.27238.04±45.625.74±0.2453)17.74±0.36255.28±57.435.61±0.21
Note:1) vs 2),1) vs 3),2) vs 3),about serum C peptide,fructosamine and hemoglobinP<0.05.表3不同分期CKD患者OGTT的葡萄糖浓度及胰岛素水平
Tab.3CKD patients′ serum concentration of glucose and insulin at different time points

StageSerumglucoseconcentration(mmol/L)LimosisPostprandialserumglucoseat1hPostprandialserumglucoseat2hSeruminsulinconcentration(μU/L)LimosisPostprandialserumglucoseat1hPostprandialserumglucoseat2h31)4.74±0.218.31±0.437.36±0.326.58±0.3257.78±5.6342.77±8.4542)4.92±0.259.14±0.158.27±0.396.03±0.5355.69±7.3562.52±5.3953)4.81±0.1310.72±0.4110.74±0.496.12±0.6562.82±9.7377.34±8.62
Note:1) vs 2),1) vs 3),2) vs 3),about serum glucose and insulin concentration at different time pointsP<0.05.
2.3不同分期CKD患者OGTT的葡萄糖浓度及胰岛素水平(1)3期CKD患者OGTT的血清葡萄糖平均浓度空腹为(4.74±0.21)mmol/L、餐后1 h为(8.31±0.43)mmol/L和餐后2 h为(7.36±0.32)mmol/L;4期CKD患者分别为(4.92±0.25)、(9.14±0.15)和(8.27±0.39)mmol/L;5期CKD患者分别为(4.81±0.13)、(10.72±0.41)和(10.74±0.49)mmol/L,三期比较有统计学差异(P<0.05)。(2)3~5期CKD空腹血糖均未超过7.0 mmol/L,餐后2 h超过11.1 mmol/L的CKD 3~5期分别为1/17例(5.88%)、3/25例(12%)和20/49例(40.81%);餐后2 h 在7.8~11.1 mmol/L者3~5期分别为5/17例(29.41%)、11/25例(44%)和18/49例(36.73%),三期比较有统计学差异(P<0.05)。(3)3期CKD患者OGTT的胰岛素平均浓度空腹为(6.58±0.32)μU/L、餐后1 h为(57.78±5.63)μU/L和餐后2 h为(42.77±8.45)μU/L;4期CKD患者分别为(6.03±0.53)、(55.69±7.35)和(62.52±5.39)μU/L;5期CKD患者分别为(6.12±0.65)、(62.82±9.73)和(77.34±8.62)μU/L三期比较有统计学差异(P<0.05),见表3。
2.4不同分期CKD患者空腹C肽、空腹果糖胺和糖化血红蛋白水平空腹C肽浓度3、4、5期CKD患者分别为(5.54±0.37)、(10.12±1.27)和(17.74±0.36)mmol/L三期比较有统计学差异(P<0.05);其中5期CKD患者空腹C肽有4例超过40 mmol/L;空腹果糖胺分别为(234.18±56.12)、(238.04±45.62)和(255.28±57.43)mmol/L,三期比较有统计学差异(P<0.05) ;糖化血红蛋白分别为(5.81±0.65)%、(5.74±0.24)%和(5.61±0.21)%,三期比较有统计学差异(P<0.05),见表4。
2.5不同分期CKD患者的1,25(OH):D3与OGTT胰岛素相关性分析相关性分析结果,不同分期的CKD患者1,25(OH):D3浓度与糖耐量试验胰岛素水平呈负相关(P<0.05)。
3讨论
慢性肾脏病(Chronic kidney disease,CKD)的概念由美国肾脏病基金会肾脏病患者生存质量指导(K/DOQI )专家组首次正式提出并由全球提高肾脏病预后组织(KDIGO)进行修订和推广[7,8]。发达国家报道CKD平均年发病率增加约5%~8%[9],是严重威胁人类健康的疾病。2007年CKD北京地区流行病学研究结果显示该地区≥18岁成人患病率为13.0%[10];另有研究报道40岁以上成年人患病率达10.8%[11]。既往多项资料均显示慢性肾小球肾炎为我国CKD首位病因,上海华山医院和叶任高等在1981年和1984年的研究显示慢性肾小球肾炎比例分别为64.4%和64.5%;杜晓霞2003年报道慢性肾炎比例较前虽有下降但仍达56.4%。糖尿病肾病在CKD病因中逐渐增多,美国、澳大利亚等多项研究表明CKD患病率的增长与糖尿病患病率的增长密切相关,李洪杰等[12]综述报道糖尿病是CKD重要危险因素。国内的研究也有类似的趋势,有报道显示20世纪糖尿病肾病比例仅为1.74%[13];而到21世纪初杜晓霞等[14]的结果显示已升到6.7%,甚至糖尿病肾病已经成为部分地区CKD首要病因。2007年中国慢性肾脏病流行病学调查涉及全国13个省市/自治区的全国性横断面研究显示糖尿病和高血压已经成为罹患CKD独立相关的危险因素[15]。严重代谢紊乱为CKD的主要并发症,包括糖代谢紊乱等。大量研究指出CKD患者多表现为波动性高血糖,少数患者表现为自发性低血糖。长期血糖波动可以通过诱发氧化应激的激活导致严重并发症,引起肾功能进一步恶化[16]。胰岛素抵抗(Insulin resistance,IR)是代谢综合征的中心环节,是糖尿病、高血压及脂代谢紊乱的始动因素和致病基础。CKD早期即可出现IR,IR增加CKD患者心血管疾病的发病率和死亡率,促进肾脏进展[17]。CKD可在胰岛素受体前水平、受体水平及受体后水平产生IR,涉及甲状旁腺素水平升高、代谢性酸中毒、1,25(OH):D3缺乏、肾素-血管紧张素系统活等因素。张桦等[18]研究报道CKD患者即使肾功能正常或轻至中度肾功能不全也存在明显的IR和高胰岛素血症,且出现肾功能不全者IR的程度更为严重。研究显示糖尿病的发病与免疫因素密切相关,特别是细胞因子介导的β细胞炎性损害和T细胞分化异常是糖尿病发生、发展的关键环节,在胰岛β细胞和机体免疫细胞中同时发现的维生素D受体(Vitamin D receptor,VDR),可能在糖尿病与免疫二者之间起着重要的桥梁作用。
大量研究已经证实了CKD患者常见维生素D3缺乏或不足,且与CKD患者的预后相关。吕轶伦等[19]报道维生素D缺乏患病率为39.66%,在CKD 1~5期中分别为5.00%、17.50%、37.21%、42.37%和57.14%,患病率随CKD分期逐级增加,维生素D不足率为44.97%,在CKD 1~5期中分别为72.50%、47.50%、45.35%、33.90%和 40.60%。有研究报道了CKD患者1,25(OH):D3浓度高低与预后密切相关[20,21]。本研究中CKD 3期患者的1,25(OH):D3平均浓度(218.38±8.67 )mmol/L、4期为(117.01±4.72)mmol/L和5期为(41.91±12.83)mmol/L;三期之间1,25(OH):D3浓度差异比较有统计学意义。刘书馨等报道127例不同分期的CKD患者1,25(OH):D3不足和缺乏常见,且与肾功能损害有关,4、5期CKD患者的1,25(OH):D3浓度明显低于1~3期[22]。
Dogra等对肾病综合征患者研究结果显示肾病综合征患者的空腹血糖、胰岛素及HOMA指数均显著升高[23]。黄文瀚等[24-28]调查了重庆市渝中区成人CKD的患病率及其主要危险因素发现糖尿病患病率在7.11%,国内类似研究报道的患病率在6.61%~28.0%。唐露等[29]报道eGFR为30~60 ml/(min·1.73 m2) 组和<30 ml/(min·1.73 m2)组的血糖波动系数及血糖>11.1 mmol/L时间比明显大于eGFR≥60 ml/(min·1.73 m2)组,eGFR为30~60 ml/(min·1.73 m2) 组餐后2 h血糖平均值大于≥60 ml/(min·1.73 m2)组,认为慢性肾衰竭中晚期患者易出现血糖的异常波动,主要表现为波动性高血糖尤其餐后明显,国外也有类似研究报道[30]。本研究比较了3~5期CKD患者OGTT时的血糖及其相关因素的差异发现3~5期CKD患者空腹血糖浓度无明显差异,而餐后1 h、2 h的浓度差异明显,尤其是餐后2 h,发现3~5期CKD餐后2 h血糖达到糖尿病诊断标准的5期有40.81%,远高于3、4期CKD,而达到糖耐量异常的4、5期明显高于3期,说明随着CKD分期升级,糖代谢紊乱更加明显,可能与肾小球滤过率下降和CKD伴发的代谢紊乱相关。
空腹胰岛素≥85 pmol/L可诊断为高胰岛素血症,其是IR的主要标志,它可以通过高脂血症、高血压、高尿酸血症、高凝状态多种途径导致肾脏损害,也可以通过直接作用加重肾损。本研究发现餐后2 h胰岛素浓度比较,4、5期明显高于3期CKD差异有统计学意义,空腹胰岛素浓度3~5期无差异,餐后1 h 5期CKD的胰岛素浓度与3期比较差异有统计学意义,与4期比较无统计学意义;4期与3期比较无统计学意义。杨悦等研究纳入465例CKD发现4、5期IR发生率分别为44.44%、42.41%显著高于1期的5.48%,eGFR<30 ml/(min·1.73 m2)是CKD患者IR的相关因素[31]。武晓春等的研究也有类似结果报道[32]。
本研究将血清1,25(OH):D3与OGTT时空腹、餐后1 h、2 h胰岛素浓度进行相关性分析发现呈负相关关系。王虹等研究发现CKD 3期的空腹胰岛素水平、血肌酐、24 h尿蛋白定量及胰岛素抵抗指数均明显升高,肾小球滤过率、1,25(OH):D3显著降低,相关分析表明血清1,25(OH):D3与24 h尿蛋白定量、血肌酐呈负相关水平,与胰岛素抵抗有显著相关性[33]。
参考文献:
[1]Levels JD.Extra-renal 1.25dihydroxylase in the classical and non-classical actions of 1α,25-dihydroxyvitamin D3[J].Seminars in Dialysis,2007,20(4):316-324.
[2]Li YC.Renoprotective effects of vitamin D analogs[J].Kidney Int,2010,78(2):134-139.
[3]Holick MF.Vitamin D deficiency[J].N Engl J Med,2007,357(3):266-281.
[4]Nagpal S,Na SQ,Rathnachalam R.Noncalcemic actions of vitamin D receptor ligands[J].Endocr Rev,2005,26(5):662-687.
[5]梅长林,蔡彦.慢性肾脏病分期的意义及争论[J].中华肾脏病杂志,2009,25(12):887-889.
[6]中华医学会糖尿病学分会.中国2型糖尿病防治指南(2013年版)[J].中国医学前沿杂志:电子版,2015,22(3):26-89.
[7]National Kidney Foundation.K/DOQI clinical practice guidelines for chronic kidney disease:evaluation,classification,and stratification[J].Am J Kidney Dis,2002,39(2 Suppl 1):S1-266.
[8]Levey AS,Eckardt KU,Tsukamoto Y,etal.Definition and classification of chronic kidney disease:a position statement from Kidney Disease:Improving Global Outcomes (KDIGO)[J].Kidney Int,2005,67(6):2089-2100.
[9]A Meguid El Nahas,Aminu K Bel-lo.Chronic kidney disease:the global challenge[J].Lancet,2005,365:331-340.
[10]Zhang L,Zhang P,Wang F,etal.Prevalence and factors associated with CKD:a population study from Beijing[J].Am J Kidney Dis,2008,51(3):373-384.
[11]张路霞,王芳,王莉,等.中国慢性肾脏病患病率的横断面调查[J].中华内科杂志,2012,51(7):570.
[12]李洪杰,王庆霞,刘雪梅.慢性肾脏病患病率及病因谱的变化[J].国际泌尿系统杂志,2014,34(2):278-282.
[13]王永明,李平生.288例慢性肾功能衰竭的病因分析[J].中华肾脏病杂志,1993,9(5):283-283.
[14]杜晓霞,刘虹,彭佑铭,等.1137例慢性肾功能衰竭病人[J].湖南医科大学学报,2003,28(6):641-644.
[15]张路霞,王海燕.中国慢性肾脏病的高患病率及其对检验医学的挑战[J].中华检验医学杂志,2012,35(9):769-772.
[16]Zheng F,Lu W,Jia C,etal.Relationships between ueose excursion and the activation of oxidative stress in patients with newly diagnosed type 2 diabetes or impaired glucose regulation[J].Endocr,2010,37(1):201-208.
[17]郭军利,张桦.慢性肾脏病胰岛素抵抗的研究进展[J].国际内科学杂志,2007,34(3):170-173.
[18]张桦,金石昆,林琳,等.早中期慢性肾病患者胰岛素抵抗与高胰岛素血症[J].中山大学学报:医学科学版,2005,26(S1):201-202.
[19]吕轶伦,林颍,史浩,等.熳性肾脏病患者维生素D不足与缺乏[J].中华肾脏病杂志,2009,25(9):668-672.
[20]Ravani P,Malberti F,Tripepi G,etal.Vitamin D levels and patient outcome in chronic kidney disease[J].Kidney Int,2009,75(1):88-95.
[21]Wolf M,Shah A,Gutierrez O,etal.Vitamin D levels and early mortality among incident hemodialysis patients[J].Kidney Int,2007,72(8):1004-1013.
[22]刘书馨,常明,郐婷婷,等.慢性肾脏病患者25-羟维生素D3检测及其临床相关因素分析[J].中国实用内科杂志,2010,30(5):447-449.
[23]Dogra GK,Herrmann S,Irish AB,etal.Insulin resistance,dyslipidaemia,inflammation and endothelial function in nephrotic syndrome[J].Nephrol Dial Transplant,2002,17(12):2220-2225.
[24]黄文瀚,唐琳,蔡莹,等.重庆市渝中区成人慢性肾脏病流行病学调查及相关因素分析[J].上海交通大学学报:医学版,2014,34(5):725-730.
[25]张路霞,左力,徐国宾,等.北京市石景山地区中老年人群中慢性肾脏病的流行病学研究[J].中华肾脏病杂志,2006,22(2):67-71.
[26]黄燕萍,王伟铭,裴道灵,等.上海城市社区成年人群慢性肾脏病流行病学研究[J].中华肾脏病杂志,2008,24(12):872-877.
[27]陈崴,王辉,董秀清,等.广州市城区普通人群中慢性肾脏病的流行病学研究[J].中华肾脏病杂志,2007,23(3):147-151.
[28]徐潇漪,多景华,罗洋,等.内蒙古呼伦贝尔地区成人慢性肾脏病流行病学调查[J].中华肾脏病杂志,2010,26(6):422-426.
[29]唐露,王子承,魏日胞,等.血糖波动在慢性肾脏病患者的发生意义及相关因素研究[J].中国中西医结合肾病杂志,2014,15(4):310-313.
[30]Boland E,Monsod T,Delucia M,etal.Limitations of conventional methods of self-monitoring of blood glucose:lessons learned from 3 days of continuous glucose sensing in pediatric patients with type 1 diabetes[J].Diabetes Care,2001,24(11):1858-1862.
[31]杨悦,魏日胞,王远大,等.223例慢性肾脏病患者胰岛素抵抗及其相关因素的研究[J].中华临床医师杂志:电子版,2012,6(9):96-99.
[32]武晓春,方奕,唐利群,等.150例慢性肾脏病患者胰岛素抵抗指数的分布及其相关因素分析[J].临床肾脏病杂志,2013,13(12):550-553.
[33]王虹,矫淑彩,王萌.慢性肾脏病患者维生素D缺乏与胰岛素抵抗的关系[J].临床肾脏病杂志,2013,13(4):168-170.
[收稿2015-06-13修回2015-07-12]
(编辑张晓舟)
Study about relationship between VitD3and insulin level in patients with 3-5 stage chronic kidney disease
HANYan,LIYun-Bo,WUChun-Lei,DENGHua-Ying.
DepartmentofOrthopedicsInjury,theFirstAffiliatedHospitalofWenzhouUniversity,Wenzhou325000,China
[Abstract]Objective:To investigate the relationship between VitD3 concentration and glucose and insulin levels of OGTT in patients with CKD 3-5 stages.Methods: We included the patients with CKD 3 and 4 and 5 stages who fulfill the including standard.All patients were recorded the concentrations of [1,25 (OH):D3]concentration of glucose and insulin at fasting,postprandial 1 h,2 h during OGTT and concentration of glycosylated hemoglobin level,C peptide concentration.We performed the correlation analysis about [1,25 (OH):D3],glucose and insulin.Results: We totally included 91 patients with 3-5 stages CKD into our study.The D3 concentration of stage 3 were 160.9-261.3 mmol/L[(218.38±8.67)mmol/L] of stage 3,75.2-166.3 mmol/L[(117.01±4.72)mmol/L] of stage 4 and 11.8-96.5 mmol/L[(41.91±12.83)mmol/L] of stage 5 (P<0.05).The average concentrations of serum glucose at fasting,1 h after the meal and 2 h after the meal was(4.74±0.21)mmol/L,(8.31±0.43)mmol/L and(7.36±0.32)mmol/L in 3 stage and (4.92±0.25) mmol/L,(9.14±0.15) mmol/L and (9.14±0.39)mmol/L at 4 stage and (4.81±0.13)mmol/L,(10.72±0.41)mmol/L and (10.72±0.49)mmol/L at 5 stage (P<0.05).The average concentrations of insulin during OGTT at fasting,1 h after the meal and 2 h after the meal was (6.58± 0.32) μU/L,(57.78±5.63)U/L and (42.77±8.45)U/L in 3 stage (6.03±0.53)U/L,(55.69±7.35)U/L and (62.52±5.39)U/L in 4 stage and (6.12±0.65)U/L,(62.82±9.73)U/L and (77.34±8.62)U/L in 5 stage (P<0.05).Correlation analysis shows that the concentration of 1,25 (OH):D3 of different stages of patients with CKD and vitamin D3 concentration and glucose tolerance test was found to be inversely associated with the insulin levels (P<0.05).Conclusion: There are obvious differences of concentration of vitamin D3 between patients with 3-5 stages of chronic kidney disease (CKD).There also showed a negative correlation relationships between glucose and insulin levels,and vitamin D3 concentration and glucose and insulin levels at OGTT of patients with 3-5 stages CKD.
[Key words]Chronic kidney disease (CKD);Vitamin D3;Serum glucose;Insulin
中图分类号R453.9
文献标志码A
文章编号1000-484X(2016)03-0405-05
作者简介:韩艳(1980年-),女,硕士,主治医师,主要从事筋骨痛症临床诊治及相关免疫学的实验研究。
doi:10.3969/j.issn.1000-484X.2016.03.024
①浙江省温州医科大学,温州325035。

