蝎毒多肽提取物调控肝脏移植瘤中自然杀伤细胞浸润的机制研究①
韩 琛 王朝霞 贾 青 王兆朋 张月英 张 钰 王恒孝
(山东省医学科学院基础医学研究所,济南大学山东省医学科学院医学与生命科学学院,济南250062)
蝎毒多肽提取物调控肝脏移植瘤中自然杀伤细胞浸润的机制研究①
韩琛王朝霞贾青王兆朋张月英张钰王恒孝
(山东省医学科学院基础医学研究所,济南大学山东省医学科学院医学与生命科学学院,济南250062)
[摘要]目的:观察蝎毒多肽提取物(PESV)对H22细胞小鼠肝脏原位移植瘤模型中肿瘤浸润自然杀伤细胞(Natural killer cell,NK cell)的浸润分布及活性的影响。方法:C57BL/6小鼠肝脏接种H22肝癌细胞株悬液构建原位移植瘤模型,设立正常对照组、荷瘤对照组、PESV小剂量组和PESV大剂量组,分别给予生理盐水及PESV灌胃干预14 d,观察比较各组小鼠给药后的肿瘤体积、肿瘤质量及生存期变化,通过HE染色比较各组肿瘤组织形态学变化,流式细胞术和免疫组化检测肝脏及癌组织中浸润NK1.1+细胞的比例及分布特点,real-time PCR法检测癌组织中穿孔素、颗粒酶B的表达。结果:PESV大、小剂量组肝脏移植瘤的生长受到抑制,肿瘤体积和瘤质量均低于荷瘤对照组,肿瘤抑制率分别为30.77%和15.38%,生存期观察显示PESV大剂量组能显著延长荷瘤小鼠生存时间,生命延长率为34.06%,P<0.05;荷瘤对照组肿瘤细胞排列紧密,异型性显著,呈浸润性生长,PESV大、小剂量组出现明显坏死区,细胞异型性减轻;PESV大剂量组小鼠肝脏NK细胞占肝脏总淋巴细胞的比例是(5.91±0.49)%,显著高于荷瘤对照组(3.69±0.50)%(P<0.05),且大量浸润分布在肿瘤组织及癌旁组织中;PESV大剂量组瘤组织中穿孔素和颗粒酶的mRNA表达量分别是荷瘤对照组的3.62倍和5.82倍(P<0.05)。结论:PESV可通过提高H22细胞肝脏原位移植瘤中浸润NK细胞的比例,促进NK细胞向肿瘤组织迁移,诱导穿孔素和颗粒酶B的产生,有助于NK细胞杀伤活性的恢复,从而增强对肿瘤细胞的清除,抑制肿瘤的浸润生长。
[关键词]蝎毒;肝肿瘤;自然杀伤细胞;穿孔素;颗粒酶B
自然杀伤(Natural killer cells,NK)细胞是一类胞内含有大颗粒、不同于T、B淋巴细胞的第三类淋巴细胞,是固有免疫系统重要成员之一,在抗感染、抗肿瘤等免疫监视过程中发挥重要作用,被视为机体免疫系统的第一道防线[1]。肝脏中含有丰富的NK细胞,而且其免疫特性表现出器官特异性,活化的NK细胞可以更好地清除机体内的肿瘤细胞,抑制肿瘤的生长[2]。原发性肝癌(Hepatocellular carcinoma,HCC)发生过程中,由于肿瘤细胞表面相关抗原的改变及微环境中细胞因子、免疫细胞的相互作用,NK细胞的活性大大降低,导致肿瘤细胞的逃逸。如何提高并恢复NK细胞对肿瘤细胞的识别和杀伤效应,成为抗肿瘤免疫治疗的重要手段[3]。蝎毒多肽提取物(Polypeptide extract from scorpion venom,PESV)是从东亚钳蝎蝎毒中提取的活性物质,本实验室前期研究表明PESV对多种肿瘤细胞具有抑制作用,可抑制肿瘤血管生成、干预肿瘤免疫逃逸发生[4],PESV在抑制肿瘤增殖过程中是否对机体NK细胞的免疫活性有调节作用尚未有相关报道,本实验通过观察PESV对H22细胞小鼠肝脏原位移植瘤肿瘤组织中NK细胞的浸润分布及功能的影响,探讨PESV对机体固有免疫的调节作用,为肝癌的免疫治疗提供新的理论依据。
1材料与方法
1.1材料
1.1.1实验动物及细胞6~8周C57BL/6 小鼠,雄性,体重20~22 g,购自北京华阜康生物科技股份有限公司,合格证号 SCXK2014-0004,饲养于山东省医学科学院基础研究所实验动物房IVC(智能型独立送回风净化笼具)中,动物在室温(22±2)℃、相对湿度50%条件下自由摄食饮水,动物购入适应5 d后开始试验。鼠源性H22肝癌细胞株由本室保存,应用时复苏后接种于昆明小鼠腹腔内,接种三代后取增殖良好的细胞用于实验。
1.1.2试剂和仪器PESV由本室研制,提取方法见参考文献[5],使用时用无菌生理盐水稀释。Percoll购自Solarbio公司,小鼠CD3-FITC(Cat.No.553 061)、NK1.1-PE-CY7(Cat.No.5620 62)标记荧光单克隆抗体购自BD公司,兔抗鼠NK1.1抗体购自Abcam公司(ab197979),Trizol购自Invitrogen公司、TransScript® First-Strand cDNA Synthesis SuperMix、TransScript® Green qPCR Sup-erMix UDG试剂盒购自北京全式金生物技术有限公司。穿孔素、颗粒酶引物购自上海铂尚生物公司。Bio-Rad MyCycleTMThermal Cycler梯度PCR仪、实时荧光定量PCR LightCycler 480仪购自德国Roche公司;Leica DM4000B光学显微、LeicaQWin V3图像分析软件购自德国徕卡仪器有限公司。流式细胞仪购自美国BD公司。
1.2方法
1.2.1H22细胞肝脏原位移植瘤模型的建立、分组及给药选取腹腔接种H22肝癌细胞株后腹水生长良好的小鼠无菌抽取腹水,洗涤后用生理盐水重悬细胞,显微镜下细胞计数,经台盼蓝染色法检测细胞存活率>95%,调整细胞浓度至2×106ml-1,置于冰上待用。采用5%水合氯醛(0.06 ml/10 g)小鼠腹腔注射进行麻醉,取仰卧位固定于实验板上,碘伏消毒皮肤,剑突下沿腹中线纵行切口,逐层剪开皮肤和腹膜,充分暴露肝左叶。用微量注射器抽取50 μl H22细胞悬液(含细胞数1×105个)缓慢注入肝脏实质,按压至不出血后逐层缝合切口。术后24 h将小鼠随机分为荷瘤对照组(Control)、PESV小剂量组(PEVS-L,10 mg/kg)、PESV大剂量组(PESV-H,40 mg/kg),每组8只。术后3 d开始灌胃给药,灌胃容量0.1 ml/10 g鼠重,每日一次,荷瘤对照组采用等体积生理盐水灌胃,共计14 d。另取6只正常小鼠作为正常对照(Normal)。
1.2.2H22细胞肝脏原位移植瘤小鼠生存期观察按1.2.1方法接种H22细胞后随机分组,每组各8只,分别连续灌胃给药14 d,于末次给药后24 h开始记录各组动物存活天数、存活数量至其自然死亡,根据公式:生存延长率=(实验组平均生存天数-荷瘤对照组平均生存天数)/荷瘤对照组平均生存天数×100%,计算生命延长率。
1.2.3取材各组动物末次给药24 h后摘取眼球取血,颈椎脱臼法处死小鼠,取肝脏肿瘤组织,测量瘤组织最大(a)及最小(b)直径,根据公式计算肿瘤体积(V),V=ab2/2[6],肿瘤抑制率(%)=[荷瘤对照组瘤质量(g)-用药组瘤质量(g)]/荷瘤对照组瘤质量(g)×100%。部分肿瘤及癌旁组织采用中性甲醛固定及-80℃冻存,部分肿瘤组织及肝组织机械研磨分离单核细胞。
1.2.4HE染色及肿瘤组织形态学观察肿瘤组织4%中性甲醛固定24 h后,常规酒精脱水、二甲苯透明、石蜡包埋,切片,厚度4 μm;切片经二甲苯脱蜡、梯度酒精水化后,采用苏木素-伊红染色,水洗后,常规脱水,透明,中性树胶封片,镜下观察原位移植瘤组织形态变化。
1.2.5流式细胞术对肝脏及肿瘤浸润组织中NK细胞的检测剪碎肝脏组织,200目滤网进行冰上研磨,加入RPMI1640保持组织湿润。将研磨后的肝组织收集于离心管中,冰浴自然沉降后,吸取上层液体离心,1×PBS洗2次。采用非连续密度梯度Percoll法分离淋巴细胞[7]:用3 ml 40% Percoll溶液重悬沉淀,用吸管将其叠加于70% Percoll溶液上,离心后用滴管小心吸取2层Percoll溶液界面的白膜层至另一离心管中,离心洗涤后收集得到的细胞即为单核细胞,进行台盼蓝染色计算细胞存活率。将分离得到的单核细胞每个样本均取1×106细胞加入流式管中,大鼠血清封闭后加入相应的荧光抗体(FICT-CD3,PE-Cy7-NK1.1)孵育30 min,洗涤后重悬细胞并上机检测。
1.2.6免疫组织化学检测肿瘤及癌旁组织中NK1.1阳性细胞分布及结果判定肿瘤组织用4%中性甲醛固定24 h,石蜡包埋,切片,脱水后采用柠檬酸钠抗原修复液(0.01 mol/L,pH6.0)进行抗原修复。正常山羊血清封闭后滴加兔抗鼠NK1.1(1∶200)一抗,4℃冰箱孵育过夜;漂洗3次后山羊抗兔IgG二抗(1∶2 000),DAB显色剂显色,苏木素复染。阴性对照用PBS代替抗体。判定标准:NK1.1主要表达于C57BL/6小鼠NK细胞膜表面,参考Schmidt等[8]以及我们之前介绍的双评分半定量法[9]对染色结果进行评分,在400倍高倍镜下随机选取10个视野,根据染色强度和阳性细胞所占百分比例进行判定:阳性细胞区域分4级,阳性率<10%为1级计1分,10%~50%为2级计2分,50%~80%为3级计3分,>80%为4级计4分。染色强度按以下标准评分:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。两种评分相加记为免疫组化染色评分,0分为阴性(-),1~2分为弱阳性(+),3~4分为中等阳性(++),4分以上为强阳性(+++)。
1.2.7Real-time PCR法检测癌及癌旁组织中穿孔素、颗粒酶mRNA的表达取冰冻肝癌组织采用TRizol 法提取总RNA,20 μl逆转录体系按照试剂盒操作说明进行,反应程序为42℃ 30 min和85℃ 5 min。Real-time PCR选用20 μl反应体系包括1 μl RT产物,0.4 μl 上游引物,0.4 μl 下游引物,10 μl 2×TransStrat Green qPCRSuperMix UDG,ddH2O至20 μl。引物序列见表1,反应条件为 94℃ 10 min,94℃ 5 s,60℃ 30 s,72℃ 10 s,40个循环,荧光信号检测。结果处理用β-actin作内参。每个样本设置3个复孔,取Ct平均值,采用2-ΔΔCt相对定量的方法表示基因的相对表达量。试验重复3次。
2结果
2.1PESV的抑瘤作用及对荷瘤小鼠的生存期影响经过14 d用药处理,PESV-H组与Control组相比小鼠肿瘤体积显著减小(80.19±28.75 mm3vs.143.44±60.36 mm3,P<0.05),瘤质量降低明显(0.18±0.0.04 g vs.0.26±0.02 g,P<0.01);PESV-L组与Control组相比肿瘤体积无显著差异[(96.63±28.17)mm3vs.(143.44±60.36)mm3,P>0.05]、瘤质量减小[(0.22±0.05)g vs.(0.26±0.02)g,P<0.05]。PESV-H、PESV-L组肿瘤抑制率分别为30.77%和15.38%。各组小鼠生存时间显示,PESV-H、PESV-L组均能延长荷瘤小鼠生存时间,平均生存时间分别(38.38±1.44)d和(33.75±1.53)d,高于Control小鼠(28.63±2.09)d,生命延长率分别为34.06%和17.88%,其中PESV-H组与Control组相比差异有统计学意义(P<0.05),能显著延长小鼠的荷瘤生存时间,见图1。
表1穿孔素、颗粒酶B引物序列及产物长度
Tab.1Perforin and Granzyme B primer sequences and products length

GenePrimer(5'-3')SequencesProductslength(bp)PerforinForwardCTGCCACTCGCTCAGAATGReverseCGGAGGGTATTCACATCCAT88GranzymeBForwardTGTGAAGGGCAGGAGATGTGTGCTAReverseTCAGCTCAGCCTCTTGTAGCGTGT92β-actinForwardGGCTGTATTCCCCTCCATCGReverseCCAGTTGGTAACAATGCCATGT156
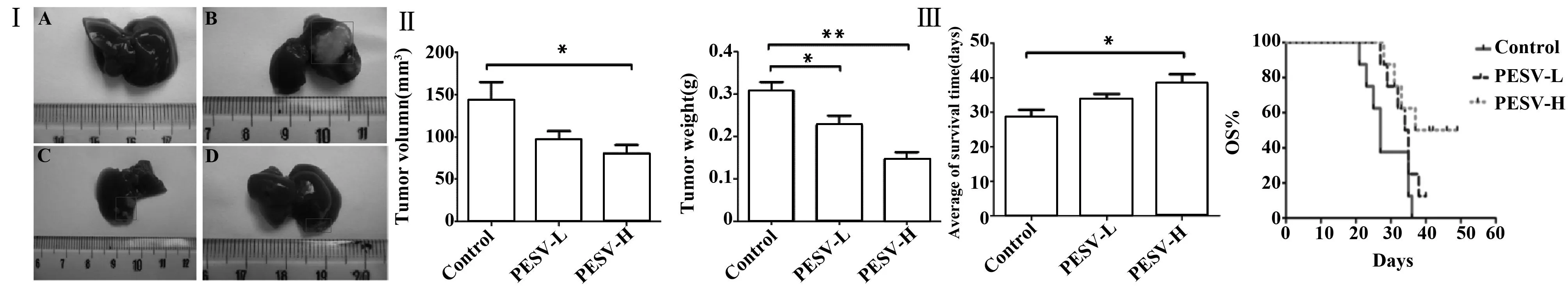
图1 PESV对肝脏移植瘤组织生长及小鼠生存期的影响Fig.1 Effects of PESV on orthotopic transplantation tumor in liver and survival time of miceNote: Ⅰ.A.Normal control group;B.Control group;C.PESV-L group;D.PESV-H group;Ⅱ.The tumor volume and weight of each group;Ⅲ.The average of survival time on each group.Compared with the control group,*.P<0.05;compared with the control group,**.P<0.01.
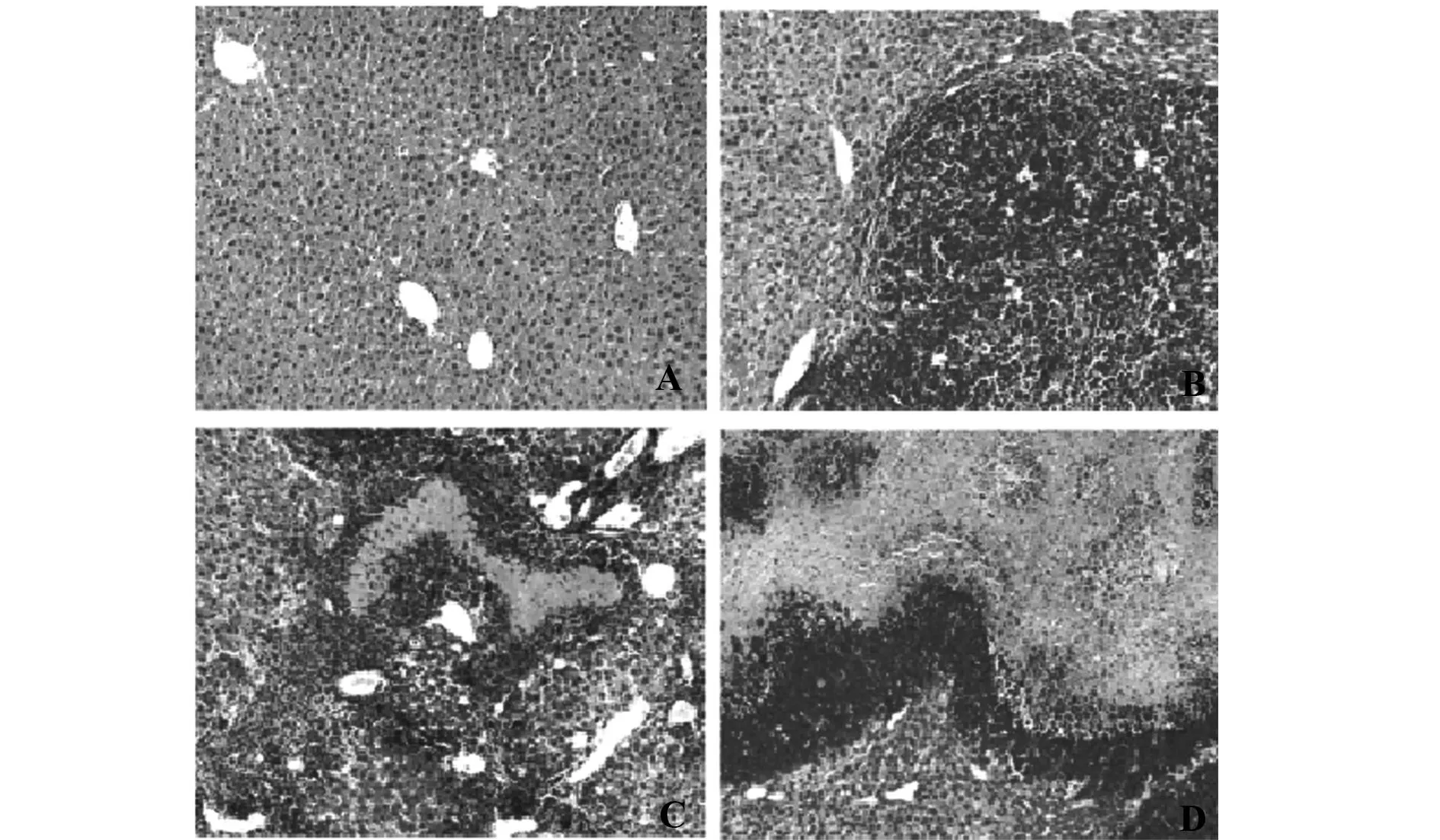
图2 PESV对小鼠肝脏移植瘤组织形态学变化的影响(光学显微镜,×100)Fig.2 Histomorphology changes of orthotopic transpla-ntation tumor with PESV treatment in liver of mice(Optical microscope,×100)Note: A.Normal control group;B.Control group;C.PESV-L group;D.PESV-H group.
2.2PESV对原位移植瘤组织病理学变化的影响HE染色显示,与正常对照相比荷瘤对照组小鼠肿瘤浸润区肝小叶结构异常,瘤细胞异型性明显,大小不等,形状各异,染色质明显增多,细胞核深染,呈现分叶、多核等病理性核分裂,肿瘤细胞排列紧密,呈浸润性生长。PESV处理后可见瘤组织坏死区域有所增加,细胞异型性减轻,PESV-H组坏死区域增加显著(图2),提示PESV能通过促进肿瘤组织坏死,增强对肿瘤的清除作用。
2.3PESV对移植肿瘤组织中浸润NK的影响对各组小鼠肝脏组织及肿瘤组织提取总淋巴细胞,流式细胞检测结果显示,与Normal组相比,Control组NK细胞占设门中总淋巴细胞的频数显著降低(3.69±0.50)% vs.(6.90±0.22)%(P<0.05),经PESV不同剂量干预作用后,NK1.1阳性细胞的频数呈增加趋势,分别为(4.13±0.43)%和(5.91±0.49)%,其中PESV-H组与Control组组间比较差异显著(P<0.05),见图3,提示经PESV干预后肿瘤环境中浸润的NK细胞增加。
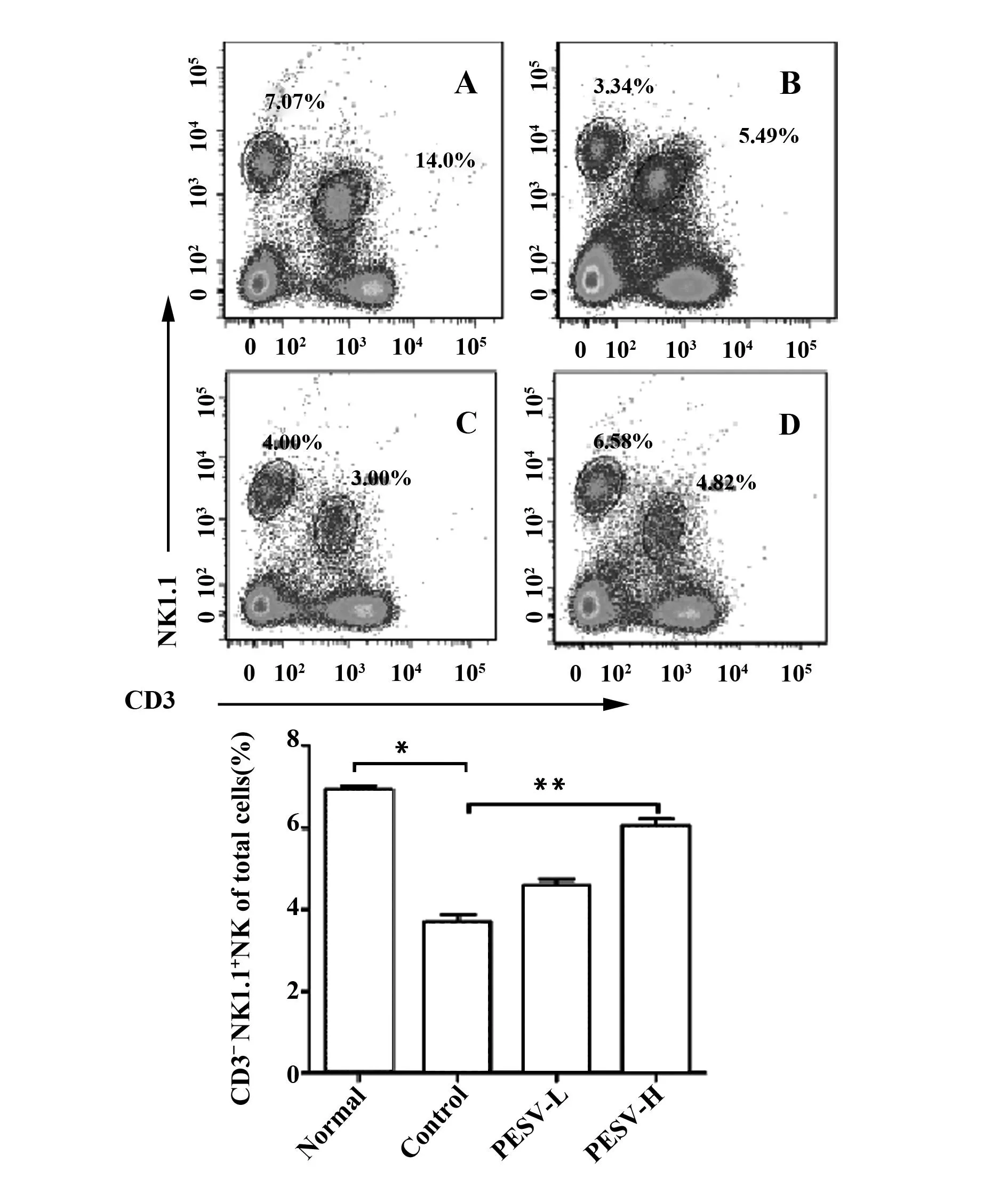
图3 PESV对肝脏移植瘤小鼠肝脏及瘤组织浸润淋巴细胞中CD3-NK1.1+细胞比例的影响Fig.3 Effects of PESV on the proportion of NK cells in liver and tumor-infiltrating lymphocytesNote: A.Normal control group;B.Control group;C.PESV-L group;D.PESV-H group.Compared with the normal group,*.P<0.05;compared with the control group,**.P<0.05.
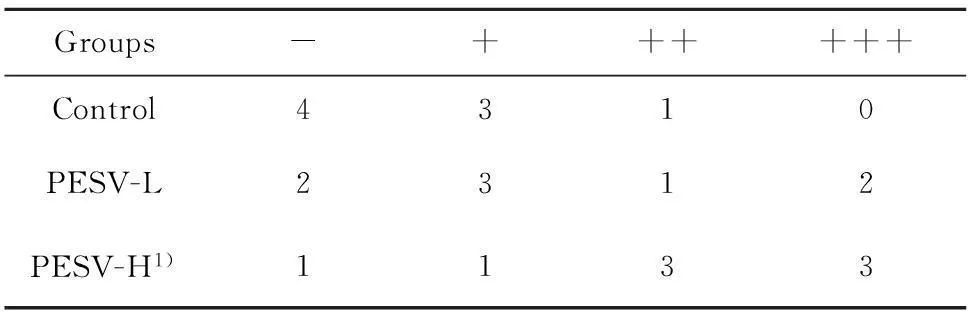
2.4PESV对移植瘤组织中浸润NK细胞分布的影响NK1.1主要表达在C57B L/6小鼠NK细胞胞膜,二氨基联苯胺(DAB)染色呈棕黄色颗粒。Control组中NK1.1阳性细胞零星分布,经PESV药物作用后,阳性细胞大量聚集分布于癌旁组织中,在坏死的肿瘤组织中也出现阳性细胞(图4)。经秩和检验显示,PESV-H组NK1.1+细胞显著多于Control组,具有统计学意义(P<0.05),见表2。
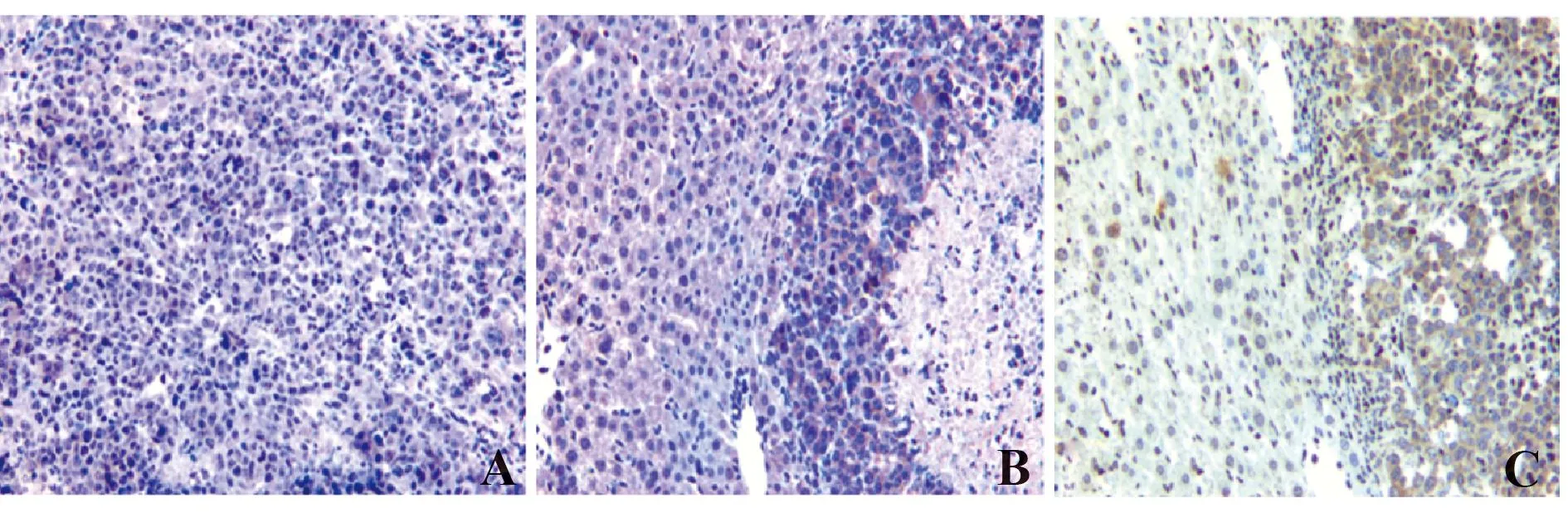
图4 PESV对肝脏移植瘤小鼠肿瘤组织中NK1.1+细胞浸润分布的影响(免疫组化,×200)Fig.4 Effects of PESV on NK1.1+cell infiltration in different HCC tissues of C57BL/6 mice(IHC,×200)Note: A.Tumor-bearing control group;B.PESV-L group;C.PESV-H group.
表2不同分组肝癌组织中NK细胞的浸润程度
Tab.2Infiltration of NK1.1+cells in HCC tissue of different groups
Groups-++++++Control4310PESV-L2312PESV-H1)1133
Note:1)P=0.017.
2.5PESV对肝脏移植瘤小鼠肿瘤组织中穿孔素、颗粒酶B表达变化的影响与Control组相比,经PESV不同剂量作用后,肿瘤组织中穿孔素、颗粒酶B的表达均呈增加趋势,PESV-H组与Control组间比较差异显著,分别是Control组的3.62倍和5.82倍,(P<0.05,P<0.01)(图5),PESV-L组与Control组间、PESV-H组与PESV-L组组间比较无显著性差异(P>0.05)。
3讨论
自然杀伤细胞是机体固有免疫系统中重要成员,它识别靶细胞无MHC限制性,无需抗原预先致敏即可直接杀伤肿瘤细胞,清除体内突变细胞,发挥免疫监视功能[10-13]。肝脏作为机体重要的“天然免疫器官”,含有丰富的免疫细胞,其中NK细胞约占肝脏淋巴细胞的30%~50%,是其他器官或组织的5~10倍,而且肝脏NK细胞在免疫表型、形态及功能特征上都表现器官特异性,较外周NK细胞具有更强的细胞毒活性和对肿瘤细胞的杀伤能力[14]。尽管如此,仍有一定比例的原发性肝癌细胞逃避机体免疫监视形成肿瘤。Guo等[15]发现HCC患者外周血中NK细胞3种亚群CD3-CD56+、CD3-CD57+、CD3-CD161+含量类似于健康志愿者,但在HCC癌组织中,CD3-CD56+、CD3-CD57+NK细胞比例显著低于癌旁组织,这种降低可能受肿瘤微环境中CD4+CD25+调节性T细胞、骨髓来源的抑制性细胞(Myeloid-derived suppressor cells,MDSC)、细胞因子TGF-β及缺氧、低pH值等因素影响,致使NK细胞无法正常识别靶细胞,使肿瘤细胞逃避了NK细胞的杀伤[16-24]。

图5 PESV对肿瘤组织中穿孔素、颗粒酶B mRNA的影响Fig.5 Effects of PESV on perforin and granzyme B expression detected by real-time PCR in tumor tissuesNote: *.P<0.05,compared with the control group;**.P<0.01,compared wtih the control group.
NK细胞发挥肿瘤杀伤作用主要通过其表面的活化性受体识别并黏附靶细胞,通过分泌相应细胞因子和释放细胞毒性穿孔素、颗粒酶等溶解、诱导靶细胞死亡[25,26]。穿孔素(Perforin)是一种具有溶细胞作用的糖蛋白,主要存在于细胞毒性T淋巴细胞(CTL)和NK细胞质的细胞毒颗粒中。穿孔素具有很高的磷酸胆碱亲和性,能促进与膜的融合并在膜上形成跨膜通道,导致靶细胞发生渗透性溶解,是机体抗肿瘤的主要方式之一[27]。穿孔素常与颗粒酶B(Granzyme B)协同发挥杀伤作用,诱导DNA断裂并参与多条凋亡途径,促使靶细胞凋亡[28]。
蝎毒多肽提取物是本实验室自东亚钳蝎蝎毒中提取的包含50~60个氨基酸多肽混合物,前期实验表明PESV具有多种生物活性,对多种肿瘤细胞具有较强的抑制作用,它可以通过抑制肿瘤微环境中的细胞因子TGF-β和VEGF的表达,在抑制肿瘤组织血管生成的同时,促进树突状细胞(DC)表面共刺激分子CD80/CD86的表达,提高抗原摄取与递呈能力,解除DC的免疫逃逸状态[29,30]。本研究在前期研究基础上,采用直接注射法构建小鼠H22细胞肝脏原位移植瘤模型,与皮下移植瘤相比能较好地表现肝癌发生过程中免疫应答过程。给予PESV大、小剂量药物14 d处理后,肿瘤的体积和肿瘤质量分别为[(80.19±28.75)mm3,(0.18±0.04)g]和[(96.63±28.17)mm3,(0.22±0.05)g],与荷瘤对照组[(143.44±60.36)mm3,(0.26±0.02)g]相比均减小,抑瘤率分别为30.77%和15.38%,表明PESV对小鼠H22细胞原位移植瘤有一定抑制作用。通过对荷瘤小鼠生存时间的观察发现PESV大、小剂量组的荷瘤小鼠平均生存时间分别为(38.38±1.44 d,33.75±1.53 d),较荷瘤对照组小鼠(28.63±2.09 d)生存时间延长,生命延长率分别为33.06%及17.88%,表明PESV可延长小鼠荷瘤生存时间。对肝脏肿瘤组织病理形态学观察,发现荷瘤对照组形成致密瘤组织,瘤细胞具有显著的异型性,核深染,出现病理性核分裂象,给药后瘤组织出现不同程度的坏死,且在癌旁组织中有大量炎性细胞浸润。经进一步观察PESV对肝癌组织中浸润NK细胞的影响,正常对照组与荷瘤对照组NK 细胞占淋巴细胞比例分别为(6.90±0.22)%和(3.69±0.50)%,表明在肿瘤发生过程中NK细胞受到显著抑制,给予PESV大、小剂量干预后,NK细胞在淋巴细胞中的比例分别为(5.91±0.49)%和(4.13±0.42)%,其中大剂量组显著升高(P<0.05),提示PESV能提高NK细胞的浸润程度。免疫组织化学结果证实,PESV处理后NK1.1阳性细胞主要聚集分布在癌旁组织,浸润数量显著高于荷瘤对照组。以上结果提示,给予PESV治疗可以上调肿瘤浸润NK细胞的比例,影响其分布,在一定程度上促进其免疫监视功能的恢复,由于受肿瘤局部微环境等因素的影响无法恢复至正常或超过正常水平,导致肿瘤仍缓慢进展。采用实时荧光定量PCR检测肝癌组织中穿孔素、颗粒酶B mRNA的表达,结果表明与荷瘤对照组比较,PESV大剂量组瘤组织中穿孔素、颗粒酶B mRNA相对表达量均出现显著升高,由此推断PESV能通过上调NK细胞穿孔素、颗粒酶B的表达,提高NK细胞的活性,增强对肿瘤细胞的清除作用。
综上所述,PESV可以通过调控肝癌组织中浸润NK细胞的比例及分布,提高NK细胞穿孔素和颗粒酶B mRNA的表达,增强对肿瘤细胞的清除作用,有助于恢复机体免疫监视功能,进一步揭示了PESV抗肿瘤作用的免疫学机制,为临床中西医联合治疗及NK细胞免疫过继疗法提供实验依据。
参考文献:
[1]Smyth MJ,Hayakawa Y,Takeda K,etal,New aspects of natural-killer-cell surveillance and therapy of cancer[J].Nat Rev Cancer,2002,2:850-861.
[2]Ishiyama K,Ohdan H,Ohira M,etal.Difference in cytotoxicity against hepatocellular carcinoma between liver and periphery natural killer cells in humans[J].Hepatology,2006,43:362-372.
[3]Rosso D,Rigueiro MP,Kassab P,etal.Gastrico correlation of Natural killer cell with the prognosis of gastric adenocarcinoma[J].Arq Bras Cir Dig,2012,2(2):114-117
[4]张维东,张月英,王朝霞,等.蝎毒多肽提取物对肿瘤生长和细胞免疫功能的影响[J].山东大学学报:医学版,2007,45(3):1-4.
[5]张维东,崔亚洲,姚成芳,等.蝎毒多肽提取物抗肿瘤血管生成作用的实验研究[J].中国药理学报,2005,21(6):708-711.
[6]Wang L,Tang ZY,Qin LX,etal.High-dose and long-term therapy with interferon-alfa inhibits tumor growth and recurrence in nude mice bearing human hepatocellular carcinoma xenografts with high metastatic potential [J].Hepatology,2000,32:43-48.
[7]邹勇,陈韬,严伟明,等,小鼠肝脏自然杀伤细胞分离纯化及受体表达分析[J].中西医结合肝病杂志,2008,18(5):277-279.
[8]Schmidt M,Voelker HU,Kapp M,etal.Expression of VEGFR(Flt-1) in breast cancer is associated with VEGF expression and with node-negative tumour stage[J].Anticancer Res,2008,(3A):1719-1724.
[9]Wang HX,Yi SQ,Li J,etal.Effects of splenectomy on spontaneously chronic pancreatitis in aly/aly mice[J].Clin Dev Immunol,2010:614890.
[10]Cerwenka A,Lanier LL.Natural killer cells,viruses and cancer [J].Nat Rev Immunol,2001,1:41-49.
[11]Stojanovic A,Cerwenka A.Natural killer cells and solid tumors [J].J Innate Immun,2011,3(4):355-364.
[12]Cooper MA,Fehniger TA,Caligiuri MA.The biology of human natural killer-cell subsets [J].Trends Immunol,2001,22(11):633-640.
[13]Krueger PD,Lassen MG,Qiao H,etal,Regulation of NK cell repertoire and function in the liver[J].Crit Rev Immunol,2011,31(1):43-52.
[14]Luo D,Verm ijlen D,Vanderkerken K,etal.Involvement of LFA-1 in hepatic NK cell(pit cell)-mediated cytolysis and apoptosis of colon carcinomacells[J].Hepatology,1999,31(1):110.
[15]郭存丽,程文,徐易,等.肝细胞癌患者外周血及肿瘤微环境中自然杀伤细胞的亚群变化及其临床意义[J].临床肿瘤学杂志,2014,19(2):117-121.
[16]Hoechst B,Voigtlaender T,Ormandy L,etal.Myeloid derived suppressor cells inhibit natural killer cells in patients with hepatocellular carcinoma via the NKp30 receptor[J].Hepatology,2009,50(3):799-807.
[17]Li H,Han Y,Guo Q,etal,Cancer-expanded myeloid-derived suppressor cells induce anergy of NK cells through membrane-bound TGF-beta 1[J].J Immunol,2009,182(1):240-249.
[18]Nausch N,Galani IE,Schlecker E,etal,Mononuclear myeloid-derived “suppressor” cells express RAE-1 and activate natural killer cells[J].Blood,2008,112(10):4080-4089.
[19]Ghiringhelli F,Menard C,Martin F,etal,The role of regulatory T cells in the control of natural killer cells:relevance during tumor progression[J].Immunol Rev,2006,214:229-238.
[20]Richard A Flavell,Shomyseh Sanjabi,Stephen H,etal.The polarization of immune cells in the tumour environment by TGFβ[J].Nat Rev Immunol,2010,10(8):1-27.
[21]Lardner A.The effects of extracellular pH on immune function [J].J Leukoc Biol,2001,69(4):522-530.
[22]Balsamo M,Manzini C,Pietra G,etal,Hypoxia downregulates the expression of activating receptors involved in NK-cell-mediated target cell killing without affecting ADCC[J].Eur J Immunol,2013,43(10):2756-2764.
[23]Siemens DR,Hu N,Sheikhi AK,etal.Hypoxia increases tumor cell shedding of MHC class I chain-related molecule:role of nitric oxide[J].Cancer Res,2008,68(12):4746-4753.
[24]Fauriat C,Long EO,Ljunggren HG,etal,Regulation of human NK-cell cytokine and chemokine production by target cell recognition[J].Blood,2010,115(11):2167-2176.
[25]Moretta A,Bottino C,Vitale M,etal,Activating receptors and coreceptors involved in human natural killer cell-mediated cytolysis[J].Annu Rev Immnol,2001,19:197-223.
[26]Gras Navarro A,Bjorklund AT,Chekenya M.Therapeutic potential and challenges of natural killer cells in treatment of solid tumors[J].Front Immunol,2015,29:6:202.
[27]O rtaldo JR,W inkler-Pickett RT,Nagashima K,etal.Direct evidence for release of pore-form ing protein during NK cellular lysis[J].J Leukocyte Biol,1992,52(5):483.
[28]Lord SJ,Rajotte RV,Korbutt GS,Bleackley RC,Granzyme B:a natural born killer[J]Immunol Rev,2003,193:31-38.
[29]张维东,崔亚洲,贾青,等.蝎毒多肽提取物对小鼠S180肉瘤和h22肝癌血管生成抑制作用的实验研究[J].山东中医药大学学报,2005,29(2):152-155.
[30]张月英,等.蝎毒多肽提取物对肿瘤微环境中树突状细胞成熟表型的影响[J].山东大学学报,2010,48(10)34-38.
[收稿2015-07-11修回2015-08-04]
(编辑倪鹏)
Regulatory mechanism of PESV on tumor-infiltrating natural killer cells in liver orthotopic transplantation tumor
HANChen,WANGZhao-Xia,JIAQing,WANGZhao-Peng,ZHANGYue-Ying,ZHANGYu,WANGHeng-Xiao.
InstituteofBasicMedicine,ShandongAcademyofMedicalSciences;SchoolofMedicineandLifeSciences,UniversityofJinan-ShandongAcademyofMedicalSciences,Jinan250062,China
[Abstract]Objective:To investigate the regulatory mechanism of PESV on tumor-infiltrating natural killer(NK) cells in a mice model with H22 orthotopic transplantation tumor.Methods: Suspensions of H22 cells were injected into the lobe of liver on C57BL/6 mice for establishing liver orthotopic transplantation tumor model ,then the mice were randomly divided into four groups:normal group,control group,PESV low dose group(PESV-L) and PESV high dose group(PESV-H).Mice were either sacrificed for mechanistic studies or survival followed 14 days of therapy.The volume and weight of the tumor were measured.The proportion of infiltrating NK cells was measured by flow cytometry and the expression of NK1.1(NK) cells was investigated by immunohistochemistry method.The expression of perforin and granzyme B were further investigated by real-time PCR.Results: In contrast to control group,the tumor inhibition rate was 15.38% and 30.77% in PESV-L group and PESV-H group respectively.The survival showed that PESV-H could significantly prolong the survival time of mice,and life extension rate was 34.06%,(P<0.05).Histological analysis revealed significant pleomorphism of the neoplastic cells and invasive extendion in control group,while there were more necrosis and less degree of atypia in PESV-L and PESV-H.The level of tumor-infiltrating NK cell was significantly higher in PESV-H than in tumor-bearing control group [(5.91±0.49)% vs.(3.69±0.50)%,P<0.05],and NK cells were infiltrating in peritumoral lesions.The mRNA of perforin and granzyme B in PESV-H were respectively 3.62 and 5.82 times than that of control group(P< 0.05).Conclusion: These findings suggest that the treatment of PESV might increase the infiltration of natural killer cells in the orthotopic transplantation tumor and contribute to NK cells migration to the tumor,which induct and maintain the activities of natural killer cells against tumor cells by expressing perforin and granzyme B in vivo.
[Key words]Scorpion venom;Hepatocellular carcinoma;Natural killer cells;Perforin;Granzyme B
中图分类号R73-36
文献标志码A
文章编号1000-484X(2016)03-0390-07
作者简介:韩琛(1981年-),女,硕士,助教,主要从事肿瘤免疫学方面研究,E-mail :441626282@qq.com。通讯作者及指导教师:王恒孝(1964年-),男,博士,硕士生导师,主要从事肿瘤免疫学方面的研究, E-mail: wanghengxiao@aliyun.com。
doi:10.3969/j.issn.1000-484X.2016.03.021
①本文为国家自然科学基金青年基金项目(81303077)和山东省医药卫生科技发展计划项目(2013WS0369)。

