沙棘多糖对急性肝损伤小鼠氧化应激的抑制作用及其对BCL-2/Bax和PPAR-γ的调控①
刘 芳 赵世敏 张 威 谢基明 邹 凯 张晓慧 王 雪 刘 欢 陈俊娜 王玉珍
(内蒙古农业大学生命科学学院,呼和浩特010018)
·生物治疗·
沙棘多糖对急性肝损伤小鼠氧化应激的抑制作用及其对BCL-2/Bax和PPAR-γ的调控①
刘芳赵世敏张威谢基明②邹凯张晓慧王雪刘欢陈俊娜王玉珍
(内蒙古农业大学生命科学学院,呼和浩特010018)
[摘要]目的:以LPS/D-GalN诱导的小鼠急性肝损伤作为模型,研究沙棘多糖对急性肝损伤的保护作用及其对BCL-2/Bax和PPAR-γ的调控。方法:C57BL/6系雄性小鼠随机分为六组:正常组(CTRL);模型组(L/G);地塞米松阳性对照组(DXM);沙棘多糖低(SPL)、中(SPM)、高剂量组(SPH)。SPL、SPM和SPH组分别用50、100、200 mg/kg沙棘多糖溶液连续灌胃14 d,然后采用D-GalN(700 mg/kg)联合LPS(10 μg/kg)腹腔注射诱导急性肝损伤。建模4 h后采集血清和并收集肝脏组织,检测ALT、AST的活性和丙二醛(MDA)的含量。通过Western blot检测肝脏组织中SOD2及BCL-2和Bax的表达水平。通过免疫组织化学法测定肝脏PPAR-γ的表达。结果:ALT、AST水平在模型组显著升高(P<0.01),沙棘多糖预处理后剂量依赖地降低了ALT和AST水平(P<0.01);模型组的MDA比正常组显著升高(P<0.01),沙棘多糖各剂量组比模型组都有显著降低(P<0.01)。模型组的SOD比正常组显著降低(P<0.01),沙棘多糖各剂量组比模型组都有显著升高(P<0.01);沙棘多糖预处理后降低了Bax的表达水平,对BCL-2的表达没有明显的影响。沙棘多糖各剂量组中PPAR-γ的表达量与模型组相比明显降低。结论:沙棘多糖对LPS/D-GalN诱导的氧化应激有抑制作用,其作用与上调SOD2的表达以及抑制Bax的表达有关。
[关键词]沙棘多糖;肝损伤;BCL-2;Bax;PPAR-γ
肝病在我国的发病率处于较高水平,保肝和护肝也成为大众关注的重点。氧化应激参与了多种肝脏疾病的发生和发展过程。LPS/D-GalN诱导的急性肝损伤可使肝脏组织MDA含量升高,SOD活性降低,发生氧化应激反应[1]。当细胞受到氧化应激等刺激时,可以通过死亡配体或线粒体途径激活天冬氨酸特异性半胱氨酸蛋白9 (Caspases 9),两种方式都导致Caspase 3的激活,促进细胞凋亡发生[2]。
细胞发生凋亡时,线粒体膜的通透性受到BCL-2蛋白家族的调控。BCL-2是目前公认的抗凋亡基因,而其同族另一成员Bax则诱导凋亡,当Bax同源二聚体形成时则促使细胞凋亡,当BCL-2与Bax形成异源二聚体时则抑制凋亡,因此BCL-2/Bax的比例在一定程度上调节凋亡的发生。所以,细胞凋亡发生与否和BCL-2家族蛋白的调控密切相关。许多研究表明,BCL-2蛋白在体外和体内都能够保护细胞并发挥抗凋亡作用[3,4]。过氧化物酶体增殖物激活受体γ (Peroxisome proliferators activated receptor gamma,PPAR-γ)属于细胞核受体家族,研究证实PPAR-γ激活后可以抑制细胞增殖[5,6]。但这些研究主要针对肿瘤,肝脏损伤时PPAR-γ与氧化应激的关系的研究较少。近年来,许多文献报道了植物多糖对急慢性肝脏损伤疾病有保护作用[7,8]。研究发现,沙棘果实、叶、根和种子等各部器官中含有丰富的营养及药用成分[9,10]。本实验研究沙棘多糖对肝脏氧化应激的抑制作用及其对BCL-2/Bax和PPAR-γ的调控,为进一步阐明肝损伤机制及其预防提供实验依据,对沙棘多糖可能作用的信号途径进行研究探索,为预防肝病的发生和新药物的开发奠定基础。
1材料与方法
1.1实验材料与试剂8周龄雄性C57BL/6小鼠60只购自北京维通利华实验动物技术有限公司,标准化喂养;沙棘多糖(SP)来自内蒙古农业大学生命科学学院分子免疫学实验室;LPS、D-GalN(G0500)购自Sigma公司;地塞米松磷酸盐注射液(国药H41020055)购自郑州卓峰制药有限公司;MDA和SOD测试盒均购自南京建成生物工程研究所有限公司;PPAR-γ抗体购自美国Cell Signaling公司;免疫组化二抗和DAB显色剂购自北京中杉金桥生物技术有限公司;Western blot二抗购自LI-COR公司。
1.2方法
1.2.1动物实验方法C57BL/6系雄性小鼠随机分为六组,每组10只:(A)正常组 (CTRL);(B)LPS/D-GalN诱导的肝损伤模型组(L/G);(C)地塞米松组 (DXM);(D)沙棘多糖低剂量组(SPL);(E)沙棘多糖中剂量组(SPM);(F)沙棘多糖高剂量组(SPH)。沙棘多糖低、中、高剂量组分别用50、100、200 mg/kg沙棘多糖溶液连续灌胃14 d。D-GalN(700 mg/kg)联合LPS (10 μg/kg) 腹腔注射诱导小鼠急性肝损伤模型。
1.2.2血清中ALT、AST的检测通过全自动生化分析仪测定血清中ALT、AST的含量,测定结果由内蒙古人民医院检验科提供。
1.2.3肝脏中MDA含量的检测将得到的小鼠肝脏组织匀浆按照MDA测定试剂盒的步骤来操作,检测肝脏组织中MDA的活性。检测原理为:过氧化脂质降解产物中的MDA可以与硫代巴比妥酸产生缩合反应,产物为红色物质,该物质在532nm处有特征吸收峰,通过紫外可见分光光度计检测吸光值,可推知MDA的含量。
1.2.4Western blot检测肝脏组织按照重量∶体积=1∶9的比例加入组织蛋白抽提液,经破碎后4 000 r/min离心10 min即得到10%肝脏匀浆,利用BCA试剂盒方法检测蛋白含量。经SDS-PAGE电泳分离蛋白,湿法转膜到聚偏二氟乙烯膜(PVDF)。5% BSA封闭1 h后,PVDF膜加入SOD2、Bax、BCL-2一抗4℃孵育过夜。TBST洗膜后加入二抗室温孵育1 h,再次洗膜后用Odyssey红外激光扫描成像仪检测蛋白表达量,并分析其变化。
1.2.5免疫组织化学染色石蜡切片经常规脱蜡水化后采用免疫组化法(IHC) 检测PPAR-γ的表达,严格按照SP试剂盒操作说明进行。
2结果
2.1沙棘多糖对血清中ALT、AST活性的影响血清中的ALT、AST通常被当作急性肝损伤早期的重要生化指标。从表1可以看出,4 h模型组均比正常对照组的ALT、AST活性有显著升高(P<0.01),表明在注射LPS/D-GalN后,动物模型建造成功。沙棘多糖显著抑制了小鼠血清中ALT和AST活性的上升,且各剂量组与模型组对比均具有统计学意义(P<0.01),并且具有剂量依赖性。
2.2沙棘多糖对肝脏中MDA含量的影响MDA是检测机体内脂质过氧化程度的重要指标,可以间接地反映出细胞损伤的程度。表2结果显示,模型组的MDA比正常组显著升高(P<0.01),沙棘多糖各剂量组比模型组都有显著降低(P<0.01)。由此表明沙棘多糖显著抑制了肝损伤小鼠肝脏MDA含量的升高。
2.3沙棘多糖对肝脏中SOD-2含量的影响SOD是清除炎症过程中产生的过氧化物游离基的最重要酶之一。从图1中看出,肝脏中模型组的SOD都比正常组显著降低(P<0.01),沙棘多糖各剂量组的SOD活性比模型组有显著升高(P<0.05,P<0.01),其中高剂量组的效果要优于中、低剂量组。由此表明沙棘多糖对肝损伤小鼠肝脏中SOD的降低具有抑制的作用。
2.4沙棘多糖对肝脏中Bax和BCL-2含量的影响可以由Western blot检测结果看出 (图2、3),模型组与对照组相比,Bax和BCL-2表达均增高。沙棘多糖组和模型组相比,Bax表达量显著降低,BCL-2没有明显变化;沙棘多糖低、中、 高剂量组中BCL-2和Bax的表达量比值依次升高。结果表明沙棘多糖通过促进BCl-2/Bax的比例,增加抗凋亡能力。
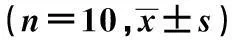
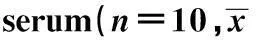
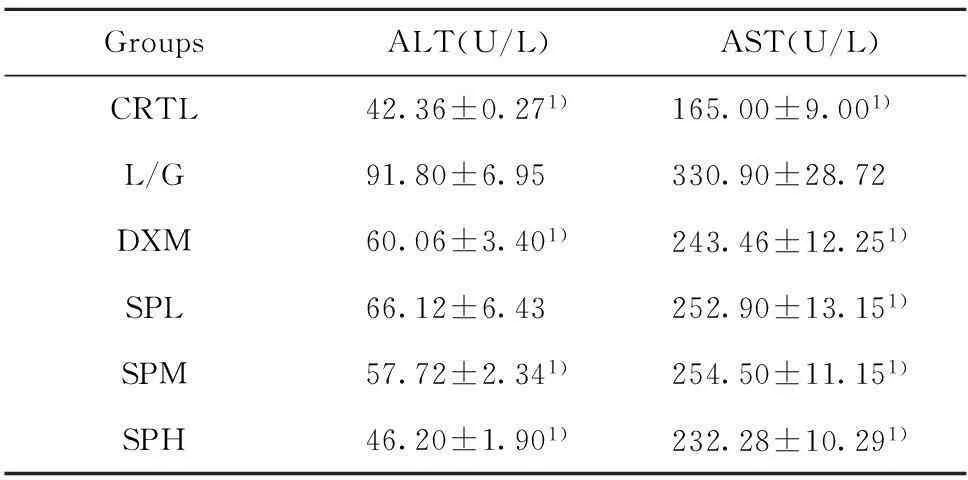
GroupsALT(U/L)AST(U/L)CRTL42.36±0.271)165.00±9.001) L/G91.80±6.95330.90±28.72DXM60.06±3.401)243.46±12.251)SPL66.12±6.43252.90±13.151)SPM57.72±2.341)254.50±11.151)SPH46.20±1.901)232.28±10.291)
Note:Compared with L/G group.1)P<0.01.

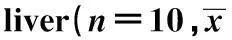
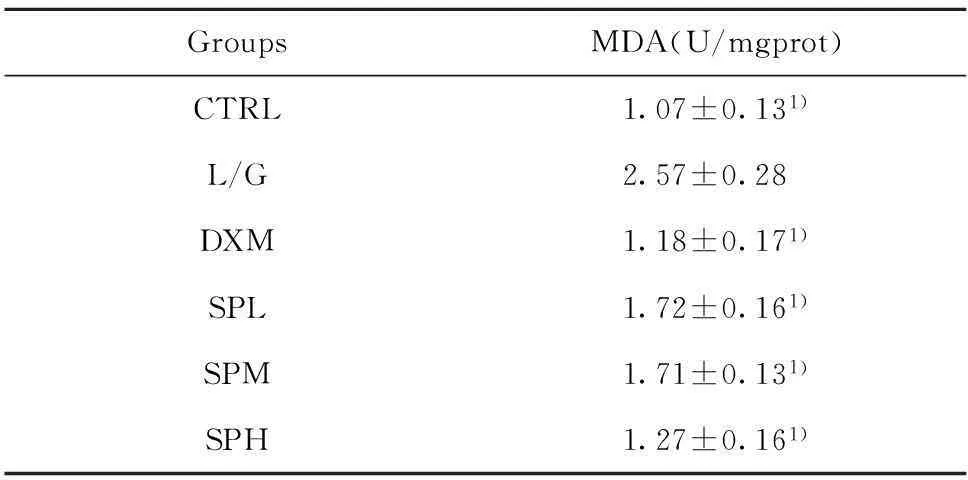
GroupsMDA(U/mgprot)CTRL1.07±0.131)L/G2.57±0.28DXM1.18±0.171)SPL1.72±0.161)SPM1.71±0.131)SPH1.27±0.161)
Note:Compared with L/G group,1)P<0.01.
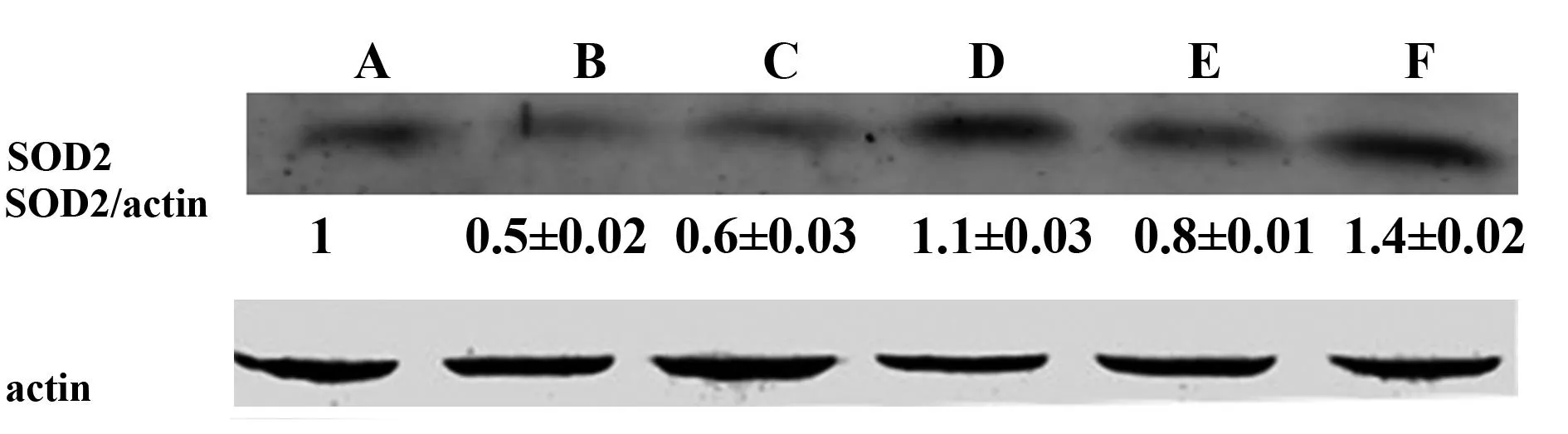
图1 Western blot检测沙棘多糖对肝脏中SOD2的影响Fig.1 Effects of seabuckthorn polysaccharide on express-ion of hepatic SOD2 Note: A.CTRL;B.L/G;C.DXM;D.SPL;E.SPM;F.SPH.
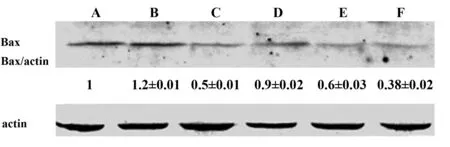
图2 Western blot检测沙棘多糖对肝脏中Bax的影响Fig.2 Effects of seabuckthorn polysaccharide on hepatic expression of BaxNote: A.CTRL;B.L/G;C.DXM;D.SPL;E.SPM;F.SPH.
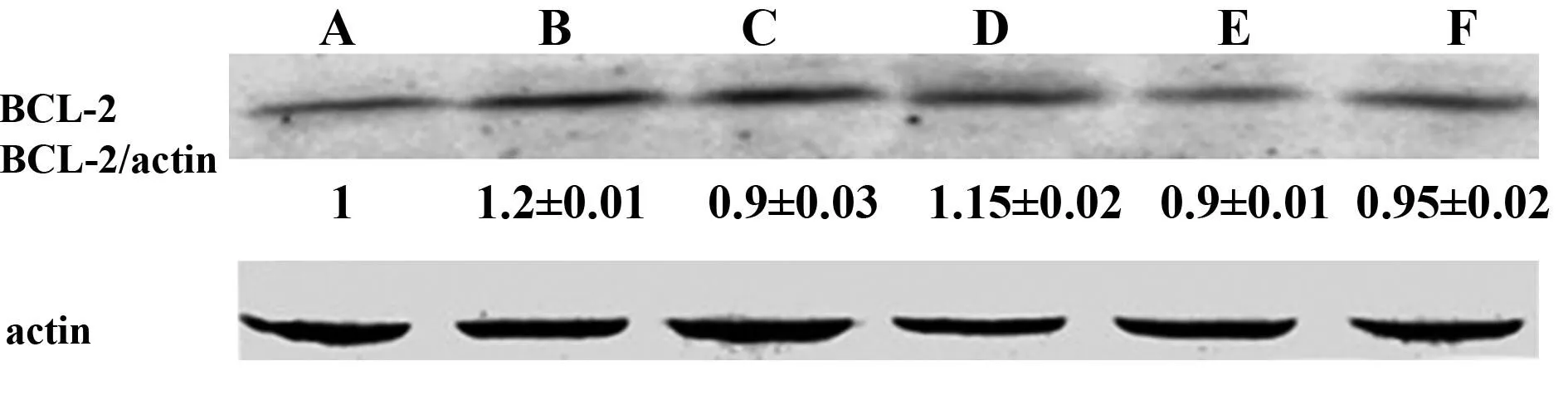
图3 Western blot检测沙棘多糖对肝脏中BCL-2的影响Fig.3 Effects of seabuckthorn polysaccharide on express-ion of hepatic BCL-2Note: A.CTRL;B.L/G;C.DXM;D.SPL;E.SPM;F.SPH.

图4 免疫组化检测沙棘多糖对肝脏中PPAR-γ的影响(×200)Fig.4 Effects of seabuckthorn polysaccharide on express-ion of PPAR-γ in liver by immunohistochemistry(×200)Note: A.CTRL;B.L/G;C.DXM;D.SPL;E.SPM;F.SPH.
2.5沙棘多糖对PPAR-γ表达的影响通过实验结果可以看出(见图4),正常组的小鼠肝脏中PPAR-γ有一定量的本底表达,基本集中在胞浆中。模型组中PPAR-γ的表达则明显升高,在胞浆中出现大量的PPAR-γ,但只有少量进入到细胞核。地塞米松组中PPAR-γ大量进入到细胞核中,胞浆中明显减少。沙棘多糖各剂量组中PPAR-γ的表达量与模型组相比明显降低。
3讨论
本实验通过LPS/D-GalN共同作用诱导急性肝损伤的发生。LPS可以引起体内天然免疫系统的激活,产生大量前炎症因子,这些炎性因子可引起一系列的炎症反应,D-GalN的作用是消耗肝细胞内的磷酸尿嘧啶核苷酸使细胞处于异常状态,成倍放大LPS的效应。地塞米松是一种糖皮质激素,可以抑制多种炎症细胞因子的生成,抑制脂质过氧化的产生,稳定细胞膜和溶酶体膜。当LPS/D-GalN共同作用还会引起强烈的炎症反应,从而引起肝细胞弥漫性变性、坏死、炎症细胞的浸润等。结合ALT和AST的检测结果,充分表明沙棘多糖可以明显抑制LPS/D-GalN诱导小鼠急性肝损伤,进而发挥抗炎的作用。LPS/D-GalN共同诱导能促使聚集在受损肝细胞周围的中性粒细胞产生呼吸暴发和脱颗粒,释放氧自由基和导致脂质过氧化。SOD是体内清除氧自由基的重要的酶,被认为是保护细胞免受过氧化损伤的关键,但大量氧自由基会打破体内的动态平衡,使SOD表达量下降。MDA是脂质过氧化的产物,被认为是重要的过氧化指标。其他研究显示很多植物多糖都可以通过抗氧化的能力来使SOD活性上升和MDA含量下降。通过本研究发现沙棘多糖也可以明显促进SOD的活性和降低MDA的量,这表明沙棘多糖通过抑制LPS/D-GalN诱导的肝细胞过氧化损伤,从而达到抗氧化的作用。为了研究沙棘多糖对急性肝损伤小鼠氧化应激的抑制作用机制,本实验对Bax,BCL-2进行了检测。研究提示,BCL-2蛋白家族在细胞凋亡过程中起重要作用,Bax基因是BCL-2基因家庭的成员之一,Bax基因受到重视是因为它与BCL- 2基因在细胞凋亡的调控中起着中心作用。本实验结果表明沙棘多糖抑制了Bax的表达,但是对BCL-2的影响不大,我们推测沙棘多糖可能通过抑制Bax的表达以及促进别的抗凋亡蛋白的表达来发挥对LPS/D-GalN诱导的急性肝损伤的保护作用。本实验进一步对转录因子PPAR-γ的表达进行了检测。PPAR-γ可以在多个水平调控细胞内多条炎症信号转导途径。实验结果显示PPAR-γ的表达在LPS/D-GalN诱导的急性肝损伤模型组中显著增高,提示可能为一种应激性反应,因为有研究表明PPAR-γ活化后能抑制肝脏氧化应激反应[11]。沙棘多糖作用后,PPAR-γ的表达降低,提示沙棘多糖可能不是通过调控PPAR-γ来发挥抑制肝脏氧化应激反应的。
根据以上论述,沙棘多糖提取物显著降低了LPS/D-GalN诱导的小鼠血清中ALT和AST水平;抑制了MDA的产生;促进了肝脏SOD活性升高。其机制可能与抑制Bax的表达有关,转录因子PPAR-γ可能不参与沙棘多糖的调控作用。
参考文献:
[1]Wang Y,Li Y,Xie J,etal.Protective effects of probiotic Lactobacillus casei Zhang against endotoxin- and d-galactosamine-induced liver injury in rats via anti-oxidative and anti-inflammatory capacities[J].Int Immunopharmacol,2013,15(1):30-37.
[2]Ueda S,Masutani H,Nakamura H,etal.Redox control of cell death[J].Antioxid Redox Signal,2002,4(3):405-414.
[3]焦俊霞,高维娟,李玉明,等.黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元Bcl-2和Bax表达的影响[J].中国病理生理杂志,2011,27(5):905-910.
[4]史婷婷,于肯明,梁月琴,等.芹菜素对缺血再灌注大鼠心肌细胞凋亡相关基因Bcl-2/Bax的影响[J].中西医结合心脑血管病杂志,2011,9(3):329-331.
[5]Luo S,Wang J,Ma Y,etal.PPARγ inhibits ovarian cancer cells proliferation through upregulation of miR-125b[J].Biochem Biophys Res Commun,2015,462(2):85-90.
[6]Song M,Tian X,Lu M,etal.Genistein exerts growth inhibition on human osteosarcoma MG-63 cells via PPARγ pathway[J].Int J Oncol,2015,46(3):1131-1140.
[7]Ren D,Hu Y,Luo Y,etal.Selenium-containing polysaccharides from Ziyang green tea ameliorate high-fructose diet induced insulin resistance and hepatic oxidative stress in mice[J].Food Funct,2015,6(10):3342-3350.
[8]Wang L,Xu N,Zhang J,etal. Antihyperlipidemic and hepatoprotective activities of residue polysaccharide from Cordyceps militaris SU-12 [J]. Carbohydr Polym,2015,131:355-362.
[9]丁小林,秦利平.沙棘中的营养成分与生物活性物质研究进展[J].中国食物与营养,2008,(9):57-59.
[10]魏贵红,王宝林.中国沙棘的开发与利用[J].内蒙古林业,2005,(12):32-33.
[11]Zhang Y,Cui Y,Wang XL,etal.PPARα/γ agonists and antagonists differently affect hepatic lipid metabolism,oxidative stress and inflammatory cytokine production in steatohepatitic rats[J].Cytokine,2015,75(1):127-135.
[收稿2015-07-25修回2015-10-10]
(编辑张晓舟)
Inhibitory effects of seabuckthorn polysaccharide on oxidative stress in mice with actue liver injury and modulatory effect on BCL-2/Bax and PPAR-γ expression
LIUFang,ZHAOShi-Min,ZHANGWei,XIEJi-Ming,ZOUKai,ZHANGXiao-Hui,WANGXue,LIUHuan,CHENJun-Na,WANGYu-Zhen.
CollegeofLifeSciences,InnerMongoliaAgriculturalUniversity,Huhhot010018,China
[Abstract]Objective:To explore the inhibitory effects of seabuckthorn polysaccharide on hepatic oxidative stress in a mice model of acute liver injury induced by intraperitoneal injection of LPS and D-GalN and detect the expression on hepatic BCL-2/Bax and PPAR-γ.Methods: C57BL/6 male mice were randomly divided into six groups:control group(CTRL),model group (L/G),dexamethasone positive control group(DXM),low (SPL),medium (SPM) and high dose group (SPH) of seabuckthorn polysaccharide.Mice in the SPL,SPM and SPH group were gavaged with 50,100 and 200 mg/kg seabuckthorn polysaccharide for 14 days respectively.Acute liver injury model were established by intraperitoneal injection of LPS(10 μg/kg) and D-GalN (700 mg/kg).Serum and liver samples were collected 4 h after model establishment.Serum levels of ALT and AST and the content of MDA were detected.Hepatic expression of SOD2 BCL-2 and Bax was determined by Western blot and the expression of PPAR-γ was detected by immunohistochemistry.Results: ALT and AST levels significantly increased in the model group and decreased dose-dependently after pretreatment with seabuckthorn polysaccharide.The level of MDA in the model group increased significantly as compared with the control group and decreased in seabuckthorn polysaccharide groups,while the level of SOD2 decreased in the model group and recovered in seabuckthorn polysaccharide groups.The expression of Bax decreased after pretreatment with seabuckthorn polysaccharide.There was no obvious effect on BCL-2 expression after sea buckthorn polysaccharide supplementation.The expression of PPAR-γ reduced in the seabuckthorn polysaccharide group as compared with the model group.Conclusion: Seabuckthorn polysaccharide protects against LPS/D-GalN-induced liver injury.The effect is associated with an upregulation of SOD2 and downregulation of Bax.
[Key words]Seabuckthorn polysaccharide;Liver injury ;BCL-2;Bax;PPAR-γ
中图分类号R392.5
文献标志码A
文章编号1000-484X(2016)03-0358-04
通讯作者及指导教师:王玉珍(1976年-),女,教授,主要从事感染与免疫方面的研究。
作者简介:刘芳 (1992年-),女,在读硕士,主要从事分子免疫学的研究。
doi:10.3969/j.issn.1000-484X.2016.03.014
①本文为国家自然科学基金(No.31270922, 81260662,81560677,81360394)和内蒙古自然科学基金(2015MS0884)资助项目。
②内蒙古自治区人民医院检验科,呼和浩特010020。

