结肠癌肿瘤相关巨噬细胞的浸润和MMP-2的表达、血管生成关系的研究
高双英 吴 静 杨贵丽
(武汉科技大学医院检验科,武汉430081)
结肠癌肿瘤相关巨噬细胞的浸润和MMP-2的表达、血管生成关系的研究
高双英吴静①杨贵丽②
(武汉科技大学医院检验科,武汉430081)
[摘要]目的:通过对不同分化程度的结肠腺癌中巨噬细胞和血管的分布和计数,利用免疫学方法检测肿瘤中MMP-2的表达,揭示结肠癌中巨噬细胞、MMP-2的表达和血管生成的关系。方法:用免疫组化染色的方法对79例结肠癌患者的肿瘤相关巨噬细胞的浸润情况、微血管的数目进行计数和分析并检测巨噬细胞中MMP-2的表达,根据结果对巨噬细胞数目、血管数目、临床病理参数、MMP-2的表达之间关系进行统计学分析。结果:结肠癌中巨噬细胞被鼠抗人CD68单克隆抗体标记为棕黄色。巨噬细胞的数目明显高于正常组(F=412.04,P<0.05);巨噬细胞的数目差异在结肠癌的分化程度和Duck’s分期中均具有统计学意义(t=10.80和F=412.04,P<0.05);微血管的密度(MVD)的差异在结肠癌的Duck’s分期有统计学的意义(t=7.35,P<0.05),有淋巴结转移的结肠癌患者中MVD高于无淋巴结转移者(t=6.77,P<0.05);MMP-2在结肠癌中的表达为强阳性;有淋巴结转移者中MMP-2的表达显著高于无淋巴结转移者(t=10.91,P<0.05);MMP-2的表达和肿瘤相关巨噬细胞(TAMs)的数目和MVD均存在正相关的关系(r值分别为0.451、0.672,P<0.05)。结论:MMP-2和TAMs与结肠癌的发生发展具有密切的关系。结肠癌中,TAMs可通过上调MMP-2的表达,促进肿瘤微血管的形成,从而促进肿瘤的生长和转移。
[关键词]肿瘤相关巨噬细胞;结肠癌;血管生成;MMP-2
肿瘤的生长和转移离不开肿瘤血管的营养作用,肿瘤血管的形成是一切恶性肿瘤生物学行为的基础。近年来有研究表明肿瘤相关巨噬细胞与肿瘤中微血管的形成具有密切的联系[1]。肿瘤相关巨噬细胞通过释放一些炎症因子、细胞因子、肿瘤因子、酶等促进肿瘤的生长和转移[2]。但结肠癌中肿瘤相关巨噬细胞(TAMs)和MMP-2在促进肿瘤血管生成中的作用及关系,目前国内外少有报道。本文采用免疫组化、流式细胞术的方法,分析巨噬细胞、肿瘤微血管在结肠癌中的数量和分布及MMP-2在结肠癌中的表达,初步探讨一下结肠癌中巨噬细胞和肿瘤血管形成的初步关系和可能的机制。
1材料与方法
1.1材料
1.1.1一般资料选择2013年3月至2015年5月间经我院外科手术切除的79例结肠癌标本,经病理标本查实均为腺癌,且术前均未进行针对肿瘤有关的治疗,入选患者均签署了知情同意书。79例结肠癌患者中有51名男性(64.56%),28名女性(35.44%),年龄36~67岁,平均年龄为(51.25±4.47)岁。经病理查实,分化程度:高分化23例,中分化37例,低分化19例。Duck’s 分期:A、B期43例,C、D期36例。有淋巴结转移者34例,另外取10例正常结肠组织作为对照。
1.1.2试剂鼠抗人CD68单克隆抗体(克隆系KPI,工作浓度为1∶100)(购于杭州言科生物技术有限公司),兔抗人CD34多克隆抗体(工作浓度为1∶50),兔抗人MMP-2多克隆抗体(工作浓度1∶40)(以上两者均购于上海沪峰化工有限公司)。
1.2方法
1.2.1免疫组化将以上标本均进行常规脱水,福尔马林固定,石蜡包埋,连续切片切4 μm厚切片。正常组织和结肠腺癌组均进行免疫组化染色,采用常规的免疫组化SP的方法。严格按照试剂盒上的步骤和说明进行操作,严格控制染色的时间和温度,每次染色都采用PBS代替一抗作为阴性对照。用鼠抗人CD68单克隆抗体(克隆系KPI)来标记肿瘤中的巨噬细胞(工作浓度为1∶100)。兔抗人CD34多克隆抗体标记血管内皮细胞(工作浓度为1∶50),兔抗人MMP-2多克隆抗体标记MMP-2(工作浓度1∶40)。
1.2.2结果判定①血管的分布和计数:微血管密度的测定采用Weidner的方法[3],用CD34标记血管内皮细胞在光镜下进行观察。先在40倍或者100倍镜下找到肿瘤中具有高密度的被染色标记的毛细血管和小血管分布的区域(即热点区),然后在200倍镜下(20倍物镜和10倍目镜,0.739 mm2每视野)进行微血管的计数。任何和邻近的微血管、肿瘤细胞和其他结缔组织细胞成分分开的棕染的血管内皮细胞或者血管内皮细胞簇,被判定为一个单独的、可计数的微血管[4];②巨噬细胞的分布和计数:用CD68标记巨噬细胞,胞膜被染为棕黄色的为CD68阳性的巨噬细胞,在光镜下观察其一般形态及分布后,参考Leek和Lewis的方法对巨噬细胞的数量进行计数[5]。即在100倍镜(10×10)下找到视野中巨噬细胞在肿瘤中密度最高的三个区域,即热点区域,然后在400倍镜下(10×40)下对巨噬细胞进行计数,取平均值进行统计学分析;③MMP-2表达的判断标准:以细胞质内出现棕黄色颗粒为表达阳性。在400镜下选择三个肿瘤视野下按照阳性细胞百分比计分:阳性细胞数<30%为阴性表达,>30%为阳性表达。

2结果
2.1免疫染色的结果正常结肠黏膜组织中,MMP-2的表达较少,仅基底层有少量染色,巨噬细胞的表达少,微血管的数目较少且分布较为均匀。在结肠癌组织的免疫组化染色中,MMP-2表达阳性,呈棕黄色颗粒,主要在癌组织的胞质和胞膜表达,分布多集中在肿瘤边缘(图1A)。以巨噬细胞特异性抗体CD68标记的巨噬细胞表达阳性呈棕黄色颗粒,主要位于巨噬细胞的胞膜和胞浆上,多分布于肿瘤的间质和坏死区,细胞体积较大,形态多样而不规则(图1B)。CD34定位于血管内皮细胞上,可见癌组织中血管内皮被染成棕黄色,血管数目明显增多,分布明显不均,多位于癌组织的边缘部,血管呈条索状(图 1C)。

图1 免疫染色的结果(SP,×100)Fig.1 Results of immune staining(SP,×100)Note: A.Positive expression of MMP-2,MMP-2 is primarily expressed in cytoplasm and cell membrane,distributed primarily at the periphery of the tumor;B.Macrophages in colon carcinoma,macrophages were stained to brown yellow,the cells has large column,irregular form and are mainly distributed in the mesenchyme of the tumor and necrotic area;C.Blood capillaries labeled by CD34 in colon carcinoma.
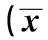


ClinicopathologicalparametersCountingofmacrophagest/FPvalueGenderMale(n=51)47.74±4.861.240.217Female(n=28)46.38±4.23Age≥50(n=42)48.31±3.640.490.629<50(n=37)47.89±4.05DegreesofdifferentiationHigh(n=23)39.43±5.7610.800.000Medium(n=37)45.14±6.02Low(n=19)47.21±5.34Duck’sstagingA,Bstage(n=43)46.74±3.87412.040.000C,Dstage(n=36)47.33±4.75Normalgroup(n=10)7.34±2.10
表2结肠癌中MMP-2的表达和临床病理学参数之间的关系[n,%]
Tab.2Relationship of expression of MMP-2 in colon carcinoma and clinicopathological parameters[n,%]

ClinicopathologicalparametersnExpressionofMMP-2PositivenumbersPositiverate%χ2PGenderMale513568.630.010.944Female281967.86Age≥50422969.050.020.888<50372567.57Duck’sstagingA,Bstage432353.499.640.002C,Dstage363186.11MetastasisoflymphnodesYes343088.2410.910.001No452453.33
2.2巨噬细胞的计数与临床病理学参数之间的关系巨噬细胞的数量在结肠癌中的表达明显地高于正常组(P<0.05)。在肿瘤的分化和Duck’s分期中,巨噬细胞数目的差异具有统计学意义(P<0.05)。而巨噬细胞的数目在年龄、性别方面经统计学分析后无显著性关系(P>0.05)。见表1。
2.3MMP-2的表达与临床病理学参数之间的关系MMP-2的表达在结肠癌中的表达明显地高于正常组(P<0.05)。在肿瘤的分期中,MMP-2的表达差异具有统计学意义(P<0.05)。有淋巴结转移的结肠癌患者MMP-2的表达显著高于无淋巴结转移组(P<0.05),而MMP-2的表达在年龄、性别方面经统计学分析后无显著性关系(P>0.05)。见表2。
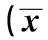


ItemnMVDtvaluePGroupsAddnocarcinomaofColon7926.47±3.1213.230.000Normalgroups1012.73±2.86MetastasisoflymphnodesYes3428.43±2.546.770.000No4524.31±2.78Duck’sstagingA,Bstage4323.76±1.997.350.000C,Dstage3627.53±2.57
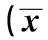


ItemExpressionofMMP-2Positive(n=54)Negative(n=25)tPCountingofmacrophages45.23±1.7938.44±1.9415.270.000MVD28.36±2.5323.04±2.179.070.000
2.4结肠腺癌中不同组织中微血管密度的分布不同组织中微血管密度差异具有统计学意义。结肠腺癌中微血管密度显著高于正常组(P<0.05);在有淋巴结转移的结肠癌中,微血管数目表达的差异具有统计学意义(P<0.05);在结肠癌的不同分期中,微血管数目的差异具有统计学意义(P<0.05)。见表3。
2.5结肠腺癌中MMP-2的表达和巨噬细胞计数和微血管密度之间的关系在结肠癌MMP-2表达阳性组中,巨噬细胞的数目以及MVD明显高于正常组,具有统计学意义(P<0.05)。MMP-2的表达与MVD、巨噬细胞的数目存在正相关的关系(r=0.672、0.451,P<0.05)。见表4。
3讨论
本研究在检测结肠癌组织中巨噬细胞的计数和分布时发现,癌组织中有大量的TAMs浸润,细胞大而形态不规则,多分布于肿瘤的间质和坏死的区域。同时,巨噬细胞的浸润程度和微血管的密度在肿瘤的不同分化程度、Duck’s分期以及有无淋巴结转移中的比较中其差异都具有统计学的意义(P<0.05)。这和白明华等[6]在结肠癌中的研究结果相一致。巨噬细胞来源于血液中的单核细胞。TAMs在肿瘤的发生发展中具有双重的作用[7]:一是巨噬细胞作为免疫细胞能够发挥杀伤肿瘤细胞的作用;二是巨噬细胞有促进肿瘤生长的作用。有研究表明,被肿瘤细胞激活的巨噬细胞,能够释放广泛的生长因子、蛋白水解酶、细胞因子和炎症介质,其中许多的因子都是肿瘤转移的关键因子[8]。Zeisberger[9]用氯膦酸盐脂质体特异性地清除巨噬细胞后,可明显抑制各种肿瘤细胞的生长和血管的生成。另外,也有研究表明TAMs能够诱导免疫抑制、肿瘤耐药性的形成来促进肿瘤的发生发展[10]。研究发现通过阳离子多聚体对TAMs上Toll样受体4(TLR-4)的激活作用可以转变TAMs免疫耐受的表现型[11]。这说明TAMs在介导肿瘤的免疫耐受上有着重要的作用。巨噬细胞中的M2型能够促进肿瘤的发展,有研究认为巨噬细胞可以通过促进IL-10的分泌,促进Treg/Th17的增加,从而促进肿瘤的生长和侵袭[12]。
在研究结果中,发现MMP-2在结肠癌组织中呈高度阳性表达,MMP-2主要分布在癌细胞的胞质和胞膜中,根据统计学分析,结肠癌中MMP-2的表达在不同肿瘤的分化程度、Duck’s分期以及有无淋巴结转移中的差异具有统计学意义(P<0.05),说明MMP-2的过表达可能和肿瘤细胞的生长和转移有关。此外,研究中也发现在结肠癌组织中TAMs的浸润程度和MMP-2的表达具有较高的一致性。同时,在对MMP-2与微血管密度进行分析时发现在微血管较少的组织中MMP-2的表达明显低于微血管数目较多的组织,且具有统计学的意义,说明MMP-2的过表达可能与肿瘤中血管的生成有密切的联系。研究证明肿瘤相关巨噬细胞能够生成大量的血管生成调节酶,如MMP-2、MMP-9、MMP-7和环氧和酶-2(COX-2)等[13]。肿瘤的侵袭和转移需要建立在少数富含胶原蛋白的组织屏障的降解基础上,其中,基膜是恶性肿瘤转移的最大的、连续的物理性屏障[14]。研究发现MMP-2能够降解基膜中的主要成分——胶原蛋白Ⅳ,从而降解基膜[14]。基膜的破坏,有利于构成血管所必需的内皮细胞的迁移,这是血管生成中最基本的过程[15]。此外,研究证明,MMP-2与多种恶性肿瘤形成有关,包括肝癌、胃癌、膀胱癌、肾细胞癌等等[16]。MMP-2被认为是血管生成中关键的因素之一。研究证明MMP-2可以刺激新生血管的形成,促使肿瘤细胞之间及肿瘤细胞与宿主细胞之间的黏附,激活其他MMPs,形成“瀑布效应”[17]。TIMPs是一组抑制MMPs活性的多功能因子,TIMPs可以激活E-Cadherin的表达,抑制肿瘤的发生[18]。通过检验结肠癌中的MMPs和TIMPs的表达,可以对结肠癌的风险进行评级并确定治疗方案,从而达到防止结肠癌进一步转移的目的[19]。
在研究中发现微血管的密度和肿瘤中巨噬细胞的浸润程度呈明显的正相关关系,TAMs浸润程度高的肿瘤中MVD也相对较高[20],说明巨噬细胞的浸润可能有促进肿瘤中血管形成的作用。TAMs能够释放许多细胞因子如VEGF、IL-8、IL-10、MMP、TNF-α等等促进肿瘤的生长和转移。有研究证明,TAMs分泌的TNF-α可促进IL-8、VEGF等血管生成因子的释放[21]。而IL-8的过表达可以上调MMP-2的活性,促进细胞基质和基膜的降解,从而促进肿瘤的血管形成和转移的过程[22]。
通过本次研究,我们发现在结肠癌中巨噬细胞的浸润程度、微血管的密度和MMP-2的表达具有一定的一致性,三者之间具有密切的联系。TAMs可能通过促进MMP-2在结肠癌中的过表达来促进肿瘤中的血管生成,进而促进肿瘤的生长转移。但三者之间的关系及具体的作用机制还需要进一步探讨。
参考文献:
[1]Wu Hui,Xu Jian-Bo.Tumor-associated macrophages promote angiogenesis and lymphangiogenesis of gastric cancer[J].J Surg Oncol,2012,106(4):462-468.
[2]徐建.肿瘤相关巨噬细胞促进肿瘤血管生成和转移的研究进展[J].复旦学报(医学版),2011,38(1):71-74.
[3]Weidner N.Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors[J].Breast Cancer Res Treat,1995,36(2):169-180.
[4]Noel Weidner.Tumor angiogenesis correlates with metastasis in invasive prostate carcinoma[J].Ame J Pathol,1993,143(2):401-409.
[5] Leek RD,Lewis CE,Whitehouse R. Association of macrophage infiltration with angiogenesis and prognosis in invasive breast carcinoma[J].Cancer Res,1996,56(20):4625-4629.
[6] 白明华,司君利,亓玉琴,等.肿瘤相关巨噬细胞在结肠肿瘤中的浸润及意义[J].中国现代普通外科进展,2014,17(1):24-27.
[7]Mantovani Alberto,Sozzani Silvano,Locati Massimo,etal.Infiltration of tumours by macrophages and dendritic cells: tumour-associated macrop ages as a paradigm for polarized M2 mononuclear phagocytes.[J].Novartis Foundation Symposium,2004,256:137-145.
[8]Jin-Yuan Shih,Ang Yuan,Chen JJW,etal.Tumor-associated macrophage:its role in cancer invasion and metastasis[J].J Cancer Molecules,2006,2(3):101-106.
[9]Zeisberger S M,Odermatt B,Marty C,etal.Clodronate-liposome-mediated depletion of tumour-associated macrophages:a new and highly effective antiangiogenic therapy approach[J].BJC,2006,95(3):272-281.
[10]何林燕,高锋.肿瘤相关巨噬细胞及其在肿瘤中的作用[J].现代免疫学,2014,34(1):85-88.
[11]Huang Zhen,Yang Yang,Jiang Y,etal.Anti-tumor immune responses of tumor-associated macrophages via toll-like receptor 4 triggered by cationic polymers[J].Biomaterials,2012,34(3):746-755.
[12]吴小丽,张婷,王昕婧,等.肿瘤相关巨噬细胞通过分泌IL-10影响上皮性卵巢癌肿瘤微环境中T细胞亚群Treg/Th17失衡[J].中国免疫学,2014,30(12):1585-1590.
[13]Klimp AH,Hollema H,Kempinga C,etal.Expression of cyclooxygenase-2 and inducible nitric oxide synthase in human ovarian tumors and tumor-associated macrophages[J].Cancer Res,2001,61(19):7305-7309.
[14]Platt D,Amara S,Mehta T,etal.Violacein inhibits matrix metalloproteinase mediated CXCR4 expression: potential anti-tumor effect in cancer invasion and metastasis[J].Biochem Biophys Res Commun,2014,455(1-2):107-112.
[15]Rothenberg ML,Nelson AR,Hande KR.New drugs on the horizon:matrix metalloproteinase inhibitors[J].Oncologist,1999,3(4):271-274.
[16]Yujuan Shan,Lanwei Zhang,Yongping Bao,etal.Epithelial-mesenchymal transition,a novel target of sulforaphane via COX-2/MMP2,9/Snail,ZEB1 and miR-200c/ZEB1 pathways in human bladder cancer cells[J].J Nutritional Biochem,2013,24(6):1062-1069.
[17]Stanley Zucker, Jeffrey Vacirca.Role of matrix metalloproteinases(MMPs) in colorectal cancer[J].Cancer Metastasis Reviews,2004,23(1):101-117.
[18]Bourboulia Dimitra, Han Huiying,Sandra Jensen-Taubman,etal.TIMP-2 modulates cancer cell transcriptional profile and enhances E-cadherin/beta-catenin complex expression in A549 lung cancer cells[J].Onco Target,2013,4(1):163-173.
[19]张瑜红,谭至柔,黄雪,等.基质金属蛋白酶-2及组织抑制因子在结肠腺瘤癌变过程中的表达及意义[J].微创医学,2015,11(3):290-292.
[20]Panico L,Ronconi F,Lepore M,etal.Prognostic role of tumor-associated macrophages and angiogenesis in classical Hodgkin lymphoma[J].Leukemia & Lymphoma,2013,54(11): 2418-2425.
[21]Dirkx AE,Oude Egbrink MG,Wagstaff J.Monocyte/macrophage infiltration in tumors: modulators of angiogenesis[J].J Leukocyte Biol,2006,80(06):1183-1196.
[22]Luca M,Huang S,Gershenwald JE,etal.Expression of interleukin-8 by human melanoma cells up-regulates MMP-2 activity and increases tumor growth and metastasis[J].Ame J Pathol,1997,151(4):1105-1113.
[收稿2015-08-25修回2015-09-11]
(编辑倪鹏)
A study on correlation of tumor-associated macrophages infiltration,MMP-2 expression and angiogenesis in colon carcinoma
GAOShuang-Ying,WUJing,YANGGui-Li.
DepartmentofLaboratoryMedicine,HospitalofWuhanScienceandTechnologyUniversity,Wuhan430081,China
[Abstract]Objective:To study the correlation of tumor-associated macrophages infiltration,MMP-2 expression and angiogenesis in colon carcinoma by testing the MMP-2 through immunological methods,and counting of macrophages and distributing of vessels in colonic adenocarcinoma at different differential degrees.Methods: Analyze the infiltration of tumor-associated macrophages(TAMs),and count blood capillaries in 79 patients with colon carcinoma by immunohistochemical staining,detect the expression of MMP-2 in macrophages by immunological methods.Analyze the relationship among numbers of macrophages and vessels,clinical pathology and expression of MMP-2.Results: Macrophages in colon carcinoma were labeled to brown yellow by murine monoclonal antibody to human. The number of macrophages was markedly higher than normal group(F=412.04,P<0.05); Variance of macrophages number had statistical significance in differentiatial degrees and Duck′s staging of colon carcinoma(t=10.80 and F=412.04,P<0.05); variance of microvessel density(MVD) had statistical significance in Duck′s staging of colon carcinoma(t=7.35,P<0.05),MVD in colon carcinoma patients with lymphatic metastasis was higher than patients without lymphatic metastasis(t=6.77,P<0.05). Expression of MMP-2 in colon carcinoma showed strong positive. Expression of MMP-2 in patients with lymphatic metastasis was higher than patients without lymphatic metastasis(t=10.91,P<0.05). There was a positive relationship among MMP-2 expression,number of tumor-associated macrophages(TAMs) and MVD(r=0.451,0.672,P<0.05,respectively).Conclusion: MMP-2 and TAMs correlated closely with the development of colon carcinoma. TAMs in colon carcinoma can promote the angiogenesis,growth and metastasis of the tumor by up-regulating the expression of MMP-2.
[Key words]Tumor-associated macrophages(TAMs); Colon carcinoma; Angiogenesis; MMP-2
中图分类号R735.34
文献标志码A
文章编号1000-484X(2016)03-0336-05
通讯作者及指导教师:吴静(1970-),女,主管技师,主要从事临床检验方面的研究。
作者简介:高双英(1971-),女,主管技师,主要从事临床检验方面的研究,E-mail:gaoshuangying8@163.com。
doi:10.3969/j.issn.1000-484X.2016.03.009
①华润武钢总医院检验科,武汉430080。
②武汉科技大学医院内科,武汉430081。

