腹腔镜与开腹远端胃切除术后手术部位感染的Meta分析
薛小军,聂凯,陈锦荣,周松,张文华,陈达丰
[中国人民解放军第175医院(厦门大学附属东南医院)普通外科,福建漳州363000]
腹腔镜与开腹远端胃切除术后手术部位感染的Meta分析
薛小军,聂凯,陈锦荣,周松,张文华,陈达丰
[中国人民解放军第175医院(厦门大学附属东南医院)普通外科,福建漳州363000]
摘要:目的比较腹腔镜与开腹远端胃切除术(LDG)对胃癌患者术后手术部位感染(SSI)的差异。方法制定严格的纳入标准与排除标准,收集LDG和开腹远端胃切除术(ODG)治疗胃癌的随机对照试验,按照Cochrane协助网推荐的方法对纳入研究进行系统分析。结果6篇随机对照试验(767例患者)纳入分析,LDG 组394例,ODG组373例。LDG组患者术后切口感染发生率[RR=0.32,95%CI(0.11,0.91),P=0.030]、总的手术部位感染发生率[RR=0.28,95%CI(0.12,0.70),P=0.006]较ODG组低,差异有统计学意义,但腹腔脓肿发生率[RR=0.35,95%CI(0.09,1.31),P=0.120]差异无统计学意义。结论Meta分析显示,LDG患者术后SSI发生率明显低于ODG患者。
关键词:腹腔镜;远端胃切除术;胃癌;感染;Meta分析
腹腔镜手术在腹部外科中已得到广泛的应用,但腹腔镜远端胃切除术(laparoscopic distal gastrectomy,LDG)在日本的第4版指南中仍只推荐应用于Ⅰc期或更早期患者[1],其他分期胃癌的腹腔镜手术仍在研究中。一些Meta分析将LDG与传统的开腹远端胃切除术(open distal gastrectomy,ODG)相比较,结果显示LDG术后患者疼痛轻、手术出血量少、总的并发症发生率低[2-4],但是有些分析并没有将淋巴结清扫范围或消化道重建方式进行比较,而这两个因素也是影响术后并发症重要因素。本文在确认患者年龄、性别、一般状况、肿瘤分期、淋巴结清扫范围和消化道重建方式等具有可比性的基础上,分析了6个随机对照试验(randomized controlled trials,RCT),并只对术后手术部位感染(surgical site infection,SSI)的发生率进行分析。
1 资料与方法
1.1纳入标准与排除标准
纳入标准:①比较LDG与ODG治疗胃癌的RCT研究;②文献的主要指标包括本文的研究指标;③文献对患者性别、年龄、一般状况、肿瘤分期、淋巴结清扫范围、消化道重建方式进行了比较,并具有可比性。根据2011年美国疾病预防控制中心(centers for disease control and prevention,CDC)指南,手术部位感染的定义包括切口感染及腹腔脓肿。
排除标准:①研究对象合并其他疾病;②研究对象局限于某一特定人群;③数据重复。
1.2检索策略
采用计算机检索1994年-2014年的中国生物医学文献检索分析系统光盘数据库(CBM)、中国期刊全文数据库(CNKI)、重庆维普数据库(VIP)、万方数据库、PubMed、EMbase、西文生物医学期刊(1994~2013)。检索语种不限。中文检索词有LDG、腹腔镜、ODG、远端胃切除术、胃癌;英文检索词有LDG、laparoscopic、ODG、gastrectomy和gastric cancer。结合手工检索,依照预先制定的纳入及排除标准,尽量获取目的文献的全文。1.3资料筛选和数据提取
由两名评价员按照预先制定好的纳入和排除标准,独立进行文献的筛选及数据提取,最后进行交叉核对,若有分歧可通过多人讨论及专家意见决定资料的取舍。
1.4质量评价
按照Cochrane系统评价员手册5.0版推荐的“偏倚风险评估”工具,对纳入研究的文献质量进行以下评价。其质量评价工具主要包括6个项目:①随机序列的产生;②分配隐藏;③盲法;④资料的完整性;⑤选择性报道结果;⑥其他影响真实性的偏倚。对于每篇纳入的RCT按以上6个项目,如果“满足”意味着低度偏倚;“不满足”意味着高度偏倚;若研究中无充分细节报道或未提及或风险未知。
1.5统计学方法
文献提取的一般性资料采用SPSS 17.0软件进行统计学处理。采用Cochrane协作网RevMan5.3软件进行Meta分析,对分类变量采用风险比(relative risk,RR)为分析统计量。采用I2为评价异质性的指标,若P>0.1,I2≤50%,则认为多个研究(亚组)之间异质性无统计学意义,采用固定效应模型合并数据进行分析;若P<0.1,I2>50%,分析异质性的来源(亚组分析),并采用随机效应模型合并数据进行分析。
2 结果
2.1纳入研究的一般资料
共检索到文献1 821篇,其中中文文献427篇,英文文献1 394篇,通过阅读文献题名排除1 628篇文献,通过阅读文献摘要排除139篇文献,对剩余的54篇文献进行全文分析,根据排除标准最终获得RCT文献6篇[5-10]。文献筛选流程图见图1。
纳入研究的一般情况见附表。该Meta分析共纳入767例患者,LDG组394例,ODG组373例。LDG组男/女比为242/152,ODG组男/女比为237/136;淋巴结清扫范围LDG组D1+/D2为98/296,ODG组D1+/D2为87/286;肿瘤的分期LDG组Ⅰ/Ⅱ/Ⅲ/Ⅳ期为311/31/48/4,ODG组Ⅰ/Ⅱ/Ⅲ/Ⅳ期为296/27/45/5。
2.2纳入研究的质量评价
按照Cochrane系统评价员手册5.0版推荐的“偏倚风险评估”工具,对纳入的6篇RCT研究的质量进行以下评价,并利用Meta分析软件作出各纳入研究偏倚风险评估总结。见图2。
2.3手术部位感染发生率的比较
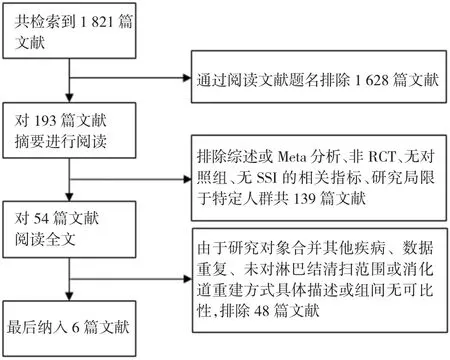
图1文献筛选流程图
2.3.1切口感染6篇文献[5-10]均研究报道了术后切口感染的发生率,各研究间无明显异质性(I2=0%,P=0.860),采用固定效应模型分析。Meta分析结果显示,LDG组和ODG组的术后切口感染的发生率差异有统计学意义[RR=0.32,95%CI(0.11,0.91),P= 0.030]。见图3。
2.3.2腹腔脓肿4篇文献[6-8,10]均研究中报道了术后腹腔脓肿的发生率,各研究间无明显异质性(I2= 0%,P=1.000),采用固定效应模型分析。Meta分析结果显示,LDG组和ODG组的术后腹腔脓肿的发生率差异无统计学意义[RR=0.35,95%CI(0.09,1.31),P=0.120]。见图4。
2.3.3总的手术部位感染6篇文献[5-10]均研究中报道了术后SSI的发生率,各研究间无明显异质性(I2= 0%,P=0.860),采用固定效应模型分析。Meta分析结果显示,LDG组和ODG组的总的SSI发生率差异有统计学意义[RR=0.28,95%CI(0.12,0.70),P = 0.006]。见图5。
2.3.4发表性偏倚分析应用Stata 11软件,采用Begg法检测纳入研究各效应指标的发表性偏倚,本研究纳入发表偏倚评估的指标,Pr>|z|均大于0.05,代表不存在明显的偏倚。
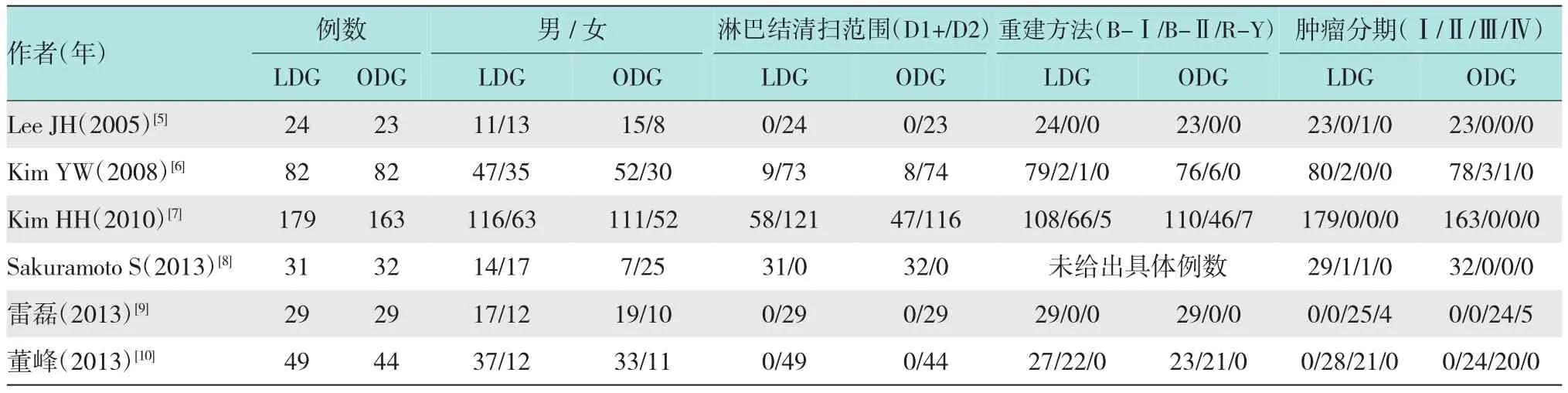
附表 纳入研究的一般资料 例
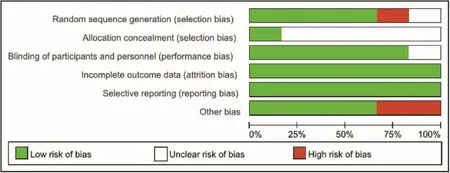
图2纳入研究的偏倚风险评估Meta总结图
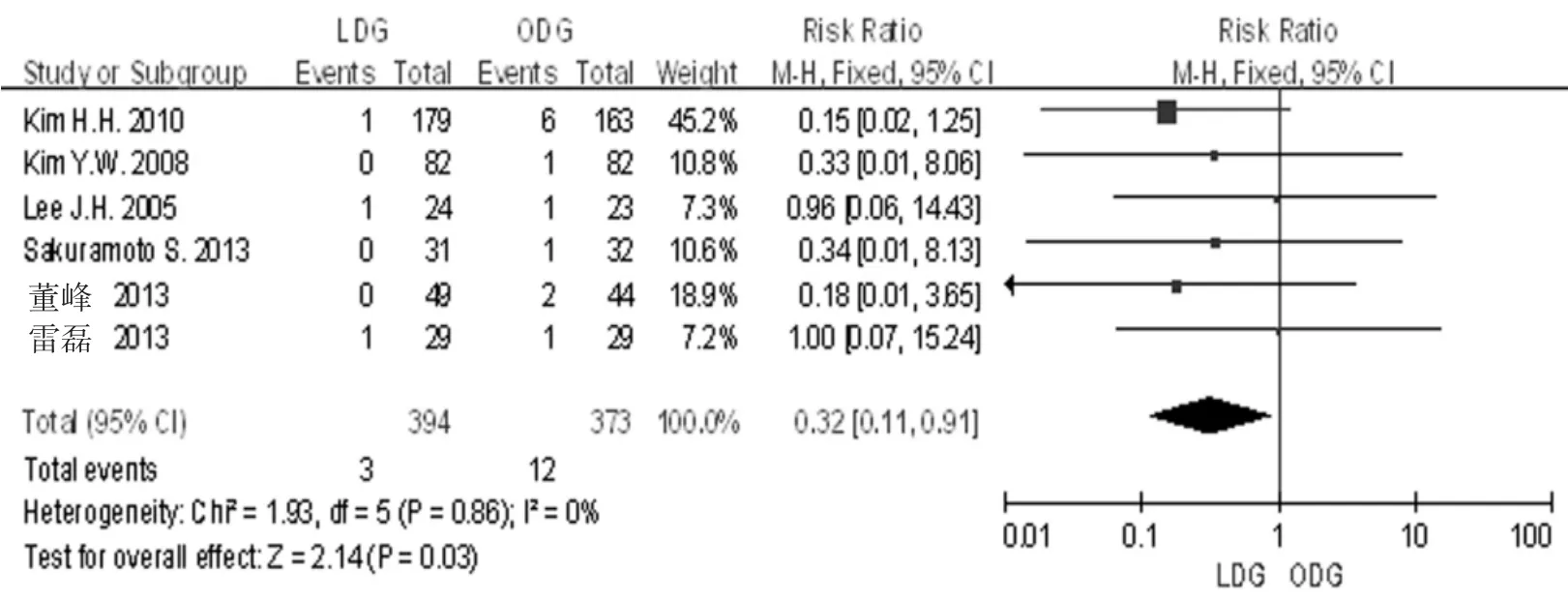
图3 LDG组和ODG组的术后切口感染的发生率比较
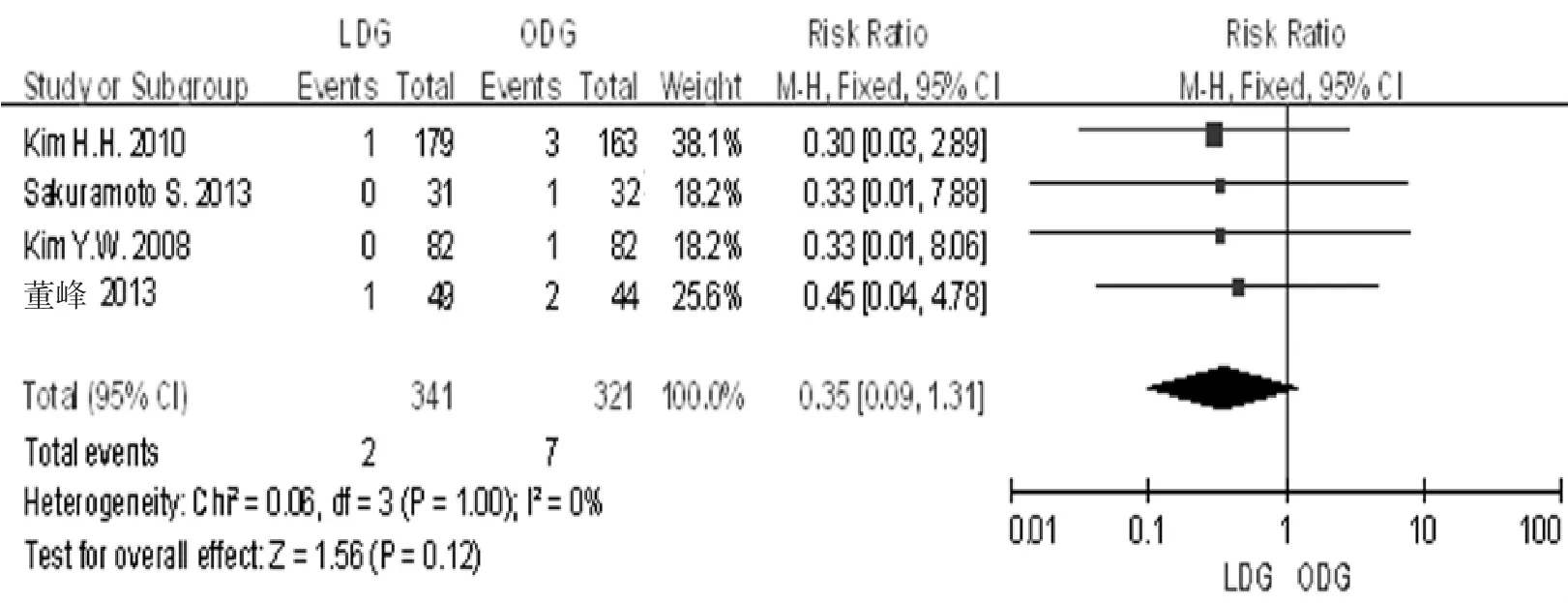
图4 LDG组和ODG组的术后腹腔脓肿的发生率比较
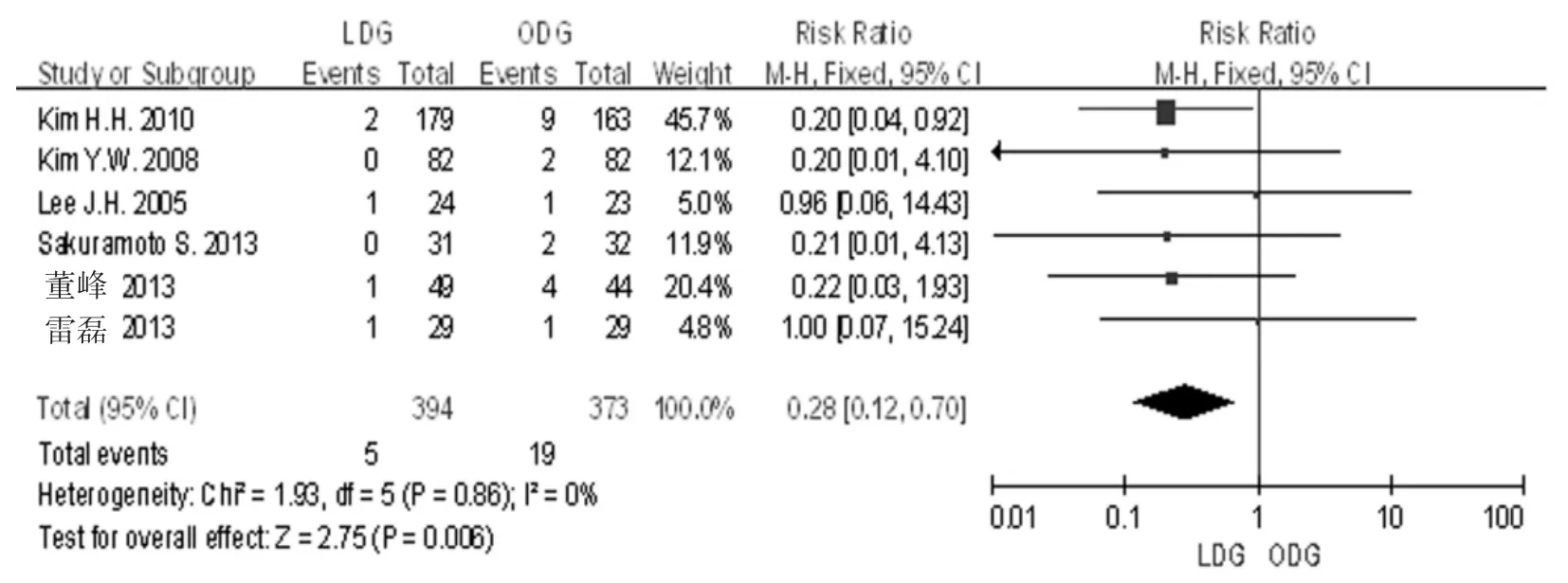
图5 LDG组和ODG组的术后手术部位感染的发生率比较
3 讨论
随着微创外科的发展,胃癌根治术逐渐从传统的开放手术向腹腔镜微创手术发展,且取得了满意的效果。国内有些学者已开始实施进展期胃癌的腹腔镜根治手术[11-12],研究证实,腹腔镜手术的近期效果优于开放手术。
影响腹腔镜远端胃切除术后感染的危险因素包括高龄、消瘦、糖尿病史和术后长时间卧床[13]。CDC指南指出影响SSI的危险因素包括患者自身的因素及手术方面的因素。患者自身的因素包括年龄、肥胖、营养状况、糖尿病、吸烟及术前住院时间。手术方面的因素包括手术时间及手术操作技术,如止血不彻底、缝合时遗留死腔、能量器械引起的组织损伤。已有大量研究证实LDG较ODG术中出血量较少、但手术时间较长。一项包括23 939例行结直肠手术的患者的大型研究证实,即使腹腔镜手术的手术时间较长,但SSI发生率仍然较开放手术低[14]。
在纳入的文献中未提及缝合切口的具体方法。日本的一项多中心的Ⅲ期随机对照试验将上消化道手术中采用皮内缝合切口与闭合钉钉合切口对术后切口感染的发生率进行比较后认为两者无明显差别[15]。有学者研究指出,采取严格的无菌操作、保护组织、皮肤和皮下脂肪层一层缝合的切口缝合方式可明显减少腹部手术切口感染并发症[16],而腹腔镜手术切口感染的发生率明显低于开腹手术[17]。术后腹腔内脓肿发生的原因主要是由于并发了胰腺炎或胰漏、吻合口漏和十二指肠残端漏,而这些并发症在腹腔镜与开腹手术中无明显差别,术后腹腔脓肿的发生率差异也无统计学意义。
综上所述,目前的研究认为,腹腔镜胃肠道手术能明显降低SSI发生的风险。
参考文献:
[1]胡祥. 2014年第4版日本《胃癌治疗指南》更新要旨[J].中国实用外科杂志, 2015, 35(1): 16-19.
[2] Ohtani H, Tamamori Y, Noguchi K, et al. A meta-analysis of randomized controlled trials thatcompared laparoscopy-assisted and open distal gastrectomy for early gastric cancer[J]. J Gastrointest Surg, 2010, 14(6): 958-964.
[3] Kodera Y, Fujiwara M, Ohashi N, et al. Laparoscopic surgery for gastric cancer: a collective review with metaanalysis of randomized trials[J]. J Am Coll Surg, 2010, 211(5): 677-686.
[4] Liang Y, Li G, Chen P, et al. Laparoscopic versus open gastrec-tomy for early distal gastric cancer: a meta-analysis[J]. ANZ J Surg, 2011, 81(10): 673-680.
[5] Lee JH, Han HS, Lee JH. A prospective randomized study comparing open vs laparoscopy-assisted distal gastrectomy in early gastric cancer: early results[J]. Surg Endosc, 2005, 19(2): 168-173.
[6] Kim YW, Baik YH, Yun YH, et al. Improved quality of life outcomes after laparoscopy-assisted distal gastrectomy for early gastric cancer: results of a prospective randomized clinical trial[J]. Ann Surg, 2008, 248(5): 721-727.
[7] Kim HH, Hyung WJ, Cho GS, et al. Morbidity and mortality of laparoscopic gastrectomy versus open gastrectomy for gastric cancer: an interim report-a phase III multicenter, prospective, randomized trial (KLASS trial)[J]. Ann Surg, 2010, 251(3): 417-420.
[8] Sakuramoto S, Yamashita K, Kikuchi S, et al. Laparoscopy versus open distal gastrectomy by expert surgeons for early gastric cancer in Japanese patients: short-term clinical outcomes of a randomized clinical trial[J]. Surg Endosc, 2013, 27(5): 1695-1705.
[9]雷磊.腹腔镜辅助与开腹远端胃癌D2根治术的疗效分析[J].现代医院, 2013, 13(9): 32-34.
[10]董峰,牛跃平,孙培春,等.腹腔镜辅助下与开腹胃癌根治术治疗进展期远端胃癌临床对照研究[J].中华实用诊断与治疗杂志, 2013, 27(5): 457-459.
[11]杜建军,王为忠,李纪鹏,等.腹腔镜辅助根治性全胃切除术治疗进展期胃癌[J].中华外科杂志, 2008, 46(1): 21-23.
[12] Bo T, Peiwu Y, Feng Q, et al. Laparoscopy-assisted vs. open total gastrectomy for advanced gastric cancer: long-term outcomes and technical aspects of a case-control study[J]. J Gastrointest Surg, 2013, 17(7): 1202-1208.
[13]陈建青.腹腔镜下胃大部切除术治疗胃癌术后感染的危险因素分析[J].中华医院感染学杂志, 2013, 13(11): 2601-2603.
[14] Aimaq R, Akopian G, Kaufman HS. Surgical site infection rates in laparoscopic versus open colorectal surgery[J]. Am Surg, 2011, 77(10): 1290-1294.
[15] Tsujinaka T, Yamamoto K, Fujita J, et al. Subcuticular sutures versus staples for skin closure after open gastrointestinal surgery: a phase 3, multicentre, open-label, randomised controlled trial[J]. Lancet, 2013, 382(9898): 1105-1112.
[16]孙培龙,孙荣勋,俞建平,等.腹部手术患者预防切口感染的措施研究[J].中华医院感染学杂志, 2015, 25(7): 1607-1609.
[17]胡炳仁,蒋飞照,朱恒梁,等.同术者同期内腹腔镜与开腹远端胃癌D2根治术的对比研究[J].中国内镜杂志, 2012, 18(6): 566-570.
(吴静编辑)
论著
Comparison of surgical site infection between laparoscopic distal gastrectomy and open distal gastrectomy for gastric cancer: A Meta-analysis
Xiao-jun Xue, Kai Nie, Jin-rong Chen, Song Zhou, Wen-hua Zhang, Da-feng Chen
[Department of General Surgery, the 175th Hospital of PLA (the Southeast Hospital affiliated to Xiamen University), Zhangzhou, Fujian 363000, China]
Abstract:Objective To compare the differences of surgical site infection (SSI) between laparoscopic distal gastrectomy (LDG) and open distal gastrectomy (ODG) for gastric cancer. Methods We set up strict inclusion and exclusion criteria. All the randomized controlled trials (RCT) on LDG and ODG for gastric cancer were collected. Meta-analysis was performed according to the recommendation by the Cochrane handbook. Results Six RCTs including 767 patients were analyzed, who were divided into LDG group (n = 394) and ODG group (n = 373). Postoperative wound infection and SSI were significantly lower in LDG than in ODG [RR = 0.32, 95 % CI (0.11, 0.91), P = 0.03; RR = 0.28, 95 % CI (0.12, 0.70), P = 0.006]. There was no significant difference in intra-abdominal abscess between the two groups [RR = 0.35, 95 % CI (0.09, 1.31), P = 0.12]. Conclusions LDG was associated with a lower incidence of SSI, especially wound infection, as compared with ODG in the meta-analysis.
Keywords:laparoscopy; distal gastrectomy; gastric cancer; infection; Meta-analysis
[通信作者]周松,E-mail:zscxy@sina.com
收稿日期:2015-11-20
文章编号:1007-1989(2016)03-0046-05
DOI:10.3969/j.issn.1007-1989.2016.03.010
中图分类号:R735.2
文献标识码:A

