H3PO4协同AlCl3改性无序介孔羟基磷灰石催化合成双酚F
夏 迪,李勇飞,董 劲,吴志民,谈 瑛,刘 宁,潘浪胜,刘跃进
(湘潭大学 化工学院,湖南 湘潭 411105)
H3PO4协同AlCl3改性无序介孔羟基磷灰石催化合成双酚F
夏迪,李勇飞,董劲,吴志民,谈瑛,刘宁,潘浪胜,刘跃进
(湘潭大学 化工学院,湖南 湘潭 411105)
摘要:用水热法合成无序介孔羟基磷灰石,再通过浸渍法将H3PO4、AlCl3负载到无序介孔羟基磷灰石。采用XRD、FT-IR、N2吸附-脱附、SEM、Pyridine-FT-IR和XPS对其进行表征。将H3PO4协同AlCl3改性制备的改性无序介孔羟基磷灰石m-HAP-P/Al作为催化剂,用于催化合成双酚F,考察了不同AlCl3负载量催化剂的催化活性以及反应时间、反应温度、催化剂量、酚/醛摩尔比对双酚F收率及其异构体分布的影响。结果表明,无序介孔羟基磷灰石表面P-OH与H3PO4的P-OH作用形成含有-P-O-P-O-P-的结构,其有利于AlCl3协同改性形成Cl/Al原子比为2的四元环或六元环结构的改性机理,经H3PO4协同AlCl3改性的无序介孔羟基磷灰石兼具Brönsted和Lewis酸位,在催化苯酚、甲醛羟烷基化合成双酚F反应中呈现较高活性。当以AlCl3负载量为1.5 mmol/g的m-HAP-P/Al作为催化剂,在反应时间120 min、反应温度90℃、酚/醛摩尔比15、催化剂/甲醛质量比3的反应条件下,双酚F收率达89.56%。
关键词:无序介孔; 羟基磷灰石;H3PO4;AlCl3;催化;双酚F
双酚F是一种重要的化工单体,由2,2’-BPF、2,4’-BPF、4,4’-BPF 3种同分异构体组成,常用于合成环氧树脂、酚醛树脂、聚碳酸酯等,这些树脂广泛应用于成型、铸造、密封、涂料、封装、增强塑料和其他化工产业[1]。双酚F由苯酚、甲醛经羟烷基化合成,目前催化合成方法有液体质子酸磷酸[2]法、Lewis酸AlCl3法。但液体质子酸难于分离回收、易腐蚀装置、具有一定毒性,而Lewis酸在水中易水解、难再生使用[3]。因此,研发新型易分离的固体酸催化剂越来越受到关注[4-6]。羟基磷灰石是人体、动物骨骼和牙齿的主要无机成分,组成为Ca10(PO4)6(OH)2,具有天然的微孔结构,同时具有良好的吸附性和离子交换能力[7],是一种具有潜在应用价值的固体酸催化载体材料[8-10]。羟基磷灰石中具有一定的酸性位点[11-13],且可进一步通过改性使其酸性位点增多。已有羟基磷灰石负载金属氯化物(ZnCl2、NiCl2、CuCl2)催化Friedel-Crafts反应的报道[14]。介孔材料具有较高比表面积和孔隙率,有利于活性组分的固载,因而将催化载体材料做成介孔形态倍受青睐[15-17]。笔者采用水热法合成无序介孔羟基磷灰石,经H3PO4协同AlCl3改性,制备改性无序介孔羟基磷灰石催化剂,表征其改性前后的结构与性能,并用于催化苯酚和甲醛合成双酚F。
1实验部分
1.1 试剂
硝酸钙(Ca(NO3)2),分析纯,天津市大茂化学试剂厂产品;氨水(NH3·H2O),分析纯,天津市凯信化学工业有限公司产品;十六烷基三甲基溴化铵(CTAB)、无水氯化铝(AlCl3)、无水硫酸钠(Na2SO4),分析纯,国药集团化学试剂有限公司产品;磷酸二氢氨(NH4H2PO4),分析纯,天津光复科技发展有限公司产品;磷酸(H3PO4),分析纯,长沙湘科精细化工厂产品;甲醛(HCHO),分析纯,长沙安泰精细化工实业有限公司产品;苯酚(C6H5OH),分析纯,西陇化工股份有限公司产品;乙醇(CH3CH2OH),分析纯,天津富宇精细化工有限公司产品;对甲酚(CH3C6H4OH),分析纯,天津市光复精细化工研究所产品。
1.2 催化剂制备
1.2.1无序介孔羟基磷灰石的制备[18]
将0.4 mol/L Ca(NO3)2溶液100 mL,用NH3·H2O溶液调节pH=9,然后加入5 g CTAB,恒温100℃至固体完全溶解,再在搅拌状态下缓慢滴入100 mL的 0.24 mol/L的NH4H2PO4溶液(用NH3·H2O调节NH4H2PO4溶液pH=9),滴加过程中同时用NH3·H2O严格控制溶液pH=9,在100℃下反应2 h,90℃陈化48 h,抽滤,水洗,放入烘箱中于100℃干燥24 h,即得羟基磷灰石,记为HAP。再于马福炉中600℃煅烧5 h,即得无序介孔羟基磷灰石,记为m-HAP。
1.2.2无序介孔羟基磷灰石的改性
按照1 g m-HAP加1 mmol H3PO4和100 mL去离子水的比例将三者置于250 mL圆底烧瓶中,在 100℃下反应12 h,抽滤,水洗,在100℃干燥24 h,得到经H3PO4改性的无序介孔羟基磷灰石,记为m-HAP-P。再将m-HAP-P 、AlCl3和无水乙醇按照1 g m-HAP-P加(0.5~3.5) mmol AlCl3和100 mL无水乙醇的比例混合,在80℃下反应12 h,抽滤,乙醇洗涤, 120℃干燥 2 h,得到H3PO4协同AlCl3改性的无序介孔羟基磷灰石,记为m-HAP-P/Al(b),b为负载的AlCl3的量,mmol/g。
1.3 催化剂表征
采用日本理学RigakuD/Max2550VB+18kW型X射线衍射仪分析催化剂物相,石墨型单色管,Cu/Ka型靶管,λ=0.15418 nm,测试电压50 kV,电流40 mA,2θ扫描范围20°~70°、扫描速率6 °/min。
采用美国热电集团公司Nicolet-380型傅里叶红外光谱仪进行FT-IR分析,波数范围4000~400 cm-1。将干燥后高纯KBr粉末与样品按照质量比为95∶5混合,置于玛瑙研钵中充分碾磨,压片。
采用美国Quantachrome公司NOVA-2200e型物理吸附仪进行N2吸附-脱附实验,BET法计算比表面积,BJH脱附计算孔容和孔径分布。
采用日本JEOL公司JSM-6610LV型扫描电子显微镜分析催化剂形貌,加速电压5 kV,样品经喷金处理。
采用北京泊菲莱科技有限公司HiCube80+Nicoletis型红外表征高真空系统分析催化剂Brönsted和Lewis酸位。样品300℃真空活化1 h,冷却降温至150℃,在此温度下吸附吡啶30 min,真空脱附吡啶30 min。
采用英国Thermo Fisher Scientific公司K-Alpha 1063型X射线光电子能谱仪测定样品元素含量。
1.4 催化合成双酚F
以苯酚、甲醛为原料合成双酚F,评价m-HAP-P/Al催化剂的催化活性。按比例将m-HAP-P/Al、苯酚加入带冷凝管的两口瓶中,恒温搅拌,再将37%(质量分数)甲醛溶液缓慢滴入其中,分别在反应15、60、120、240、360 min时取样,采用气相色谱内标法分析双酚F产物。考虑不同AlCl3负载量及不同催化剂对双酚F收率的影响和反应时间、反应温度、催化剂量、酚醛比对双酚F收率及其异构体分布的影响。根据式(1)和式(2)计算双酚F收率与异构体分布。

(1)
双酚F同分异构体分布=
(2)
2结果与讨论
2.1 无序介孔羟基磷灰石和改性的无序介孔羟基磷灰石的表征结果
2.1.1FT-IR和XRD表征结果
图1为羟基磷灰石HAP和无序介孔羟基磷灰石m-HAP的FT-IR谱。图1中,HAP的2924 cm-1处的不对称伸缩振动和2854 cm-1处的对称伸缩振动表明羟基磷灰石煅烧前存在模板剂CTAB[19],3170 cm-1处的伸缩振动和1379 cm-1处
图2为m-HAP的XRD谱。由图2可知,在2θ为25.8°、32°和32.9°时出现3个强晶体特征衍射峰(002,211,300),与HAP国际标准PDF卡片数据(JCPDS #09-0432)[23]匹配,表明得到了晶体结构完整的羟基磷灰石。
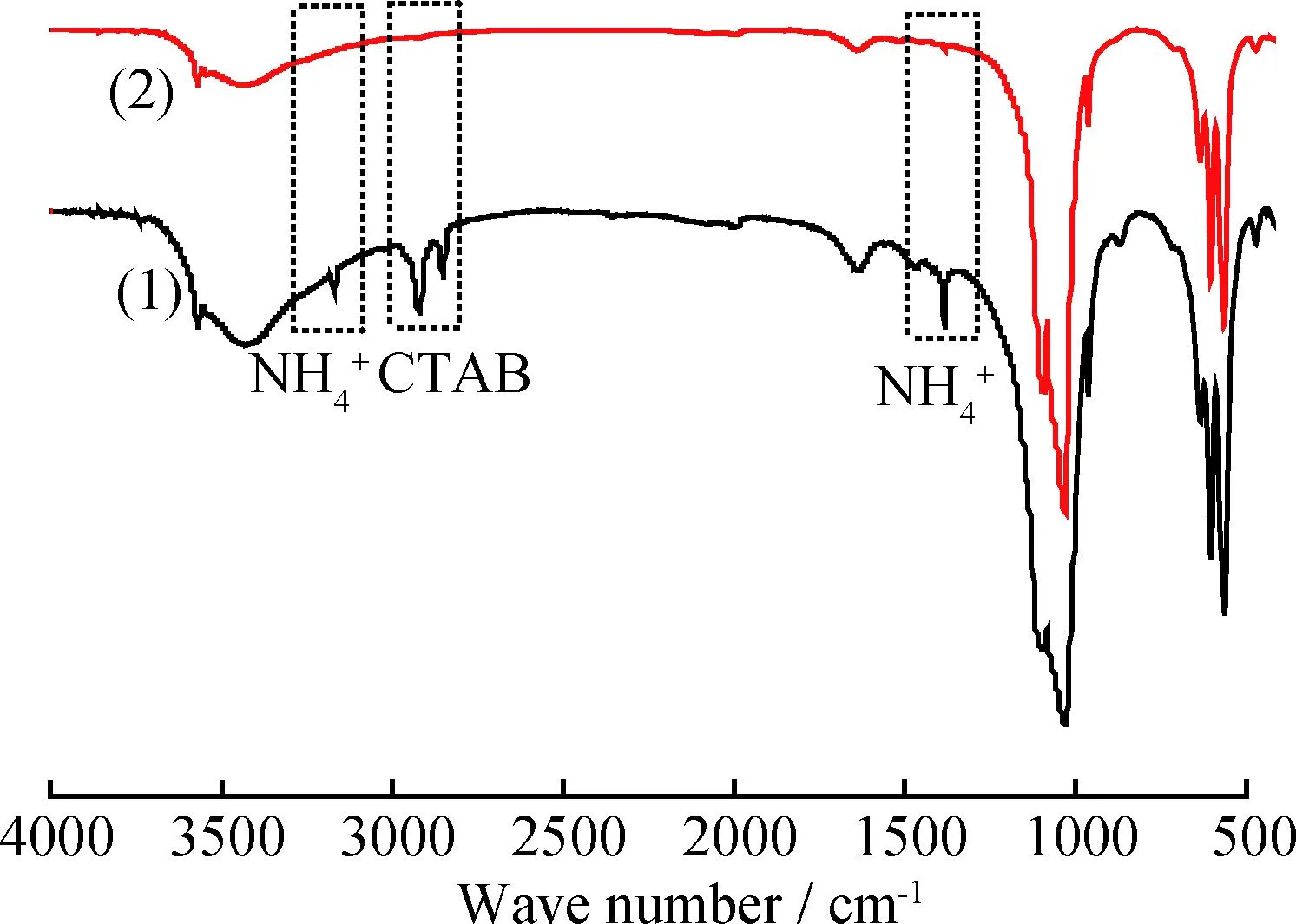
图1 HAP和m-HAP的FT-IR谱
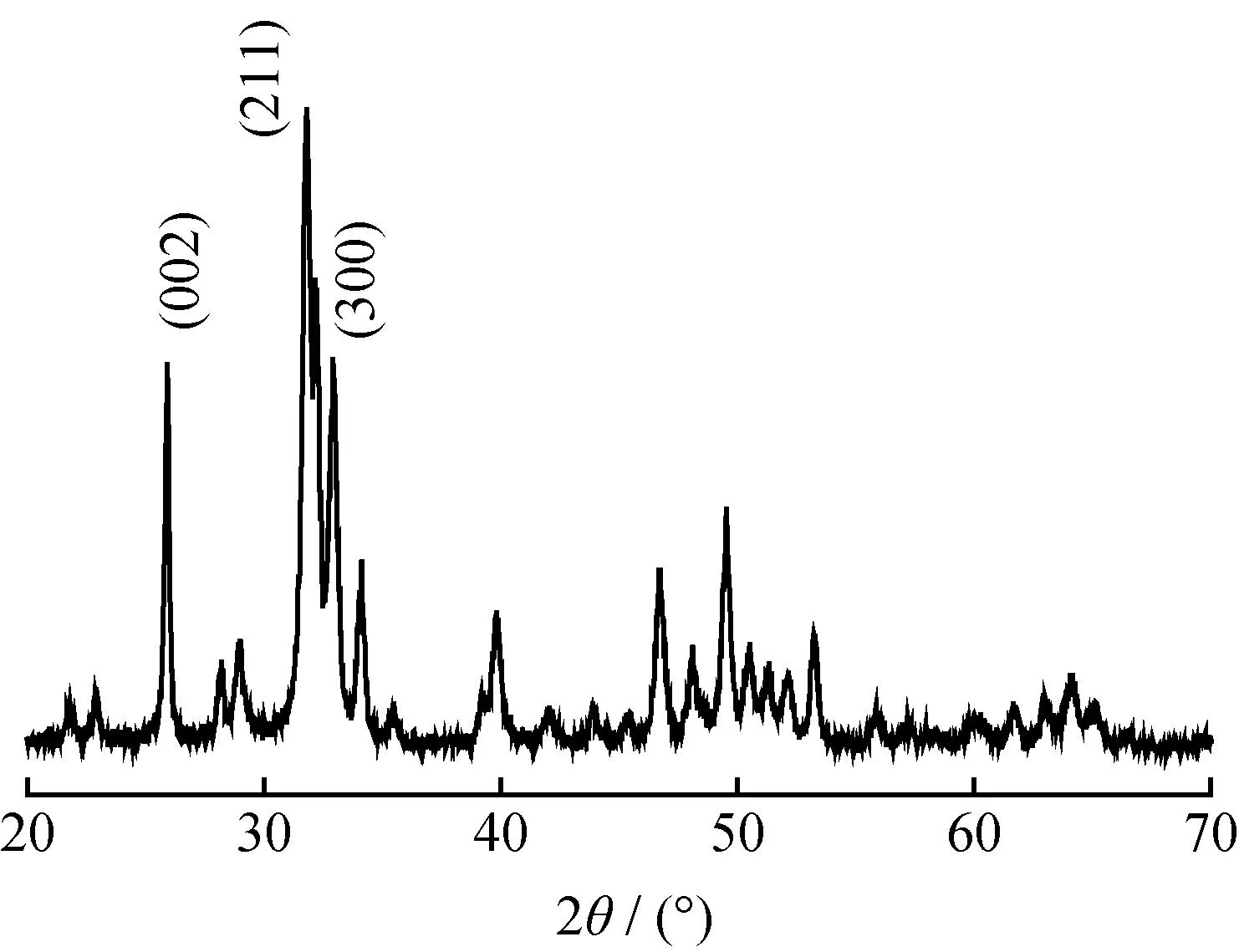
图2 m-HAP的XRD谱
2.1.2比表面积、孔径
图3为m-HAP、m-HAP-P和m-HAP-P/Al(1.5)的N2吸附-脱附等温线和孔径分布曲线,其比表面积、孔容、孔径和平均粒径数据列于表1。
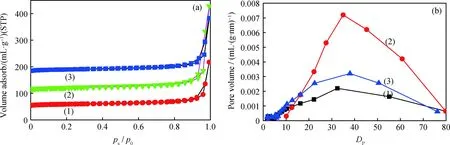
图3 m-HAP、m-HAP-P、m-HAP-P/Al(1.5)的N2吸附-脱附等温线和孔分布曲线

SampleSBET/(m2·g-1)Vp/(cm3·g-1)Dp/nmAverageparticlesize/nmm-HAP32.670.25636.57183.65m-HAP-P39.400.49238.33152.29m-HAP-P/Al(1.5)34.780.31239.28172.52
由图3可见,m-HAP、m-HAP-P和m-HAP-P/Al(1.5)的N2吸附-脱附曲线均属于典型IV型等温线,在相对压力(ps/p0)为0.8~1.0范围内有明显闭合滞回环,说明m-HAP、m-HAP-P、m-HAP-P/Al(b)均具有介孔结构特征[24]。由表1可知,经H3PO4改性后其比表面积、孔径略有增加,但孔容有较大增加,平均粒径略有降低,孔径分布变窄。这是因为H3PO4溶液溶解了部分m-HAP的少部分内外表面的缘故,这也为下一步负载AlCl3提供了有利条件。经H3PO4改性后的m-HAP再进一步用AlCl3改性,当AlCl3负载量为1.5 mmol/g时(m-HAP-P/Al(1.5)),其比表面积、孔容又有所下降,而孔径、平均粒径又有所增加,孔径分布变宽。这是因为m-HAP-P负载AlCl3后,表面P—OH吸附了一定量AlCl3,AlCl3在孔道和表面聚集降低了孔径和比表面积。m-HAP经H3PO4协同AlCl3改性后其比表面积、孔容、孔径均有增加。
2.1.3SEM表征
图4为HAP、m-HAP、m-HAP-P和m-HAP-P/Al(1.5)的SEM照片。由图4可见, HAP呈一定絮状纤维聚集态,煅烧后由于大分子CTAB模板剂被烧掉而得到充分分散。由图4还可见,煅烧后呈分散态的纤维经H3PO4改性后有所膨胀、黏连,整体呈疏松态,比表面积有所增加,再经AlCl3改性后又有所聚集,分散性又有所下降。
2.1.4Pyridine-FT-IR
图5为m-HAP、m-HAP-P/Al(1.5)的Pyridine-FT-IR谱。由图5可见,在1446、1490、1545和1600 cm-1处均有4个明显的吸收峰,其中在1446 cm-1处的吸收峰说明存在Lewis酸位,在1545 cm-1处的吸收峰说明存在Brönsted酸位[25-26],在1490 cm-1处的吸收峰说明存在Brönsted酸和Lewis酸的结合酸位[27]。未改性的m-HAP在1600 cm-1处有吸收峰是因为其表面存在—OH[28-29]的缘故,而改性后其—OH与AlCl3以AlClx形式相结合,故没有明显的峰出现。由图5还可见,m-HAP改性前后都是Lewis酸位占主导地位。

图4 HAP、m-HAP、m-HAP-P和m-HAP-P/Al(1.5)的SEM照片
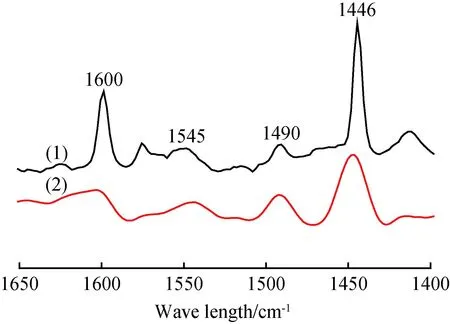
图5 m-HAP、m-HAP-P/Al(1.5)的Pyridine-FT-IR谱
2.2 H3PO4协同AlCl3改性无序介孔羟基磷灰石的改性机理
根据Pyridine-FT-IR表征结果及文献[30-31]报道,提出m-HAP的改性机理如式(3)~式(6)所示。

(3)

(4)

(5)
(6)
m-HAP在H3PO4浸渍下,其表面的P-OH与H3PO4的P-OH反应,脱去1分子水形成P-O-P键,再进一步与H3PO4的P-OH反应,脱去1分子水形成P-O-P-O-P键,如反应式(3)、式(4)所示,以此方式继续反应,最终形成含有-P-O-P-O-P-的框架结构。m-HAP表面存在大量P-OH基团,可通过改性物与其表面的P-OH结合而达到改变其性能的目的[32]。H3PO4改性后的m-HAP-P,既增加了比表面,又增加了表面的P-OH数,为后续AlCl3的协同改性提供了更多的活性位点。
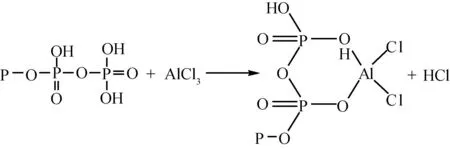
用AlCl3乙醇液浸渍所形成的-P-O-P-O-P-架构进一步协同改性,AlCl3可分别与式(3)、式(4)产物反应形成四元环与六元环结构,如反应式(5)、式(6)所示,其中Cl/Al原子比均为2,与Zhao等[33]等提出的MCM-41中Si-OH负载AlCl3的结构类似。
通过XPS测得所改性的无序介孔羟基磷灰石m-HAP-P/Al(b)中的Cl/Al原子比为2.5,与上述推测机理中Cl/Al原子比为2很相近,但未完全一致。这可能是因为AlCl3主要嫁接在m-HAP-P的表面,而没有嵌入到框架结构中去;另外,又由于m-HAP-P表面的P-OH可吸附AlCl3,故m-HAP-P/Al(b)中既存在AlCl3又存在—AlCl2,理论计算表明,式(5)四元环状结构的可能性比式(6)六元环结构的可能性大[34]。
图6为不同AlCl3负载量的m-HAP-P/Al(b)的FT-IR谱。由图6可知,随着AlCl3负载量由0.5、1.0、1.5、2.5、3.5 mmol/g依次增加时,3570 cm-1处—OH峰逐渐减弱,即P-OH数逐渐减少,这进一步证明了AlCl3与P-OH结合从而降低了P-OH数。

图6 m-HAP-P/Al(b)的FT-IR谱
2.3 AlCl3负载量和反应条件对m-HAP-P/Al(b)催化合成双酚F反应的影响
2.3.1不同AlCl3负载量的影响
图7为m-HAP-P/Al(b)催化合成双酚F的收率随反应时间的变化。由图7可见,随着m-HAP-P/Al(b)中AlCl3负载量的增加,其催化所得双酚F收率先增加后降低,m-HAP-P/Al(1.5)催化所得双酚F收率达最大。由HAP分子组成Ca10(PO4)6(OH)2可知,1 g HAP 表面最多含2 mmol P-OH,经1 mmol H3PO4改性后表面P-OH数至多增加1 mmol,又由式(5)、(6)可知,每2 mmol P-OH与1 mmol AlCl3结合,故负载AlCl3量1.5 mmol/g时达饱和状态,再继续增加AlCl3负载量,过多的AlCl3在其表面聚集,导致晶型结构破坏,从而引起双酚F收率降低。故最佳负载量为1.5 mmol/g。此外,由图7还可知, m-HAP-P的催化活性极低,反应360 min,双酚F收率低于10%。与m-HAP/Al(1.5)对比,m-HAP-P/Al(1.5)催化合成双酚F的收率增加约14%,即 H3PO4协同AlCl3改性无序介孔羟基磷灰石m-HAP-P/Al(1.5)比只是用AlCl3改性无序介孔羟基磷灰石m-HAP/Al(1.5)的催化活性更高。
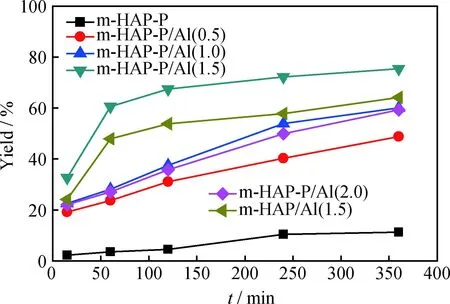
图7 不同AlCl3负载量的催化剂催化合成双酚F的
2.3.2反应时间的影响
图8为反应时间对m-HAP-P/Al(1.5)催化合成双酚F的收率及异构体分布的影响。从图8可见,在反应最初120 min 内,双酚F收率快速增加;继续延长反应时间,双酚F收率增加缓慢。反应时间延长,双酚F产物发生后续聚合副反应的几率也会增加[35-36],故最佳反应时间为120 min。双酚F异构体分布随反应时间的变化较小,4,4’-BPF选择性随反应时间延长略有下降,与之相对的是2,4’-BPF选择性略有增加,2,2’-BPF选择性基本保持不变。

图8 反应时间对m-HAP-P/Al(1.5)催化合成双酚F
2.3.3反应温度的影响
图9为反应温度对m-HAP-P/Al(1.5)催化合成双酚F收率及其异构体分布的影响。结果表明,当反应温度在70~90℃范围,随温度的升高双酚F收率有较大增加,但继续增加温度至110℃,收率反而略有下降,温度过高加剧反应原料甲醛的逃逸,故最佳反应温度为90℃。反应温度对双酚F异构体分布有一定影响,当反应温度从70℃增至80℃时,受动力学控制的4,4’-BPF选择性有一定下降,受热力学控制的2,4’-BPF选择性有一定增加,而2,2’-BPF选择性略有增加,其后随着反应温度的增加它们的选择性变化很小[37]。
2.3.4催化剂量的影响
表2为催化剂量(m(Catalyst)/m(Formaldehyde))对m-HAP-P/Al(1.5)催化合成双酚F收率和异构体分布的影响。从表2可见,随着m(Catalyst)/m(Formaldehyde)增加,收率显著增加,当m(Catalyst)/m(Formaldehyde)=3时,双酚F收率达最大,为85.58%;当m(Catalyst)/m(Formaldehyde)继续增加至4时,双酚F收率趋于稳定。故最佳m(Catalyst)/m(Formaldehyde)为3。双酚F异构体分布只在最初60 min内有一定变化,选定反应时间15 min,m(Catalyst)/m(Formaldehyde)对双酚F异构体分布几乎无影响。

图9 反应温度m-HAP-P/Al(1.5)催化合成双酚F

m(Catalyst)/m(Formaldehyde)YieldofbisphenolF/%BisphenolFisomersdistribution/%15min120min4,4’-BPF2,4’-BPF2,2’-BPF121.4544.7123.0053.1823.82232.6467.4623.0253.3823.60339.2485.5822.7953.0224.19425.2565.1822.5353.9223.55
n(Phenol)/n(Formaldehyde)=30;T=80℃
2.3.5原料组成(n(Phenol)/n(Formaldehyde))的影响
图10为n(Phenol)/n(Formaldehyde)对m-HAP-P/Al(1.5)催化合成双酚F收率及其异构体分布的影响。从图10可见,当n(Phenol)/n(Formaldehyde)从7.5增至15时,双酚F收率从60%增至79%,再进一步增加n(Phenol)/n(Formaldehyde),双酚F收率几乎不再增加,故最佳n(Phenol)/n(Formaldehyde)为15。另外,n(Phenol)/n(Formaldehyde)对双酚F的异构体分布几乎没有影响。

图10 n(Phenol)/n(Formaldehyde)对m-HAP-P/Al(1.5)
3结论
无序介孔羟基磷灰石m-HAP经H3PO4协同AlCl3改性后,比表面积、孔容、孔径均有所增加;m-HAP表面的P-OH与H3PO4的P-OH反应形成含有-P-O-P-O-P-的框架结构,有利于AlCl3协同改性形成Cl/Al原子比为2的四元环或六元环结构。H3PO4协同AlCl3改性无序介孔羟基磷灰石m-HAP-P/Al(b)兼具Brönsted和Lewis酸位,用于催化苯酚、甲醛合成双酚F反应时,表现出较高的催化活性。在以AlCl3负载量为1.5 mmol/g 的m-HAP-P/Al(b)为催化剂时,在酚/醛摩尔比为15、催化剂/甲醛质量比为3、反应温度90℃、反应时间120 min的条件下,双酚F收率达89.56%。
参考文献
[1] JANA S K, OKAMOTO T, KUGITA T, et al. Selective synthesis of bisphenol F catalyzed by microporous H-beta zeolite [J]. Appl Catal A: Gen, 2005,288 (1): 80-85.
[2] 邹友思, 赵军, 温庆如, 等. 一步法合成高4,4' 位含量二羟基二苯基甲烷的方法: 中国, 101440022 [P].2009-5-27.
[3] ZHAO X S, LU G Q, SONG C. Mesoporous silica-immobilized aluminium chloride as a new catalyst system for the isopropylation of naphthalene [J]. Chem Commun, 2001,(22): 2306-2307.
[4] MATHEW A, PARAMBADATH S, PARK S S, et al. Hydrophobically modified spherical MCM-41 as nanovalve system for controlled drug delivery [J]. Microporous Mesoporous Mater, 2014,200: 124-131.
[5] NIU Y, WANG H, ZHU X, et al. Ru supported on zirconia-modified SBA-15 for selective conversion of cellobiose to hexitols [J].Microporous Mesoporous Mater, 2014,198: 215-222.
[6] DZYAZKO Y S, PONOMARYOVA L N, VOLFKOVICH Y M, et al. Ion-exchange resin modified with aggregated nanoparticles of zirconium hydrophosphate morphology and functional properties [J]. Microporous Mesoporous Mater, 2014, 198: 55-62.
[7] SEBTI S, TAHIR R, NAZIH R, et al. Hydroxyapatite as a new solid support for the Knoevenagel reaction in heterogeneous media with out solvent [J]. Appl Catal A: Gen, 2002,228(1): 155-159.
[8] CUI Q, CHAO S, BAI Z, et al. Based on a new support for synthesis of highly efficient palladium/hydroxyapatite catalyst for ethanol electrooxidation [J]. Electrochim Acta, 2014,132: 31-36.
[9] DASIREDDY V D B C, SINGH S, FRIEDRICH H B. Vanadium oxide supported on non-stoichiometric strontium hydroxyapatite catalysts for the oxidative dehydrogenation ofn-octane [J]. J Mol Catal A:Chem, 2014,395: 398-408.
[10] WEN C, CUI Y, CHEN X, et al. Reaction temperature controlled selective hydrogenation of dimethyl oxalate to methyl glycolate and ethylene glycol over copper-hydroxyapatite catalysts[J]. Appl Catal B: Environ, 2015, 162: 483-493.
[11] RESENDE N S, NELE M, SALIM V M M. Effects of anion substitution on the acid properties of hydroxyapatite[J]. Thermochim acta, 2006, 451(1): 16-21.
[12] ELAZARIFI N, EZZAMARTY A, LEGLISE J, et al. Kinetic study of the condensation of benzaldehyde with ethylcyanoacetate in the presence of Al-enriched fluoroapatites and hydroxyapatites as catalysts[J]. Appl Catal A: Gen, 2004, 267(1): 235-240.
[13] VENUGOPAL A, SCURRELL M S. Hydroxyapatite as a novel support for gold and ruthenium catalysts: Behaviour in the water gas shift reaction[J]. Appl Catal A : Gen, 2003, 245(1): 137-147.
[14] SEBTI S, TAHIR R, NAZIH R, et al. Comparison of different Lewis acid supported on hydroxyapatite as new catalysts of Friedel-Crafts alkylation[J]. Appl Catal A : Gen, 2001, 218(1): 25-30.
[15] ZHAO D, HUO Q, FENG J, et al. Correction to nonionic triblock and star diblock copolymer and oligomeric surfactant syntheses of highly ordered, hydrothermally stable, mesoporous silica structures[J]. J Am Chem Soc, 2014, 136(29): 10546-10546.
[16] WILSON B E, RUDISILL S G, STEIN A. Use of a sacrificial layer for an efficient EISA synthesis of mesoporous carbon[J]. Microporous Mesoporous Mater, 2014, 197: 174-179.
[17] TAM D, FERRIS D P, BARNES J C, et al. A reversible light-operated nanovalve on mesoporous silica nanoparticles[J]. Nanoscale, 2014, 6(6): 3335-3343.
[18] WANG H, ZHAI L, LI Y, et al. Preparation of irregular mesoporous hydroxyapatite [J]. Mater Res Bull, 2008,43 (6): 1607-1614.
[19] JIANG F, WANG D P, YE S, et al. Strontium-substituted, luminescent and mesoporous hydroxyapatite microspheres for sustained drug release[J]. J Mater Sci Mater Med, 2014,25 (2): 391-400.
[20] WANG Y J, CHEN J D, WEI K, et al. Surfactant-assisted synthesis of hydroxyapatite particles[J]. Mater Lett, 2006, 60(27): 3227-3231.
[21] LIANG T, QIAN J, YUAN Y, et al. Synthesis of mesoporous hydroxyapatite nanoparticles using a template-free sonochemistry-assisted microwave method[J]. J Mater Sci, 2013, 48(15): 5334-5341.
[22] 柯行飞, 曹洁明, 郑明波,等. 双模板法合成介孔/大孔二级孔道碳材料[J]. 物理化学学报, 2007,23 (5): 757-760.(KE Xingfei, CAO Jieming, ZHENG Mingbo, et al. Synthesis of hierarchically meso-macroporous structured carbon sieve by dual-template method[J]. Acta Phys Chim Sin , 2007, 23(5): 757-760.)
[23] No. 9-432 PDF card, ICDD, Newton Square, Pennsylvania, USA [S].
[24] El-HAMMARI L, MARROUN H, LAGHZIZIL A , et al. Organically modified porous hydroxyapatites: A comparison between alkylphosphonate grafting and citrate chelation [J]. J Solid State Chem, 2008, 181 (4): 848-854.
[25] BENALIOUCHE F, BOUCHEFFA Y, AYRAULT P, et al. NH3-TPD and FTIR spectroscopy of pyridine adsorption studies for characterization of Ag-and Cu-exchanged X zeolites [J]. Microporous Mesoporous Mater, 2008,111 (1): 80-88.
[26] AUROUS A, DATKA J. Microcalorimetric and IR spectroscopic studies of pyrindine sorption in NaH-mordenites [J]. Appl Catal A : Gen, 1997,(165): 473-479.
[27] XUE B, XU J, XU C, et al. A novel, shape-selective H-MCM-22/MCM-41 composite catalyst: Synthesis, characterization and catalytic performance [J]. Catal Commun, 2010, 12 (2): 95-99.
[28] SOBCZAK I, MUSIALSKA K, PAWLOWSKI H, et al. NO and C3H6adsorption and coadsorption in oxygen excess-A comparative study of different type zeolites modified with gold [J]. Catal Today ,2011,176 (1): 393-398.
[29] BUSCA G. Spectroscopic characterization of the acid properties of metal oxide catalysts[J]. Catal today, 1998, 41(1): 191-206.
[30] AISSA A, DEBBABI M, GRUSELLE M, et al. Covalent modification of calcium hydroxyapatite surface by grafting phenyl phosphonate moieties[J]. J Solid State Chem, 2007, 180(8): 2273-2278.
[31] TANAKA H, FUTAOKA M, HINO R. Surface modification of calcium hydroxyapatite with pyrophosphoric acid[J]. J Colloid Interf Sci, 2004, 269(2): 358-363.
[32] CHOI H W, LEE H J, KIM K J, et al. Surface modification of hydroxyapatite nanocrystals by grafting polymers containing phosphonic acid groups[J]. J Colloid Interf Sci, 2006, 304(1): 277-281.
[33] ZHAO X S, LU M G Q, SONG C. Immobilization of aluminum chloride on MCM-41 as a new catalyst system for liquid-phase isopropylation of naphthalene[J]. J Mol Catal A: Chemical, 2003, 191(1): 67-74.
[34] 蔡天锡. 固载化AlCl3催化剂的研制与应用[J]. 石油化工, 2001,30 (4): 315-318.(CAI Tianxi. Preparation and application of immobilized AlCl3catalysts[J]. Petrochemical Technology, 2001,30 (4): 315-318.)
[35] GARADE A C, KSHIRSAGAR V S, RODE C V. Selective hydroxyalkylation of phenol to bisphenol F over dodecatungstophosphoric acid (DTP) impregnated on fumed silica[J]. Appl Catal A : Gen, 2009, 354(1): 176-182.
[36] THOMAZEAU C, OLIVIER-BOURBIGOU H, MAGNA L, et al. Determination of an acidic scale in room temperature ionic liquids [J]. J Am Chem Soc, 2003, 125 (18): 5264-5265.
[37] JANA S K, KUGITA T, NAMBA S. Aluminum-grafted MCM-41 molecular sieve: An active catalyst for bisphenol F synthesis process[J]. Appl Catal A : Gen , 2004, 266(2): 245-250.
Irregular Mesoporous Hydroxyapatite Modified Synergistically With Phosphoric Acid and Aluminium Chloride for Catalytic Synthesis of Bisphenol F
XIA Di, LI Yongfei, DONG Jin, WU Zhimin, TAN Ying, LIU Ning, PAN Langsheng, LIU Yuejin
(CollegeofChemicalEngineering,XiangtanUniversity,Xiangtan411105,China)
Abstract:The irregular mesoporous hydroxyapatites(m-HAP-P/Al) were first synthesized by the hydrothermal method and then were modified synergistically with phosphoric acid and aluminium chloride by the impregnation method. They were characterized by XRD, FT-IR, N2adsorption-desorption, SEM, Pyridine-FT-IR and XPS. m-HAP-P/Al was then used as catalyst for synthesis of bisphenol F. The effects of aluminium chloride content loaded on m-HAP-P/Al, and reaction conditions of time, temperature, catalyst content and phenol/formaldehyde molar ratio on bisphenol F yield and its isomers distribution were investigated. The results showed that the P-OH of irregular mesoporous hydroxyapatite reacted with P-OH groups of phosphoric acid to form -P-O-P-O-P- frame structure, which are beneficial for the synergistic modification of AlCl3to form four membered and/or six membered rings with Cl/Al atom ratio 2. The irregular mesoporous hydroxyapatite modified synergistically with phosphoric acid and aluminium chloride afford both Brönsted acid and Lewis acid sites,and exhibited high catalytic activity in synthesis of bisphenol F. With m-HAP-P/Al loaded aluminium chloride 1.5 mmol/g as catalyst, under the optimal reaction conditions of temperature of 90℃, phenol/formaldehyde molar ratio of 15 and catalyst/formaldehyde mass ratio of 3 and time of 120 min, the yield of bisphenol F reached 89.56%.
Key words:irregular mesoporous; hydroxyapatite; phosphoric acid; aluminium chloride; catalyzation; bisphenol F
中图分类号:TQ243.2
文献标识码:A
doi:10.3969/j.issn.1001-8719.2016.01.010
文章编号:1001-8719(2016)01-0064-09
基金项目:国家自然科学基金项目(21276217)和湖南省教育厅开放基金项目(15K125)资助
收稿日期:2014-10-13
第一作者: 夏迪,女,硕士研究生,从事绿色催化有机合成方面的研究;E-mail:dear_xiadi@126.com
通讯联系人: 李勇飞,男,博士,从事化学工程与有机催化合成的研究;E-mail:liyongfei98@163.com;刘跃进,男,教授,博士,从事化学工程与有机催化合成的研究;E-mail:xdlyj@163.com

