无花果水提取液对抑制肿瘤细胞增殖作用的初步研究
周 宁, 陈江涛, 于文燕
(新疆医科大学1附属肿瘤医院消化内科, 乌鲁木齐 830011;1第一附属医院骨科中心, 乌鲁木齐 830054;
3病理生理学教研室, 乌鲁木齐 830011)
无花果水提取液对抑制肿瘤细胞增殖作用的初步研究
周宁1, 陈江涛2, 于文燕3
(新疆医科大学1附属肿瘤医院消化内科, 乌鲁木齐830011;1第一附属医院骨科中心, 乌鲁木齐830054;
3病理生理学教研室, 乌鲁木齐830011)
摘要:目的探讨无花果水提取液 (fig extract,FE) 对宫颈癌细胞细胞(Hella)及肝癌细胞 (Hepg2) 增殖的影响及其机制。方法采用人外周血的单核细胞系(Thp-1)作为Hella细胞对照组;HepG2细胞对照组为正常肝细胞(7702),细胞分别给予PBS处理和无花果水提液处理;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐法(MTT)检测不同浓度无花果提取液对细胞增殖的影响,荧光显微镜观察细胞形态改变,流式细胞术检测细胞凋亡变化。结果经无花果水提液处理后,Thp-1细胞细胞活性及形态无明显改变;随着提取液浓度的增加,Hella细胞细胞活性逐渐降低,细胞凋亡的数量逐渐增加,细胞固缩失去正常形态。无花果水提液对人肝癌细胞和正常肝细胞增殖均有抑制作用,随着剂量增加,增殖抑制作用增强,呈剂量效应关系(P=0.006),无花果水提液0.06 g/mL时,人肝癌细胞和正常肝细胞增殖率差异有统计学意义(P=0.021);无花果水提液处理肝癌细胞后,随着无花果水提液浓度增加凋亡细胞显著增加。当剂量<0.08 g/mL时对正常细胞以及肝癌细胞形态无明显影响,当剂量>0.08 g/mL时Hepg2细胞变形固缩,失去正常形态。结论无花果水提取液可能通过影响细胞凋亡而抑制肿瘤细胞增殖。
关键词:无花果; 宫颈癌细胞; 肝癌细胞; 细胞凋亡
无花果树是一种落叶乔木,隶属于桑科榕属,原产地中海沿岸,分布于土耳其至阿富汗。中国唐代即从波斯传入,现南北均有栽培,新疆南部尤多,其果实(称为无花果)被用作食物和药材已经有几个世纪[1-5]。无花果中的酚类化合物可以增加血浆脂蛋白含量,在体外还能保护其免受氧化损伤。研究发现除了抗氧化作用,在大鼠体内,无花果干的水提液可以抑制埃利希癌症、肉瘤S180和肝癌的生长[6]。还有研究发现无花果超临界流体萃取物,在体外对U937、95D及AGS肿瘤细胞具有一定的抗增殖作用,并且能够抑制肝癌异种移植大鼠细胞增殖,抑制率约为49%[7]。
宫颈癌是常见妇科肿瘤,尤其在新疆发病率较高;原发性肝癌 (hepatocellular carcinoma, HCC) 为我国常见恶性肿瘤之一,居肿瘤病死率的第3位,仅次于胃癌和食管癌,因此寻找天然有效的抗癌防癌植物资源,尤其是可食植物,具有重要的科学意义和应用价值。本研究使用无花果水提液处理宫颈癌及肝癌细胞,观察其对肿瘤细胞增殖的影响,为寻找有效的防癌抗癌植物资源提供理论依据。
1材料与方法
1.1材料无花果提取液制备,取无花果干果,干燥后称取400 g加蒸馏水3 L,水提,弃渣,合并浸出液,浓缩至1.3 g/mL,用PBS配制成0.1~1 mg/mL浓度。CO2培养箱 (Heraes公司,德国),培养基(DMEM)、胎牛血清 (无花果水提液tal bovine serum,FBS) (GibcoBRL公司,美国),胰酶及DMSO,噻唑蓝 (MTT),FITC Annexin V细胞凋亡检测试剂盒 (BD公司,美国)。细胞均购自美国典型培养物种(American Type Culture Collection, ATCC)。
1.2方法
1.2.1细胞增殖检测实验分为4组,分别为Hella 细胞组及其对照组THP-1细胞组,Hepg2细胞组及其对照组7702细胞组。用完全培养液调整细胞浓度为2×104个/mL,接种于96孔板,每孔总体积为200 μL,培养过夜使细胞贴壁,次日分别用不同剂量的无花果提取液(0.1~1 mg/mL)分别处理细胞24 h,对照组加入PBS处理24 h,每个剂量组接种3个复孔,置于37℃、5%CO2孵箱处理24 h后,每孔加入5 mg/mL MTT试剂20 μL,继续培养4 h,再加 DMSO 150 μL,振荡混匀10 min,用酶标仪(K=490 nm)测定OD值(OD值与活细胞数成正比),细胞抑制率 =1-加药组OD值/对照组OD值,实验重复3次。
1.2.2细胞形态学观察采用Leica共聚焦显微镜观察细胞生长状态。
1.2.3细胞凋亡检测于12孔板分别接种细胞2×105个/孔,培养过夜,给予不同剂量的无花果提取液(0.1~1 mg/mL)处理Hella细胞及Hepg2细胞,空白对照组不处理,阴性对照的 THP-1细胞组及7702细胞组给予相应最大浓度药物同体积的PBS,培养24 h后弃去细胞培养液,用PBS洗涤贴壁细胞1次,加入适量胰酶细胞消化液(不含有EDTA)消化离心收集细胞(避免胰酶过度消化)。用PBS洗细胞2次(2 000 r/min离心5 min)收集细胞,计数2×105个细胞,加入200 μL的Binding Buffer无花果水提液悬浮细胞;加入5 μL FITC Annexin V混匀后,再加入5 μL Propidium Iodide,混匀;室温避光、反应15 min,利用流式细胞仪进行细胞凋亡的检测。
1.3统计学处理使用SPSS 13.0较件进行统计学分析,绘图软件为OriginPro 8.0。首先采用Levene进行方差齐性检验,文中样本方差均齐,则采用单因素方差分析(One-way ANOVA)及两独立样本t检验处理,检验水准为α=0.05。
2结果
2.1无花果水提液对Hella细胞增殖的影响随着提取液浓度的增加,Hella细胞活力逐渐降低,抑制增殖的作用增强(图1),当提取液浓度达到0.9 mg/mL时,细胞活力降至最低;当提取液浓度为0.4~1 mg/mL,对细胞增殖率的影响与PBS对照组相比有统计学差异。Thp-1细胞给予不同浓度的提取液处理后与PBS对照组相比增殖率差异无统计学意义(表1),抑制率变化不明显(图2)。与PBS对照组细胞形态相比(图3),Hella细胞形态发生明显改变,细胞固缩,失去正常形态(图4);与PBS对照组细胞形态相比(图5),Thp-1细胞形态学无明显变化(图6)。
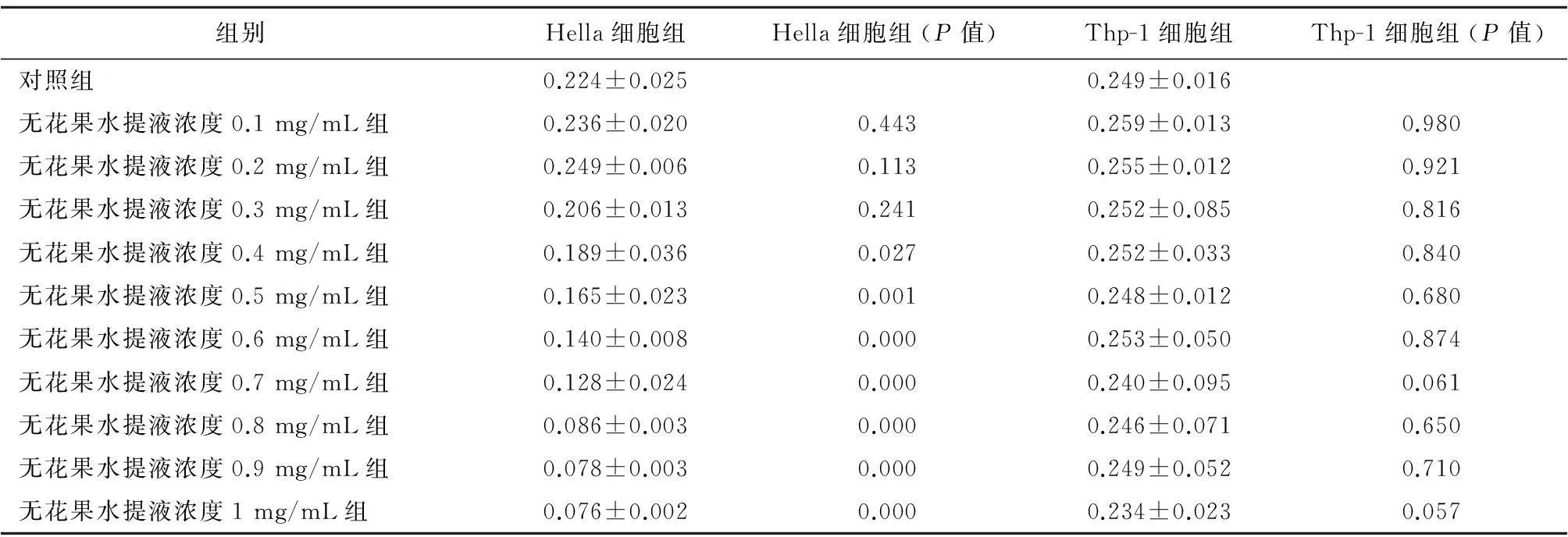
表1 无花果水提液对Hella细胞及Thp-1细胞增殖的影响(-x±s)
注: P值为与PBS对照组相比较。
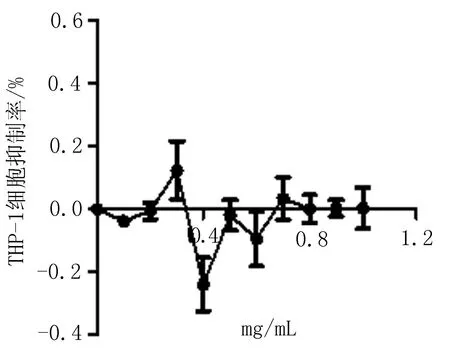
图1无花果提取液处理后Hella 细胞抑制率
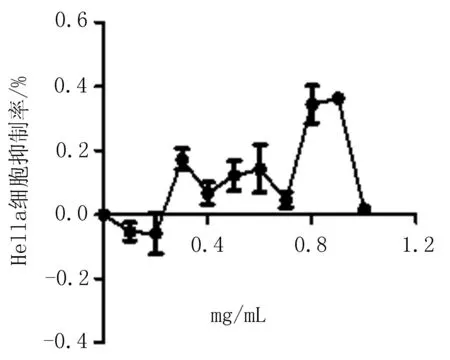
图2无花果提取液处理后Thp-1细胞抑制率

图3对照组用PBS处理24 h后 Hella细胞生长状态
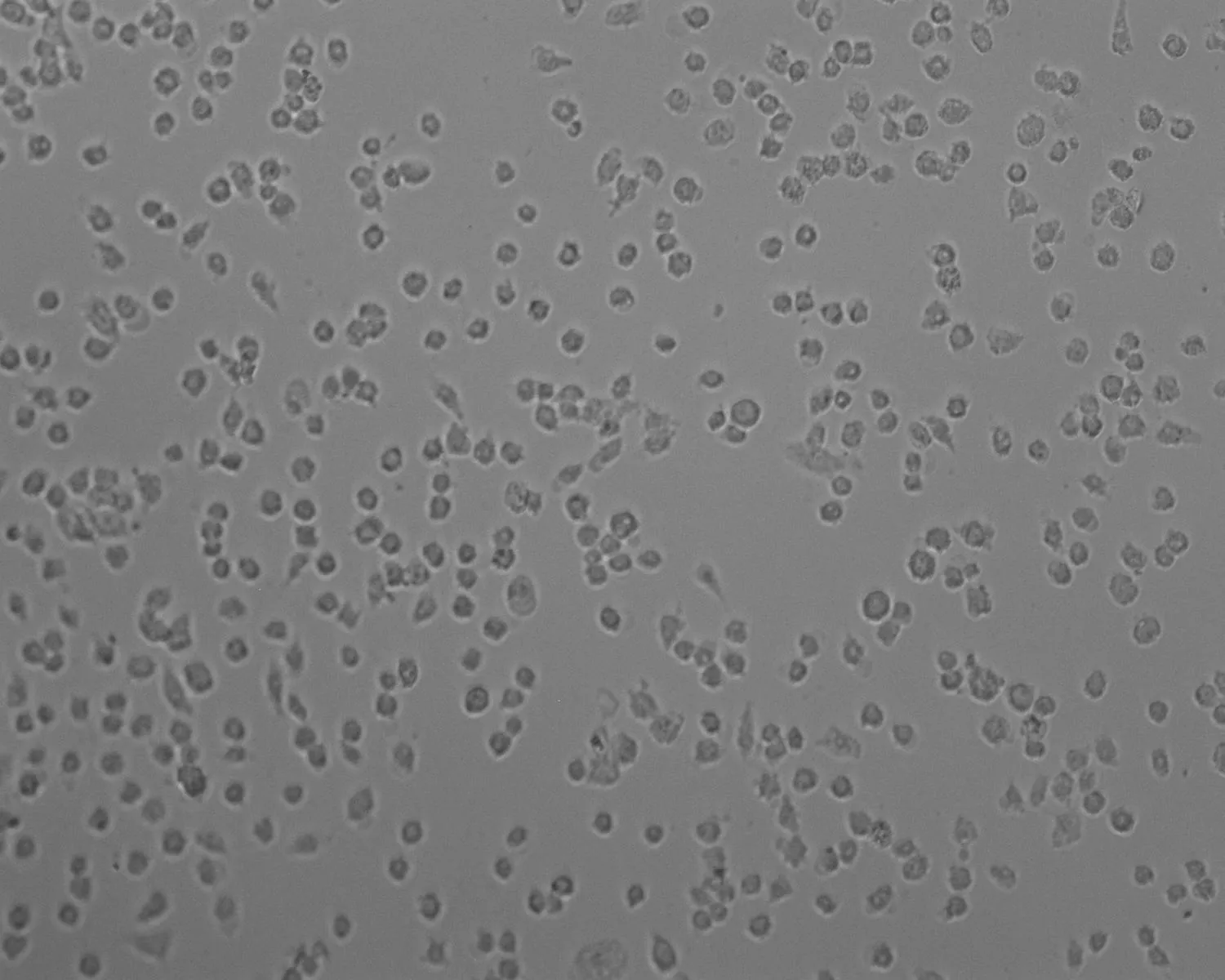
图4无花果水提液(0.9 mg/mL)处理24 h后Hella细胞生长状态

图5对照组用PBS处理24 h后 THP-1细胞生长状态

图6无花果水提液(0.9 mg/mL)处理24 h后Thp-1细胞生长状态
2.2不同浓度无花果水提液对Hella细胞凋亡的影响随着无花果水提液浓度的增加,凋亡细胞的数量逐渐增加(图7,右下象限代表凋亡的细胞)。
2.3无花果水提液抑制肝癌细胞增殖及抑制浓度的确定无花果水提液对人肝癌细胞和正常肝细胞的增殖均有抑制作用,随着剂量增加增殖抑制作用增强,呈剂量效应关系(P=0.006), 且浓度在0.06 g/mL时正常肝细胞以及肝癌细胞增值率的差异有统计学意义(P=0.021)(图8)。当无花果水提液剂量<0.08 g/mL时对正常肝细胞以及肝癌细胞形态无明显影响,当无花果水提液剂量>0.08 g/mL时Hepg2细胞变形固缩,失去正常形态(图9)。
2.4无花果水提液诱导细胞凋亡经各种浓度无花果水提液处理肝癌细胞后进行流式细胞仪检测,结果随着无花果水提液浓度的增加,凋亡细胞的数量逐渐增加(图10)。
3讨论
宫颈癌是全世界范围内妇科最常见的恶性肿瘤之一,且在发展中国家的发病率最高[8],是仅次于乳腺癌居第2位常见的恶性肿瘤。中国每年新增发病数超过13万,占女性生殖系统恶性肿瘤发病率的73%~93%。肝癌是第五大常见的恶性肿瘤,占肿瘤致死原因的第3位,其5年自然死亡率>95%。全球每年有超过50万人患有肝癌,其中一半以上在中国。如果能发现具有防癌抗癌作用的天然食材, 则对肿瘤防治有重要的科学意义和应用价值。
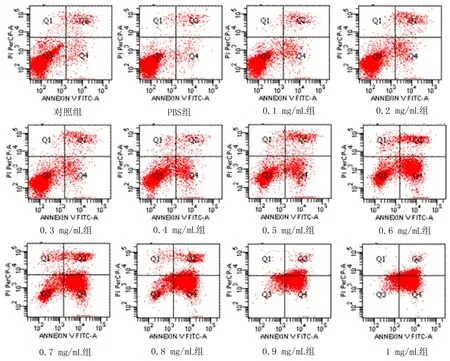
图7 Hella细胞凋亡检测
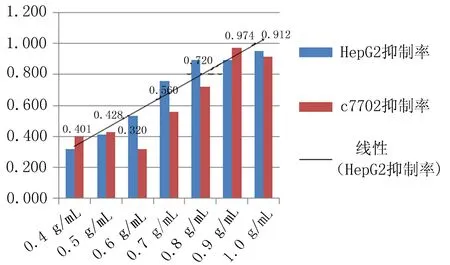
图8 不同剂量无花果水提液对HepG2细胞抑制率的影响
近年来,日本、法国、挪威和我国的科研人员相继开展了无花果抗癌防癌的现代研究,证实无花果含有多种抗癌活性物质,其中多酚类具有抗氧化、抗炎、抗过敏及抗癌等多种作用, 对13种癌细胞生长有明显抑制作用,能够有效阻止癌细胞蛋白质的合成,使其自然死亡[9]。本研究用不同浓度无花果提取液处理Hella细胞后发现,随着浓度的增加,Hella细胞的增殖明显受到抑制,细胞形态发生明显改变,细胞固缩,失去正常形态,但对Thp-1细胞增殖及形态无明显影响;通过流式细胞术检测发现随着无花果浓度的增加,细胞凋亡数量逐渐增加。同时发现无花果水提液对Hpg2细胞增殖有明显地抑制作用(P<0.05),并具有剂量效应关系,当剂量为0.06 g/mL时,抑制率>60%,剂量为0.1 g/mL时,可以完全抑制肿瘤细胞增殖,初步证实无花果水提液复合物对肿瘤细胞增殖具有抑制作用。同时观察到当无花果水提液剂量为0.01~0.07 g/mL时,对正常细胞增殖、凋亡及细胞周期无明显影响,但当剂量为>0.07 g/mL时,Hpg2细胞变固缩,失去正常细胞形态,此结果提示无花果水提液的毒性作用不容忽视。综上可见,无花果水提液对人肿瘤细胞的增殖有显著地抑制作用。其作用机理可能与抑制肿瘤细胞DNA合成、诱导细胞期凋亡有关[10],值得进一步深入研究。

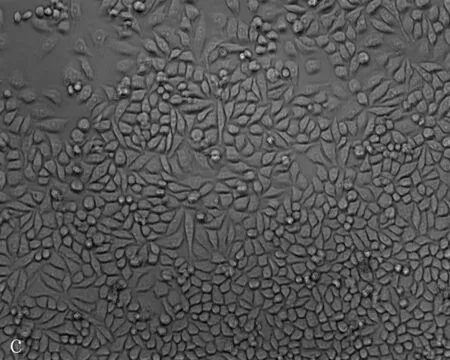

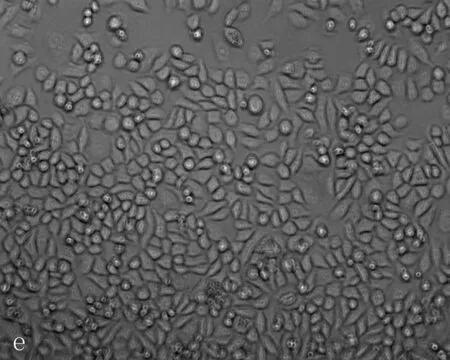
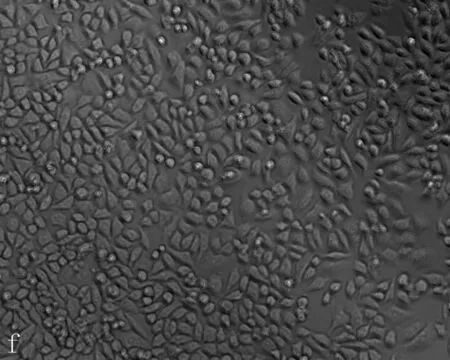
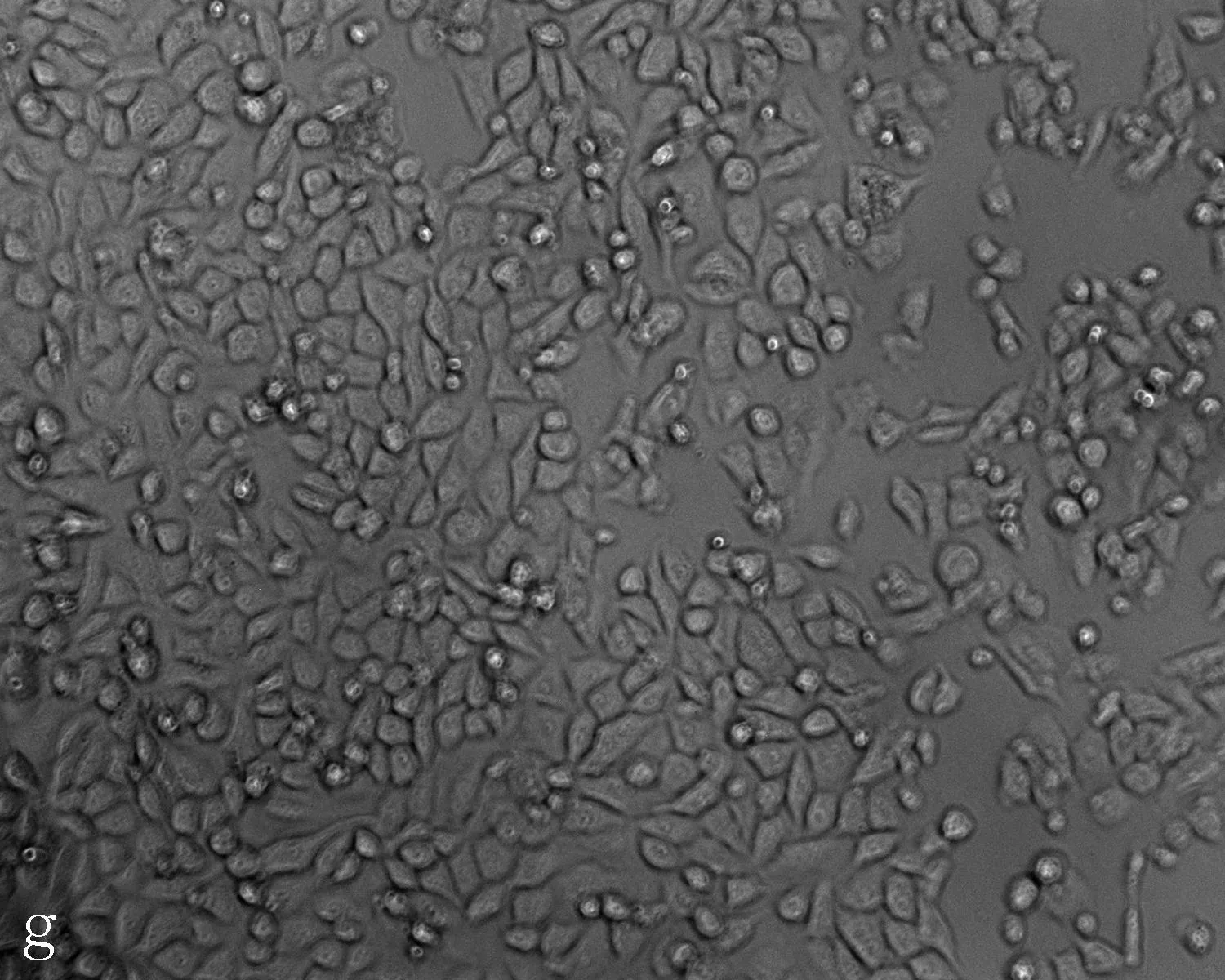
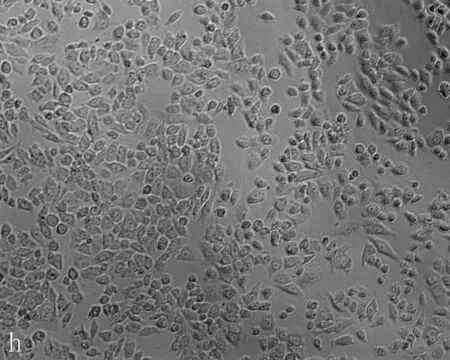
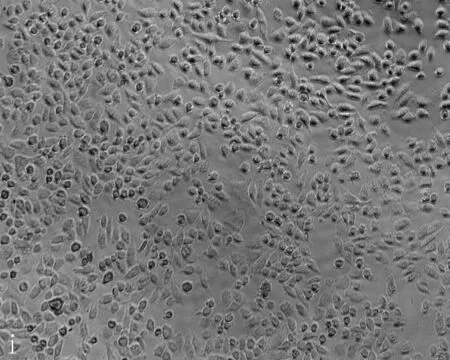
a: 对照组; b: PBS 组; c-i: 不同浓度的无花果水提液,浓度分别为0.04、0.05、0.06、0.07、0.08、0.09、0.1 g/mL
图9HepG2细胞经各浓度无花果水提液处理后的形态变化
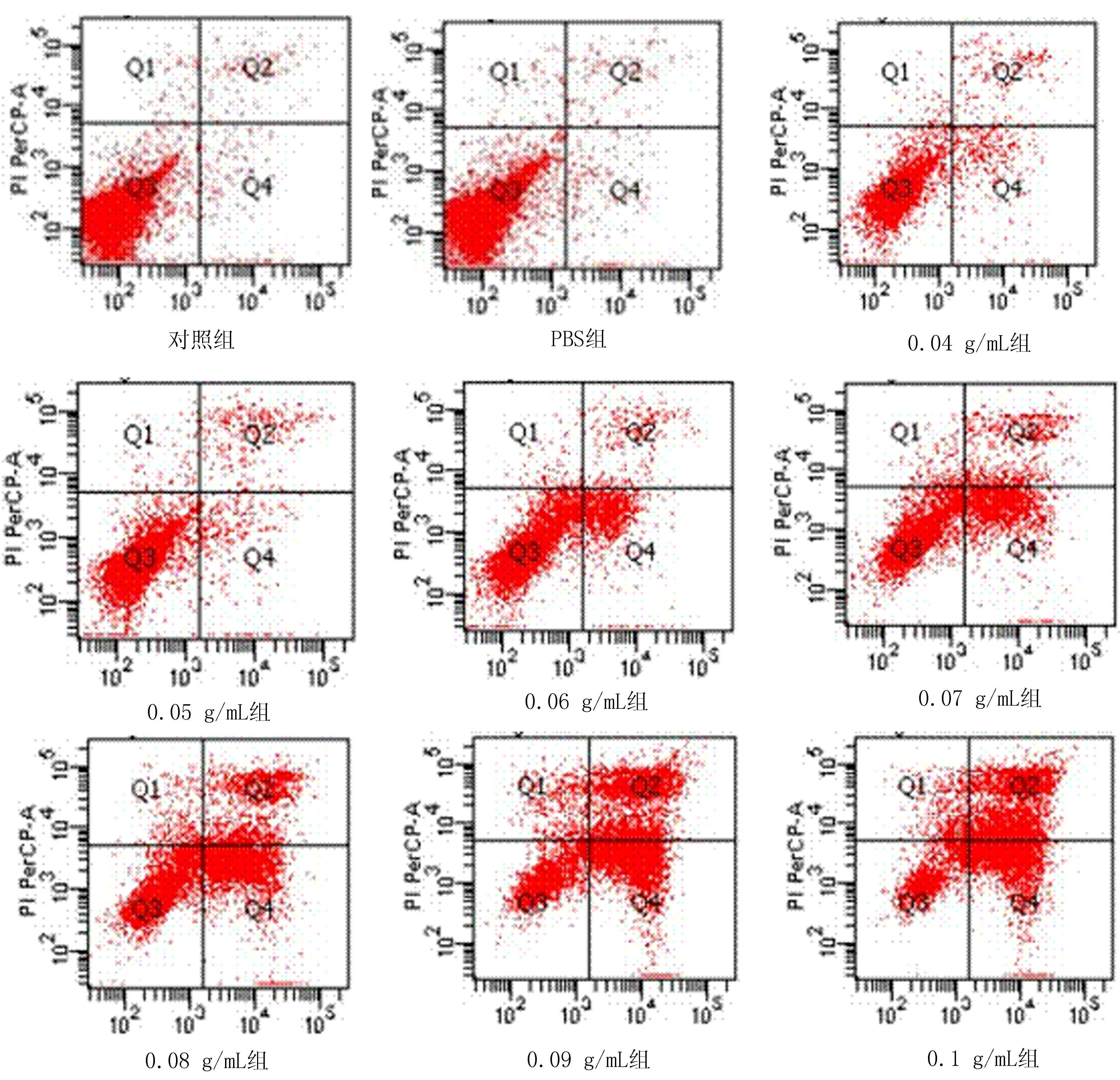
图10 流式细胞仪测不同浓度无花果水提液对HepG2细胞凋亡的影响
本研究结果进一步证实天然植物具有重要的抗肿瘤作用。无花果中含有多种不同生物活性的化学成分[11],且不同部位及不同的提取物[12]均具有一定抗癌活性及抗突变作用:无花果多糖口服可抑制小鼠肿瘤生长。也有研究报道,用无花果果浆(Fig fruit latex, FFL)处理体外培养的人肿瘤细胞,细胞增殖试验 (MTT法) 和克隆形成试验表明FFL对人肿瘤的增殖具有抑制作用[13]。尹卫平等[14]对无花果抗癌机理的研究结果表明,无花果所含苯甲醛是其抗癌的主要成分,香豆素类化合物和呋喃类小分子芳香物也有抗癌作用。本研究有待于从无花果水提液中分离出促进肿瘤细胞凋亡的有效生物学成分,并进一步明确其作用机制,为临床诊治提供理论依据。
参考文献:
[1]Lansky EP, Paavilainen HM, Pawlus AD, et al.Ficus spp. (fig): Ethnobotany and potential as anticancer and anti-inflammatory agents[J].Ethnopharmacology,2008,119(2):195-213.
[2]Veberic R, Colaric M, Stampar F. Phenolic acids and flavonoids of fig fruit (Ficus carica L.) in the northern Mediterranean region[J]. Food Chem ,2008,106(1):153-157.
[5]Vinson JA, Zubik L, Bose P, Samman N, et al. Dried fruits: excellent in vitro and in vivo antioxidants[J]. Am Coll Nutr,2005, 24(1):44-50.
[6]Wang YX, Zhang XL, Gao L, et al. Antitumor activity of ficus[J]. Cancer China,1990,9:223-225.
[7]Wang ZB, Ma HL, Study on anti-cancer components of fig residues with supper (sic) critical fluid CO2extracting technique[J]. Zhongguo Zhong Yao Za Zhi,2005,30(18):443-447.
[8]Parkin DM, Bray F, Ferlay J, et al Estimating the world cancer burden: Globocan 2000[J]. Int J Cancer, 2001, 94(2):153-156.
[9]Cushnie TP, Lamb AJ. Anti microbial activity of flavonoids[J].Antimicrob Agents,2005,26:343-356.
[10]Hashemi SA, Abediankenari S, Ghasemi M, et al. The effect of fig tree latex (ficus carica) on stomach cancer line[J]. Iran Red Crescent Med J, 2011, 13(4): 272-275.
[11]王钊, 林琳, 邹邦银, 等. 无花果不同部位中的营养成分分析[J].食品科学, 2002,23(9):135-137.
[12]Hussein A, Shugaev I. Phototoxic response to Ficus carica leaf and shoot saps[J]. Isr Med Assoc J, 2012, 14(6): 399-400.
[13]王静, 王修杰, 林苹, 等. 无花果果浆对肿瘤细胞增殖抑制和诱导凋亡作用[J]. 天然产物研究与开发, 2006,18(5):760-764.
[14]尹卫平,陈宏明,王天欣,等,无花果水提物抗肿瘤成分分析[J].新乡医学院学报,1995,12(4):316-320.
(本文编辑杨晨晨)
更正声明
《新疆医科大学学报》2015年12期第1542页《高b值扩散加权成像在早期缺血性脑梗死诊断中的应用价值》一文的作者简介:王俭更正为通信作者,特此更正。
Antiproliferation Activity of Water Extract from Ficus carica L. Fruit on Cervical cancer cell line
ZHOU Ning1, CHEN Jiangtao2, YU Wenyan3
(1DepartmentofGastroenterology,theAffiliatedTumorHospitalofXinjiangMedicalUniversity,
Urumuqi830011;2DepartmentofOrthopaedics,theFirstAffiliatedHospitalof
XinjiangMedicalUniversity,Urumuqi830054;3DepartmentofPathophysiology,
XinjiangMedicalUniversity,Urumqi830011,China)
Abstract:ObjectiveTo investigate the effect of fig water extract (WE) from Ficus carica L. fruit (FCLF) on the proliferation of different cancer cells and to elucidate the mechanism of its activity in vitro. Meth-odsTHP-1cell line were used as control group vs Hella cell as objective group, and 7702 cell line was used as the control group for the Hepg2 cell. The cells were treated with PBS and WE of FCLF respectively. Effects of different doses of WE of FCLF on cancer cell line were detected by MTT, changes of cell morphology were observed by immunofluorescence and cell apoptosis was measured by flow cytometry. ResultsThere was no obvious change in Thp-1 when treated with WE of FCLF. After treating with FCLF, the cell vitality of Hella cell line gradually reduced, while the cell apoptosis gradually increased and lost its normal form with pycnosis; the cell proliferation were inhibited both in Hepg2 and 7702 cell line with dose-effect relationship (P=0.006) and at 0.06 g/mL of FCLF, the inhibition was statistical significance (P=0.021); the Hepg2 Cell apoptosis increases gradually. At above of 0.08 g/mL of WE of FCLF, the Hepg2 cell showed deformation and pycnosis, while at <0.08 g/mL, there were no obvious changes of cellular morphology both in Hepg2 cell line and 7702 cell line. ConclusionThe WE of FCLF can inhibit the proliferation of different cancer cell line mainly through affecting the cell apoptosis.
Keywords:Ficus carica; cervical cancer cell line; hepatocellular carcinoma; cell apoptosis
通信作者:张巍,女,博士,主任医师,博士生导师,研究方向:肿瘤分子病理学,E-mail:zwyhr100@163.com。
作者简介:宋艳艳(1988-),女,在读硕士,研究方向:肿瘤病理诊断。
基金项目:新疆维吾尔自治区自然科学基金(2014211C049)
[收稿日期:2015-06-16]
doi:10.3969/j.issn.1009-5551.2016.01.009
中图分类号:R363.2
文献标识码:A
文章编号:1009-5551(2016)01-0042-06

