亚砷酸钠对人胚肺成纤维细胞氧化应激与细胞增殖的影响
董娟娟, 孙高峰, 谢惠芳
(1新疆医科大学公共卫生学院, 乌鲁木齐 830011;2新疆乌鲁木齐市疾病预防控制中心, 乌鲁木齐 830000)
亚砷酸钠对人胚肺成纤维细胞氧化应激与细胞增殖的影响
董娟娟1, 孙高峰2, 谢惠芳1
(1新疆医科大学公共卫生学院, 乌鲁木齐830011;2新疆乌鲁木齐市疾病预防控制中心, 乌鲁木齐830000)
摘要:目的探讨亚砷酸钠(NaAsO2)对人胚肺成纤维细胞(HELF)氧化应激与细胞增殖的影响。方法分别将含0.0、10.0、20.0、30.0 μmol/L的NaAsO2染毒HELF细胞 24、48、72 h,观察细胞形态学变化,检测NaAsO2对HELF细胞增殖活力和超氧化物歧化酶(SOD)、还原性谷胱甘肽过氧化物酶(GSH-PX)活性及丙二醛(MDA)含量的影响。其中0.0 μmol/L的NaAsO2组为对照组,10.0、20.0、30.0 μmol/L的NaAsO2组为实验组。结果与对照组相比,各浓度NaAsO2染毒24、48、72 h后细胞抑制率均升高,差异有统计学意义(P<0.05)。HELF细胞抑制率与NaAsO2浓度和作用时间均呈正相关(P<0.05)。SOD和GSH-PX活性均随NaAsO2染毒剂量升高而降低,随染毒时间延长而降低,各剂量组与对照组相比差异有统计学意义(P<0.01),且都存在剂量-时间交互作用(P<0.01)。与对照组相比,各剂量组MDA含量随NaAsO2染毒剂量升高而升高,随染毒时间延长而升高,差异有统计学意义(P<0.01),存在剂量-时间交互作用(P<0.01)。结论NaAsO2可降低HELF细胞增殖活力,降低HELF细胞SOD和GSH-PX活性,抗氧化作用减弱,使氧化代谢产物MDA含量升高。
关键词:亚砷酸钠; 人胚肺成纤维细胞; 细胞活力; 氧化应激
长期砷暴露能导致肝、肾、肺等多器官损害,并可引发多种疾病[1]。氧化应激反应增强一直被认为是砷化物致机体损伤的机制之一。超氧化物歧化酶(Superoxide dismutase,SOD)活性、还原性谷胱甘肽过氧化物酶(Reducing glutathione peroxidase,GSH-PX)活性、丙二醛(Malondialdehyde,MDA)含量是反映机体氧化应激的常用指标。人胚肺成纤维细胞(Human embryonic lung fibroblast,HELF)易于培养[2],是进行亚砷酸钠(NaAsO2)对肺组织作用效应体外实验研究的主要细胞系之一[3]。研究表明NaAsO2可引起细胞增殖降低而凋亡升高[4],10.40 μmol/L的NaAsO2处理人体细胞24 h后即可产生细胞凋亡[5]。为进一步研究NaAsO2对HELF细胞氧化损伤的作用机制,本研究使用0.0、10.0、20.0、30.0 μmol/LNaAsO2对HELF细胞进行染毒,分析其对细胞形态、细胞增殖活力、抗氧化酶SOD、GSH-PX活性及氧化代谢产物MDA含量的影响,为探讨砷致肺损伤的分子机制提供一定的理论依据。
1材料与方法
1.1试剂与仪器亚砷酸钠(NaAsO2,湖南衡阳凤凰化学工业厂),DMEM高糖培养基、PBS中性磷酸缓冲液、青霉素钠、硫酸链霉素(美国Hlyclone公司),胰蛋白酶、EDTA(美国Amresco公司),胎牛血清(以色列Biological Industries公司),噻唑蓝(美国Sigma公司),超氧化物歧化酶(SOD)WST-1法测定试剂盒、谷胱甘肽过氧化物酶(GSH-PX)测试盒、丙二醛(MDA)测试盒、BCA法蛋白定量试剂盒(南京建成生物工程研究所)。
ZHJH-1214C型超净工作台(上海智诚分析仪器制造有限公司),IX71-12FL/PH 型倒置荧光研究级三目显微镜(日本奥林巴斯公司),Benchmark Plus全波长自动酶标仪(上海新振仪器设备有限公司),BP211D型电子分析天平(美国Sartorius公司),800DH (3543IR)型二氧化碳恒温培养箱(美国热电公司),MLS-3750型高压灭菌器(日本三洋公司),SCIENTZ-950E型触摸式超声波细胞粉碎仪(宁波新芝生物科技股份有限公司),MILLI-QBIOCEI型超纯水系统(美国Millipore公司)。
1.2细胞培养及处理HELF细胞(南京凯基生物科技发展有限公司),接种于DMEM培养液(含体积分数为10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素)中,于37℃、5%CO2培养箱中培养。用0.05%胰蛋白酶消化传代,待细胞进入对数生长期、细胞融合率达70%~80%时,分别用含 0.0、5.0、10.0、15.0、20.0、25.0、30.0、35.0、40.0、45.0、50.0、55.0、60.0 μmol/L的NaAsO2培养液处理HELF细胞24、48、72 h,测得24、48、72 h的IC50分别为51.8、48.0、40.0 μmol/L,结合后期试验需求选择低于40.0 μmol/L的NaAsO2浓度作为染毒剂量。故选取0.0 μmol/L的NaAsO2组为对照组,10.0、20.0、30.0 μmol/L的 NaAsO2组为实验组,培养24、48、72 h,分别收集细胞或培养液进行检测。
1.3细胞形态的观察调整HELF细胞密度为1×105个/mL,接种于6孔板上,每孔1 mL,细胞贴壁48 h后加入含0.0(对照)、10.0、20.0、30.0 μmol/L NaAsO2的DMEM高糖培养基,分别作用24、48、72 h后使用荧光倒置显微镜观察并拍照(20×10倍)。
1.4细胞增殖活力的测定调整HELF细胞密度为1×105个/mL,接种于96孔板上,每孔100 μL,细胞贴壁48 h后加入含0.0(对照)、10.0、20.0、30.0 μmol/L NaAsO2的DMEM高糖培养基作用至染毒终点,每个样本平行做5孔。每孔加入含0.5 mg/mL的MTT溶液10 μL;继续在培养箱中孵育4 h,弃去培养液,加入150 μL的二甲基亚砜(DMSO)作用10 min,用全自动酶标仪于490 nm波长处测定光密度(OD)值,并计算细胞抑制率[抑制率=(对照组OD值-实验组OD值)/对照组OD值×100%]。
1.5细胞GSH-PX活性、SOD活性、MDA含量测定将HELF细胞以3×106个/mL的密度接种于25 mL的培养瓶内,加入浓度为0.0、10.0、20.0、30.0 μmol/L的NaAsO2,分别染毒24、48、72 h,每个样本平行做3瓶。收集细胞和培养上清,BCA法测定总蛋白质浓度,硫代巴妥酸法(TBA)测定MDA含量,二硫代二硝基苯甲酸比色法测定GSH-PX活性;取培养液上清,黄嘌呤氧化酶法测定SOD活性,均按试剂盒说明书操作。
1.6统计学处理使用SPSS17.0软件进行统计学分析,计量数据以均数±标准差(-x±s)表示,采用重复测量方差分析,进一步进行组间两两比较时,采用SNK法检验。浓度与抑制率关联分析采用多重线性回归分析,检验水准α=0.05。
2结果
2.1细胞形态学变化对照组HELF细胞生长状态良好,呈长梭状,扁平,两角或多角形,胞质近中央有一个较清晰的细胞核呈圆形,细胞形态基本一致,界限清晰, 细胞间连接紧密。随着培养时间的延长,细胞排列逐渐密集并可见正常代谢老化死亡的细胞(图1A、图2A、图3A);随着染毒剂量加大和染毒时间延长,细胞生长密集度逐渐降低,老化凋亡的细胞逐渐增多(图1B~D、图2B~D、图3B~D)。其中染毒48 h后,30.0 μmol/L NaAsO2染毒组大部分细胞体积变小,收缩变形,细胞间正常的紧密连接消失,细胞排列稀疏凌乱(图2D)。染毒72 h后,30.0 μmol/L NaAsO2染毒组细胞较48 h、30.0 μmol/L NaAsO2染毒组细胞进一步收缩变形、变小,间隙大,部分细胞膜破裂,可见大量细胞死亡(图3D)。
2.2不同浓度NaAsO2染毒HELF细胞不同时间对细胞抑制率的影响与对照组相比,实验组作用24、48、72 h后,细胞抑制率随染毒时间延长而升高,差异有统计学意义(P<0.05)。HELF抑制率与NaAsO2浓度呈正相关(r=0.934,P<0.05)。HELF抑制率与NaAsO2作用时间和浓度的交互作用也呈正相关(r=0.963,P<0.05),见表1。

A:对照组
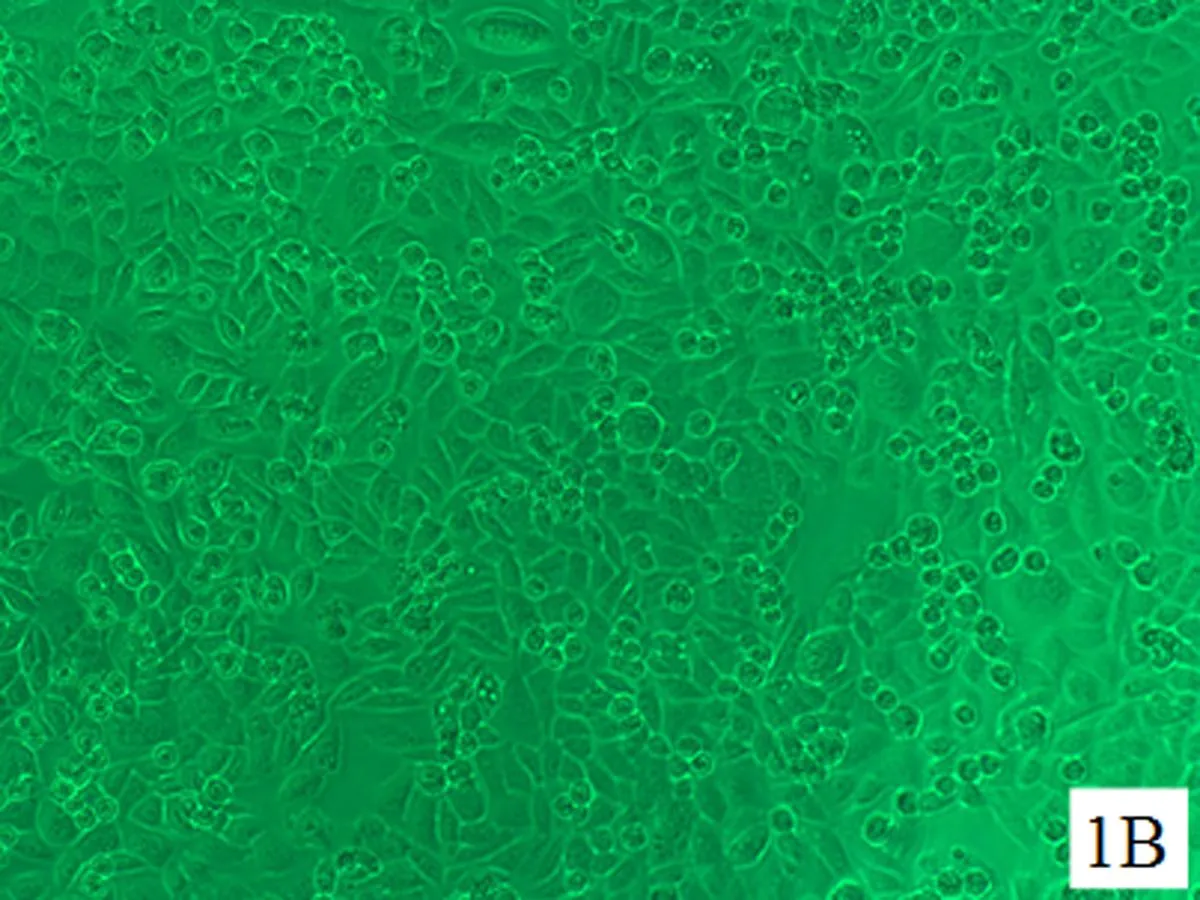
B: 10.0 μmol/L NaAsO2染毒组
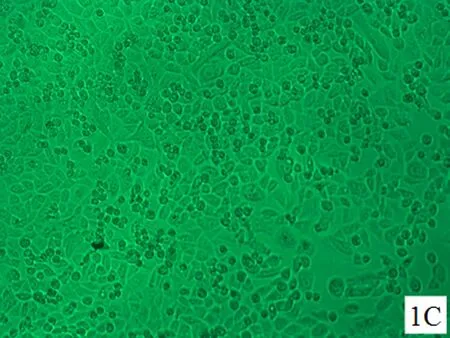
C: 20.0 μmol/L NaAsO2染毒组
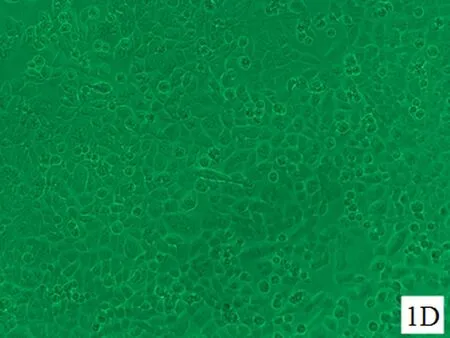
D: 30.0 μmol/L NaAsO2染毒组
图1亚砷酸钠染毒24 h后HELF细胞的形态(×200)

A:对照组

B: 10.0 μmol/L NaAsO
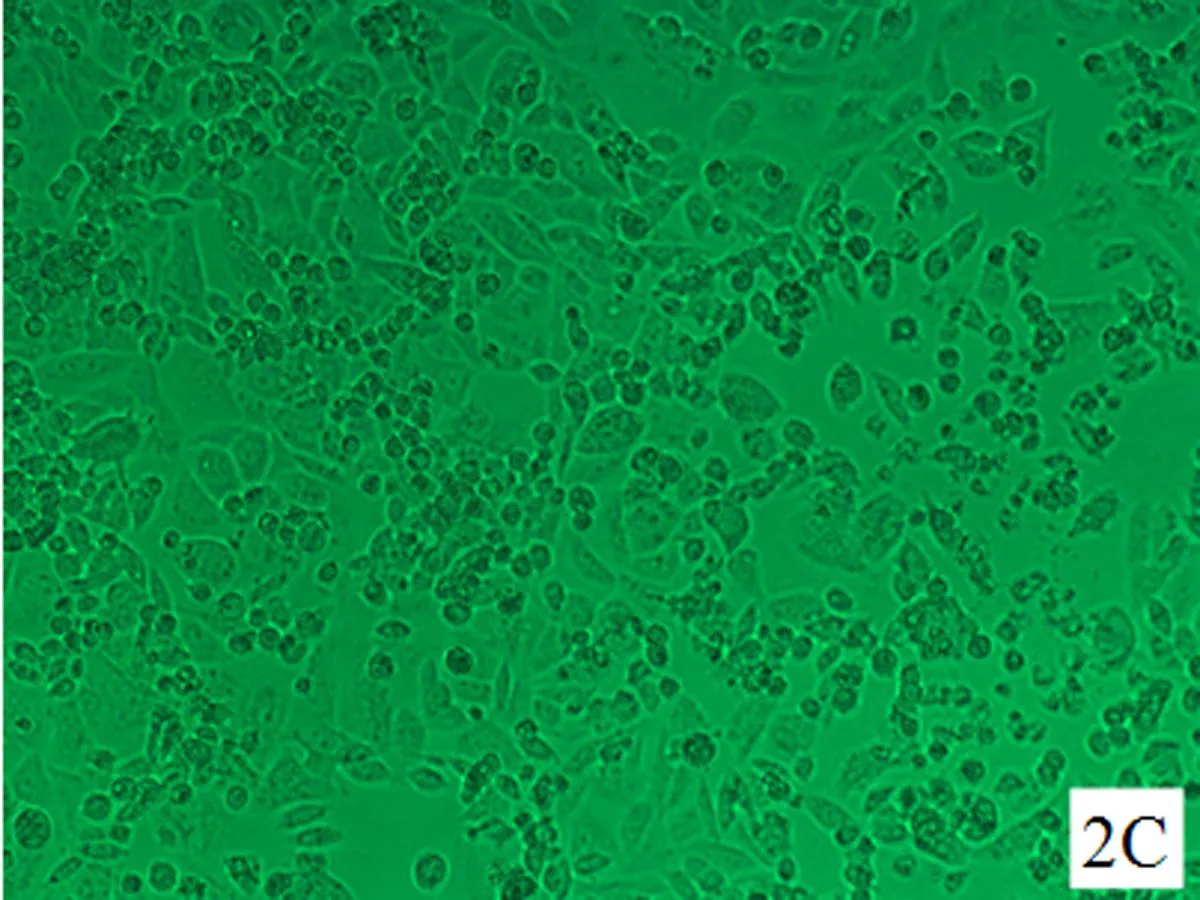
C: 20.0 μmol/L NaAsO2染毒组

D: 30.0 μmol/L NaAsO2染毒组
图2亚砷酸钠染毒48 h后HELF细胞的形态(×200)

A:对照组

B: 10.0 μmol/L NaAsO2染毒组

C: 20.0 μmol/L NaAsO2染毒组

D: 30.0 μmol/L NaAsO2染毒组
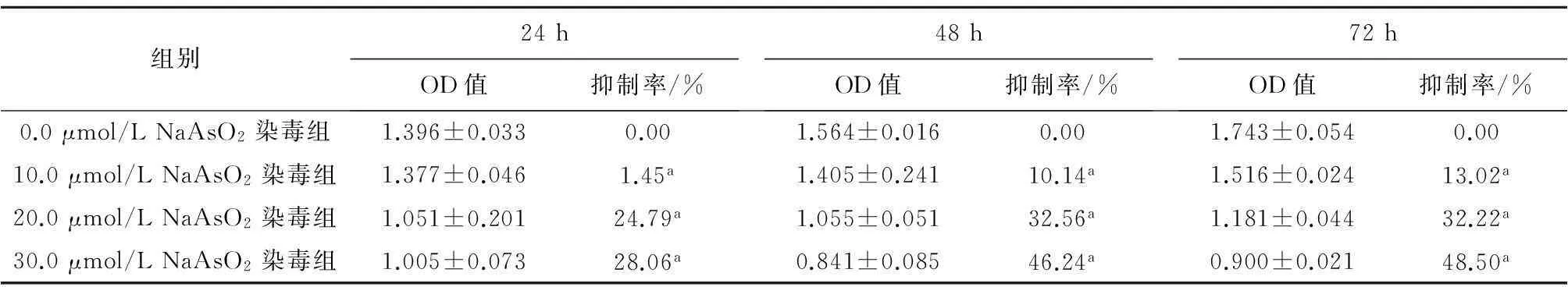
图3 亚砷酸钠染毒72 h后HELF细胞的形态(×200)
注:组内与对照(0.0 μmol/L)比较,aP<0.05,组间两两比较,aP<0.05。
2.3不同浓度NaAsO2染毒HELF细胞不同时间SOD活性、GSH-PX活性、MDA含量变化SOD活性随NaAsO2染毒剂量升高而降低,实验组与对照组相比差异有统计学意义(F=450.778,P<0.01)。SOD活性随NaAsO2作用时间延长而降低,实验组与对照组相比差异有统计学意义(F=3401.813,P<0.01)。实验组SOD活性存在剂量-时间交互作用(F=93.478,P<0.01)。GSH-PX活性亦随NaAsO2染毒剂量升高而降低(F=244.359,P<0.01),随NaAsO2作用时间延长而降低(F=79.295,P<0.01),实验组GSH-PX活性存在剂量-时间交互作用(F=15.689,P<0.01)。MDA含量与对照组相比,随NaAsO2染毒剂量升高而升高,差异有统计学意义(F=105.383,P<0.01);随NaAsO2作用时间延长而升高,差异有统计学意义(F=1338.288,P<0.01);实验组MDA含量存在剂量-时间交互作用(F=10.628,P<0.01),见表2。

表2 NaAsO2染毒HELF对GSH-PX、SOD活性和MDA含量影响(n=3, -x±s)
注:组内与对照(0.0 μmol/L)比较,aP<0.01; 组间两两比较,aP<0.01。
3讨论
砷是一种广泛存在于自然界中的类金属特性的元素,可以通过污染水和空气而导致多种疾病。肺作为砷毒性作用和致癌作用的靶器官之一,长期的砷暴露会导致肺损伤甚至引发肺癌。国外学者在对儿童进行肺功能评价时发现胚胎期或婴幼儿早期发生砷暴露的个体,用力肺活量减少,肺功能相较非暴露儿童差[6]。Chen等[7]发现肺癌发病风险(RR)与砷暴露浓度存在一定剂量反应关系。因此研究砷致肺损伤的分子机制对于砷暴露相关肺疾病的防治具有十分重要的意义。
近年的实验研究发现,砷通过引发氧化应激,可进一步造成机体内多种细胞和分子通路的变化,包括信号通路的异常、抗氧化物酶活性的改变、机体自身抗氧化防御系统功能的降低等[8]。SOD作为重要的抗氧化酶,能清除多余的自由基;GSH-PX作为机体内能使过氧化物分解的酶,可使有毒的过氧化物还原成无毒的羟基化合物;MDA是自由基作用于脂质发生过氧化反应的氧化终产物[9]。SOD、GSH-PX和MDA的异常变化,能较客观地反映HELF细胞是否受到氧化损伤[10]。本研究结果显示抗氧化酶SOD、GSH-PX活性和氧化产物MDA含量受NaAsO2染毒浓度和染毒时间的双重影响。实验组HELF细胞在10.0、20.0、30 μmol/L的NaAsO2分别作用24、48、72 h后,GSH-PX活性低于0.0 μmol/LNaAsO2的对照组(P<0.01)。GSH-PX活性的降低可能是砷与其活性中心发生氧化反应所致,也可能由于砷与该酶的底物-GSH结合而使其大量消耗所致[11]。本研究结果显示实验组SOD活性在NaAsO2作用24、48、72 h后,低于对照组(P<0.01),而MDA含量高于对照组(P<0.01)。SOD是含有二硫键的巯基酶,其活性降低可能是砷进入机体后,与二硫键结合,使含有巯基的酶受到破坏;SOD减少,机体自由基清除能力下降,脂质过氧化反应的持续进行,可进一步导致SOD的大量消耗,脂质过氧化产物MDA的大量堆积[12]。这3项指标的变化,表明了HELF细胞在受到NaAsO2刺激时,HELF细胞的氧化应激损伤作用增强。
砷诱导的氧化应激损伤也可进一步导致细胞增殖受到抑制[13]。Jiang等[14]研究发现三价砷诱导的人支气管上皮细胞内GSH平衡紊乱,细胞增殖受到抑制;Han等[15]在对人肺退行性癌细胞(Calu-6)的研究中发现三氧化二砷可通过降低GSH的活性,诱导细胞凋亡,并且细胞内铜锌超氧化物歧化酶(CuZn-SOD)的活性也显著降低。本研究使用亚砷酸钠(≥10.0 μmol/L)染毒HELF细胞,结果显示细胞抑制率与染毒浓度和作用时间均呈正相关,并且HELF细胞形态也随着染毒剂量和染毒时间的加大发生异常的变化。此研究结果与杨萍等[16]研究发现5.0、10.0 μmol/L的NaAsO2致HELF的增殖率低于对照组的结论也相似。这可能与砷诱导细胞氧化损伤产生的某些氧化性物质激活了某细胞信号通路,致使调控细胞生长的基因表达异常所致。如Ling等[17]研究发现慢性砷暴露诱导HELF细胞产生的活性氧可以激活通过ERK/NF-κB信号通路来促进肿瘤的发生和进展[18]。另外,砷化物本身可以作为一种刺激因素,激活某些细胞信号通路,如尹仕伟等[19]研究发现砷化物处理HELF细胞能使JNK信号通路产生剂量依赖性地激活(磷酸化),使HELF发生凋亡。
结合本研究结果可以认为,亚砷酸钠能扰乱人胚肺成纤维细胞的氧化/抗氧化平衡,使HELF细胞失去正常生长的形态,增殖受到抑制,抗氧化酶SOD、GSH-PX活性下降,脂质过氧化产物MDA含量上升,但砷致细胞氧化损伤及增殖抑制的具体机制尚需进一步研究。
参考文献:
[1]WHO.Exposure to arsenic:a major health concern[R].Geneva:WHO,2010:1.
[2]刘玉琴.细胞培养实验手册[M].北京:人民军医出版社,2009:170.
[3]何晓庆.JNK与ERK1/2信号通路在亚砷酸钠所致人胚肺成纤维细胞兴奋效应中的作用[D]. 南京医科大学,2007.
[4]田凤契,徐媛,高向东,等.亚砷酸钠对大鼠外周血淋巴细胞DNA损伤的研究[J].中国地方病学杂志,2011,30(1):13-15.
[5]Benhusein G, Mutch E, Williams FM. Effect of arsenic on DNA damage, glutathione content,apoptosis and necrosis in HaCat cells[J].Toxicology,2007,231:116-117.
[6]Recio-Vega R,Gonzalez-Cortes T,Olivas-Calderon E,et al.In utero and early childhood exposure to arsenic decreases lung function in children[J]. J Appl Toxicol,2015, 35(4):358-366.
[7]Chen CL,Chiou HY,Hsu LI,et al.Ingested arsenic,characteristics of well water consumption and risk of different histological types of lung cancer in northeastern Taiwan[J]. Environmental Res,2010,110(5):455-462.
[8]Flora SJ.Arsenic-induced oxidative stress and its reversibility[J].Free Radic Biol Med,2011,51(2):257-281.
[9]Nourazarian AR,Kangari P,Salmaninejad A.Roles of oxidative stress in the development and progression of breast cancer[J].Asian Pac J Cancer Prev,2014,15(12):4745-4751.
[10]Hashmi MZ,Khan KY,Hu J,et al.Hormetic effects of noncoplanar PCB exposed to human lung fibroblast cells (HELF) and possible role of oxidative stress[J].Environ Toxicol,2015, 30(12):1385-1392.
[11]You BR, Park WH. Arsenic trioxide induces human pulmonary fibroblast cell death via increasing ROS levels and GSH depletion[J].Oncol Rep,2012,28(2):749-757.
[12]梅树珍,李智文,刘爱萍.慢性砷中毒患者体内超氧化物歧化酶和丙二醛含量分析[J].中国地方病学杂志,2002,1(3):232.
[13]Park WH.MAPK inhibitors and siRNAs differentially affect cell death and ROS levels in arsenic trioxide-treated human pulmonary fibroblast cells [J].Oncol Rep,2012,27(5):1611-1618.
[14]Jiang X, Chen C, Liu Y, et al. Critical role of cellular glutathione homeostasis for trivalent inorganic arsenite-induced oxidative damage in human bronchial epithelial cells[J].Mutat Res Genet Toxicol Environ Mutagen,2014,770(8):35-45.
[15]Han YH, Kim SH, Kim SZ, et al. Apoptosis in arsenic trioxide-treated Calu-6 lung cells is correlated with the depletion of GSH levels rather than the changes of ROS levels[J].J Cell Biochem,2008,104(3):862-878.
[16]杨萍,刘起晨,李爱萍.亚砷酸钠所致人胚肺成纤维细胞增殖兴奋效应与氧化应激的关系[J].中华劳动卫生职业病杂志,2006,24(2):103-105.
[17]Ling M, Li Y, Xu Y, et al. Regulation of miRNA-21 by reactive oxygen species-activated ERK/NF-κB in arsenite-induced cell transformation[J]. Free Radic Biol Med,2012,52(9):1508-1518.
[18]闫雍容,周序珑,夏明汗,等.TGF-β1与乳腺癌中microRNA-21表达的关系[J].暨南大学学报, 2011,32(2):176-180.
[19]尹仕伟,徐辉,彭雷,等.JNK信号通路在二甲基胂酸所致人胚肺成纤维细胞DNA损伤和凋亡中的作用[J].环境与职业医学,2008,25(2):132-136.
(本文编辑张巧莲)
Effects of NaAsO2on oxidative stress and cell proliferation in
human embryonic lung fibroblast
DONG Juanjuan1, SUN Gaofeng2, XIE Huifang1
(1SchoolofPublicHealth,XinjiangMedicalUniversity,Urumqi830011,China;
2UrumqiDiseaseControlandPreventionCenter,Urumqi830000,China)
Abstract:ObjectiveTo discuss effects of NaAsO2on oxidative stress and cell proliferation in human embryonic lung fibroblast (HELF). MethodsHELF were contaminated by NaAsO2of 10.0, 20.0 and 30.0 μmol/L which were the experimental groups for 24, 48 and 72 hours, respectively. The cell proliferation activity, the activity of Superoxide dismutase (SOD), the activity of Reducing glutathione peroxidase (GSH-PX), and the content of Malondialdehyde (MDA) were measured. ResultsCompared with the control group, after 24, 48 and 72 hours of contamination with NaAsO2at the three exposed doses, cell inhibition rates increased significantly dose-dependently and time-dependently (P<0.05). SOD and GSH-PX in all experimental groups decreased in dose-dependent way (P<0.05), while MDA in all groups increased significantly in dose-dependent way (P<0.01). And the 3 indexes all were in time-dependent interaction (P<0.01). ConclusionNaAsO2could reduce HELF proliferation activity and maybe exert antioxidant effect through regulating the 3 indexes.
Keywords:NaAsO2; human embryonic lung fibroblast; cell proliferation activity; oxidative stress
通信作者:王俭,女,教授,主任医师,博士生导师,研究方向:中枢神经系统肿瘤与肉芽肿影像诊断,E-mail: jeanw1265@sina.com。
作者简介:徐虓(1974-),男,博士,副教授,副主任医师,研究方向:乳腺癌、甲状腺癌分子致病机制及应对策略,E-mail:329590035@qq.com。 陈乐(1981-),男,在读硕士,研究方向:分子影像学与中枢神经系统影像诊断。
基金项目:新疆维吾尔自治区自然科学基金(2013211A069) 新疆医科大学第一附属医院干细胞基金(20091GXB-10)
[收稿日期:2015-07-06]
doi:10.3969/j.issn.1009-5551.2016.01.006
中图分类号:R994.6
文献标识码:A
文章编号:1009-5551(2016)01-0028-05

