新疆哈萨克族及汉族食管鳞状细胞癌组织中CtBP1、CyclinD1的表达及意义
李梦妍, 王 慧, 马遇庆
(1新疆医科大学第一附属医院病理科, 乌鲁木齐 830054;2新疆油田公司准东采油厂职工医院病理室, 新疆 阜康 831511)
新疆哈萨克族及汉族食管鳞状细胞癌组织中CtBP1、CyclinD1的表达及意义
李梦妍1,2, 王慧1, 马遇庆1
(1新疆医科大学第一附属医院病理科, 乌鲁木齐830054;2新疆油田公司准东采油厂职工医院病理室, 新疆阜康831511)
摘要:目的探讨新疆哈萨克族及汉族食管鳞状细胞癌组织中 CtBP1与CyclinD1蛋白的表达情况及其与临床病理参数的关系。 方法应用免疫组化法检测125例食管鳞状细胞癌组织及其癌旁正常组织中CtBP1、Cyclin D1的表达。结果(1)哈萨克族及汉族食管鳞状细胞癌均多见于中老年人,食管鳞状细胞癌好发于中下端。(2)CyclinD1阳性染色细胞主要分布于肿瘤组织细胞核中,CyclinD1在食管鳞状细胞癌组织的阳性表达率(50.4%)显著高于癌旁正常组织的阳性表达率(20%)(P<0.01);而CtBP1在癌旁正常鳞状上皮的阳性表达率(88 %)高于食管鳞状细胞癌组织的阳性表达率(66.4%),差异有统计学意义(P<0.01)。(3)哈萨克族食管鳞状细胞癌组织中CyclinD1阳性表达率(65%)高于汉族食管鳞状细胞癌组织的阳性表达率(36.9%),差异有统计学意义(P=0.02);(4)在哈萨克族食管鳞状细胞癌组织中,肿瘤直径≥3 cm和<3 cm者CtBP1的表达差异有统计学意义(P=0.037),同时在不同肿物类型中CtBP1的差异有统计学意义(P=0.02);在汉族食管鳞状细胞癌组织中,CtBP1的阳性表达在不同性别、不同年龄组、肿瘤部位、肿瘤大小、大体类型、浸润深度、分化程度、淋巴结转移、血管侵犯、神经侵犯等临床指标差异均无统计学意义(P>0.05)。CtBP1和CyclinD1在食管鳞癌组织的表达呈正相关。结论Cyclin D1、CtBP1可能在哈萨克族食管鳞状细胞癌的发展中发挥着重要作用,二者联合检测可能对哈萨克族与汉族食管鳞状细胞癌的诊治具有指导意义。
关键词:食管鳞状细胞癌; CtBP1; Cyclin D1; 免疫组织化学
食管癌是常见的消化道恶性肿瘤,我国男、女性食管癌发病率和病死率均居全球首位[1]。不同人群、种族间食管癌的发病及部分生物学特性也存在一定的差异。新疆作为多民族聚集地,是我国食管癌的高发地,哈萨克族食管癌的发病率高于其他民族。Cyclin D1是重要的细胞周期调节蛋白,其过度表达可促使细胞持续增殖,并可能导致细胞发生恶性转化,多种肿瘤如乳腺癌、肝癌、结直肠癌、喉癌等均发现了Cyclin D1的高表达[2-4]。CtBP1是一种转录辅抑制因子,可以促进细胞的增殖,具有抑制多种抑癌基因、激活癌基因的作用,参与肿瘤的发生、发展及转移等[5-6]。Wnt 信号转导通路是一条高度保守的对细胞的分化、迁移、增殖有着重要作用的信号通路,CtBP1与Cyclin D1分别处于Wnt 通路的中、下游,故探讨CtBP1与Cyclin D1是否存在相互影响的关系显得尤为重要。本研究通过检测新疆地区哈萨克族与汉族食管鳞状细胞癌组织中CtBP1及Cyclin D1的表达情况,并分析CtBP1及Cyclin D1是否存在民族差异。
1资料与方法
1.1一般资料收集新疆医科大学第一附属医院2007-2014年经病理组织学和免疫组织化学确诊为食管鳞状细胞癌标本共125例。所有病人均无术前相关化疗或者放疗病史,其中哈萨克族患者癌组织60例、癌旁正常组织60例,汉族患者癌组织65例、癌旁正常组织65例。患者年龄38~84岁,平均年龄62.39岁。标本均经4%中性甲醛固定,常规石蜡包埋,全部重新制作HE切片。
1.2试剂CtBP1浓缩型兔抗人多克隆抗体(abcam公司,NO.ab79417,USA ),CyclinD1浓缩型兔抗人单克隆抗体 (abcam公司,NO.ab16663,USA),二抗购于北京中杉金桥生物技术有限公司,CtBP1抗体以1∶150稀释,CyclinD1抗体以1∶100稀释。
1.3方法严格按照试剂盒说明书操作,免疫组化检测步骤:(1)载玻片防脱片剂处理:选择APES,捞片后置60 ℃烤箱烤30 min以使切片紧密粘附;(2)切片脱蜡至水;(3)3%双氧水,室温10 min以灭活内源性酶,蒸馏水水洗2 min×3次;(4)对切片进行抗原热修复20 min(选择pH=9.0柠檬酸缓冲修复液);(5)室温冷却后滴加适当稀释的一抗,4℃过夜,次日0.01 mol/L磷酸盐缓冲液(PBS)洗2 min×3次;(6)滴加二抗,37 ℃孵育30 min,PBS冲洗2 min×3次;(7)DAB显色:室温显色,控制反应时间不超过5 min,显色后用自来水冲洗去DAB;(8)苏木精复染、脱水、透明、中性树胶封片、观察。
1.4评价标准
1.4.1CyclinD1评价标准CyclinD1以肿瘤细胞的细胞核出现棕黄色或棕褐色颗粒为阳性染色,在正常鳞状上皮呈低表达或不表达,将肿瘤细胞中或正常食管鳞状上皮细胞中未见棕黄色颗粒或隐约见淡黄色颗粒视为阴性表达,每张切片在400×光镜下随机观察10个视野,每个视野计数100个上皮细胞,共计1 000个细胞,采用双评分法进行判定[7],依据阳性细胞的比例和显色强度决定。计分标准:阳性细胞数<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;显色强度评分:不着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;二者乘积≤1为阴性,2~4分为(+),5~7分为(++),≥8分为(+++),(+~+++)均视为阳性表达。
1.4.2CtBP1评价标准CtBP1以肿瘤细胞的细胞质和细胞核同时出现棕黄色或棕褐色颗粒为阳性染色,在正常鳞状上皮呈低表达或不表达,光镜视野观察与CyclinD1相同,亦采用双评分法进行判定,将肿瘤细胞或正常食管鳞状上皮细胞中未见棕黄色颗粒或隐约见淡黄色颗粒视为阴性表达,阳性细胞数占细胞总数的30%为1分,30%~70% 为2分,>70%为3分;细胞无显色0分,浅黄色1分,棕黄色2分,棕褐色3分;二者乘积0~1分为阴性,≥2分为阳性。以上结果均由2位高年资病理医师同时进行评价。
1.5统计学处理采用SPSS17.0统计软件整理数据,分析CtBP1和Cyclin D1阳性表达情况与哈萨克族及汉族食管鳞状细胞癌患者的民族、年龄、性别、肿瘤部位、肿瘤大小、分化程度、浸润深度、淋巴结转移、血管侵犯、神经侵犯等指标间的差异。计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
2结果
新疆哈萨克族及汉族食管鳞状细胞癌组织中 CtBP1与CyclinD1蛋白表达情况及其与临床病理结果显示:(1)哈萨克族及汉族食管鳞状细胞癌均多见于中老年人,食管鳞状细胞癌好发于中下端。(2)CyclinD1阳性染色细胞主要分布于肿瘤组织细胞核中(图1),CyclinD1在食管鳞状细胞癌组织的阳性表达率(50.4%)显著高于癌旁正常组织的阳性表达率(20%)(P<0.01);而CtBP1在癌旁正常鳞状上皮的阳性表达率(88.0 %)高于食管鳞状细胞癌组织的阳性表达率(66.4 %),差异有统计学意义(P<0.01)。(3)CyclinD1在哈萨克族食管鳞状细胞癌组织的阳性表达率(65.0 %)高于汉族食管鳞状细胞癌组织的阳性表达率(36.9 %),差异有统计学意义(P=0.02)(表1);(3)在哈萨克族食管鳞状细胞癌组织中,肿瘤直径≥3 cm和<3 cm者CtBP1的表达差异有统计学意义(P=0.037),同时在不同肿物类型中CtBP1表达差异有统计学意义(P=0.02);在汉族食管鳞状细胞癌组织中,CtBP1的阳性表达与不同性别、不同年龄组、肿瘤部位、肿瘤大小、大体类型、浸润深度、分化程度、淋巴结转移、血管侵犯、神经侵犯等临床指标差异均无统计学意义(P>0.05)(表2)。CtBP1和CyclinD1在食管鳞癌组织的表达呈正相关(表3)。
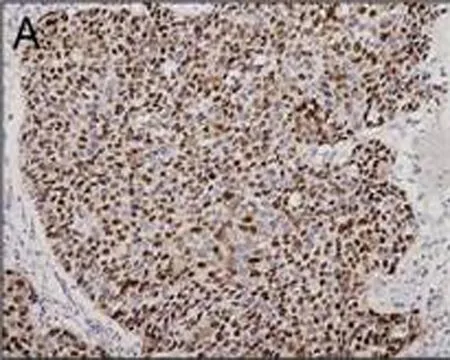
A: CyclinD1阳性信号呈棕黄色颗粒状
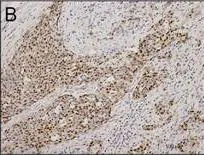
B: CyclinD1表达于细胞核
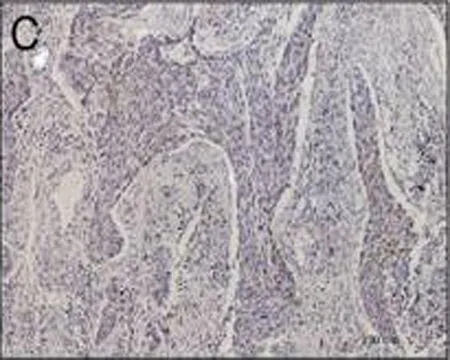
C: CyclinD1在食管鳞癌组织中呈阴性表达
图1免疫组织化学检测CyclinD1在食管鳞状细胞癌的表达情况(DAB,×100)
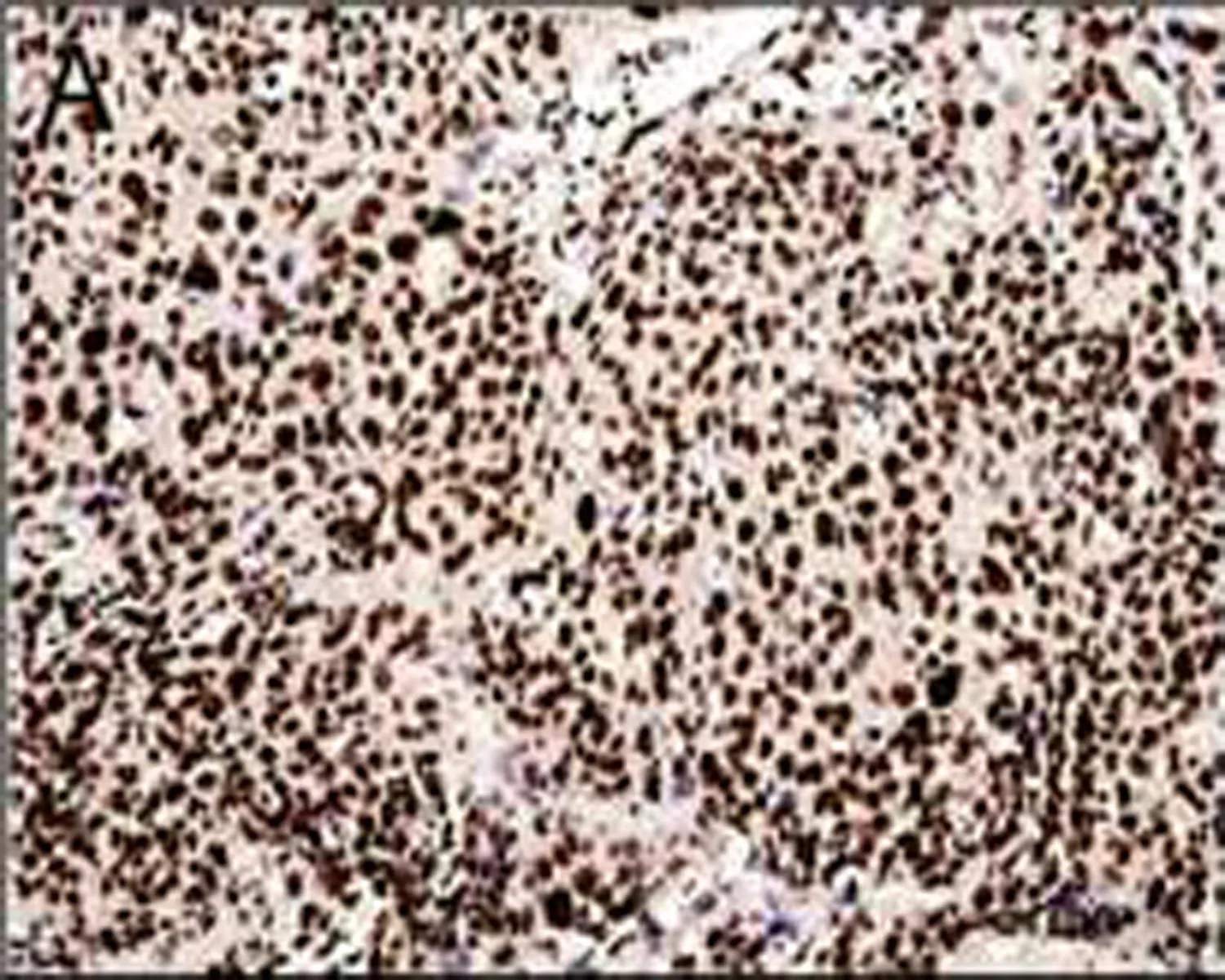
A: CtBP1在食管鳞癌组织中呈强阳性表达
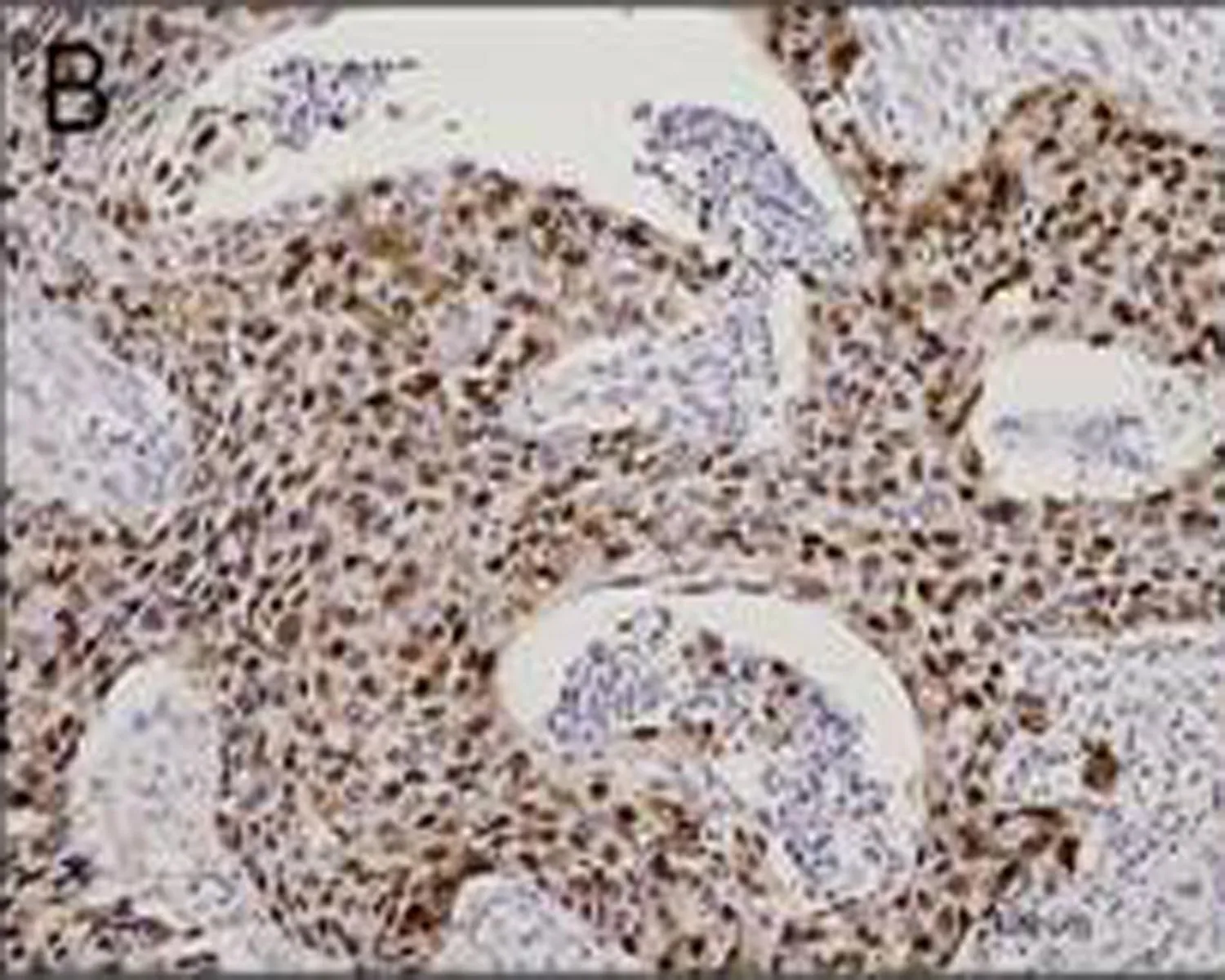
B: CtBP1在食管鳞癌组织中呈弱阳性表达
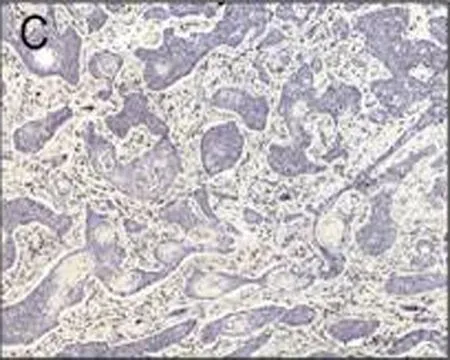
C: CtBP1在食管鳞癌组织中呈阴性表达
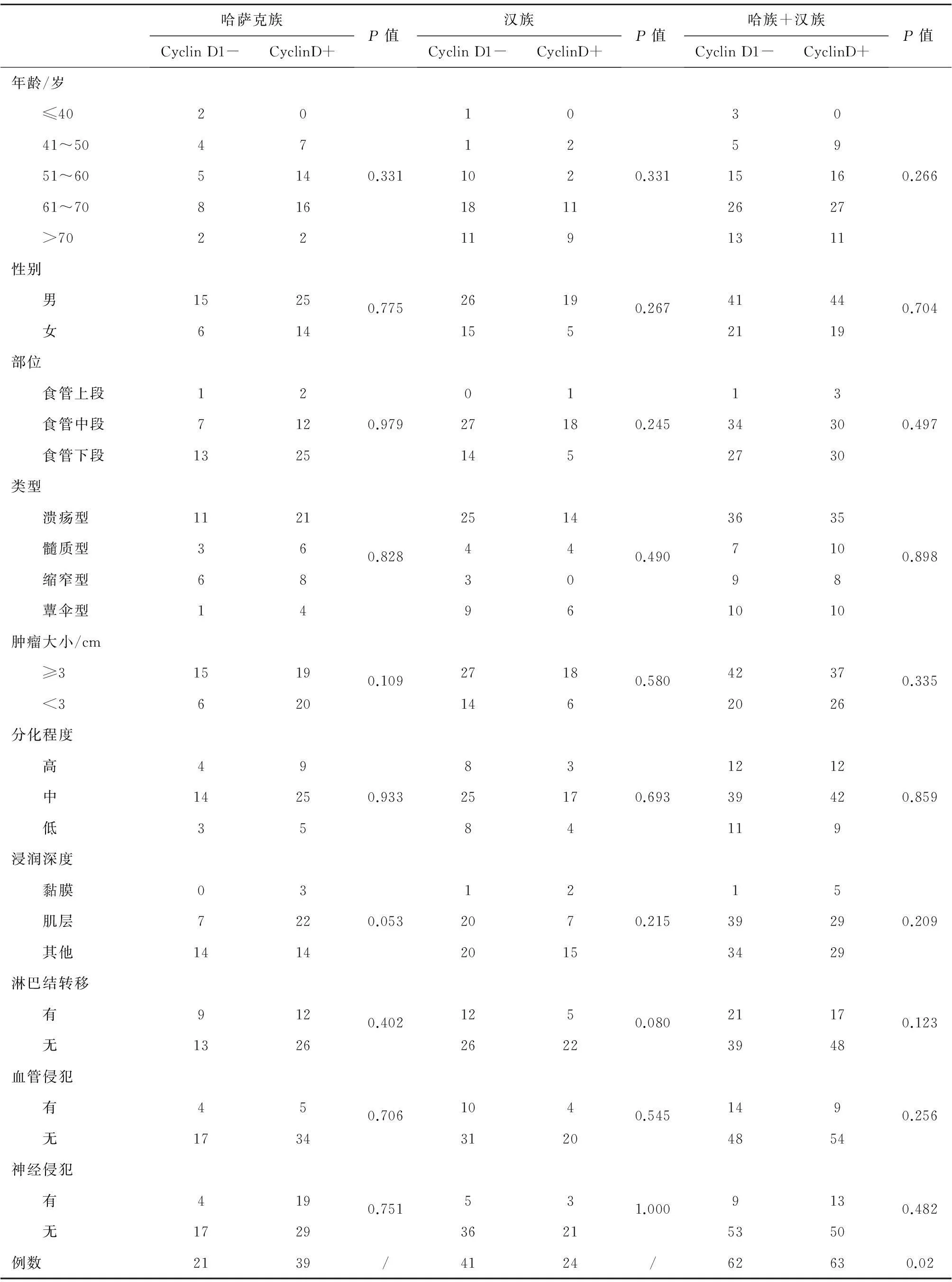
图2 免疫组织化学检测CtBP1在食管鳞状细胞癌的表达情况(DAB, ×100)
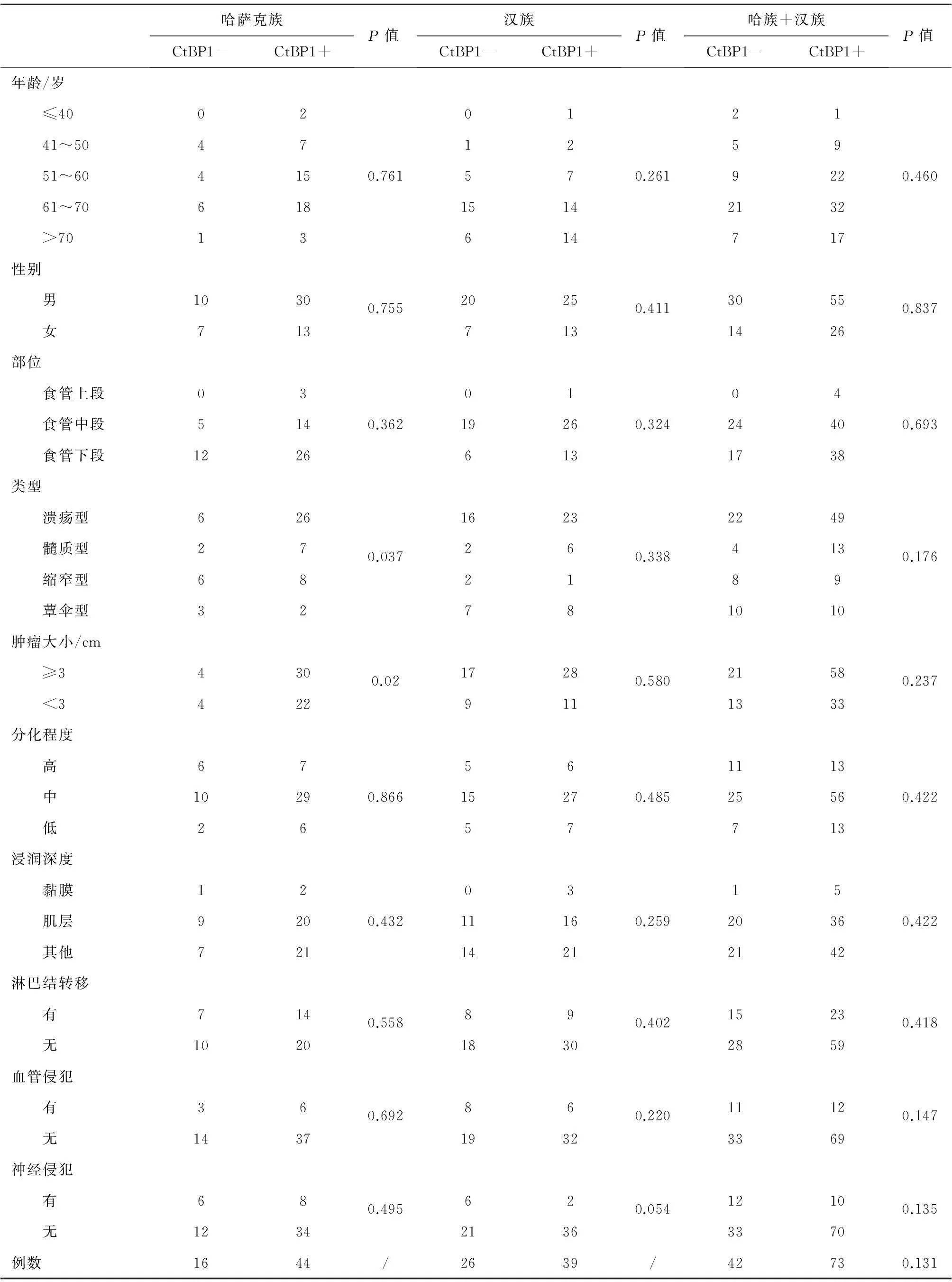
表2 哈萨克族与汉族食管鳞状细胞癌患者临床病理参数与CtBP1表达的关系

表3 CtBP1与CyclinD1的表达与食管鳞状细胞癌的相关性
3讨论
组织细胞的有丝分裂包括G1、S、G2、M 4个时期,G1、S、G2属于分裂间期,M为分裂期。细胞周期蛋白Cyclin D1作为细胞周期调节因子之一,主要作用于G1期,其异常表达可导致细胞周期失调,加速细胞从G1期向S期转化,使细胞一直处于不断增殖的类似前体细胞的状态,从而引起肿瘤的发生。目前的研究中,Cyclin D1的表达与食管癌组织的各临床病理指标的关系的结论并不统一[8-10]。张冬坤等[11]研究认为Cyclin D1表达与上述临床指标无明显相关性。本研究结果显示,Cyclin D1的阳性表达与食管癌的分化程度、浸润深度、淋巴结转移、血管侵犯和神经侵犯无关。导致CyclinD1的过表达与食管癌各临床指标结果不一致的原因可能是目前缺乏统一的、能够被广泛接受并采用的免疫组化评分标准,选用不同的判定方法其统计学结果可能不同。另外,本研究显示在汉族与哈萨克族食管癌组织中Cyclin D1的表达有民族差异,哈萨克族食管癌组织的Cyclin D1阳性表达比例明显高于汉族,说明Cyclin D1的阳性表达在民族间至少汉族及哈萨克族表达差异有统计学意义,提示Cyclin D1在哈萨克族食管癌的发生、发展中具有比汉族更加明显的作用,并且有望成为食管鳞状细胞癌潜在的诊断标志物。
CtBP是转录辅抑制因子,由CtBP1基因和CtBP2基因编码,CtBP1作为CtBP家族重要成员之一,通过调节细胞浆中高尔基体的功能,协同多种癌基因作用于肿瘤的发生、发展过程中,CtBP1还可以发挥细胞增殖因子的作用,抑制细胞周期抑制因子,以促进细胞的增殖。CtBP1以间接依赖烟酰胺腺嘌呤二核苷酸(NADH)的方式与多种DNA 绑定抑制剂结合,其在鳞状细胞癌中的高表达,考虑是因为癌细胞通常有更多的NADH以对抗低氧或缺氧状态,所以癌细胞中CtBP1的活性比正常细胞高。CtBP1在上皮性卵巢癌中的表达高于正常卵巢及卵巢良性肿瘤,在人脑神经胶质瘤中,其表达随着胶质瘤级别的升高而逐渐升高,而在正常脑组织中表达水平极低,CtBP1可能在上皮性卵巢癌及胶质瘤的发生、发展中扮演重要角色[12-13];但是国内其他学者认为: CtBP1在结肠腺癌组织中并没有百分之百表达,而在癌旁组织中却百分之百表达;在子宫内膜样癌和正常子宫内膜组织亦均有高度表达,两者比较差异无统计学意义,CtBP1蛋白不能作为结肠腺癌与子宫内膜癌诊断和治疗的潜在标志物[14-15]。本研究显示:CtBP1在食管鳞状细胞癌组织的表达低于癌旁正常鳞状上皮的表达。对于这项指标的研究尚存在争议,考虑产生这一结果有以下原因:由于免疫组织化学判定方法尚不统一,各位研究者均有自己的看法及观点,故导致结果也不统一;尚存在某些其他仍不熟知的基因干扰了CtBP1的作用,或是尚有个别基因的功能目前医学并不知晓,其影响了CtBP1的正常功能;目前对于CtBP1表达与食管癌的研究并不多,不同民族间CtBP1的表达研究几乎没有文献可以查阅,本研究结果显示在汉族与哈萨克族食管癌组织CtBP1的表达不存在民族差异,提示种族因素不能影响CtBP1的阳性表达;但是在哈萨克族食管癌组织的CtBP1阳性表达病例中,肿瘤直径≥3 cm及肿物大体类型为溃疡型所占比例高,本研究推测CtBP1对肿瘤的发展起着促进作用。
CtBP1与Cyclin D1参与肿瘤发生、发展的Wnt信号通路,当Wnt经典通路被激活,wnt蛋白与细胞膜受体特异性结合,引起β-catenin由细胞膜向细胞质甚至细胞核移动,使β-catenin在核内累积无法降解,最终与TCF/LEF(T cell factor/lymphoid enhancer factor)结合,促使Wnt通路中的靶基因之一的致癌基因Cyclin D1的转录和翻译,pRb蛋白的磷酸化修饰提前实现,加速细胞由G1期向S期转化,导致G1/S期调控紊乱,细胞周期转换速度加快,细胞增殖失控,最终导致癌变。另一方面,当Wnt信号通路被激活后,CtBP1又能够与TCF/LEF结合,抑制抑癌基因的转录,下调多种抑癌基因;结合本研究关于CtBP1和Cyclin D1关系的结果,即两者均阳性的病例数所占病例高,推测CtBP1可能在抑制抑癌基因转录的同时,还具有促进致癌基因转录的双向作用,即CtBP1的上调可能可以促进Cyclin D1的上调,而CtBP1的表达缺失则可能抑制了原癌基因Cyclin D1的转录,但是CtBP1和Cyclin D1的阳性表达与民族无关,目前并未见到关于CtBP1和Cyclin D1在食管癌中的表达的其他文献,CtBP1和Cyclin D1之间到底是如何在细胞周期中发挥相互促进的机制尚不完全明了,有待今后进一步研究。
综上所述,Cyclin D1、CtBP1可能在哈萨克族食管鳞状细胞癌的发展中发挥着重要作用,CtBP1和Cyclin D1联合检测可能对哈萨克族与汉族食管鳞状细胞癌的诊治具有指导意义。
参考文献:
[1]张思维, 张敏, 李光琳, 等. 2003~2007年中国食管癌发病与死亡分析[J]. 中国肿瘤, 2012,21(4):241-247.
[2]Huang SF, Cheng SD, Chuang WY, et al. Cyclin D1 overexpression and poor clinical outcomes in Taiwanese oral cavity squamous cell carcinoma[J].World J Surg Oncol, 2012,10(2):40-43.
[3]Sven G, Christoph K, Andreas E, et al. Expression of P53,P21 and CyclinD1 in penile cancer: P53 predicts poor prognosis[J]. J Clin Pathol,2011,65(3):232-236.
[4]Lin RJ, Lubpairee T, Liu KY, et al. CyclinD1 overexpression is associated with poor prognosis in oropharyngeal cancer[J]. J Otolaryngol Head Neck Surg, 2013,42(1):23-25.
[5]Oh J,Takahashi R, Kondo S. The membrane-anchored MMP inhibitor RECK is a key regulator of extracellular matrix integrity and angiogenesis[J].Cell,2001, 107(6):789-800.
[6]Chinnadurai G. The transcriptional corepressor CtBP:a foe of multiple tumor suppressors[J].Cancer Res,2009,69(3):731-734.
[7]许良中, 杨文涛. 免疫组织化学反应结果的判读标准[J].中国癌症杂志,1996,6(4):229-231.
[8]柴小军, 王剑云, 郑健,等. 食管癌组织中HIF-1a、Survivin、CyclinD1蛋白的表达及其意义[J].现代生物医学进展,2013,13(2):2221-2244.
[9]刘馨莲, 李淑蓉, 孙静. 细胞周期蛋白在食管癌中的表达及意义[J].中国实验诊断学,2012,16(7):1249-1252.
[10]常佳, 任景丽, 杨鲲鹏,等. 食管鳞状细胞癌组织中FOXO3a、EGFR和CyclinD1蛋白的表达[J].郑州大学学报:医学版,2014,9(49):615-618.
[11]张冬坤, 苏晓东, 张旭,等. CyclinD1蛋白在T2-3N0M0期食管癌中的表达及其预后的关系[J].中国胸心血管外科临床杂志,2014,21(1):47-51.
[12]王浩. CtBP1在上皮性卵巢癌组织中表达及意义[J]. 齐齐哈尔医学院学报,2013,34(15):2201-2202.
[13]许志华, 苏星, 缪海燕,等. CtBP1在神经胶质瘤组织中表达及意义的研究[J]. 齐齐哈尔医学院学报,2013,34(11):1572-1574.
[14]肖胜军, 贾丽婷, 周辉蓉,等. Zeb1,CtBP1与E-cadherin在结肠腺癌中的表达及意义[J].华夏医学,2013,26(6):1048-1051.
[15]曾用群, 肖胜军, 李凡彩. P16、PTEN、E-cadherin、CtBP1联合检测对子宫内膜腺癌的诊断意义[J].山东医药,2010,50(24):26-28.
(本文编辑周芳)
Expression and significance of CtBP1 and CyclinD1 in xinjiang kazak
and han esophageal squamous cell carcinoma
LI Mengyan1,2, WANG Hui1, MA Yuqing1
(1DepartmentofPathology,theFirstAffiliatedHospitalofXinjiangMedicalUniversity,
Urumqi830054,China;2DepartmentofPathology,ZhundongworkerHospitalofPetrochina
XinjiangOilfieldCompany,Fukang831511,China)
Abstract:ObjectiveTo compare the expression of CtBP1 and CyclinD1 in Kazak and Han′s esophageal squamous cell carcinoma (ESCC) tissue, and analyzing the relationship between them with clinical pathological parameters. MethodsThe expression of CtBP1 and Cyclin D1 proteins in 125 cases of ESCC and 125 cases of normal squamous epithelial tissue were detected by immunohistochemistry using the streptaridin-peroxidase method. Results(1) The ESCC of the two groups were more common in middle and old aged people. (2) The positive expression rate of CyclinD1 in ESCC tissues was significantly higher than that in normal tissues (50.4% vs 20%, P<0.01). But the positive expression rate of CtBP1 in normal squamous epithelium was higher than that of ESCC (88% vs 66.4%, P<0.01). (3) The positive expression rate of CyclinD1 in Kazakh ESCC tissue is higher than that of Han (65% vs 36.9%, P<0.05). (4) In Kazak, the positive expression of CtBP1 had statistical differences between tumor sizes (P=0.037) and types (P=0.02); in Han, there were no correlations between CtBP1 expression and the ethnic, gender, age, depth of invasion, tumor differentiation degree and lymph node metastasis in ESCC (P>0.05). ConclusionThe expression of CtBP1 and CyclinD1 may play an important role in ESCC between Kazak and Han. The combining detection would be a guiding significance for the diagnosis and treatment of ESCC between Kazak and Han.
Keywords:esophageal squamous cell carcinoma; CtBP1; CyclinD1; immunohistochemistry
[收稿日期:2015-07-08]
doi:10.3969/j.issn.1009-5551.2016.01.005
中图分类号:R735
文献标识码:A
文章编号:1009-5551(2016)01-0021-07

